INTRODUCCIÓN
El surgimiento de la enfermedad por el coronavirus 2019 (COVID-19), causada por el virus SARS-CoV-2 a finales del 2019 en Wuhan, China y su posterior extensión como una pandemia, ha provocado importantes daños económicos y sociales. 1-3
Hasta el 18 de noviembre del 2021 la Organización Mundial de la Salud (OMS) había reportado 254 847 065 casos confirmados y 5 120 712 muertes mundiales. A pesar de la administración de 7 370 902 499 dosis de vacunas y del esfuerzo de la comunidad internacional, todavía no se ha podido erradicar la pandemia. (4
Por otro lado, las enfermedades crónicas no transmisibles han constituido la primera causa de morbilidad y mortalidad en el mundo y dentro de estas, la obesidad ocupa un lugar destacado como importante factor de riesgo de enfermedades cardiovasculares, diabetes mellitus e infecciones. 5,6
La obesidad es una enfermedad multifactorial que implica interacciones entre factores hormonales, genéticos y ambientales que aumentan la adiposidad o grasa. 2) Su prevalencia se ha incrementado en todo el mundo. En el año 2015 la frecuencia de obesidad en adultos de países seleccionados fue de 19,5 % variando desde 3,7 % en Japón hasta 38,2 % en Estados Unidos. 5 Los países en vías de desarrollo tampoco escapan a esta problemática. 7-10
La sorprendente susceptibilidad de las personas obesas al COVID-19 grave, evidente por las tasas de hospitalización y mortalidad, ha centrado la atención de la comunidad científica en los vínculos entre ambas enfermedades. La obesidad es un factor de riesgo de complicaciones graves en la COVID-19. 5,11-16
En una revisión de Demeulemeester et al. 5 de 11 estudios que investigaron la asociación entre el índice de masa corporal (IMC) y la mortalidad en pacientes hospitalizados por COVID-19, 10 estudios observaron un aumento de la tasa de mortalidad en pacientes que tenían sobrepeso u obesidad. Otro estudio 11) informó que, de 95 966 casos clínicos de COVID-19 en diferentes países, hubo una prevalencia de obesidad del 13,4 % y una tasa aún mayor de obesidad (41,7 %) en pacientes hospitalizados en Nueva York.
En Estados Unidos, personas menores de 60 años con IMC de 30 kg/m2 a 35 kg/m2 y mayores que 35 kg/m2 tenían de 1,8 a 3,6 veces más probabilidades de ingresar en la unidad de cuidados intensivos (UCI) respectivamente, en comparación con los pacientes con un IMC menor que 30 kg/m2. 12 Un estudio francés descubrió que el IMC mayor que 35 kg/m2 aumentaba 7,36 veces la necesidad de ventilación mecánica invasiva respecto a los pacientes con peso normal. 12
Un estudio en Italia 13 demostró que de 92 pacientes ingresados con COVID-19, los pacientes con sobrepeso y obesidad eran más jóvenes que los pacientes con peso normal y presentaron una mayor necesidad de ventilación asistida y mayor tiempo de ingreso en la UCI. Otras investigaciones confirmaron estos resultados adversos de la COVID-19 en personas obesas. 14-16
Los trastornos metabólicos y hormonales de la obesidad se agrupan en la resistencia a la insulina (RI) o síndrome metabólico. 17 La RI favorece un estado proinflamatorio crónico que provoca un desenlace adverso de la COVID-19 en estos pacientes. 18-21 Además, la obesidad se acompaña de otros factores de riesgo como la diabetes mellitus tipo 2 (DM2), hipertensión arterial, apnea obstructiva del sueño y enfermedad cardiovascular, que también son predictores de gravedad y mortalidad para la COVID-19. 16,22
La comprensión de los complejos mecanismos vinculantes entre la obesidad y la infección grave por SARS-CoV-2 es de crucial significado para el desarrollo de nuevas intervenciones terapéuticas y medidas preventivas en este grupo de alto riesgo. 23-26
En esta revisión se describirán los principales vínculos entre la obesidad y la COVID-19 grave, destacando los trastornos metabólicos de la RI y la inflamación crónica como mecanismo fisiopatológico común. Por tanto, el objetivo de esta revisión es describir los principales mecanismos que vinculan la obesidad con un desenlace desfavorable de la infección por SARS-CoV-2, entre los que han destacado: aumento de la entrada celular del virus, RI, disfunción inmune, alteraciones hormonales, trastornos de la coagulación, disfunción endotelial, disfunción respiratoria por deterioro de la mecánica respiratoria y del intercambio gaseoso y la presencia de comorbilidades.
Se aclara que la COVID-19 es una enfermedad nueva, investigada mucho en todo el mundo con aspectos polémicos y controversiales y que pueden surgir nuevos conocimientos que contradigan o confirmen lo planteado en este trabajo. No obstante, aquí se expondrán los aspectos en que hay mayor consenso internacional.
DESARROLLO
Métodos
La revisión bibliográfica se efectuó en:
Google Académico (https://scholar.google.com.cu)
PubMed Central (https://www.ncbi.nlm.nih.gov/pmc)
SciELO (https://scielo.org/es)
Infomed (http://www.bvscuba.sld.cu/clasificacion-de-revista/revistas-cubanas)
Se utilizaron los descriptores COVID-19, SARS-CoV-2 y obesidad sacados de Descriptores en Ciencias de la Salud (DeCS). (https://decs.bvsalud.org/es)
Se seleccionaron artículos disponibles a texto completo en español e inglés, de revistas revisadas por pares y páginas de organizaciones internacionales reconocidas. Cada autor realizó la búsqueda por separado en un período de 3 meses.
Al final por consenso se aprobaron las referencias, luego de que cada autor propusiera un número similar de trabajos publicados.
Obesidad, resistencia a la insulina e inflamación crónica
El tejido adiposo además de almacenar energía en forma de triglicéridos, es uno de los más importantes órganos endocrinos porque secreta citocinas denominadas adipocinas. 2 La obesidad se caracteriza por la remodelación del tejido adiposo y la alteración proinflamatoria del perfil de adipocinas. 16 El desequilibrio resultante entre las adipocinas pro- y antinflamatorias se ha implicado como clave para que la obesidad sea un importante factor de riesgo de lesión tisular.
La inflamación crónica o metainflamación se debe a la actividad de las células inmunes y adiposas en el tejido visceral disfuncional. 27 El exceso de adipocitos hipertróficos favorece la hipoxia, el estrés celular y la apoptosis. La hipoxia induce la infiltración de células inmunes en el tejido adiposo y la síntesis excesiva de adipocinas proinflamatorias como el factor de necrosis tumoral alfa (TNFα), interleucina (IL)-6, interferones (INF) y leptina por los adipocitos hipertróficos. 5
Esta producción excesiva de citocinas inflamatorias en la obesidad también deteriora la respuesta inmunitaria innata y adaptativa. 12,16,28 La inflamación crónica inducida por obesidad inhibe la activación y reubicación de los macrófagos, interrumpe la formación de anticuerpos neutralizantes y células T de memoria, y disminuye la activación de las células efectoras del sistema inmunitario. 28 Por lo tanto, esta inflamación crónica conduce a la disfunción inmune, lo que aumenta el riesgo de gravedad durante la infección por COVID-19.
El TA visceral, determinado fácilmente por el perímetro de cintura o abdominal y el índice cintura/cadera con una cinta métrica, presenta más RI que el tejido subcutáneo. En el estado de RI, el páncreas libera mayor cantidad de insulina para mantener la glicemia en valores normales, lo que a la larga sobrecarga las células β y origina DM2. 7
Las citocinas proinflamatorias secretadas por el tejido adiposo en la obesidad también genera RI. 2 Durante la RI se produce un aumento del flujo de ácidos grasos procedentes de la grasa visceral hasta el hígado con 2 consecuencias principales: aumento de la síntesis de triglicéridos con esteatosis y la liberación de lipoproteínas de muy baja densidad (VLDL) ricas en triglicéridos. 7
El aumento de las VLDL en sangre y la disminución de su eliminación por déficit de la lipasa lipoproteica insulinodependiente produce hipertrigliceridemia. La hipertrigliceridemia repercute en el patrón de lipoproteínas al reducir las lipoproteínas de alta densidad (HDL) y elevar las lipoproteínas de baja densidad (LDL), lo que constituye la tríada dislipidémica de la RI. 8) Esta dislipidemia favorece la ateroesclerosis. 9
Entrada del SARS-CoV-2 a las células
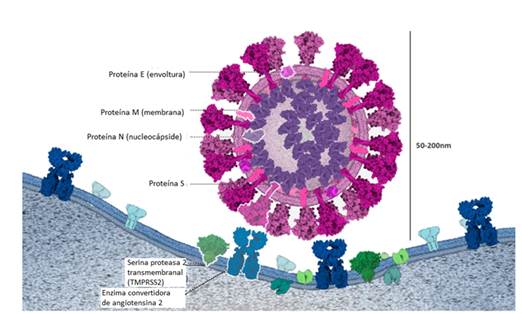
El SARS-CoV-2 es un ARN virus cuyo genoma codifica proteínas estructurales y no estructurales. Las proteínas estructurales son: la proteína de la espiga o espícula (S), la proteína de la membrana (M), la proteína de la envoltura (E) y una proteína de la nucleocápside (N). 29-31 El tropismo celular y tisular parece depender en gran medida de la expresión del receptor de entrada de la enzima convertidora de angiotensina 2 (ACE2), así como de las proteasas celulares. 29,32,33
La proteína S se ensambla en múltiples copias en la membrana del virus, lo que le da una forma semejante a una corona, de ahí el nombre de coronavirus. 24 Los anticuerpos neutralizantes se dirigen principalmente a la proteína S. 32 Para interactuar con la ACE2, las proteasas celulares escinden y activan la proteína S en 2 subunidades funcionales S1 y S2, lo que da lugar a la exposición del dominio de unión al receptor (RBD) de S1 que interacciona con su receptor (fig. 1). 34
Estudios recientes han sugerido que la furina, los proteoglicanos de heparán sulfato (HSPG) y la neuropilina 1 (NRP1) son factores adicionales del huésped que pueden ser utilizados para la adhesión y la entrada celular por el SARS-CoV-2, además de la ACE2 y la TMPRSS2. 29,34
Mecanismos que vinculan la obesidad a la COVID-19 grave
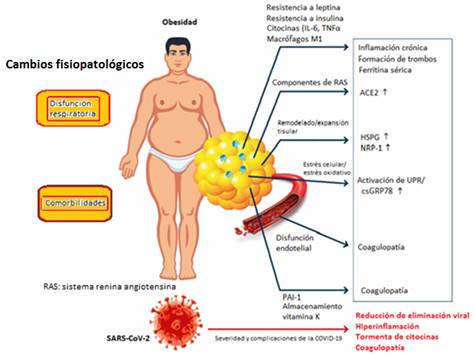
La comprensión de los mecanismos que vinculan la obesidad y la COVID-19 grave es crucial para el desarrollo de nuevas opciones preventivas y terapéuticas en este grupo de alto riesgo. 35,36 La figura 2 representa un esquema de los complejos mecanismos vinculantes. La obesidad se caracteriza por la presencia de grandes adipocitos hipóxicos infiltrados con células inmunitarias y macrófagos M1 que conducen a un estado inflamatorio crónico, hipercoagulabilidad e hiperferritinemia. 5
El mayor número de adipocitos y la mayor expresión de la ACE2 en los adipocitos en las personas obesas conducen a una mayor carga viral y a una viremia prolongada. 27) La expansión y remodelación tisular, junto al estrés celular, también puede aumentar la expresión de otros receptores del SARS-CoV-2, como el csGRP78, el HSPG y el NRP1 en el tejido adiposo y otros órganos. Los cambios fisiopatológicos también influyen como la disfunción respiratoria y la presencia de comorbilidades. 12
Se debe aclarar que la determinación clínica de la obesidad se basa en el IMC, un método de amplio uso, pero con limitaciones para valorar con exactitud la grasa corporal, sobre todo en edades extremas de la vida y en personas con mucha masa muscular.
 Fuente: Demeulemeester F et al.5)
Fuente: Demeulemeester F et al.5)Fig. 2 Representación esquemática de los vínculos entre obesidad y la gravedad durante infección por COVID-19.
La obesidad favorece la entrada del SARS-CoV-2
La ACE2 se expresa en una gran variedad de tejidos como el intestino delgado, los testículos, los riñones, el corazón, la tiroides, los pulmones, tejido adiposo y el cerebro. 26
La entrada del virus en las células diana ocurre por la unión de la proteína S a la ACE2 y el cebado de la proteína S por diferentes proteasas. La ACE2 forma parte del sistema renina-angiotensina (SRA) y desempeña un papel importante en la regulación de la presión arterial. 5
La acción de la ACE induce la vasoconstricción y la inflamación, mientras que la ACE2 actúa como un contrarregulador del SRA. La ACE2 induce la vasodilatación y tiene un efecto antiinflamatorio, al convertir la Ang-II proinflamatoria en Ang-1-7 que se opone a las acciones de la Ang-II. 5
La expresión de ACE2 puede ser regulada por una amplia gama de citocinas proinflamatorias. Por tanto, el estado inflamatorio de la obesidad facilita la entrada y posterior replicación del virus. Además, los virus pueden alojarse en el TA y promover el desprendimiento, la activación inmunitaria y la liberación excesiva de citocinas. 11,22)
El uso de inhibidores de la enzima convertidora de la angiotensina se asoció con una menor expresión de TMPRSS2 y de ACE2, lo que puede atribuirse a que reducen la conversión de Ang II y en consecuencia, disminuyen la disponibilidad del sustrato de la ACE2. 37,38) Sin embargo, existe una controversia sobre el papel protector o deletéreo de estos inhibidores y de los bloqueadores de los receptores de la angiotensina en la COVID-19. 22
Los tejidos adiposos viscerales como el epicárdico y ectópico en el espacio alveolar desempeñan un papel en la COVID-19 grave, al expresar un alto nivel de ACE2. 39) Sin embargo, el TA tiene un mayor nivel de expresión de ACE2 que el tejido pulmonar.
Hay datos considerables que apoyan el aumento de la expresión de TMPRSS2 por parte de los andrógenos, lo que proporciona una hipótesis para una mayor gravedad de la enfermedad en los hombres. 11
Los HSPG se localizan en la matriz extracelular y superficie celular, median la angiogénesis, la coagulación sanguínea, los procesos de desarrollo y la homeostasis celular. (5 La unión de citocinas y factores de crecimiento a los HSPG impide su degradación. Muchos virus pueden interactuar con los HSPG como es el caso del SARS-CoV-2.
La NRP1 también facilita la entrada del SARS-CoV-2 in vitro. 5 En la obesidad podría aumentar la expresión del HSPG y de la NRP1 en diversos tejidos y facilitar la entrada celular del SARS-CoV-2. Sin embargo, es necesario realizar más estudios para confirmar esta teoría. 5
La obesidad induce la resistencia a la insulina
En el tejido adiposo, la RI se ve favorecida por la acumulación excesiva de lípidos, lo que provoca hipoxia e inflamación. 5) La posterior invasión de macrófagos que liberan citocinas proinflamatorias perjudica aún más la señalización de la insulina.
La RI es la principal causa de hiperglucemia en pacientes con COVID-19 grave. 18) La conexión entre la obesidad y la RI podría conducir a una inmunidad deteriorada y a una infección por SARS-CoV-2 más grave.
Las elevaciones crónicas de citocinas proinflamatorias, como el TNFα y la IL6 influyen en el curso de la COVID-19. Dado que el TNFα desempeña un papel importante en la promoción del síndrome respiratorio grave, los individuos obesos con un TNFα sérico elevado tienen un mayor riesgo de desarrollar esta complicación potencialmente mortal. En los pacientes con COVID-19, los niveles de IL6 están significativamente elevados y se asocian con resultados clínicos adversos. 5
La obesidad también induce la remodelación y el aumento de tamaño del tejido adiposo para acomodar el exceso de energía dietética, lo que está mediado por el aumento de la masa y el número de adipocitos y va acompañado de un aumento de los niveles de infiltración de células inmunitarias y de la polarización hacia macrófagos más "inflamatorios" del tejido adiposo como M1. 40
Tanto las células inmunitarias asociadas al tejido adiposo -por ejemplo, macrófagos- como los adipocitos liberan adipocinas proinflamatorias, y la obesidad provoca: aumento de la leptina, incremento de resistina sérica y reducción de la adiponectina sérica. Este desequilibrio de adipocinas contribuye en parte a la inflamación sistémica crónica. 40
La leptina y la resistina son adipocinas proinflamatorias secretadas por los adipocitos de los individuos obesos. 25) La señalización de la leptina puede activar la respuesta efectora en los macrófagos para secretar IL6, IL18, IL12 y TNFα a través de la activación del factor de transcripción STAT-3. La hipoxia prevalente por la hipertrofia e hiperplasia de los adipocitos, puede aumentar aún más la inflamación debido a que los adipocitos hipóxicos se necrosan e inducen la infiltración de leucocitos y un incremento de la inflamación. 25
Como se especificó, la hipoxia en los tejidos adiposos promueve la infiltración de macrófagos circulatorios. 25) Tras la infiltración, estos macrófagos se convierten en macrófagos inflamatorios de tipo M1 y liberan citocinas proinflamatorias. La presencia de una polarización proinflamatoria M1 preexistente en los obesos puede agravar aún más la respuesta de los macrófagos al virus invasor, lo que conduce a una mayor gravedad ante infección por COVID-19.
Los mastocitos infiltrados en el tejido adiposo en la fase inicial de la obesidad, influyen en el comportamiento de los adipocitos mediante la secreción de IFNϒ e IL6. 25) Las células dendríticas, que son células presentadoras de antígenos profesionales, pueden estimular la respuesta Th17 y atraer macrófagos y neutrófilos. Así pues, pueden impulsar el círculo vicioso de infiltración de células inmunitarias y favorecer un medio proinflamatorio.
Así, en el estado de obesidad, los mediadores proinflamatorios como las citocinas, adipocinas y células inmunes pueden escalar la inflamación sistémica y afectar a múltiples sistemas de órganos del cuerpo. 25
La resistencia a la insulina provoca disfunción inmunitaria
La obesidad conduce a la disfunción de la respuesta inmunitaria por la alteración de la integridad del tejido linfoide y las alteraciones en el desarrollo y la actividad de los leucocitos. 14,39 El aumento de las citocinas proinflamatorias circulantes, así como la reducción de los niveles de adiponectina pueden perjudicar la respuesta inmunológica a la infección en obesos. 1,27 Esto conlleva a una alteración de la estructura del tejido linfoide y cambios en las poblaciones de leucocitos y en los fenotipos inflamatorios. Además, las respuestas de las células B y T están alteradas en los obesos, lo que provoca una mayor susceptibilidad y un retraso en la resolución de las infecciones víricas. Por último, se ha observado una menor eficacia de las vacunas en los obesos, al menos a largo plazo. 27
La insulina actúa sobre las células inmunitarias y, por tanto, la RI puede tener un impacto sustancial en el sistema inmunitario. 5) En animales la señalización de la insulina es esencial para una función efectora óptima de las células T. En los seres humanos, los individuos con RI mostraron un retraso en la activación de la vía inmunitaria innata tras una infección viral en comparación con los individuos sensibles a la insulina, lo que sugirió un deterioro de la respuesta inmunitaria innata precoz.
El depósito ectópico de grasa en tejidos inmunitarios como el timo, el bazo, la médula ósea y los ganglios linfáticos conduce a la destrucción de la integridad de los tejidos y a una alteración del entorno celular. 12) El microentorno del tejido linfoide socavado por la obesidad da lugar a alteraciones de las células inmunitarias. Estas alteraciones perpetúan aún más el deterioro de la inmunidad innata y adquirida.
Las células NK en obesos no pueden limitar la transmisión del SARS-CoV-2, ni frenar la inflamación sistémica eliminando a las células dendríticas activadas, los monocitos o las células T. Aunque esta hipótesis necesita más aclaraciones, alude a los posibles mecanismos de los malos resultados de los pacientes obesos con COVID-19. 12
Las células dendríticas de los obesos no son competentes para iniciar las respuestas inmunitarias para hacer frente al SARS-CoV-2. 12) Teniendo en cuenta el debilitamiento de las respuestas antivirales y la eliminación del virus por parte de las células dendríticas alteradas en estas personas, la estrecha causalidad entre el desarrollo de COVID-19 grave y estas células anormales es razonable.
El SARS-CoV-2 puede afectar negativamente la respuesta de las células T. Dos subtipos inusuales de células T CD4+ se asociaron con la gravedad de la enfermedad, mientras que la polifuncionalidad y la citotoxicidad de las células T CD8+ se atenuaron en los pacientes graves de COVID-19. Las células T disfuncionales causadas por una combinación de factores del huésped y virales predisponen a los pacientes de COVID-19 con obesidad a cuadros más graves. 12
La disfunción de las células T en las personas con obesidad también se debe en parte a la deficiencia de IFN en la fase inicial de la infección. En lugar de ser protectores y estimulantes en la respuesta de las células T, los IFN inhiben la proliferación de las células T, impiden su salida de los órganos linfáticos y provocan la destrucción de las células T. 12
El mayor riesgo de un pronóstico más grave con títulos más altos de anticuerpos sugiere que una respuesta robusta de anticuerpos por sí sola es insuficiente para evitar la enfermedad grave. Teniendo en cuenta que la citotoxicidad celular dependiente de anticuerpos probablemente agrave la tormenta de citocinas y la enfermedad en los ratones obesos, es necesario averiguar si se da una situación similar en los seres humanos. 12
Los ensayos clínicos iniciales mostraron que las vacunas COVID-19 protegen eficazmente a los pacientes con obesidad a corto plazo, aunque parece que se reduce la protección a largo plazo. 1
Alteraciones hormonales
La obesidad se caracteriza también por una hiperleptinemia persistente, resistencia a la leptina y alteraciones en otras hormonas como adiponectina y testosterona. (41
La leptina es secretada principalmente por el tejido adiposo cuyos efectos en el sistema nervioso central y en los tejidos periféricos regula la homeostasis metabólica y la función del sistema neuroendocrino e inmunitario.41,42) En condiciones fisiológicas, la leptina informa al cerebro sobre el estado energético en la periferia, pero en la obesidad se interrumpe la señalización a los centros reguladores del cerebro que inhiben la ingesta de alimentos, regulan el peso corporal y la homeostasis energética.
La leptina actúa como una potente citocina inflamatoria, estimula la respuesta inmunitaria innata promoviendo la activación de los monocitos/macrófagos y puede promover la tormenta de citocinas asociada a la COVID-19.
La leptina regula la activación de las células T y la producción de citocinas. 16) Se cree que el deterioro de la defensa del huésped contra las infecciones pulmonares está relacionado con la resistencia a la leptina resultante de una hiperleptinemia prolongada. De hecho, en la obesidad se ha demostrado la resistencia a la leptina en las células T, las células NK y los monocitos de la sangre periférica.
El aumento de leptina y el estado proinflamatorio propicia una respuesta inflamatoria excesiva tras la infección por SARS-CoV-2. 5) La infección por el SARS-CoV-2 aumenta la expresión del gen que codifica para el supresor de la señalización de citoquinas 3 (SOCS3) en el epitelio pulmonar. Este gen es un regulador de la inflamación y un inhibidor de la señalización de la leptina, por tanto, el aumento de su expresión como resultado de la infección viral podría perjudicar aún más la señalización de la leptina.
La adiponectina tiene propiedades antiinflamatorias y ejerce efectos favorables sobre la sensibilidad a la insulina. 16) La adiponectina funciona como un regulador de la polarización de los macrófagos desde los M1 proinflamatorios a los M2 antiinflamatorios, y los niveles bajos en la obesidad se han asociado con resultados adversos en pacientes con enfisema, asma e insuficiencia respiratoria en el entorno de los cuidados críticos.
La adiponectina secretada casi exclusivamente por los adipocitos, disminuye en la mayoría de las personas con obesidad. 42 La relación adiponectina/leptina se ha propuesto como marcador de la disfunción del tejido adiposo y se correlaciona negativamente con marcadores de inflamación de bajo grado, como la proteína C reactiva. En modelos animales la deficiencia de adiponectina aumenta la inflamación pulmonar y reduce la eliminación de células apoptóticas. 16
Las concentraciones de testosterona son más bajas en los hombres de edad avanzada y con obesidad grave. 16) Mientras que un nivel bajo de testosterona se asocia a una reducción de la actividad muscular respiratoria y de la capacidad de ejercicio y a niveles más altos de citocinas proinflamatorias, el tratamiento de sustitución de la testosterona mejora el consumo máximo de oxígeno y reduce los niveles de citocinas.
Por lo tanto, surgió la hipótesis de que la testosterona disminuida en los hombres que envejecen con obesidad puede tener un papel en la tormenta de citocinas de la infección grave por el SARS-CoV-2, aunque no se sabe si la hormona es beneficiosa en el tratamiento de la COVID-19 en estos hombres. 16
Hay una hipótesis contraria sobre la progresión de la COVID-19 impulsada por la testosterona que se basa en la activación por parte del receptor de andrógenos de una proteasa crucial para la propagación de la COVID-19. Se postula que los niveles más altos de testosterona observados en los hombres se vinculan a mayor mortalidad, sin embargo, se necesitan más investigaciones antes de sacar conclusiones definitivas. 16
La obesidad favorece los trastornos de la coagulación
La inflamación crónica provocada por las citocinas proinflamatorias conduce a la regulación al alza de factores procoagulantes (factor tisular) y de moléculas de adhesión (P-selectina), a la regulación a la baja de proteínas anticoagulantes (como el inhibidor de la vía del factor tisular, la antitrombina y el sistema anticoagulante de la proteína C), al aumento de la generación de trombina y a una mayor activación de las plaquetas, lo que incrementa el riesgo de trombosis. 12,43
La hiperleptinemia también es un factor de riesgo para desarrollar trombosis. La leptina afecta a la coagulación al aumentar la expresión de las proteínas protrombóticas y antifibrinolíticas en las células vasculares e inflamatorias produciendo un estado más hipofibrinolítico, lo que aumenta el riesgo de desarrollar complicaciones trombóticas en la COVID-19. 5
El inhibidor del activador del plasminógeno 1 (PAI-1) es el principal inhibidor fisiológico de la activación del plasminógeno. Las elevaciones de PAI-1 en plasma comprometen los mecanismos normales de eliminación de fibrina y favorecen la trombosis. El PAI-1 se sintetiza excesivamente por el tejido adiposo en la obesidad. 5
La leptina, además, contribuye a un estado protrombótico al aumentar la expresión de PAI-1 en el endotelio vascular. Así pues, la regulación ascendente del PAI-1 inducida por la obesidad aumenta aún más el riesgo de coagulopatía, tras la infección por el SARS-CoV-2. 5
Disfunción endotelial
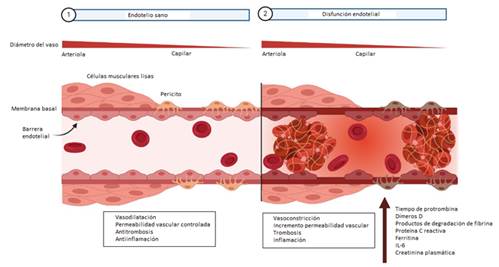
El endotelio regula la homeostasis vascular manteniendo un delicado equilibrio entre la secreción de vasodilatadores y vasoconstrictores. 44
La disfunción endotelial contribuye a diversos estados patológicos como la aterotrombosis, la trombosis arterial, la trombosis venosa, la coagulación intravascular y las microangiopatías trombóticas. 5
El estrés oxidativo se considera la principal causa de la disfunción endotelial. La obesidad genera estrés oxidativo a través de diferentes vías como la hiperglucemia, que daña los vasos por la acumulación de especies reactivas de oxígeno. 5
La hiperglucemia también activa el NF- κB, un factor de transcripción que media en la inflamación vascular. La producción exacerbada de citocinas proinflamatorias por el tejido adiposo aumenta aún más los niveles de estrés oxidativo y promueve la regulación al alza de los factores procoagulantes y disminuye las proteínas reguladoras anticoagulantes, genera trombina y activa las plaquetas. 5
No es casualidad que la disfunción endotelial sea una característica común de las comorbilidades que aumentan el riesgo de la COVID-19 grave, como la hipertensión, la obesidad, la diabetes mellitus, la enfermedad arterial coronaria y la insuficiencia cardíaca. 5
Además, dado que la ACE2 se expresa en las células endoteliales, la infección por el SARS-CoV-2 agrava aún más la disfunción endotelial. Así pues, la disfunción endotelial puede deberse a la infección por el SRAS-CoV-2 y a la excesiva inflamación sistémica asociada a la obesidad. Evidentemente, la disfunción endotelial preexistente aumenta el riesgo de complicaciones graves por SRAS-CoV-2. 5
Además de la furina, el endotelio expresa en alto grado la ACE2 y la TMPRSS2, lo que hace que el endotelio de los pacientes obesos sea muy susceptible a la infección por SARS-CoV-2. 44
La RI de la obesidad reduce los efectos protectores y antiinflamatorios del óxido nítrico (NO). 44 La administración de tocilizumab a pacientes con artritis reumatoide mejora la función vascular, por lo que podría presumirse un beneficio similar en los pacientes con COVID-19. 43
En la figura 3 se representa el endotelio vascular sano y disfuncional. 45 La disfunción del endotelio está indicada por una serie de biomarcadores.
Disfunción respiratoria relacionada con la obesidad
En los sujetos obesos, el depósito de grasa en el mediastino y en las cavidades abdominales altera las propiedades mecánicas del pulmón y de la pared torácica, con lo que cambia la estructura y la función del pulmón. 28
La obesidad deteriora la mecánica respiratoria y el intercambio de gases, aumenta la resistencia de las vías respiratorias, disminuye la fuerza muscular respiratoria, produce disfunción del surfactante y afecta los volúmenes pulmonares. 14,26,39,46
El exceso de tejido adiposo en el mediastino y el abdomen aumenta la presión intraabdominal sobre el diafragma, reduciendo más la capacidad vital y la hipoventilación pulmonar. 12,39 El efecto mecánico del depósito de grasa eleva la resistencia y condiciona el cierre prematuro de las vías respiratorias, la retención de gases, la presión positiva al final de la espiración y se exacerban enfermedades respiratorias como el síndrome de apnea del sueño, asma, disnea, apnea obstructiva del sueño, síndrome de hipoventilación, enfermedad pulmonar obstructiva crónica y la hipertensión pulmonar. 28
El aumento de las citocinas inflamatorias y las células inmunitarias altera la función pulmonar e inflama las vías respiratorias y pulmones, más grave en los pacientes con COVID-19. 27,28 La leptina actúa sobre los fibroblastos y contribuye a la inflamación pulmonar al inducir citocinas proinflamatorias. 26
Las zonas pulmonares inferiores tienen una mayor perfusión debido a la gravedad; sin embargo, estas zonas no están bien ventiladas porque la capacidad residual de los obesos está cerca de su volumen residual. Este desajuste de ventilación-perfusión disminuye la presión parcial de oxígeno (PO2). Además, estos pacientes consumen más oxígeno, por lo tanto, un mayor requerimiento de oxígeno y la hipoxia podrían exacerbar los problemas de oxigenación. 39
Los adipocitos pulmonares tienen un efecto proinflamatorio adicional en la función respiratoria de los pacientes con COVID-19. 26 El exceso de grasa puede conducir a la localización de adipocitos ectópicos en el espacio intersticial alveolar. Esos adipocitos pueden ser infectados por SARS-CoV-2, lo que agrava el infiltrado inflamatorio y el edema intersticial masivo.
Presencia de otras comorbilidades
Las comorbilidades frecuentes que se presentan en los obesos son la enfermedad respiratoria crónica, la enfermedad cardiovascular, la enfermedad renal crónica, DM2 y esteatosis hepática. 44,46 Estas enfermedades son factores de riesgo independientes para un mal pronóstico, cada una de las cuales contribuye a la progresión de la COVID-19 a través de diferentes mecanismos.
Las anomalías de los pacientes con esteatosis, como el deterioro del metabolismo de la glucosa y los lípidos, la hiperactivación plaquetaria y el estado de hipercoagulabilidad, la fibrosis hepática, la regulación ascendente de la ACE2 y una respuesta inflamatoria pronunciada, probablemente contribuyen a la gravedad de la COVID-19. 12
En los pacientes diabéticos y obesos, la RI debida al exceso de grasa podría conducir a una respuesta metabólica inadecuada al desafío inmunológico y a un mayor requerimiento de insulina durante la infección severa. 39) Incluso en ausencia de otras comorbilidades, la hipertensión, la dislipidemia y la RI podrían aumentar el riesgo de eventos cardiovasculares en pacientes obesos infectados por SARS-CoV-2.
Además, la hiperactividad del SRA en los pacientes obesos podría afectar al miocardio al aumentar los niveles de angiotensina II. 39) Asimismo, la obesidad podría conducir a la disfunción del ventrículo derecho en los pacientes con la COVID-19 debido al mayor volumen de plasma circulante.
El estado proinflamatorio de los pacientes obesos aumenta el riesgo de trombosis al crear un desequilibrio entre factores procoagulantes y anticoagulantes, generar trombina y activar las plaquetas. 39
La deficiencia de vitamina D es otro posible factor de riesgo para la COVID-19 grave porque esta vitamina desempeña un papel en la disminución de citocinas proinflamatorias. (39 Alrededor del 40 % a 80 % de la población obesa presenta una deficiencia debido a la dilución volumétrica, al secuestro de la vitamina D en el tejido adiposo y a la retroalimentación negativa de la 1,25-dihidroxivitamina D.
Estos datos indican que las comorbilidades asociadas a la obesidad se correlacionan con un peor pronóstico y mayor mortalidad, lo que sugiere que la obesidad es un factor de alto riesgo para los pacientes con la COVID-19. (44,47
La COVID-19 es una enfermedad nueva que se está estudiando todavía con aspectos polémicos y controversiales que requerirán posterior aclaración, lo que pudiera cambiar en el futuro cercano algunos de los postulados de este trabajo. No obstante, se desarrollaron los aspectos con mayor consenso actual entre los científicos sobre la relación de la obesidad con la COVID-19 grave.
Conclusiones
La obesidad es un factor de riesgo de la COVID-19 grave dado por el aumento de la tasa de hospitalización y de mortalidad por la infección por SARS-CoV-2.
La obesidad se acompaña de RI y de un estado inflamatorio crónico de bajo grado que provoca alteraciones metabólicas que favorecen los efectos adversos de la COVID-19.
Los mecanismos que vinculan la obesidad con la COVID-19 son múltiples e incluyen el aumento de la entrada del virus a sus células diana, disfunción de la respuesta inmune, alteraciones de la señalización de hormonas, trastornos de la coagulación, disfunción endotelial, trastornos respiratorios y la presencia de comorbilidades.