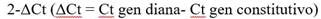INTRODUCCIÓN
Desde marzo del 2020 la Organización Mundial de la Salud (OMS) declaró como pandemia la infección por el Coronavirus 2 del síndrome respiratorio agudo severo (SARS-CoV-2, del inglés: severe acute respiratory syndrome coronavirus 2), agente causal de la enfermedad por coronavirus 2019 (COVID-19, del inglés: Coronavirus Disease 2019). El espectro clínico de la COVID-19, va desde una infección asintomática, infección respiratoria leve a moderada, hasta una dificultad respiratoria severa, con complicaciones que conducen a un fallo multiórgano. 1
Las formas severas de la COVID-19 se observan con mayor frecuencia en personas de la tercera edad y en individuos con comorbilidades asociadas, como la diabetes mellitus, trastornos cardiovasculares, enfermedad renal y la obesidad. El SARS-CoV-2 tiene un nivel de replicación alto en las células epiteliales y del sistema inmune innato, de las vías respiratorias altas, que constituyen la primera línea de defensa contra este virus. El reclutamiento y la activación de células de la respuesta inmune, productoras de citoquinas inflamatorias y antiinflamatorias, es indispensable para la eliminación del virus y paradójicamente están relacionadas con la patogénesis de la enfermedad. Dentro de la fisiopatología de la enfermedad, se describe la respuesta inflamatoria descontrolada, conocida como tormenta de citoquinas, que se caracterizada por la producción de citocinas inflamatorias asociada con las formas graves de la infección por SARS-CoV-2. Varios investigadores observaron que en el contexto de la COVID-19, se produce una regulación alta de la interleuquina (IL)-1, IL-6 y factor de necrosis tumoral alfa (TNF-α), que provocan daño alveolar y en la microvasculatura pulmonar. 2
El SARS-CoV-2 se une al receptor 2 de la enzima convertidora de la angiotensina (ACE2), localizado en la superficie de las células dianas. En el interior de las células infectadas el virus interactúa con receptores citosólicos de la inmunidad innata, estimulan la producción de citoquinas inflamatorias como los interferones (IFN), con actividad antiviral e inmunomoduladora, en particular el IFN gamma (IFN-γ). El factor transformador del crecimiento beta (TGF-β) modula la producción y los efectos del IFN en las infecciones respiratorias. Esta citocina tiene 3 isoformas, siendo el TGF-β1 la que tiene el papel fundamental en regulación inmune. 3 Para mantener el reclutamiento y tráfico de células inmunes (neutrófilos, macrófagos, células asesinas naturales) es necesario que se produzcan quimioquinas. El RANTES es un quimiotáctico potente, ha sido empleado como marcador subrogado de la actividad del IFN. 4
Considerando el papel crucial de la respuesta inmune innata de mucosa en el control temprano de la infección, y por ende, en la presentación clínica de la COVID-19; en el presente trabajo se emplearon los exudados nasofaríngeos, para evaluar los niveles de expresión de genes de mediadores inflamatorios tempranos. Además, se estimó sí el título viral influía en la aparición de síntomas al inicio de la infección por SARS-CoV-2.
MÉTODOS
Población de estudio
Muestras de exudado nasofaríngeos (ENF) fueron colectadas de 45 individuos diagnosticados con SARS-CoV-2 (18 mujeres, edad media igual a 39, 14 años y 27 varones, edad media igual a 40,22 años), de marzo a abril de 2020. Los individuos infectados fueron divididos en asintomáticos (24) y sintomáticos (21); y refirieron de 3 a 10 días de comienzo de los síntomas de COVID-19 o de contacto con casos confirmados. Los pacientes declararon síntomas como fiebre, tos seca, anorexia, fatiga, anosmia, dolor faríngeo y disnea. Ninguna enfermedad crónica fue identificada en los sujetos estudiados. La mayoría de los pacientes estudiados se recuperaron de la infección por SARS-CoV-2, excepto un paciente con síntomas que falleció. En el momento de colectar el ENF, ningún individuo tenía antecedentes de tratamiento antiviral o inmunomodulador. Como grupo control se incluyeron 20 individuos (13 mujeres y 7 varones, edad media igual a 45,31 años), negativos SARS-CoV-2, reclutados durante chequeos realizados a trabajadores de la salud. Todos los pacientes y controles que participaron en este estudio fueron tratados de forma anónima e identificados por códigos. Esta investigación fue aprobada por el Comité de Ética para las investigaciones del IPK.
Reverso transcripción PCR en tiempo real para el diagnóstico del SARS-CoV-2
Esta prueba de reverso de transcripción de la reacción en cadena de la polimerasa en tiempo real (RT-PCR), se realizó siguiendo el protocolo recomendado por la Organización Panamericana de la Salud. A partir de 140 μL de muestra, el ARN fue extraído usando el estuche comercial de QIAamp Viral RNA Kit (QIAGEN, Alemania). En un volumen final de 25 μL se realizó la RT-PCR, que contenía 5 μL de ARN, 2X solución de reacción y enzimas del estuche One-Step RT rt-PCR (Invitrogen, Life Technologies). El programa de ciclaje empleado fue 55 °C por 10 min. para la transcripción reversa, seguida por 95 °C por 3 min. y 45 ciclos de 95 °C por 15 seg., 58 °C por 30 seg., con oligonucleótidos y sondas específicas para el gen de la envoltura. La RT -PCR para el gen de la polimerasa fue usada como prueba confirmatoria. Como control de calidad se incluyeron controles internos, negativos y positivos en cada ensayo. El título viral fue semicuantificado por el valor del ciclo umbral (Ct) detectado en la RT-PCR.
Cuantificación relativa de citoquinas y quimioquina
El ARNm fue extraído de las células precipitadas de los ENF usando el estuche RNA Easy kit (QIAGEN, Alemania), siguiendo estrictamente el protocolo del fabricante. Las muestras de ARN fueron tratadas con la solución que elimina ADN genómico (gDNA Wipeout). La RT -PCR para la cuantificación de IFN-γ se realizó con el sistema TaqMan Universal One-Step qRT-PCR (Invitrogen, Life Technologies), siguiendo el protocolo descrito por Kim et al.5 El gen de la enzima glutaraldehido-3 fosfato deshidrogenasa (GAPDH) se usó como gen de referencia. La expresión de RANTES y TGF-β1 fue estimada según lo descrito por Ziklo et al.;6 primeramente el ARNm fue reverso-transcrito usando cebadores random y la enzima SuperScript® Reverse Transcriptase Kit (Invitrogen, Life Technologies). El ADNc sintetizado fue empleado como molde en la reacción de PCR, usando QuantiFastTMSYBR® Green PCR Kit (QIAGEN, Alemania). El gen de la beta actina (βactin) fue empleado para normalizar la expresión de RANTES y TGF-β1. Todos los PCR fueron corridos en triplicado en el equipo de Rotor Gene Q software 2.3.1.49. La concentración relativa del ARNm de las citoquinas fue controlada con los valores de Ct de los genes constitutivos, y transformada para cuantificar usando el método:
Análisis estadístico
Se realizó un estudio descriptivo, con una selección no aleatorizada de los individuos estudiados, el título viral de SARS-CoV-2 y los niveles de expresión de citoquinas fueron expresados en mediana y rango del intercuartil (m, RIC). Las diferencias y similitudes entre los casos sintomáticos y asintomáticos infectados por SARS-CoV-2 con el grupo control fueron realizadas con la prueba no paramétrica, Mann-Whitney U y Kruskal-Wallis con comparación múltiple Dunn's, para comparar 2 o 3 variables respectivamente. La correlación entre los niveles de expresión de IFN-γ y TGF-β1 fue analizada con el coeficiente de correlación rho (r) de Spearman's. La razón entre la mediana del IFN-γ:TGF-β1 se calculó para estimar la relación entre ambos marcadores, según los grupos definidos en el estudio. Todos los datos fueron evaluados con GraphPad Prism 7 (GraphPad, La Jolla, CA) y los valores de p< 0,05 se consideraron como estadísticamente significativos.
RESULTADOS
Teniendo en cuenta que el valor del Ct, guarda relación con el nivel de replicación viral presente en las muestras de ENF, se identificó que el título de SARS-CoV-2 fue similar en los casos asintomáticos (33,00; 29,00-37,00) y sintomáticos (30; 27,00-37,00); por lo que la diferencia entre los grupos no fue significativa (p = 0,4373).
El IFN-γ se expresó significativamente en individuos infectados por SARS-CoV-2, al comparar con el grupo control (1,18; 0,32-4,64 vs. 0,44; 0,13-0,98; p = 0,0393). Esta citoquina tuvo una expresión mayor en los pacientes sintomáticos; en contraste con el grupo control (2,61; 0,39-4,87; p = 0,0405). Sin embargo, no se identificó diferencias en la expresión del IFN-γ entre los casos sintomáticos y asintomáticos (0,84; 0,16-4,07; p = 0,2892) (figura 1A).
Al analizar el TGF-β1, se detectó que su expresión fue significativamente más baja en los individuos infectados con SARS-CoV-2, con respecto a los controles (0,05; 0,01-0,09 vs. 0,73; 0,22-2,35; p < 0,0001). Según los síntomas, la concentración relativa de ARNm de TGF-β1 no difirió significativamente entre los grupos, aunque la expresión decreció en personas asintomáticas con respecto a los sintomáticos (0,03; 0,01-0,10 vs. 0,07; 0,04-0,09) (figura 1B).
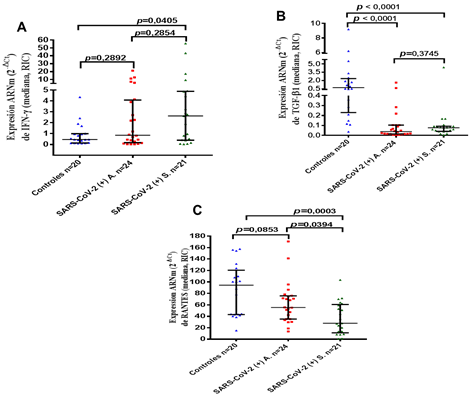
Fig. 1 Expresión relativa de mediadores inflamatorios en células colectadas del ENF. Las comparaciones se realizaron entre el grupo control (n =20) e individuos asintomáticos (SARS-CoV-2 (+) A, n = 24) y sintomáticos (SARS-CoV-2 (+) S, n = 21). A: expresión de ARNm de IFN-γ; B: expresión de ARNm de TGF-β1 y C: expresión de ARNm de RANTES. 7
Teniendo en cuenta que el balance entre citoquinas inflamatorias y antiinflamatorias, está relacionada con la expresión clínica e inmunopatogénesis de la infección por SARS-CoV-2, se evaluó la correlación entre la expresión de IFN-γ y TGF-β1. Se identificó una correlación positiva entre ambos biomarcadores en los controles (r = + 0,2723) y en los individuos asintomáticos infectados por SARS-CoV-2 (r = + 0,6141), la que resultó estadísticamente significativa (p = 0,0014) (Figura 2). Mientras que, se obtuvo una correlación negativa en los pacientes sintomáticos (r = -0,0390, p = 0,8667). Además, se empleó la razón IFN-γ:TGF-β1 por grupos para estimar el balance entre el mediador inflamatorio (IFN-γ) y el antiinflamatorio (TGF-β1). Estos valores fueron considerablemente menores en el grupo control (0,44/0,73 = 0,60), seguido por los asintomáticos (0,84/0,03 = 28,00), hasta alcanzar el valor más elevado en los pacientes sintomáticos infectados por SARS-CoV-2 (2,61/0,07 = 37,28).
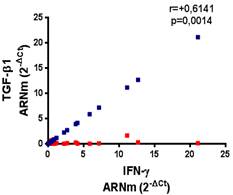
Fig. 2 Correlación entre el TGF-β1 e IFN-γ en pacientes sintomáticos infectados por SARS-CoV-2 (n= 21). 7
El RANTES es un quimioatrayente bien conocido de monocitos, células NK y linfocitos T, y constituye un enlace importante entre la respuesta inmune innata y adaptativa. El RANTES decreció significativamente en personas infectadas con SARS-CoV-2 (100,50; 43,38-124,00 vs. 50,91; 27,11-70,11; p = 0,0011), al compararla con el grupo control. A la par, la diferencia entre los controles y los casos sintomáticos fue relevante (31,73; 13,50-61,42; p = 0,0003). Sin embargo, la mediana y el RIC (55,15; 35,16-75,94; p = 0,0853) no difirió entre los pacientes asintomáticos con los individuos controles (Figura 1C), aunque la más baja expresión de RANTES se detectó en pacientes con síntomas de la infección por SARS-CoV-2.
DISCUSIÓN
Con respecto a los niveles de replicación de SARS-CoV-2, los hallazgos no difieren de lo obtenido por Zhou et al., lo que demuestra que en los individuos infectados por SARS-CoV-2, los títulos virales no determinan la presencia de síntomas de COVID-19, al momento del diagnóstico de la infección. 8 Sin embargo, se describió que la sintomatología de esta infección puede estar relacionada con cargas virales altas a nivel de la faringe al compararla con la nasal. 9 Por tanto, aunque no existe un tratamiento antiviral específico contra el SARS-CoV-2, es importante controlar y reducir la multiplicación viral, por lo que se recomienda independientemente de la sintomatología, administrar antivirales con probada eficacia contra otros virus (remdesevir), para evitar que personas infectadas actúen como reservorios y diseminen potencialmente el virus en la comunidad. 10 Además, al reducir el titulo viral se restringe la propagación del virus al pulmón y sitios extrapulmonares. 11
La expresión elevada de IFN-γ en células de vías aéreas superiores de los pacientes sintomáticos, sugiere que esta citocina contribuye a la patogenia de la infección por SARS-CoV-2. El IFN-γ es una citoquina crucial en la inmunidad mediada por células contra las enfermedades ocasionadas por virus. El papel del IFN-γ en la infección por coronavirus ha sido documentado, dado que puede inducir proteínas antivirales, que restringen la pérdida de la cubierta viral, la entrada del virus en la célula del hospedero e interfiere con el acceso al citoplasma de los viriones fagocitados en endosomas. 12 Esta citoquina tiene actividad antiviral e inmunomoduladora, pero al mismo tiempo su acción requiere ser regulada. La hiper-producción de IFN-γ conduce a una respuesta inflamatoria excesiva, contribuyendo a la patogénesis de la COVID-19. 13
Jamilloux et al. describieron que un desbalance entre citoquinas pro- y antiinflamatoria, puede determinar la aparición de síntomas en la etapa temprana de la infección por SARS-CoV-2. 14 En la presente investigación se identificó que el balance en la expresión de mediadores pro- y antiinflamatorio, tiene impacto en la presentación clínica de la infección, lo que avala el uso de inmumoduladores en el manejo terapéutico de la enfermedad. Se identificó que una correlación positiva entre el IFN-γ y el TGF-β1, evidencia que el control de la respuesta inmune podría determinar la ausencia de síntomas en la presentación de la infección por SARS-CoV-2. Los individuos asintomáticos no estaban inactivos desde el punto de vista inmunológico, sin embargo, ellos tenían un control temprano de la respuesta inflamatoria en el sitio primario de infección.
Aunque, varias quimioquinas (MCP1, MIP1α, MIP1β, IP-10) son producidas durante la infección por SARSCoV-2 y diferentes células son reclutadas y activadas por la interacción quimioquina/quimioquina receptor. 15 El reclutamiento de células inmunes dependiente de RANTES, decrece en la fase inicial de la infección, ya que disminuye la síntesis de novo, por tanto la quimiotaxis de células inmunes productoras de citoquinas se reduce. Sin embargo, la cinética del RANTES es bastante diferente en la fase tardía de la COVID-19, amplificando la cascada inflamatoria en los casos severos de infección por SARS-CoV-2. 16
Al finalizar, cabe destacar el valor añadido de la muestra del ENF, ya que es una muestra mínimamente invasiva y necesaria para el diagnóstico de SARS-CoV-2, que puede ser útil para la detección temprana de mediadores inmunológicos para determinar el curso clínico de la COVID-19.
Conclusiones
Teniendo en cuenta los resultados se concluye que, la infección por SARS CoV-2 incrementa la expresión de novo del IFN-γ en las células residentes del epitelio del tracto respiratorio superior, para tratar de controlar la replicación y diseminación viral del sitio inicial de infección. Por el contrario, estas células reducen su capacidad de producción de TGF-β1 y RANTES, en repuesta a la estimulación con IFN-γ. En los individuos con ausencia se síntomas en la etapa temprana de la infección pudiera estar justificada por la expresión de TGF-β1 y RANTES, que atenuaron el efecto inflamatorio del IFN-γ, y preservaron el flujo de células mononucleares, con actividad virucida, lo que reduce el daño inflamatorio de la mucosa respiratoria. Los autores sugieren que la evaluación del eje IFN-γ:TGF-β1 en el sitio primario de multiplicación viral, podría ser un biomarcador importante para predecir el curso clínico y evolución de la COVID-19, en la fase inicial de la infección por SARS-CoV-2.