INTRODUCCIÓN
La terapia antirretroviral de gran actividad (TARGA) ha constituido uno de los avances más significativos en el control de la epidemia de VIH/sida, debido a que ha permitido reducir la morbilidad y mortalidad en las personas que viven con VIH (PVV). Sin embargo, debido a que la TARGA no ha sido capaz de erradicar el virus del organismo, se ha necesitado que el tratamiento sea de por vida. 1 La aparición y transmisión de variantes del VIH resistentes a los antirretrovirales pueden producir un impacto negativo en el éxito del tratamiento a corto o largo plazo 2 y en el cumplimiento del tercer 90 de las metas 90-90-90 enunciadas por ONUSIDA para el año 2020. Dicha meta consiste en lograr valores de carga viral no detectable en el 90 % de los pacientes que están recibiendo TARGA. 3 La OMS ha recomendado que los países que han instaurado programas de terapia antirretroviral deben establecer sistemas de vigilancia de la resistencia del VIH a los antirretrovirales (HIVDR, siglas del inglés HIV drug resistance) en PVV que reciben TARGA y aquellas que no están tratadas, en conjunto con el monitoreo de los indicadores de alerta temprana. El propósito de la estrategia de la OMS con la vigilancia de la HIVDR ha sido reducir al mínimo la aparición de resistencia a los medicamentos, prolongar la eficacia de las terapias de primera y segunda línea, y mejorar la calidad de vida de las PVV. 4
La TARGA comenzó en Cuba en el año 2001 con el empleo en los esquemas de primera y segunda línea de antirretrovirales genéricos producidos por la industria biofarmacéutica nacional, lo que ha favorecido a más de 25 000 PVV hasta diciembre de 2018 según datos del Registro Informatizado MINSAP. En el año 2009 el Laboratorio de Investigaciones del Sida (LISIDA) introdujo los ensayos de resistencia genotípica del VIH para la población seropositiva del país, fundamentalmente en aquellas PVV sin historia previa de TARGA. La necesidad de conocer la prevalencia de mutaciones asociadas a la resistencia del VIH-1 a los antirretrovirales (ARV) conllevó a la realización del presente estudio, el cual además de brindar una actualización de la situación epidemiológica y molecular de la epidemia en Cuba, podría ser útil para optimizar la distribución de los recursos destinados a combatir la infección de VIH/sida y de ser necesario, diseñar nuevas estrategias terapéuticas por parte del MINSAP. El objetivo del presente estudio fue estimar la prevalencia de resistencia pretratamiento (PDR) del VIH-1 en pacientes cubanos que comenzaban TARGA.
MÉTODOS
Diseño del estudio y colección de la muestra
Se realizó un estudio analítico y descriptivo de corte transversal, donde participaron 610 individuos cubanos diagnosticados de la infección por VIH-1 y sin historia previa de TARGA, procedentes de todas las provincias del país. El estudio constó de 2 partes, la primera incluyó el período 2009-2016 y la segunda el año 2017, que abarcó la encuesta nacional de PDR.
Durante el período 2009-2016 la selección de los pacientes se realizó mediante un muestreo no aleatorio (muestras por cuotas) de acuerdo al total de diagnosticados en cada una de las provincias del país, lo que permitió estudiar a 469 pacientes diagnosticados recientemente de la infección por VIH-1. En el año 2017 según recomendaciones de la OMS se empleó el método de muestreo proporcional de la muestra para la selección de 141 pacientes procedentes de 15 municipios del país.
Se obtuvo el consentimiento informado de cada paciente que participó en el estudio, previo a la toma de muestra y colección de datos clínicos y demográficos. Se obtuvieron 10 mL de sangre total en tubos con EDTA y se enviaron a LISIDA para la determinación de la carga viral plasmática y la resistencia del VIH-1 a los ARV.
Determinación del subtipo y resistencia del VIH-1 a los antirretrovirales
El subtipo viral se determinó mediante la herramienta REGA HIV subtypingtool v 3.0 y se confirmó mediante el análisis filogenético. La resistencia del VIH-1 a los antirretrovirales se determinó mediante la herramienta HIVdb versión 8.2.0 de la base de resistencia del VIH a ARV de la Universidad de Stanford. Se evaluaron algunas variables clínicas y epidemiológicas.
Asociación de las variantes genéticas del VIH-1 y las mutaciones asociadas a la resistencia pretratamiento con la progresión clínica en seropositivos cubanos diagnosticados entre 2009 y 2016
Para asociar la progresión clínica de la enfermedad a las diferentes variantes genéticas del VIH-1 y las mutaciones asociadas a la resistencia transmitida del VIH-1 a los antirretrovirales, se realizó un estudio observacional retrospectivo a 160 pacientes del total de estudiados en el período 2009-2016. Se tuvo en cuenta los valores absolutos de los conteos de las células CD4+ de cada paciente desde el momento del diagnóstico confirmatorio hasta que clasificaron como sida y comenzaron la TARGA. Para el análisis de supervivencia según el estimado KAPLAN-MEIER y la prueba log-rack se compararon los diferentes subtipos, las agrupaciones subtipos B y no B y los que presentaron mutaciones asociadas a resistencia incluidos en el grupo “resistentes”, y un segundo grupo “no resistentes”.
Análisis estadístico
El análisis estadístico fue realizado mediante el programa GraphPad Prism 6 (San Diego, CA, USA). Las comparaciones entre grupos se determinaron mediante el test de Fisher o chi cuadrado para variables categóricas y para los valores de prevalencias se calculó el 95 % de los intervalos de confianza empleando el método modificado de Wald.
RESULTADOS
Comportamiento de los subtipos del VIH-1 y resistencia pretratamiento a los antirretrovirales durante el período 2009-2016
En las muestras analizadas durante el período 2009-2016 las variantes genéticas predominantes fueron: el subtipo B (27 %), las CRF 20, 23, 24_BG (23,5 %) y la CRF19_cpx (20,2 %). Se describió un aumento de las formas únicas recombinantes (URF) en la población de reciente diagnóstico en el período 2015-2016 (24,5 %; p<0,05). Las URF más frecuentes presentaron las combinaciones CRF19_cpx/B, BF1, BC, CRF19_cpx/CRF18_cpx.
El 19 % de los pacientes presentaron virus con alguna mutación asociada a la PDR del VIH-1 a los ARV: el 10,4 % a los inhibidores de la transcriptasa inversa análogos de nucleósidos (ITIAN), 12,8 % a los inhibidores de la transcriptasa inversa no análogos de nucleósidos (ITINAN), 2,8 % a los inhibidores de la proteasa (IP). Las mutaciones más frecuentes fueron K103N/S, Y181C en la familia de los ITINAN y M184V/I y D67N en la familia de los ITIAN, las cuales disminuyen la susceptibilidad a Nevirapina (NVP), Efavirenz (EFV) y lamivudina (3TC), zidovudina (AZT), respectivamente.
Asociación de las variantes genéticas del VIH-1 y las mutaciones asociadas a la resistencia pre-tratamiento con la progresión clínica en seropositivos cubanos diagnosticados entre 2009 y 2016
Las comparaciones realizadas entre los grupos de interés (subtipo No B versus subtipo B y CRF18_cpx versus CRF19_cpx versus B versus CRF 20, 23, 24_BG versus otros) no mostraron diferencias significativas entre los estimados de supervivencia (valor p = 0,964; valor p = 0,221, respectivamente).
La comparación realizada de los estimados de supervivencia entre los grupos resistentes y no resistentes no mostró diferencias significativas (valor p = 0,499).
Encuesta nacional de resistencia pretratamiento del VIH-1 en pacientes cubanos (período 2017)
El 80,9 % de los pacientes estudiados durante la encuesta nacional de resistencia pretratamiento del VIH-1 correspondieron al sexo masculino y el 76,3 % eran hombres que practicaban sexo con otros hombres (HSH). La mediana de la carga viral fue de 68 000 copias de ARN/mL y el conteo de células CD4+ de 371 cel/mm3. El 14,9 % de los pacientes estudiados presentó conteo de células CD4+ por debajo de 200 células/mm3. Las variantes genéticas predominantes fueron: el subtipo B (26,9%), CRF19_cpx (24,1 %), CRF 20, 23, 24_BG (23,4 %) y la CRF18_cpx (12 %).
En general, la prevalencia de PDR fue de 29,8 % (95 %, IC 22.3-38.1). La prevalencia fue de 10,6 % (95 %, IC 6.07-16.9) para algún ITIAN, 23,4 % (95 %, IC 16.7-31.3) para algún ITINAN y 1,4 % (95 %, IC 0.17-5.03) para algún IP. Las mutaciones más frecuentes detectadas fueron: K103N (12,9 %), G190A (6,4 %) y Y181C (4,8 %). El análisis filogenético de las 41 secuencias con mutaciones asociadas a resistencia no detectó ningún clúster de transmisión. La prevalencia de la resistencia pretratamiento del VIH-1 fue significativamente mayor en los pacientes con menos de 25 años de edad (43,9 %, 95% IC, 28,5-60,3; p=0,03). Las mujeres presentaron mayor prevalencia de resistencia pretratamiento (28,9 %, 95 % IC, 22,3-61,2), seguido de los HSH (21,6 %, 95 % IC; 14,3-30,4) y los hombres heterosexuales (20,6 %, 95 % IC 8,7-37,9). Con respecto a las familias de ARV y combinaciones terapéuticas, la detección de resistencia a los ITINAN en los pacientes menores de 25 años de edad fue altamente significativa (21,9 %; 95 % CI; 10,6-37,6, p<0,0001).
La determinación de los niveles de resistencia a las combinaciones de ARV de acuerdo a los valores de puntuación brindados por el algoritmo de interpretación de la base de datos de la Universidad de Stanford (resistencia alta e intermedia), indicaron que el tratamiento no sería efectivo en el 29,7 % de los pacientes que iniciaron terapia con el esquema lamivudina (3TC), zidovudina (AZT) y Nevirapina (NVP). La combinación terapéutica tenofovir (TDF), emtricitabina (FTC) y Efavirenz (EFV), componentes de la ATRIPLA ®, no sería efectiva en el 27,6 % de los pacientes que iniciaron TARGA (figura 1).
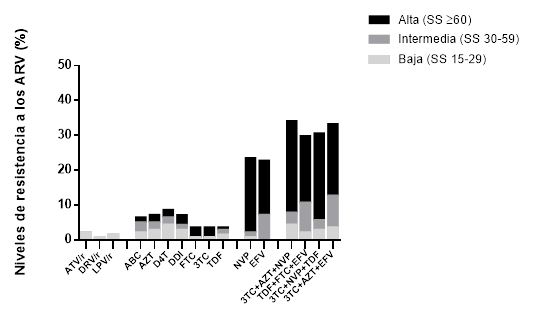
Fig. 1 Niveles de resistencia del VIH-1 a los antirretrovirales. Los niveles de resistencia pretratamiento del VIH-1 por fármaco antirretroviral se estimaron de las secuencias proteasa-RT de VIH-1 empleando el algoritmo Stanford HIVdbtool (v 8.3). Los niveles de resistencia a los antirretrovirales de acuerdo a la puntuación de Stanford (SS) se clasificaron como: alto, ≥60; intermedio, 30-50; o bajo (≥15-29). Se muestra la resistencia pretratamiento del VIH-1 para las combinaciones terapéuticas empleadas con más frecuencia. ATV/r: atazanavir/ritonavir; DRV/r: darunavir/ritonavir; LPV/r: lopinavir/ritonavir; ABC: abacavir; AZT: zidovudina; D4T: estavudina; DDI: didanosina; FTC: emtricitabina; 3TC: lamivudina; TDF: tenofovir; NVP: nevirapina, EFV: efavirenz.
DISCUSIÓN
Los resultados obtenidos en el presente trabajo permitieron profundizar en la epidemiología molecular del VIH-1 y por primera vez en Cuba se realizó un estudio representativo a nivel nacional para estimar la prevalencia de la PDR del VIH-1 en población no tratada, con el empleo de la metodología descrita por la OMS.
Los valores de prevalencia de resistencia pretratamiento en ambos períodos fueron superiores al 10 %. Valores de prevalencia de resistencia pretratamiento superiores al 10 % han sido reportados por países que han realizado estudios nacionales, tales como Namibia, Nicaragua, Uganda, Zimbabwe y Argentina. 5 Otros países que implementaron estudios nacionales de resistencia pretratamiento del VIH-1 según la metodología de la OMS mostraron una prevalencia menor del 10 %, tales como Myanmar, Brasil, México, Camerún, 5 Sudáfrica 6 y Tailandia. 7
La no adherencia a la TARGA es un factor que ha contribuido a la rápida aparición de virus resistentes y la persistencia de variantes virales con mutaciones asociadas a la resistencia a los ARV en un individuo, ha posibilitado una prolongada “ventana de oportunidades” para la transmisión secundaria de virus resistentes en el momento en que la carga viral plasmática se encuentraba elevada. 8,9 La detección de una mayor presencia de variantes del VIH-1 con mutaciones de resistencia pretratamiento en personas con menos de 25 años de edad indicó la transmisión de virus resistentes y su presencia en los primeros años de la infección. 10 Sin embargo, se detectaron variantes con mutaciones asociadas a resistencia en individuos infectados crónicamente con el VIH, lo que sustentó lo referido por varios autores sobre la persistencia de virus resistentes entre 3 y 10 años en individuos no tratados. 8,11 Además, la presencia de virus resistentes en sitios santuarios y la capacidad de integrarse al ADN de la célula del huésped ha favorecido la persistencia de las variantes de VIH-1 resistentes a los ARV. 12
Desde el 2001 Cuba comenzó la TARGA con el empleo de combinaciones de ITIAN y ITINAN producidos por la industria biofarmacéutica nacional, lo que ha beneficiado a más de 25 000 personas que viven con VIH. El empleo sostenido de la NVP o EFV en la primera línea terapéutica pudo favorecer la acumulación de mutaciones asociadas a la resistencia a estos medicamentos (K103N, G190A y Y181C) y la posterior transmisión de las variantes con estos cambios a la población. Diversos estudios llevados a cabo en población pretratamiento han descrito un aumento de la prevalencia de la resistencia del VIH-1 a los ITINAN desde el año 2001, a medida que se ha incrementado la cobertura de terapia ARV. En estudios realizados en varios países con la metodología de la OMS entre 2014-2016 la prevalencia de ITINAN en personas pretratamiento fue mayor en aquellos que habían estado expuestos previamente a ARV (21,6%), comparado con los no expuestos (8,3%) (p< 0.0001). 11
El 14,9 % de los pacientes que participaron en la encuesta nacional presentaron valores de conteo de células CD4+ por debajo de las 200 células/mm3, lo que indicó la depresión marcada de sus sistemas inmunológicos. En este grupo de personas la posible reinfección con variantes genéticas del VIH-1 diferentes a la causante de la infección primaria y que presentaban en su genoma mutaciones asociadas a resistencia a los ARV, podía ser una de las causas de detección de la resistencia pretratamiento. Varios estudios han asociado una mayor prevalencia de mutaciones de resistencia del VIH-1 en el subtipo B que en subtipos no B. 13,14
En el presente estudio no se encontró asociación de las variantes virales descritas y la presencia de mutaciones de resistencia. Empero, se detectó una mayor presencia de mutaciones en la CRF20, 23, 24_BG, la cual ha aumentado su circulación en la población seropositiva cubana. 15-18 En el período 2009-2016 se describió un aumento de las URF. Estos recombinantes han sido frecuentes en las regiones donde circulan múltiples subtipos, tal como han referido varios estudios realizados en Cuba. 18
En el grupo de seropositivos cubanos diagnosticados entre 2009-2016 no se encontraron diferencias significativas entre las variantes genéticas del VIH-1 y la progresión clínica de la enfermedad en la muestra estudiada. Este resultado es similar al obtenido por Díaz et. al.19 al analizar la asociación de los subtipos B y no B con la progresión a sida en 400 pacientes cubanos infectados por el VIH-1. Sin embargo, han diferido de los resultados descritos por un grupo de autores cubanos que asociaron a la CRF19_cpx con la rápida progresión a sida en pacientes recientemente diagnosticados. 20 Estas diferencias han podido estar dadas en que el número de pacientes estudiados en el presente trabajo es superior (160 versus 95), donde 41 pacientes presentaron la variante CRF19_cpx y de ellos, 25 progresaron a sida durante el período que abarcó el estudio.
La comparación realizada de los estimados de supervivencia entre los grupos resistentes y no resistentes no mostró diferencias significativas. Estos resultados han concordado con lo referido por otros autores que han planteado que la rápida progresión clínica a sida o la muerte no está asociada a la presencia de variantes de VIH-1 resistentes a fármacos antirretrovirales, debido a que las mismas pueden ser menos patogénicas que las variantes salvajes. 21,22 Sin embargo, la importancia de realizar este tipo de estudios en individuos recientemente diagnosticados radica en alertar sobre la influencia negativa de la resistencia a los ARV y sería una contribución a mejorar la atención médica y la calidad de vida a las PVV.
De forma general, los resultados obtenidos en el período 2009-2016 evidenciaron la necesidad de continuar la vigilancia epidemiológica y la búsqueda de nuevas estrategias terapéuticas que contribuyeran al cumplimiento acelerado de las metas enunciadas por la OMS. Dicha afirmación ha sido confirmada a través de los resultados obtenidos en la encuesta nacional de PDR, donde se evidenció que las combinaciones de fármacos empleados en la primera línea de tratamiento no serían efectivas en el 29,7 % de las PVV que comenzaran con 3TC+AZT+NVP y el 27,6 % de aquellos que iniciaran con ATRIPLA ®, por lo que se valoró el cambio de las estrategias de tratamiento en Cuba.
La OMS ha recomendado no emplear los ITINAN en la primera línea terapéutica si la prevalencia de la resistencia del VIH-1 a esta familia de fármacos es superior al 10 % y de no ser posible, considerar la realización del ensayo genotípico de resistencia del VIH-1 a los ARV antes de prescribir el tratamiento. 23 La no prescripción de ITINAN y la incorporación de dolutegravir (DTG), inhibidor de la integrasa en las combinaciones terapéuticas de primera línea en Cuba desde el cuarto trimestre del año 2018, constituyó una de las respuestas rápidas del MINSAP para enfrentar la resistencia del VIH-1 a los antirretrovirales. 24 Igualmente, la OMS ha descrito en el Plan de Acción Global para enfrentar la resistencia del VIH 2017-2021 un grupo de intervenciones a desarrollar, e inversión de recursos a nivel global y de país para guiar la respuesta frente a esta problemática. 23
El monitoreo sistemático de los indicadores de alerta temprana de la resistencia del VIH y las intervenciones educativas y profilácticas en cuanto a la buena adherencia al tratamiento en las personas que viven con VIH -principalmente en los jóvenes y mujeres- permitirá mantener el logro alcanzado por Cuba de ser el primer país del mundo en eliminar la transmisión del VIH de la madre al hijo y contribuir a cumplir el tercer 90 de las metas 90, 90, 90 propuestas por la OMS para el año 2020. Dicha meta consiste en garantizar que el 90 % o más de las PVV con TARGA alcancen valores no detectables de carga viral del VIH-1.
Conclusiones
En el presente estudio se describió un aumento de la PDR del VIH-1 a los ITINAN en pacientes cubanos, lo que evidenció la necesidad de valorar el cambio a estrategias terapéuticas más óptimas y eficaces y fortalecer las acciones de prevención y vigilancia de la resistencia del VIH-1 a los ARV.














