Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Información en Ciencias de la Salud
versión On-line ISSN 2307-2113
Rev. cuba. inf. cienc. salud vol.24 no.4 La Habana oct.-dic. 2013
ARTÍCULO ORIGINAL
Búsqueda en bases de datos de actividad biológica de moléculas quinoides
Database search on biological activity of quinoid molecules
CDr. C. Marlene Durán Lengua, Dr. C. Ricardo Gaitán Ibarra, Dr. C. Jesús Tadeo Olivero Verbel
Universidad de Cartagena, Colombia.
RESUMEN
Introducción: las quinonas son moléculas biológicas ampliamente distribuidas en la naturaleza. Recientemente el grupo de investigación de productos naturales, de la Universidad de Cartagena; obtuvo por extracción de plantas del género tabebuia y por síntesis química un número importante de estos compuestos. Sin embargo, con el fin de seguir profundizando en los estudios de sus actividades y su relación con el tipo de estructura lineal o angular se realizó una revisión en varias bases de datos.
Objetivo: buscar información que permitiera conocer si los compuestos obtenidos se encontraban reportados; así como también la actividad biológica y los bioensayos realizados a estas moléculas in vivo, in vitro e in silico.
Métodos: esta investigación fue desarrollada con el uso de un diseño que aplicó la edición de moléculas, mediante la interfaz gráfica de servidores (PUBCHEM CHEMIDPLUS ADVANCE, CHEBI) y una búsqueda de datos complementarios en la base de datos PUBMED. Los datos de la actividad biológica más relevantes fueron relacionados con la estructura química de los compuestos sintetizados y de los análogos suministrados por PUBMED.
Resultados: de los compuestos hallados en las bases de datos, 24 presentaron código en la base de datos PUBCHEM, 12 mostraron reportes de actividad biológica en las bases de datos, y se encontró que el mayor número de bioensayos fue reportado con furanonaftoquinonas, seguido por naftoquinonas.
Conclusiones: la actividad citotóxica y anticancerígena en diferentes líneas celulares, representa el mayor número de bioensayos realizados a estos compuestos.
Palabras clave: quinonas, moléculas pequeñas, bioensayos, bases de datos, actividad biológica.
ABSTRACT
Introduction: quinones are biological molecules widely distributed on the nature. Recently the group of natural products of the University of Cartagena (Colombia) obtained by extraction of plants of genus tabebuia and by chemistry synthesis an important number of these compounds. However with the purpose of made more detailed studies about the biological activity and structural type reported for these compounds, (naphtoquinone and furanonaphtoquinone linear o angular) reviewed in several database.
Objective: search information that allows us to know 1) The compounds were already registered 2) Biological activity and bioassay performed to these molecules, in vivo, in vitro and in silico.
Methods: this research was developed using a design of review than involved the edition of molecules by a graphic interface of server (PUBCHEM CHEMIDPLUS ADVANCE, CHEBI) and supplementary data search in PUBMED database. The most relevant data about biological activity was related with chemical structure of the synthesized compounds and their analogues obtained from databases.
Results: the compounds tested on the database, 24 were already on PUBCHEM database, 12 molecules show reports of biological activity on the databases. Founding that bigger number of bioassays was reported with furanonaphtoquinones, followed by naphtoquinones.
Conclusion: the cytotoxic and anticancer activity in cell lines of different type, represent the most of performed bioassay.
Key words: quinones, small molecules, bioassay, databases, biological activity.
INTRODUCCIÓN
Las quinonas son metabolitos secundarios ampliamente distribuidos en la naturaleza, los cuales se han obtenido de plantas, hongos, bacterias y organismos marinos.1 El grupo de investigación de productos naturales ha obtenido de fuentes naturales (bignoniáceas) y por síntesis química, compuestos quinoides diferenciados en el número y tipo de sustituyentes en el núcleo base.2 Los compuestos con base quinoide han sido estudiados in vivo, in vitro e in silico con el fin de evaluar y caracterizar efectos biológicos, entre los que se destacan anticancerígenos, antiparasitarios y citotóxicos atribuidos a estos compuestos. Los organismos internacionales han elaborado legislaciones para minimizar el uso de animales vertebrados, en la evaluación de efectos biológicos de compuestos, y han fomentado métodos alternativos.3 Estos métodos incluyen bases de datos internacionales actualizadas, usos de modelos matemáticos que relacionan la estructura química, y la actividad bioquímica y fisiológica de compuestos químicos (QSAR). Los experimentos virtuales, comúnmente llamados in silico, son un conjunto de herramientas que permiten modelar interacciones a nivel molecular y entender el comportamiento general de cualquier sistema biológico.4 Los modelos computacionales están basados en información biológica y producen datos confiables que dan la posibilidad de planear nuevas hipótesis.5 Las técnicas in vitro comprenden el uso de hongos, bacterias, fracciones subcelulares, cultivos celulares, tejidos u órganos mantenidos en nutrientes; sin embargo, los métodos in vitro no suplantan los ensayos in vivo.6
Por la importancia biológica presentada por los compuestos con estructuras quinoides, muchos investigadores han dirigido sus investigaciones a la búsqueda de mecanismos que justifiquen su actividad y han hallado, entre otros, los siguientes: alteración de la membrana celular y/o nuclear, generación de acoplamientos con ácido desoxirribonucleico (ADN) y formación de especies reactivas de oxigeno (ERO). Los compuestos quinoides aceptan electrones, por la atracción conferida por los sustituyentes de los residuos quinoides, los cuales modulan las propiedades redox responsables del estrés oxidativo, mecanismo implicado en la inhibición del crecimiento bacteriano, viral y de células cancerígenas.6 La búsqueda de información adicional podría ampliar posibles aplicaciones para moléculas de este tipo, que ayudarían a dirigir de manera racional futuras investigaciones apoyadas en características estructurales y su relación con la actividad biológica descrita para los compuestos investigados.
Algunas quinonas son utilizadas como agentes farmacológicos: doxorubicina y mitomicina con actividad anticancerígena,7 y atovaquona como agente antipalúdico.8 López y otros sugieren que las actividades que presentan estos compuestos están basadas en una relación estructura-actividad, para lo cual tienen en consideración el tipo, la posición y la electrofilia de los sustituyentes.9
Este trabajo tuvo como objetivo buscar información para conocer si los compuestos obtenidos se encontraban reportados, así como la actividad biológica y los bioensayos realizados a estas moléculas in vivo, in vitro e in silico.
MÉTODOS
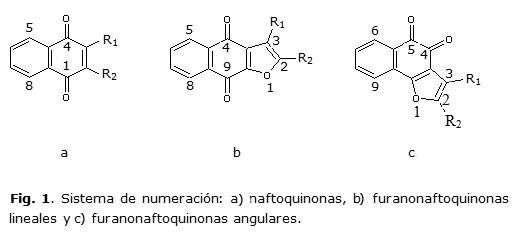
Las estructuras de 30 moléculas tipo quinonas, de origen natural y sintético, cuya numeración se explica en la figura 1, fueron sometidas a un proceso de revisión: ocho naftoquinonas, seis furanonaftoquinonas (lineales), cuatro furanonaftoquinonas (angulares), siete dihidrofuranonaftoquinonas (lineales) y cinco dihidrofuranonaftoquinonas (angulares).
En esta revisión las estructuras de las quinonas naturales y sintéticas fueron editadas en la interfaz gráfica de la base de datos PubChem: http://pubchem.ncbi.nlm.nih.gov/help.html10,11 y en ChemIDplus Advance: http://chem.sis.nlm.nih.gov/chemidplus/Chebi.12,13 La base de datos más consultada por su completa información fue PubChem, ya que presenta las estructuras de las moléculas codificadas y vínculos, mediante el cual se accede a otros servidores. Este sistema está soportado y operado por el Centro Nacional para la Información de la Biotecnología (NCBI), un componente de la Biblioteca Nacional de Medicina, y el Instituto Nacional de Salud (NIH) de los Estados Unidos.11 Una vez obtenida la evidencia de actividad biológica, se utilizó un vínculo (related record) que permitió el acceso a estructuras análogas a la revisada, y con esa información se analizaron las características estructurales comunes que coincidían con una actividad biológica determinada.
RESULTADOS Y DISCUSIÓN
De las quinonas sometidas a la interfaz gráfica, 24 están registradas y codificadas en las bases de datos consultadas, de las cuales 12 tienen reportados bioensayos con actividad biológica (Figs. 2 y 3). Durante el proceso con cada molécula, se obtuvo un amplio número de compuestos similares, con reportes de bioensayos realizados a cada molécula en particular, hecho que permitió correlacionar características estructurales con la actividad biológica reportada para cada grupo en estudio.
El servidor PubChem registra la mayor información, sustentado por tres bases de datos PubChem (PC):
- PC sustancia: esta tiene más de 61 millones de sustancias registradas.
- PC compuesto: con más de 25 millones de estructuras.
- PC bioensayos: con más de 1 600 bioensayos realizados. Esta base de datos posee vínculos con otros servidores, que permiten la conexión a literatura científica relacionada, y vínculos que llevan a moléculas similares, denominadas isómeros conformacionales, y detalles acerca de la relación estructura-actividad.12
A lo largo de esta revisión se hallaron numerosos estudios con estas moléculas, en los cuales se muestra el efecto tripanocida,14 así como la actividad antimalárica,2,15,16 anticancerígena,17 antiproliferativa,18 y antibacteriana.19
Los datos arrojados para el compuesto 1 (2-cloro, 3-metil-1,4-naftoquinona), identificado en PubChem con el código 123368, reporta un ensayo positivo como inhibidor de la peroxidación lipídica, estudio evaluado en muestras homogenizadas de cerebro de ratas.20 El método utilizado en este estudio fue la determinación malonildialdehído (MDA) producto de la oxidación, a través de la reacción con ácido tiobarbitúrico (TBA), aunque esta reacción es inespecífica, ya que TBA reacciona con una variedad de aldehídos, no solo con los formados como resultado de la peroxidación lipídica, sino también con glucosa, desoxirribosa, ácido ascórbico, homocisteína y algunos aminoácidos, como prolina, arginina y glutamato.21 Sin embargo, esta reacción es utilizada ampliamente en el campo investigativo.
Análogos relacionados, sustituidos con átomos de cloro, presentan actividad anticancerígena.22 Este estudio fue evaluado usando como blanco específico la enzima indolamina 2,3 dioxigenasa, la cual cataliza la degradación del triptófano hasta formilquinurenina. La degradación de triptófano mediada por esta enzima se considera tóxica y responsable de la progresión tumoral,23 inhibición de serino-proteasa en citomegalovirus,24 que juega un papel importante en la maduración y ensamblaje de la cápside del citomegalovirus. Esta enzima es un blanco atractivo en la investigación de agentes promisorios en quimioterapia antiviral.
Estos análogos fueron evaluados en bioensayos relacionados con procesos inflamatorios, medidos in vitro en el modelo polimorfonuclear neutrófilos (PMN), en el cual evaluaron liberación de lisozima y b-glucoronidasa. Estos compuestos mostraron inhibición de la desgranulación del PMN cuando fueron estimulados por el formilpeptido N-formil-metionil-leucil-fenilalanina (fMLP). La actividad antialérgica, para estos compuestos, fue evaluada por liberación de histamina en mastocitos obtenidos de la cavidad peritoneal de rata Sprague-Dawley, la cual mostró un efecto significativo en la inhibición de la desgranulación de estas células.25 Basados en la anterior información, se podría postular al compuesto 1 como candidato para profundizar estudios relacionados con las actividades antes reportadas.
Investigaciones con compuestos quinoides han mostrado inhibición del crecimiento de células cancerígenas, ya que actúan como agentes alquilantes biorreductores.26 Estas prodrogas no son citotóxicas en su forma original, pero pueden activarse al experimentar reducción enzimática dentro de las células, y convertirse en especies químicas capaces de producir alquilación en macromoléculas biológicas.27 Las quinonas actúan como oxidantes y electrófilos, una adición nucleofílica a una biomolécula; representan una reducción que implica 1 o 2 electrones;28 juegan un papel clave como agentes biorreductores, potenciadores del estrés oxidativo y alquilación de nucleófilos celulares, y abarcan un amplio rango de biomoleculas.29
El compuesto 2, muestra reporte de 30 ensayos biológicos, en la base de datos PubChem, de los cuales 4 muestran actividad anticancerígena. Estos ensayos fueron realizados en cepas de levaduras Saccharomyces cereviseae, con mutaciones genéticas definidas en la reparación del ADN; control de genes encargados de la proliferación y control del crecimiento celular.30 Esta información está registrada en la base de datos del Instituto Nacional del Cáncer de los Estados Unidos (NCI). Este compuesto tiene estudios que reportan la inhibición de polimerasa de ARN de Vibrio cholerae. Los datos se encuentran detallados en esta base de datos. De otro lado, estudios realizados por Moret y otros mostraron que la actividad biológica se relaciona con la hidrofobicidad de estos compuestos.31
A través del vínculo a Pubmed se obtuvo información referente a análogos al compuesto 2 obtenido de plantas, con actividad contra Pseudomona aeruginosa, ampliamente extendida en la naturaleza. Esta se ha aislado de infecciones nosocomiales, neumonía, infecciones del tracto urinario y en bacteriemia.32 El estudio sobre Staphylococcus aureus pone de manifiesto el papel de las estructuras quinoides y el carácter lipofílico en la actividad de estos compuestos. Las furanonaftoquinonas evaluadas inhibieron el crecimiento de Staphylococcus aureus resistentes y sensibles a meticilina. En esta investigación la furanonaftoquinona con un doble enlace adicional presentó menor valor en la concentración mínima inhibitoria (MIC).33
El pigmento quinoide phthiocol, aislado de Mycobacterium tuberculosis; y piocianina producido por Pseudomona aeruginosa, similares al compuesto 3, 3-metil- 2-hidroxi-naftoquinona, fueron evaluados en su efecto sobre la producción de anión superóxido (O2-) en cultivo de células epiteliales pulmonares tipo A 549, y se midió específicamente la inhibición de la enzima aconitasa, la cual es un indicador sensible de cambios en la actividad de anión superóxido O2- in vivo e in vitro y cataliza la conversión de citrato a isocitrato. La producción de anión superóxido es un mecanismo de interés, al momento de diseñar compuestos con actividad citotóxica y antibiótica.34 Los compuestos 4, 5, 6 y 7 no tienen reporte de actividad biológica en las bases de datos consultadas.
El compuesto epoxídico 8, tiene reportada inhibición de la enzima metiltransferasa de histona-lisina, relacionada con la transferencia de grupos metilos desde adenosil-metionina hasta los aminoácidos lisina o arginina de las histonas. Las histonas metiladas se unen fuertemente al ADN e inhiben el proceso de transcripción.
Esta molécula ha sido evaluada en cepas de levadura Saccharomyces cerevisiae, la cual inhibió la enzima b-DNA polimerasa, y la proteína TOR (blanco de rapamicina); esta última participa en el inicio de la transcripción del ARN mensajero (mARN) y la síntesis de proteínas; regula rutas de señalización relacionadas con el crecimiento y progresión del ciclo celular; TOR se encuentra asociada a las regiones promotoras de los genes que se transcriben y esta interacción es bloqueada por rapamicina (macrolido inmunosupresor utilizado para evitar el rechazo en trasplantes de órganos).35 Estas actividades están relacionadas con el desarrollo de células cancerígenas (Base de datos PubChem-CID 85844).
El compuesto 9 metil epóxido, similar a menadiona, genera radical hidroxilo (OH-) en presencia de iones metálicos. Los radicales libres producen alteración al ácido desoxirribonucleico (ADN) e inducen apoptosis. Estudios realizados a compuestos similares reportan inhibición de la proliferación celular y detención del ciclo celular.36 Bioensayos de actividad anticancerígena por inducción de apoptosis en células U87 línea celular humana de glioblastoma mostraron fragmentación del ADN y condensación de cromatina.37
El compuesto 10 (Naphtho[2,3-b] furan-4,9-diones) fue reportado en Pubchem con más de 20 bioensayos positivos, los cuales evaluaron la citotoxicidad del compuesto en varias líneas celulares normales: fibroblastos gingivales (HGF), célula pulpa (HPC), fibroblastos del ligamento periodontal (HPLF); y líneas celulares tumorales: células escamosas de carcinoma oral (HSC-2, HSC-3, HSC-4) y leucemia promielocitica (HL-60).38,39 La misma molécula fue evaluada in silico para determinar su potencial contra Tripanosoma cruzi.14 Mediante métodos estadísticos se seleccionaron cuatro descriptores que se correlacionaron con la actividad tripanocida: 1) ángulo de torsión, 2) suma de valores absolutos de cargas atómicas, 3) volumen de sustituyentes en la región B, y 4) energía del orbital molecular bajo, los cuales fueron calculados mediante el método DFT/B3LYP (teoría del funcional densidad), en una de las versiones más utilizadas, el funcional hibrido B3LYP (Becke, 3-parámetro, Lee-Yang-Parr), con aproximaciones de correlación-intercambio para compuestos orgánicos y metales de transición.40 Muchas propiedades están relacionadas con energías totales o diferencias. Estos descriptores proporcionan información acerca del tipo de interacción que ocurre entre los compuestos y el receptor biológico. De otro lado, estas moléculas, por su estructura planar aromática, se pueden intercalar en la molécula de ADN, con la consecuente producción de apoptosis y necrosis en células malignas.41
El compuesto 11 fue evaluado en su actividad citotóxica, y se destacó su selectividad en comparación con las células epiteliales normales. Este compuesto actúa como antitumoral por inducción de apoptosis, con efecto sobre la expresión de proteínas pertenecientes a la familia Bcl-2 (proteína 2 de células B), las cuales regulan procesos en la permeabilización mitocondrial, con un papel importante en la vía intrínseca de la apoptosis celular. Su alteración podría estar relacionada con necrosis por daño mitocondrial.42 La actividad metabólica y el efecto de los oncogenes favorecen el aumento de las especies reactivas de oxígeno, con lo que promueven la inestabilidad genética.43 De otro lado, las células cancerígenas tienen bajas defensas antioxidantes,44 característica que las hace más vulnerables y selectivas comparadas con las células normales.
El compuesto 12, furanonaftoquinona sustituida en la posición dos por un grupo 2-hidroxietil y varias estructura similares, fueron evaluadas en tripomastigote de Tripanosoma cruzi con resultados inespecíficos (Base de datos Pubchem CID 497532). Ferreira evaluó la actividad de una serie de compuestos quinoides contra Toxoplasma gondii, in vitro e in vivo, de los cuales siete mostraron actividad in vitro, mientras que tres fueron efectivos in vivo.45
Los compuestos 13, 14, 16, 17 y 18 no registran reportes de ensayos biológicos en las bases de datos investigadas. El compuesto 15 2-acetil furanonaftoquinona lineal, reportó bioensayos positivos para actividad citotóxica, anti-proliferativa46 y anticancerígena.47
Una serie de compuestos quinoides similares, aislados de Tabebuia impetiginosa, fueron evaluados in vitro, y mostraron inhibición del crecimiento de keratinocitos humanos línea HaCaT. Estas células han permitido la caracterización de procesos metabólicos en piel y vitamina D.48 Compuestos que inhiben el crecimiento de estas células merecen estudios más profundos que avalen su potencial actividad antipsoriasis. En investigaciones que evalúan la inhibición de estas células son consideradas potenciales agentes antipsoriasis.46,49,50
El compuesto 19, 2-fenil furanonaftoquinona lineal y moléculas similares, fue investigado por Klebe, y el efecto citotóxico en un ambiente virtual, con el uso de modelos de relación estructura-actividad (3D QSAR) para lo cual utilizó el método CoMSIA (del inglés Comparative Molecular Similarity Index Analysis), el cual calcula índices de similitud para un conjunto de moléculas previamente alineadas con respecto a propiedades fisicoquímicas; interacciones de distintos tipos, estéricas, electrostáticas y puentes de hidrógeno. Esos índices luego se correlacionan con la actividad citotóxica.51 Pérez-Sacau determinó estructuras específicas capaces de unirse a ligando claves para el despliegue de propiedades antitumorales.52
Con respecto al compuesto 20, una furanonaftoquinona angular, Tseng reportó inhibición de la proliferación celular. Los ensayos fueron realizados en líneas celulares de carcinomas humanos MCF7 (cáncer de mama), SF268 (glioblastoma), K562 (eritroleucemia) y en la línea de fibroblastos Detroit 551; y mostraron inhibición del crecimiento celular en la línea K562, mientras que los ensayos efectuados en fibroblastos no mostraron citotoxicidad.53 En este estudio fue determinado el índice de selectividad (IS=concentración citotóxica50/concentración inhibitoria 50), el cual es utilizado para determinar la selectividad de un compuesto o especie química con respecto a una serie de ensayos biológicos.54,55 Un compuesto análogo al 20 arrojó un IS alto comparable con el IS de daunorrubicina, un fármaco utilizado en quimioterapia.53 Este compuesto inhibió de manera reversible la enzima tirosina fosfatasa (CD45), de particular importancia en desórdenes autoinmunes, rechazo y trasplantes; hecho que pudiera explicar por qué este compuesto inhibe la proliferación celular.56 Por los bioensayos realizados al compuesto 20 y los resultados obtenidos en las diferentes investigaciones, sus indicios de selectividad hacen a esta molécula interesante para seguir ahondando en su estudio y evaluación de la actividad antiproliferativa y citotóxica de este compuesto. Un análogo de este: 2-Methyl-2-(2-methylpropenyl)-2,3-dihydronaphthoquinone [2,3-b] furan-4,9-dione (NFD-37), inhibió la interleucina 6 (IL 6),57 ensayo realizado en macrófagos de murino estimulados con lipopolisacáridos (LPS), lo cual nos hace inferir que estos compuestos podrían ser explorados en su potencial antiinflamatorio.
El compuesto 21, codificado en la base de datos con ensayos biológicos de citotoxicidad realizados en células KB (carcinoma epidermoide humano); furanonaftoquinonas angulares con estructura similar, aisladas de Psychotria rubra, mostraron citotoxicidad significativa en la línea celular KB, que señalaron que sustituciones con grupos hidrofílicos disminuyen la actividad biológica de estos compuestos.58
Furanonaftoquinonas similares a los compuestos estudiados fueron activos contra tripomastigotes de Tripanosoma cruzi,59 y confirmaron que la geometría angular está fuertemente relacionada con la actividad biológica presentada por estos compuestos. Otros análogos quinoides tricíclicos, tipo alfa lapachona, fueron significativamente citotóxicos en células de mamíferos cultivadas in vitro; línea P388 linfoblástica.60 Estos compuestos también presentaron actividad frente a cepas de Plasmodium falciparum resistentes a cloroquina, cepa K1 y cepa sensible T9-96.61 Los compuestos 22, 23 y 24 están registrados y sin reportes de actividad biológica al momento de terminar esta revisión.
Naftoquinonas y furanonaftoquinonas ejercen efectos anticancerígenos gracias a sus capacidades de generar especies reactivas de oxígeno, teniendo en cuenta su electrofilia, mediante la cual forman aductos con los constituyentes celulares; características que fueron demostradas por Kviecinski, quien observó un aumento en los niveles de especies reactivas de oxígeno (ERO) en células T24 expuestas a juglona (naftoquinona hidroxilada en la posición ocho). La generación de ERO fue acompañada por un aumento en el consumo intracelular de glutatión reducido GSH.62 Los resultados obtenidos a través de esta revisión en los diferentes ensayos realizados a estas moléculas (in vivo e in vitro), apuntan hacia mecanismos relacionados con la capacidad de inhibir la cadena transportadora de electrones, desacopladores de la fosforilación oxidativa, agentes intercalantes en la doble hélice del ADN y alquilantes de biomoleculas.63
En esta revisión, el mayor número de bioensayos con actividad biológica corresponde a la actividad citotóxica y anticancerígena, mientras que la actividad antiparasitaria fue realizada a Plasmodium spp y Tripanosoma cruzi. Las propiedades antitumorales y el mecanismo de acción de las quinonas ha sido estudiado y se conoce que ellas pueden actuar como inhibidores de la topoisomerasa, intercalación en el DNA y posterior reducción de las quinonas por oxido-reductasas.64
Simamura realizó estudios con furanonaftoquinonas en células A 549 de adenocarcinoma pulmonar humano, las cuales desarrollaron una masiva producción de H2O2, alteración del potencial de la membrana mitocondrial, liberación de citocromo C y caspasa 9,65 acciones que inducen la muerte celular (apoptosis), un mecanismo a tener en cuenta en la terapia contra el cáncer. Entre los compuestos evaluados, la mayor cantidad de reportes para actividad biológica y el mayor número de ensayos se han realizado en el grupo de las furanonaftoquinonas lineales. Estos ensayos en su mayoría evaluaron citotoxidad. La actividad antiparasitaria parece concentrarse en las furanonaftoquinonas tanto lineales como angulares, con ensayos in vitro e in silico relacionados principalmente con T. cruzi y P. falciparum. A lo largo de esta revisión la atención se concentró en estos dos parásitos, posiblemente por dos razones: la primera, el limitado número de fármacos utilizados para el tratamiento, y la segunda, la resistencia que estos presentan a los medicamentos existentes.
Se concluye que las bases de datos consultadas suministran amplia información que puede ser aprovechada como herramienta para dirigir con altas probabilidades de éxito el tamizaje biológico de productos naturales y sintéticos. La correcta utilización de esta información puede correlacionarse, para encontrar evidencias adicionales que permitan crear modelos cercanos a farmacóforos que reducen tiempo y costo en el diseño de moléculas con potencial biológico.
La información relacionada con las actividades biológicas ensayadas brinda la posibilidad de conocer blancos moleculares sobre los cuales podrían actuar nuevas estructuras análogas e, incluso, datos fisicoquímicos reportados suministran ideas aproximadas acerca de las características fisicoquímicas necesarias para optimizar nuevas moléculas. Los ensayos biológicos de las moléculas revisadas son escasos, los cuales cubren solo el 40 % de los compuestos evaluados, hecho que en cierta forma abre grandes posibilidades de indagación para las moléculas sin reporte, y para profundizar en los estudios reportados. Estos ensayos en su gran mayoría estuvieron relacionados con actividad anticancerígena y citotóxica, en menor grado con actividad antibacteriana y antiparasitaria.
Estos resultados estimulan la obtención de nuevas moléculas naturales o sintéticas, con el cuidado de mantener características estructurales necesarias para la actividad biológica y adicionar otras que pudieran mejorar el perfil biológico, según la tendencia evidenciada en el análisis de las estructuras reportadas.
La ausencia de reportes y la no codificación de algunos de estos compuestos, son indicativos que se convierten en soportes adicionales, que sopesan la novedad estructural de algunos de los compuestos sintetizados.
REFERENCIAS BIBLIOGRÁFICAS
1. Bernardo PH, Chai CL, Le Guen M, Smith GD, Waring P. Structure-activity delineation of quinones related to the biologically active Calothrixin B. Bioorg Med Chem Lett. 2007;17(1):82-5.
2. Gaitán Ibarra RAE, Álvarez W, Jaraba-Salgado Z. Obtención de análogos de productos naturales furanonaftoquinónicos y evaluación de su actividad antimalárica frente a Plasmodium falciparum. Scientia et Technica. 2007;33:141-4.
3. Repetto G, Repetto M. Métodos alternativos: estudios toxicológicos in vitro. Toxicología especial. Díaz de Santos; 1995:37-59.
4. Kumar N, Hendriks BS, Janes KA, de Graaf D, Lauffenburger DA. Applying computational modeling to drug discovery and development. Drug discovery today. 2006;11(17):806-11.
5. Frazier JM. In vitro toxicity testing: applications to safety evaluation: Inform Health Care; 1992.
6. Canales M, Hernández T, Serrano R, Hernández LB, Durán A, Ríos V, et al. Antimicrobial and general toxicity activities of Gymnosperma glutinosum: a comparative study. J Ethnopharmacol. 2007;110(2):343-7.
7. Koo DH, Lee JL, Kim TW, Chang HM, Ryu MH, Yook JH, et al. Adjuvant chemotherapy with 5-fluorouracil, doxorubicin and mitomycin-C (FAM) for 6 months after curative resection of gastric carcinoma. Europ J Surg Oncol (EJSO). 2007;33(7):843-8.
8. Siregar JE, Syafruddin D, Matsuoka H, Kita K, Marzuki S. Mutation underlying resistance of Plasmodium berghei to atovaquone in the quinone binding domain 2 (Qo2) of the cytochrome b gene. Parasitology International. 2008;57(2):229-32.
9. López L, Ll I. Las naftoquinonas: más que pigmentos naturales. Rev Mex Cienc Farmacéut. 2011;42(1):6-17.
10. Ihlenfeldt W, Bolton E, Bryant S. The PubChem chemical structure sketcher. J Cheminform. 2009;1(1):20.
11. Chen B, Wild D, Guha R. PubChem as a source of polypharmacology. J Chem Inf Model. 2009;49(9):2044-55.
12. Degtyarenko K, de Matos P, Ennis M, Hastings J, Zbinden M, McNaught A, et al. ChEBI: a database and ontology for chemical entities of biological interest. Nucleic Acids Res. 2008:D344-50.
13. de Matos P, Alcantara R, Dekker A, Ennis M, Hastings J, Haug K, et al. Chemical Entities of Biological Interest: an update. Nucleic Acids Res. 2009;38(Database issue):D249-54.
14. Molfetta FA, Bruni AT, Honorio KM, da Silva AB. A structure-activity relationship study of quinone compounds with trypanocidal activity. Eur J Med Chem. 2005 Apr;40(4):329-38.
15. Grellier P, Maroziene A, Nivinskas H, Sarlauskas J, Aliverti ANC. Antiplasmodial activity of quinones: Roles of aziridinyl substituents and the inhibition of Plasmodium falciparum glutathione reductase. Arch Biochem Bioph. 2010;494(1):32-9.
16. El Hage S, Ane Ml, Stigliani JL, Marjorie M, Vial H, Baziard-Mouysset GV, et al. Synthesis and antimalarial activity of new atovaquone derivatives. Europ J Med Chem. 2009;44(11):4778-82.
17. Sagar S, Green IR. Pro-apoptotic activities of novel synthetic quinones in human cancer cell lines. Canc Lett. 2009;285(1):23-7.
18. Rios-Luci C, Bonifazi EL, Leon LG, Montero JC, Burton G, Pandiella A, et al. beta-Lapachone analogs with enhanced antiproliferative activity. Eur J Med Chem. 2012;53C:264-74.
19. Rodríguez EGR, Méndez D, Martelo J, Zambrano R. Análogos de quinonas naturales con actividad antibacteriana. Scien Techn. 2007;33:281-3.
20. Jung YS, Joe BY, Cho SJ, Konishi Y. 2,3-Dimethoxy-5-methyl-1,4-benzoquinones and 2-methyl-1,4-naphthoquinones: glycation inhibitors with lipid peroxidation activity. Bioorg Med Chem Lett. 2005;15(4):1125-9.
21. Spickett CM, Wiswedel I, Siems W, Zarkovic K, Zarkovic N. Advances in methods for the determination of biologically relevant lipid peroxidation products. Free radical research. 2010;44(10):1172-202.
22. Kumar S, Malachowski WP, DuHadaway JB, LaLonde JM, Carroll PJ, Jaller D, et al. Indoleamine 2,3-dioxygenase is the anticancer target for a novel series of potent naphthoquinone-based inhibitors. J Med Chem. 2008;51(6):1706-18.
23. Adams S, Braidy N, Bessesde A, Brew BJ, Grant R, Teo C, et al. The kynurenine pathway in brain tumor pathogenesis. Canc res. 2012;72(22):5649-57.
24. Ertl P, Cooper D, Allen G, Slater MJ. 2-chloro-3-substituted-1,4-naphthoquinone inactivators of human cytomegalovirus protease. Bioorg Med Chem Lett. 1999;9(19):2863-6.
25. Lien JC, Huang LJ, Wang JP, Teng CM, Lee KH, Kuo SC. Synthesis and antiplatelet, antiinflammatory and antiallergic activities of 2-substituted 3-chloro-1,4-naphthoquinone derivatives. Bioorg Med Chem. 1997;5(12):2111-20.
26. Hodnett EM, Wongwiechintana C, Dunn WJ, Marrs P. Substituted 1,4-naphthoquinones vs. the ascitic sarcoma 180 of mice. J Med Chem. 1983;26(4):570-4.
27. Urdaneta N, Roberts K, Vera R, Vera A, Gutiérrez E, Aguilar Y, et al. Papel de la mitomicina C como adyuvante a la radioterapia en el tratamiento de cáncer del cuello uterino localmente avanzado; Role of mitomycin C as adyunct in the treatment of locally advanced cancer of uterine cervix. Gac méd Caracas. 1998;106(3):310-31.
28. Hillard EA, de Abreu FC, Ferreira DCM, Jaouen G, Goulart MOF, Amatore C. Electrochemical parameters and techniques in drug development, with an emphasis on quinones and related compounds. Chem Commun. 2008 (23):2612-28.
29. Begleiter A, Leith MK. Activity of quinone alkylating agents in quinone-resistant cells. Cancer research. 1990;50(10):2872-6.
30. Efferth T, Dunstan H, Sauerbrey A, Miyachi H, Chitambar CR. The anti-malarial artesunate is also active against cancer. Int J Oncol. 2001;18(4):767-73.
31. Moret EE, de Boer M, Hilbers HW, Tollenaere JP, Janssen LH, Holthuis JJ, et al. In vivo activity and hydrophobicity of cytostatic aziridinyl quinones. J Med Chem. 1996;39(3):720-8.
32. Habbal OA, Al-Jabri AA, El-Hag AH, Al-Mahrooqi ZH, Al-Hashmi NA. In-vitro antimicrobial activity of Lawsonia inermis Linn (henna). A pilot study on the Omani henna. Sau Med J. 2005;26(1):69.
33. Machado T, Pinto A, Pinto M, Leal I, Silva M, Amaral A, et al. In vitro activity of Brazilian medicinal plants, naturally occurring naphthoquinones and their analogues, against methicillin-resistant Staphylococcus aureus. Internat J Antimicr Agents. 2003;21(3):279-84.
34. Gardner PR. Superoxide production by the mycobacterial and pseudomonad quinoid pigments phthiocol and pyocyanine in human lung cells. Arch Biochem Biophys. 1996;333(1):267-74.
35. Malik AR, Urbanska M, Macías M, Skalecka A, Jaworski J. Beyond control of protein translation: What we have learned about the non-canonical regulation and function of mammalian target of rapamycin (mTOR). Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics. 2013.
36. Klaus V, Hartmann T, Gambini J, Graf P, Stahl W, Hartwig A, et al. 1, 4-Naphthoquinones as inducers of oxidative damage and stress signaling in HaCaT human keratinocytes. Archives of biochemistry and biophysics. 2010;496(2):93-100.
37. Wu J, Chien CC, Yang LY, Huang GC, Cheng MC, Lin CT, et al. Vitamin K3-2,3-epoxide induction of apoptosis with activation of ROS-dependent ERK and JNK protein phosphorylation in human glioma cells. Chemico-biological interactions. 2011;193(1):3-11.
38. Ogawa M, Koyanagi J, Sugaya A, Tsuda T, Ohguchi H, Nakayama K, et al. Cytotoxic activity toward KB cells of 2-substituted naphtho[2,3-b]furan-4,9-diones and their related compounds. Biosc, biotech, biochem. 2006;70(4):1009-12.
39. Takano A, Hashimoto K, Ogawa M, Koyanagi J, Kurihara T, Wakabayashi H, et al. Tumor-specific cytotoxicity and type of cell death induced by naphtho[2,3-b]furan-4,9-diones and related compounds in human tumor cell lines: relationship to electronic structure. Anticancer research. 2009;29(1):455-64.
40. Tlahuice Flores A, Pérez Tijerina E, Mejía Rosales S. Modos vibracionales de C60 obtenidos mediante el método DFT. Universidad Autónoma de Nuevo León, México: Ciencia UANL. 2007;10(3):261-68.
41. Jiménez-Alonso S, Guasch J, Estévez-Braun A, Ratera I, Veciana J, Ravelo AG. Electronic and cytotoxic properties of 2-amino-naphtho[2,3-b]furan-4,9-diones. J Org Chem. 2011;76(6):1634-43.
42. Pan J, Simamura E, Koyama J, Shimada H, Hirai KI. Induced apoptosis and necrosis by 2-methylfuranonaphthoquinone in human cervical cancer HeLa cells. Cancer detection and prevention. 2000;24(3):266-74.
43. Trachootham D, Zhou Y, Zhang H, Demizu Y, Chen Z, Pelicano H, et al. Selective killing of oncogenically transformed cells through a ROS-mediated mechanism by beta-phenylethyl isothiocyanate. Cancer Cell. 2006;10(3):241-52.
44. Verrax J, Beck R, Dejeans N, Glorieux C, Sid B, Pedrosa RC, et al. Redox-active quinones and ascorbate: an innovative cancer therapy that exploits the vulnerability of cancer cells to oxidative stress. Anticancer Agents Med Chem. 2011;11(2):213-21.
45. Ferreira RA, Oliveira AB, Gualberto SA, Vitor RW. Activity of natural and synthetic naphthoquinones against Toxoplasma gondii, in vitro and in murine models of infection. Parasite. 2002;9(3):261-9.
46. Muller K, Sellmer A, Wiegrebe W. Potential antipsoriatic agents: lapacho compounds as potent inhibitors of HaCaT cell growth. J Nat Prod. 1999;62(8):1134-6.
47. Eyong KO, Kumar PS, Kuete V, Folefoc GN, Nkengfack EA, Baskaran S. Semisynthesis and antitumoral activity of 2-acetylfuranonaphthoquinone and other naphthoquinone derivatives from lapachol. Bioorg Med Chem Lett. 2008;18(20):5387-90.
48. Lehmann B. HaCaT cell line as a model system for vitamin D3 metabolism in human skin. J Invest Dermatol. 1997;108(1):78-82.
49. Baumer W, Hoppmann J, Rundfeldt C, Kietzmann M. Highly selective phosphodiesterase 4 inhibitors for the treatment of allergic skin diseases and psoriasis. Inflamm Aller-Dr Targ. 2007;6(1):17-26.
50. Tse WP, Che CT, Liu K, Lin ZX. Evaluation of the anti-proliferative properties of selected psoriasis-treating Chinese medicines on cultured HaCaT cells. J Ethnopharmacol. 2006;108(1):133-41.
51. Klebe G, Abraham U, Mietzner T. Molecular similarity indices in a comparative analysis (CoMSIA) of drug molecules to correlate and predict their biological activity. J Med Chem. 1994;37(24):4130-46.
52. Pérez-Sacau E, Díaz-Penate RG, Estévez-Braun A, Ravelo AG, García-Castellano JM, Pardo L, et al. Synthesis and pharmacophore modeling of naphthoquinone derivatives with cytotoxic activity in human promyelocytic leukemia HL-60 cell line. J Med Chem. 2007;50(4):696-706.
53. Tseng CH, Chen YL, Yang SH, Peng SI, Cheng CM, Han CH, et al. Synthesis and antiproliferative evaluation of certain iminonaphtho[2,3-b]furan derivatives. Bioorg Med Chem. 2010;18(14):5172-82.
54. Fernández-Calienes Valdés A, Mendiola Martínez J, Acuña Rodríguez D, Caballero Lorenzo Y, Scull Lizama R, Gutiérrez Gaitén Y. Actividad antimalárica y citotoxicidad de extractos hidroalcohólicos de seis especies de plantas usadas en la medicina tradicional cubana. Rev Cubana Med Trop. 2011;63(1):52-7.
55. Quispe A, Zavala D, Rojas J. Efecto citotóxico selectivo in vitro de muricin H (acetogenina de Annona muricata) en cultivos celulares de cáncer de pulmón. Rev Per Med Exp Sal Púb. 2006;23(4):265-9.
56. Urbanek RA, Suchard SJ, Steelman GB, Knappenberger KS, Sygowski LA, Veale CA, et al. Potent reversible inhibitors of the protein tyrosine phosphatase CD45. J Med Chem. 2001;44(11):1777-93.
57. Shin HM, Lee YR, Chang YS, Lee JY, Kim BH, Min KR, et al. Suppression of interleukin-6 production in macrophages by furonaphthoquinone NFD-37. Int Immunopharmacol. 2006;6(6):916-23.
58. Hayashi T, Smith FT, Lee KH. Antitumor agents. 89. Psychorubrin, a new cytotoxic naphthoquinone from Psychotria rubra and its structure-activity relationships. J Med Chem. 1987;30(11):2005-8.
59. Goulart MlOF, Zani CL, Tonholo J, Freitas LR, de Abreu FC, Oliveira AdB, et al. Trypanocidal activity and redox potential of heterocyclic- and 2-hydroxy-naphthoquinones. Bioorganic & Med Chem Lett. 1997;7(15):2043-8.
60. Mi Q, Lantvit D, Reyes-Lim E, Chai H, Zhao W, Lee IS, et al. Evaluation of the potential cancer chemotherapeutic efficacy of natural product isolates employing in vivo hollow fiber tests. J Nat Prod. 2002;65(6):842-50.
61. Weiss CR, Moideen SV, Croft SL, Houghton PJ. Activity of extracts and isolated naphthoquinones from Kigelia pinnata against Plasmodium falciparum. J Nat Prod. 2000;63(9):1306-9.
62. Kviecinski MR, Pedrosa RC, Felipe KB, Farias MS, Glorieux C, Valenzuela M, et al. Inhibition of cell proliferation and migration by oxidative stress from ascorbate-driven juglone redox cycling in human bladder-derived T24 cells. Biochem Biophys Res Commun. 2012;421(2):268-73.
63. Simamura E, Hirai KI, Shimada H, Pan J, Koyama J. Mitochondrial damage prior to apoptosis in furanonaphthoquinone treated lung cancer cells. Canc detect prevent. 2003;27(1):5-13.
64. Miguel del Corral JM, Castro MA, Oliveira AB, Gualberto SA, Cuevas C, San Feliciano A. New cytotoxic furoquinones obtained from terpenyl-1,4-naphthoquinones and 1,4-anthracenediones. Bioorg Med Chem. 2006;14(21):7231-40.
65. Simamura E, Hirai KI, Shimada H, Pan J, Koyama J. Mitochondrial damage prior to apoptosis in furanonaphthoquinone treated lung cancer cells. Cancer detection and prevention. 2003;27(1):5-13.
Recibido: 15 de marzo de 2013.
Aprobado: 18 de julio de 2013.
CDr. C. Marlene Durán Lengua. Grupo de Productos Naturales, Facultad de Ciencias Farmacéuticas. Universidad de Cartagena. Campus de la Salud, Barrio Zaragocilla. Cartagena de Indias, Bolívar. Colombia. Correo electrónico: mduranl@unicartagena.edu.co