My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Cubana de Información en Ciencias de la Salud
On-line version ISSN 2307-2113
Rev. cuba. inf. cienc. salud vol.28 no.3 La Habana July.-Sept. 2017
ARTÍCULO ORIGINAL
Enfoque para la gestión de la I+D+i en la Industria Biofarmacéutica cubana
Approach to R&D&i in the Cuban biopharmaceutical industry
Mercedes Delgado Fernández
Escuela Superior de Cuadros del Estado y del Gobierno. La Habana, Cuba.
RESUMEN
La gestión de la investigación, el desarrollo y la innovación constituye un factor clave de éxito para la competitividad de las industrias de alta tecnología, como la biofarmacéutica, y se convierte en un requisito a satisfacer para tener más éxito comercial y en la salud. El presente artículo tiene como objetivo proponer un enfoque para la gestión de la investigación, el desarrollo y la innovación, y mostrar algunas de las aplicaciones realizadas en los últimos 20 años en un centro biofarmacéutico cubano. El enfoque integrado y abierto desde las primeras etapas de la generación de las innovaciones de productos, servicios, procesos, organizacionales y de comercialización contribuye al incremento sistemático de la eficiencia y de la eficacia y al cumplimiento de los requisitos regulatorios.
Palabras clave: gestión de I+D+i; industria biofarmacéutica; gestión de la calidad; gestión del conocimiento; innovación abierta.
ABSTRACT
Research, development and innovation management is a key success factor for the competitiveness of high technology industries, such as the biopharmaceutical, and a requirement to be met in order to accomplish greater commercial and health achievements. The present paper proposes an approach to research, development and innovation management, and presents some of the applications implemented in the past 20 years in a Cuban biopharmaceutical center. Integrated and open from the very first stages in the generation of innovations for organizational and commercial products, services and processes, the approach contributes to systematically enhance efficiency and efficacy, as well as meet the regulatory requirements.
Key words: R&D&i management; biopharmaceutical industry; quality management; knowledge management; open innovation.
INTRODUCCIÓN
El descubrimiento y el desarrollo de nuevos productos biotecnológicos efectivos y seguros, es un proceso largo, difícil y costoso,1 que propicia la búsqueda de vías para enfrentar esta situación con éxito. Aun así, anualmente el uso de los biofarmacéuticos se incrementa en más de un 20 %, el mercado crece alrededor de un 15 % en comparación con un 6 a 7 % del farmacéutico y se estima que más del 30 % de las líneas de productos que simultanean la investigación y el desarrollo (I+D) son biofarmacéuticos.2
La planeación estratégica y la cultura de proyectos de desarrollo con las transferencias tecnológicas de investigación a desarrollo y de esta a la producción son requeridas, así como la planificación, la revisión y el control de los proyectos3 y la implementación armónica de las diferentes modalidades de innovación existentes. La innovación referida a la introducción de nuevos productos, métodos de producción, mercados, fuentes de suministro de materias primas u otros insumos y la creación de estructuras de mercado en un sector4 ha evolucionado, y se ha ampliado a mejoras, servicios y cambios organizacionales.5,6
Las capacidades absortivas, las alianzas estratégicas y la variedad del conocimiento para la introducción de los productos en el mercado son más empleadas en las empresas biofarmacéuticas que en las farmacéuticas,7 lo que explica la tendencia de crear centros de excelencia de desarrollo de productos biofarmacéuticos más que la asimilación de estos en grandes empresas farmacéuticas.8 Un modelo gerencial innovador en esta industria mostró que la innovación está optimizada cuando las colaboraciones externas y estratégicas, así como la apertura gerencial a redes y las nuevas tecnologías, son facturadas dentro del proceso del desarrollo terapéutico.9
El conocimiento adquirido de las experiencias de las fallas sirve como núcleo competitivo de las organizaciones que dependen de su capacidad absortiva, y demuestra que es más útil este aprendizaje en la fase de transformación o más conocida en idioma inglés como downstream, que en la fase de elaboración o denominada en inglés como upstream.10 Un estudio con 193 equipos de I+D biotecnológicos permitió concluir que el aprendizaje tecnológico estuvo asociado positivamente con la innovación tecnológica y su asociación con el aprendizaje externo.11 Para el diseño de los proyectos se divide el proceso de innovación por etapas con controles de calidad y actividades concurrentes, funcionalidades cruzadas, prescritas y probadas.12
La duración de la investigación, el desarrollo y la innovación (I+D+i) de un producto biofarmacéutico es muy elevado por los desafíos y exigencias regulatorias a vencer en todas las etapas, en las que se genera un gran cúmulo de información a ser gestionada con buenas prácticas. La metodología para la gestión y generación de conocimiento (MGGC) permite la identificación de las necesidades de los usuarios y dar respuesta por la socialización del nuevo conocimiento mediante sus factores críticos,13 y puede ser aplicado en los diferentes estadios del ciclo de vida de los proyectos. Esta metodología puede contribuir a la innovación abierta, entendida como el uso de los flujos internos y externos de conocimiento útiles para acelerar la innovación interna y la expansión al mercado para el uso externo de la innovación,14 lo que refuerza la necesidad de la colaboración entre un sinnúmero de organizaciones y actores,15 y responde al qué (contenido de la innovación abierta), al cuándo (dependencia del contexto) y al cómo (los procesos).16
Con la innovación abierta se requiere aplicar tres procesos muy relacionados: la exploración, la retención y la explotación del conocimiento, a ser ejecutados dentro y fuera de los límites de la organización,17 en las que las partes interesadas dependen unas de otras para alcanzar la efectividad.
Se reportan nuevas aplicaciones de la biotecnología en las que se requieren las tecnologías de información, la colección de datos experimentales, el análisis de datos, los sistemas de soporte a la decisión (DSS) para la optimización del portafolio de la I+D farmacéutica,18 así como el Big Data y la Bioinformática para el desarrollo de nuevos productos.19 El diagnóstico y los sistemas de vigilancia tecnológica también son requeridos.20 Se proponen indicadores para la toma de decisiones de políticas científicas biomédicas en relación con la información de las áreas en las que más investigación se genera y las causas de mortalidad, morbilidad y medicamentos expendidos, y así poder responder a las demandas sociales y la elevación de la calidad de vida.21
El éxito alcanzado en la biotecnología cubana se pone de manifiesto por la capacidad de generación de nuevos productos, su impacto en la salud pública, en el número sostenido de patentes, en el ritmo de crecimiento de sus exportaciones y en el retorno de las inversiones acometidas,22 lo que requiere la aplicación de un enfoque sistémico e integrado de la gestión23 y de empresas de alta tecnología.22 Las normativas de la calidad en la I+D+i facilitan el cumplimiento del entorno regulatorio, las transferencias de tecnología, el registro de los medicamentos y la introducción de los productos en los sistemas de salud y mercados objetivos; aunque no es el único enfoque que ha de tenerse en cuenta en este sector.
El artículo propone un enfoque integrado para la gestión de la I+D+i biofarmacéutica cubana, que evidencia las capacidades generadas, con un capital humano y un cúmulo de experiencias y conocimientos que datan desde los inicios de este sector a nivel mundial. Primeramente se muestra el enfoque en lo relativo a los principios, el esquema y la información básica requerida en las fases por las que se transita en la I+D+i biofarmacéutica. Posteriormente se abordan en detalle las fases de la gestión en diferentes ámbitos de la I+D y la producción de biofarmacéuticos, con la aplicación del enfoque en el Centro de Inmunología Molecular (CIM). Los resultados reflejan el nivel científico alcanzado en la industria biofarmacéutica cubana y su contribución al desarrollo económico y a la salud en el país, y se exponen algunos de los retos y riesgos a vencer para alcanzar metas aún superiores.
ENFOQUE DE GESTIÓN EN LA I+D+i BIOFARMACÉUTICA
Cuba es pionera en la creación de varios centros de I+D+i, hace más de 20 años, y demuestra que con la voluntad política de la dirección del país fue posible avanzar en el desarrollo de una tecnología emergente24 y exhibir resultados relevantes a nivel nacional e internacional, como los del Centro de Ingeniería Genética y Biotecnología y el Centro de Inmunología Molecular. En este artículo se propone un enfoque de gestión de la I+D+i teniendo en cuenta los aspectos siguientes:
- Principios de la gestión de la I+D+i.
- Esquema simplificado de la I+D+i.
- Información para la toma de decisiones.
Los principios de la gestión de la I+D+i se han establecido sobre la base de la integración de los requisitos de la industria biofarmaceútica y la ISO 9001,23 así como de la evolución a una industria de conocimiento y de alta tecnología. Estos son:
- La gestión se extiende a todos los niveles de dirección, y la responsabilidad estratégica de la alta dirección es la coordinación para la generación continua del conocimiento y de productos de alto valor agregado.
- La gestión se analiza en todos los procesos que intervienen en el desarrollo, producción y registro del producto biofarmacéutico con sus procesos, subprocesos, entradas, salidas y requisitos a cumplir.
- Todas las actividades deben estar normalizadas para satisfacer las crecientes exigencias regulatorias y normativas de la industria con la suficiente flexibilidad en la investigación para la generación de invenciones, patentes y un espacio de diseño en el desarrollo de producto.
- Las etapas de investigación, desarrollo, producción y registro deben ser integradas en proyectos de conocimiento que se han de gestionar en equipos, con las redes internas y externas de todas las partes interesadas y el empleo intensivo de las Tecnologías de Información y las Comunicaciones.
- Se requiere del compromiso, la participación activa y la preparación sistemática del recurso humano, que contribuyan al aprendizaje, con una dinámica continua de asimilación y generación de nuevos conocimientos.
- La I+D+i debe ser medida y evaluada en todas las etapas, y los resultados deben servir de retroalimentación sistemática, con la toma de decisiones más efectivas basadas en datos, evidencias, conocimiento y riesgos con enfoque preventivo y sistemas inteligentes.
Una gestión efectiva para la industria biofarmacéutica requiere establecer los requerimientos del usuario y regulatorios mediante el entendimiento profundo de los procesos y sistemas de la organización, el establecimiento de los objetivos para que sea escalable, disponible y con el espacio de diseño (estructurado y no estructurado) en un ambiente de buenas prácticas de laboratorio y de producción.25 Hay tres categorías de problemas principales de la I+D+i: 1) la gestión de las líneas de desarrollo de productos, 2) la planificación de la capacidad y 3) la gestión de la cadena de suministro.26
Se reporta la conceptualización de las cadenas de suministros27 y la internacionalización entre el mercado emergente farmacéutico de China y países menos desarrollados con infraestructuras tecnológicas débiles, propiedad intelectual y ambientes regulatorios que garantizan la seguridad, la calidad y la integración en las cadenas de valor farmacéutica.28
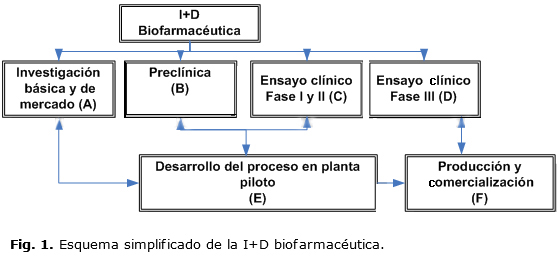
La I+D+i biofarmacéutica la conforman complejos y extensos procesos de la cadena de valor desde la investigación básica hasta el registro, la introducción y la comercialización del medicamento, puestos a disposición del sistema de salud. La figura 1 muestra un esquema simplificado de la I+D+i biofarmacéutica, adaptado del modelo en cadena de Kline29 y de otros estudios realizados hace 20 años en Cuba sobre la calidad y la innovación tecnológica en la biotecnología30 y del sistema de gestión de la calidad para el desarrollo de productos biofarmacéuticos.31
La tarea principal en la industria biofarmacéutica cubana es la conexión de la ciencia con la economía, ya que la creación de valor depende cada vez más de un mejor uso del conocimiento,22 lo que requerirá la internalización de la investigación científica, a diferentes planos, en casi todas las actividades económicas, y presupone la capacidad de utilización del método científico hasta convertirse en un componente de la "cultura general".32
Las organizaciones que cuentan con un mayor nivel de información están en condiciones de tomar mejores decisiones durante las fases de I+D del producto y, de esta forma, generar los flujos internos y externos de conocimientos con más capacidad. El cuadro 1 muestra algunas informaciones de la I+D+i biofarmacéutica que deben ser gestionadas, aunque pueden ser muchas más las que se pueden mencionar.
El enfoque de la innovación abierta es aplicable en la industria biofarmacéutica al integrar y combinar las diferentes fuentes de información, conocimientos y tecnologías que se generan y gestionan desde las primeras etapas de la I+D, por las disímiles partes interesadas que participan en el tiempo elevado que transcurre en la cadena de valor hasta la introducción de la innovación, a través de nuevos y mejorados procesos y productos en la práctica social, incluyendo el registro y la comercialización de los medicamentos en diferentes mercados. En este contexto el conocimiento llega a ser un medio importante de interacción que se genera entre los miembros del ecosistema del negocio, en el cual las agencias regulatorias y las partes interesadas juegan un rol relevante. No menos importante es la gestión de riesgos, la que debe tener un enfoque preventivo y estratégico.
En la I+D+i de la industria biofarmacéutica son muchos los riesgos y requerimientos que se pueden presentar, los que han de evaluarse permanentemente para su gestión efectiva. Se pueden mencionar algunos como:
- Necesidad de disponer de elevado financiamiento para la I+D+i ante cambios continuos regulatorios y validaciones requeridas.
- Largos tiempos de los proyectos de I+D e incertidumbre con el registro e introducción de los medicamentos en el mercado que limita la rentabilidad en el corto o mediano plazo.
- Transferencia temprana de productos desde la I+D al escalado de la Producción con poca definición de los atributos de calidad de los productos.
- La no correspondencia entre la disponibilidad de recursos financieros y el estado de desarrollo del producto.
- Desarrollo de productos sin visión comercial desde su definición limitan posteriormente su comercialización.
- Insuficientes capacidades productivas de alto estándar en plantas de desarrollo de productos y productivas y que no satisfagan el cronograma de desarrollo del producto, la entrega de productos a ensayos clínicos y la comercialización.
- Descoordinación entre la I+D, la negociación y comercialización de los productos.
- Insuficiente calidad en los datos que se aportan de la farmacología y el ensayo clínico lo que limita el valor del producto para su registro y negociación.
- Indefiniciones en el diseño farmacéutico del producto para su comercialización en mercados altamente regulados y su impacto en el desarrollo del producto.
- Compleja logística y cadena de suministros para los centros que cierran los ciclos desde la I+D hasta la introducción y comercialización de los productos en el mercado.
- Capacidad y entrenamiento de todo el personal que participa en la cadena de valor de la I+D+i, que requiere de un aprendizaje sistemático por la dinámica de cambio regulatoria y diversa según el producto, la región y el mercado a la que se decide exportar.
En las secciones siguientes se muestran algunas aplicaciones del enfoque de la gestión de la I+D+i en el Centro de Inmunología Molecular (CIM) que se han estado realizando hace 20 años. El CIM es un prestigioso centro biofarmacéutico cubano, que fue inaugurado en el año 1994 por el Comandante en Jefe Fidel Castro. Actualmente pertenece a la Organización Superior de Dirección Empresarial (OSDE) BioCubaFarma. Se dedica a la investigación básica, desarrollo, producción y comercialización a partir del cultivo de células de mamíferos para el diagnóstico y tratamiento del cáncer y enfermedades relacionadas con el sistema inmune, cumpliendo con las regulaciones de las Buenas Prácticas de Manufactura (BPM), la agencia regulatoria nacional y las internacionales donde registra sus productos.
GESTIÓN DE LAS ETAPAS DE LA I+D BIOFARMACÉUTICA
En esta sección se muestran algunos resultados de la aplicación del Sistema de Gestión de la Calidad de la I+D en las diferentes etapas, que se muestran en la figura 1. Se valora el análisis de la aplicación de la encuesta de innovación33 a directivos y especialistas con 21 encuestados. De la encuesta se analizan las preguntas de los objetivos y fuentes de innovación, por su relación con la gestión de la I+D+i,5 con el conocimiento de que los objetivos de la innovación son el remplazamiento de productos, la extensión de la gama de productos y el mantenimiento de la cuota de mercado, seguidas por la mejora de la calidad de los productos y servicios. Las fuentes que más impulsan la innovación son las actividades internas de investigación y desarrollo, la comparación con el mejor estándar (benchmarking), el conocimiento, la capacitación y el entrenamiento. Otras fuentes en las que el 75 % de los encuestados la valoraron como importantes son: la alta dirección, los competidores y la consulta a patentes.
PROCESO: INVESTIGACIÓN BÁSICA Y PRECLÍNICA
La elaboración del programa de calidad en la investigación básica del CIM estableció como fases la de invención y el proyecto en desarrollo,34 que permitió identificar y evaluar los procesos relacionados con las buenas prácticas de laboratorios, los indicadores de la producción científica, los estudios preclínicos y del inicio de los ensayos clínicos. Referido a los criterios de calidad de la investigación básica se definieron: la novedad y la originalidad, la oportunidad y la factibilidad.34 Otros criterios recomendados son los resultados experimentales, las características del mercado, el nivel de información y la comunicación interna y externa de la organización y la metodología de la investigación.30 En la documentación generada está la evaluación de la transferencia tecnológica de la investigación básica al desarrollo de procesos, que es la obtención de un producto cuya "prueba de principio" haya resultado satisfactoria y culmina con la medición de la satisfacción de los clientes, referidos a la próxima fase.
La calidad del producto se asegura desde las fases más tempranas de la I+D, orientado al registro temprano del producto. De esta forma, en el diseño de la guía de calidad para el registro de una vacuna terapéutica contra el cáncer tuvieron gran importancia los estudios preclínicos requeridos para garantizar la seguridad del producto, el desarrollo clínico y la autorización para el registro y la comercialización del producto farmacéutico. Se generó el diagrama de flujo para las actividades con las posibles decisiones e informaciones generadas en relación con el registro para la preclínica,35 teniendo en cuenta que ante cambios regulatorios el diagrama se actualiza. Una representación simplificada de las transferencias en la I+D biofarmacéutica del primer programa de calidad para esta etapa en el CIM22 se muestra en la figura 2, el que incluyó un enfoque integrado de los requerimientos científico-técnicos, regulatorios y de mercado.
DESARROLLO DEL PROCESO Y DEL PRODUCTO
El desarrollo del proceso y del producto biofarmacéutico requiere el cumplimiento de regulaciones, estándares de calidad, personal altamente calificado, equipos de trabajo multidisciplinarios, tecnologías avanzadas y la aplicación de transferencias desde la investigación al escalado de los procesos,36 que deben efectuarse en plantas piloto.37 Es común realizar experimentos, como el que permitió comprobar la influencia que varios factores tratados a dos niveles (formulación, operarios y año) tenían sobre el rendimiento del llenado en un producto en desarrollo.
La calidad por diseño, también conocida por QbD, por sus siglas en inglés de Quality by Design, es esencial en la I+D biofarmacéutica.38 Algunos de los elementos a tener en cuenta son el perfil de la calidad a alcanzar en el producto final, la evaluación de los riesgos, el diseño de experimentos y el espacio de diseño, con el criterio de que la calidad no puede ser probada en el producto sino construida en el diseño.39 La QbD exige que un producto biotecnológico sea diseñado para que alcance su rendimiento clínico deseado y el proceso sea consistente.40 Es aquel que cumple con los atributos de calidad necesarios para dicha acción clínica y enfatiza en la comprensión de cómo pueden influir los parámetros de proceso sobre las variables de calidad de los productos y en la gestión del riesgo.41 En el CIM se elaboró un procedimiento para la liberación de los lotes de productos en desarrollo con el enfoque de QbD, el análisis de riesgo, el uso de las correlaciones, el análisis factorial, la evaluación de los parámetros clínicos, las características de calidad y los controles de procesos, para asegurar la calidad del producto.42 Se usaron las datas de los parámetros del laboratorio, medidos para los pacientes de un ensayo clínico Fase II, con un producto y los expedientes de los lotes usados, y se calcularon las correlaciones. Posteriormente se realizó un análisis factorial, que propició ganar conocimiento en desarrollo de ese producto y en el establecimiento de las especificaciones de calidad.
La validación de las técnicas analíticas de control de la calidad es un requisito a cumplir en esta industria. En el CIM se elaboró un procedimiento que permite planificar, ejecutar y controlar la validación de los métodos analíticos en el departamento de Control de Calidad, en correspondencia con el ciclo de vida de cada producto y con los requisitos regulatorios aplicables en cada mercado donde se realicen sus ensayos clínicos o su comercialización. Basándose en el método de expertos, se definieron criterios propios de calificación y validación para las Fases I, II y III de ensayos clínicos de los productos.43
GESTIÓN DE LA PRODUCCIÓN BIOFARMACÉUTICA
El CIM se ha dedicado a lograr productos terapéuticos con elevados niveles de seguridad y eficacia, dirigidos a pacientes aquejados de enfermedades crónicas no trasmisibles, como anticuerpos monoclonales, proteínas recombinantes y vacunas. Un estudio de un producto biofarmacéutico comercial del CIM permitió conocer que se generaban aproximadamente 11 324 datos anuales. Esta situación y las exigencias regulatorias condicionaron que se elaborara un procedimiento de ingeniería de la calidad para los productos comerciales,44 combinando la utilidad de dichas herramientas para analizar los datos y su variabilidad para tomar decisiones eficaces en respuesta a objetivos como los mostrados en el cuadro 2.
La aplicación del procedimiento de ingeniería de la calidad a un producto comercial, con gráficos de control para el análisis de la consistencia del proceso "descongelación celular", con el análisis de las células totales y la viabilidad celular, entre otras variables, permitió concluir que era consistente el proceso, lo cual fue generalizado al resto de los productos, procesos y variables del CIM.44
El procedimiento de liberación de lotes en tiempo real (LTR) para los productos comerciales en el CIM (Fig. 3) incorporó el conocimiento de todas las etapas productivas. Se evaluaron sus parámetros y controles para asegurar la calidad del ingrediente farmacéutico activo (IFA) y del producto final, con el objetivo de disminuir significativamente el tiempo de liberación y garantizar la calidad del producto, el cumplimiento de las regulaciones y un mayor conocimiento del proceso y del producto.45 La aplicación del procedimiento a un producto permitió crear bases de datos con las variables del proceso productivo, definir parámetros y controles de proceso, analizar la data histórica para evaluar su comportamiento, definir rangos aceptables para los controles de proceso, establecer la correlación entre los controles de proceso y las características de calidad del IFA, y la interrelación entre los controles del proceso de cada etapa.
En el CIM se gestionan las no conformidades en la fabricación y la distribución de productos comerciales, soportado en la gestión por procesos, así como la administración del riesgo y el enfoque en sistema con indicadores de eficiencia y eficacia. Se gestionaron 129 no conformidades y el 83 % de ellas ya estaban cerradas al término del primer año de implementación.46 El procedimiento tuvo en cuenta la ICH Q1040 que establece las acciones correctivas y preventivas (CAPA) para los problemas de calidad, el análisis de las tendencias en el desempeño del proceso y la calidad del producto.
Los sistemas de gestión integrada de la calidad y la seguridad y salud del trabajo, integrados a las normativas del sector, han sido aplicados en el CIM en la producción, y se han obtenido los procedimientos de diagnóstico integrado para la elaboración del IFA, los de la gestión integrada de riesgos y de procesos.47
En el balance del año 2016, el Director del Centro de Inmunología Molecular expresaba que se beneficiaron 9 000 pacientes cubanos, y destacó la vacuna contra el cáncer de pulmón. Se beneficiaron 150 000 pacientes de otros países y las ventas superaron los 230 millones de pesos con exportaciones a 30 países,48 todo lo cual refleja el esfuerzo desplegado en los 20 años de creado el centro.
Se desea puntualizar que el análisis de la I+D+i biofarmacéutica ha permitido visualizar cómo esta industria ha transitado de una orientación a la tecnología a una evidencia clínica y preclínica sólida, al énfasis en la prueba de concepto, a la calidad en el diseño de las pruebas experimentales, a proyectos con diseños robustos y uso de la estadística, a la repetición de los estudios cruciales antes de avanzar en proyectos extensos y costosos que posteriormente no puedan ser reproducibles.49 Se insiste en propiciar el cambio de mentalidad hacia un diálogo científico y hacia la búsqueda permanente del posible error en las hipótesis antes de emprender la I+D+i que no haya sido avalada rigurosamente con los resultados científicos requeridos, lo cual ayudará a la reducción de gastos, al aumento de la productividad y a la calidad.
CONSIDERACIONES GENERALES
La gestión integrada de la información y el conocimiento interno y externo que se genera por las disimiles partes interesadas que intervienen en las fases de la I+D+i biofarmacéutica, con un enfoque de innovación abierta y de empresas de alta tecnología, contribuye a elevar la calidad, a cumplir con los requisitos regulatorios, a reducir el tiempo de registro del medicamento, la entrada del producto en el mercado, así como al aumento de la competitividad.
El cumplimiento de los principios de la I+D+i Biofarmacéutica, la gestión de la calidad con un enfoque a riesgos y de espacio de diseño y la necesaria repetición de pruebas y experimentos con diseños robustos, contribuyen al éxito en la cadena de valor y al esperado registro e introducción más temprana de los productos en el mercado; no obstante, el desarrollo hacia una empresa de alta tecnología requiere de la adopción de una estrategia de diversificación y diferenciación continua de productos y mercados, que lo logran en el mundo muy pocas empresas de esta industria en la actualidad.
Los éxitos alcanzados en la industria biofarmacéutica cubana y el desarrollo del capital humano formado, corroborado en lo expuesto del Centro de Inmunología Molecular, constituyen condiciones y premisas para lograr el salto de convertirse en una industria de alta tecnología, acompañada por varios centros de BioCubaFarma, como uno de los sectores estratégicos del Plan de Desarrollo a Largo Plazo al 2030 del país.
La capacidad de penetrar mercados altamente regulados con productos novedosos y biosimilares de alto valor agregado de la industria biofarmacéutica cubana, contando con las instalaciones productivas requeridas para el desarrollo del producto tanto para los ensayos clínicos como los productos comerciales, que satisfagan los elevados estándares y garanticen la reproducibilidad, constituyen los principales retos a vencer, unido a los sistemas potentes de información soportados en Big Data que permitan generar negocios más "inteligentes".
Conflicto de intereses
Se declara que no hay conflicto de intereses.
REFERENCIAS BIBLIOGRÁFICAS
1. DiMasi JA, Hansen RW, Grabowski H.G. The price of innovation: new estimates of drug development costs. J Health Econ. 2003;22:151-85.
2. Agrawal P. Biopharmaceuticals: An emerging trend in Drug Development. SOJ Pharm Pharmaceut Sci. 2015;2(1):1-2. DOI: 10.15226/2374-6866/2/1/00120.
3. Miranda F. La gestión del proceso de diseño y desarrollo de productos. 5campus.com, Economía de la Empresa. 2010 [citado 10 de enero de 2017]. Disponible en:
http://www.ciberconta.unizar.es/LECCION/desapro/100.HTM
4. Schumpeter J. The theory of economic development. An inquiry into profits, capital, credit, interest and the business cycle. Cambridge: Harvard University Press; 1934. ISBN 9780674879904.
5. Delgado M. Innovación empresarial. Dirección y Gestión Empresarial. Diplomado de Dirección y Gestión Empresarial. La Habana: Escuela Superior de Cuadros del Estado y del Gobierno. Editorial Félix Varela; 2013. p. 1-78.
6. Manual de Oslo. Guía para la recogida e interpretación de datos sobre innovación. OCDE y EUROSTAT; 2006 [citado 10 de enero de 2017]. Disponible en: http://www.oecd-ilibrary.org/docserver/download/9205114e.pdf?expires=1497881466&id=id&accname=guest&checksum=BFEBC9571C5317072D6A5A85ADBDAB4B
7. Ng D. Thinking outside the box: an absorptive capacity approach to the product development process. International Food and Agribusiness Management Review. 2011 [citado 20 de enero de 2017];14(3). Disponible en: http://ageconsearch.umn.edu/bitstream/114704/2/20110040_Formatted.pdf
8. Schweizer L. Knowledge transfer and R&D in pharmaceutical companies: a case study. J Engin Technol Manag. 2005;(22):315-33.
doi:10.1016.
9. Kim HR. Managerial cognition, strategic behavior and innovation: biopharmaceutical R&D. Pharm Pharmacol Internat J. 2015;2(1):2. DOI: 10.15406/ppij.2015.02.00008.
10. Wang T. Staged R&D processes and learning from failure: evidence from the U.S Biotechnology Industry. Copenhagen: DRUID Society Conference CBS; June 16-18. 2014. p. 17.
11. Huang HC. Technological learning and technological innovation creation: an empirical analysis of biotechnology R&D teams. J Engin Sci Technol Rev. 2013 [citado 5 de enero de 2017];6(2):120-4. Disponible en: http://www.jestr.org/downloads/Volume6Issue2/fulltext256213.pdf
12. Cooper RG. New products: What separates the winners from the losers and what drives success. PDMA handbook of new product development; 2013. p. 3-34.
13. García B, Delgado M, Infante M. Metodología para la generación y gestión del conocimiento para proyectos de I+D+I vista desde sus factores críticos. Rev Cubana Inform Cienc Salud. 2014 [citado 15 de enero de 2017];25(3):285-302. Disponible en: http://www.acimed.sld.cu/index.php/acimed/article/view/570
14. Chesbrough HW. Open innovation: A new paradigm for understanding industrial innovation. In: Chesbrough HW, Vanhaverbeke W, West J (eds). Open innovation: researching a new paradigm. Oxford: Oxford University Press; 2006. p. 1–12.
15. Chesbrough HW. The era of open innovation. MIT Sloan Management Review. Cambridge: Spring. 2003 [citado 18 de enero de 2017];44(3):35-41. Disponible en: http://sloanreview.mit.edu/article/the-era-of-open-innovation/
16. Huizingh EK. Open innovation: State of the art and future perspectives. Technovation. 2010 [citado 22 de enero de 2017]. Disponible en: https://www.rug.nl/staff/k.r.e.huizingh/openinnovationstate.pdf
17. Lichtenthaler U, Lichtenthaler E. A capability-based framework for open innovation: complementing absorptive capacity. J Manag Stud. 2009;46(8):1315-38 [citado 22 de enero de 2017]. Disponible en: http://www.innovationagencynwc.nhs.uk/media/Images/LichtenthalerLinchetnthaler.pdf
18. Lo Nigro G, Morreale A, Abbate L. An Open Innovation Decision Support System to Select a Biopharmaceutical R&D Portfolio. Wiley Online Library; 2015 [citado 22 de enero de 2017]. Disponible en: http://onlinelibrary.wiley.com/doi/10.1002/mde.2727/pdf
19. Kumar S, Plotnikov NV, Rouse JC, Singh SK. Biopharmaceutical Informatics: supporting biologic drug development via molecular modeling and informatics. Royal Pharmaceutical Society. J Pharm Pharmacol. 2017 [citado 12 de junio de 2017];1-14. Disponible en: http://onlinelibrary.wiley.com/doi/10.1111/jphp.12700/full
20. Delgado M, Arrebato L. Diagnóstico integrado de la vigilancia tecnológica en organizaciones. Ing Industr. 2011;XXXII(2):151-6 [citado 25 de enero de 2017]. Disponible en: http://www.redalyc.org/pdf/3604/360433576009.pdf
21. Lascurain LM, García C, Martín C, Suárez C, Sanz E. Impact of health science research on the Spanish health system, based on bibliometric and healthcare indicators. Scientometrics. 2008;77(1):131-46. DOI: 10.1007/s11192-007-1922-6,
22. Lage A. La economía del conocimiento y el socialismo. La Habana: Editorial Academia; 2013 [citado 30 de enero de 2017]. Disponible en: http://www.areitodigital.net/la_economia_del_conocimiento%20Lage.htm
23. Delgado M. Tendencias en los sistemas de gestión de calidad en la I+D biofarmacéutica. Biotecnol Aplic. 1998;15(2):111-6 [citado 20 de enero de 2017]. Disponible en: http://elfosscientiae.cigb.edu.cu/PDFs/Biotecnol%20Apl/1998/15/2/111-116.pdf
24. Lage A. Biotechnology: Offering new opportunities for developing countries. Biopharm. 1994;7(5):18-9.
25. Jaspinder H, Anshuman Bl. Biopharmaceutical Information Infrastructure 2.0 by Information Technology. BioProcess International. 2009 [citado 10 de enero de 2017]. Disponible en: http://www.bioprocessintl.com/manufacturing/information-technology/biopharmaceutical-information-infrastructure-2-0-188252/
26. Majozi T, Seid ER, Lee JY (Eds.). Synthesis, design and resource optimization in batch chemical plants. CRC Press; 2015 [citado 12 de enero de 2017]. Disponible en: http://www.crcnetbase.com/doi/pdfplus/10.1201/b18200-7
27. Mazzola E, Bruccolerin M, Perrone G. Supply chain of innovation and new product development. J Purch Sup Manag. 2015 [citado 9 de enero de 2017];(21):273–84. Disponible en: https://iris.unipa.it/retrieve/handle/10447/161655/259384/Mazzola%20et%20al%202015.pdf
28. Grimes S, Miozzo M. Big Pharma’s Internationalization of R&D to China. European Planning Studies; 2015 [citado 12 de enero de 2017]. Disponible en: http://dx.doi.org/10.1080/09654313.2015.1029442
29. AENOR. Gestión de la I+D+i: Sistema de Vigilancia Tecnológica e Inteligencia Competitiva. Norma Española. Madrid: UNE-166002. AENOR; 2014.
30. Delgado M. La calidad y la innovación tecnológica en la biotecnología aplicada a la salud. Direc Organiz Empr. 1998 [citado 12 de enero de 2017]. Disponible en: http://www.revistadyo.com/index.php/dyo/article/view/332/332
31. Delgado M. Sistemas de calidad en el desarrollo de productos biofarmacéuticos. Tesis doctoral. La Habana: ISPJAE; 1997.
32. Lage A. Cuba ha creado las bases para el tránsito a una economía basada en el conocimiento. La Habana: Intervención en el programa informativo de la Televisión Cubana "Mesa Redonda". 2007 [citado 12 de enero de 2017]. Disponible en: http://m.cubadebate.cu/etiqueta/revolucion.cubana/page/32/
33. Delgado M. Evaluación de la innovación tecnológica en Cuba. La Habana: IX Taller de Gestión Tecnológica en la Industria. Congreso Internacional de Gestión del Conocimiento GESTEC; 2005 [citado 12 de enero de 2017]. Disponible en: https://www.researchgate.net/publication/314976961_Evaluacion_de_la_innovacion_tecnologica_en_Cuba
34. Infante-Santana D, Delgado-Fernández M, Arias-Valdés ET, Ferrer-Corral A. Programa de calidad para las investigaciones básicas del Centro de Inmunología Molecular. Ing Industr. 2011 [citado 12 de enero de 2017];XXXII(3):198-206. Disponible en: http://rii.cujae.edu.cu/index.php/revistaind/article/view/327
35. Delgado M, Cuevas A. Guía de la calidad para el registro de vacunas terapéuticas contra el cáncer. Ing Industr. 2007;XXVIII(2):57-63 [citado 12 de enero de 2017]. Disponible en: http://rii.cujae.edu.cu/index.php/revistaind/article/view/76
36. Delgado M. Metodología de evaluación del sistema de calidad para la investigación y desarrollo de nuevos productos biofarmacéuticos. Ing Industr. 2002;XXIII(3):10-9 [citado 17 de enero de 2017]. Disponible en: http://rii.cujae.edu.cu/index.php/revistaind/article/view/365
37. Delgado M, García AT, Arias ET. Gestión de calidad en el desarrollo de procesos y productos biofarmacéuticos. Ing Industr. 2007 [citado 21 de enero de 2017];XXVIII(2):3-8. Disponible en: http://rii.cujae.edu.cu/index.php/revistaind/article/view/75
38. Zurdo J, Arnell A, Obrezanova O, Smith N, Gómez R, Gallagher T, et al. Early implementation of QbD in biopharmaceutical development: a practical example. BioMed Res Internat. 2015 [citado 12 de enero de 2017]. p. 1-19. Disponible en: https://www.hindawi.com/journals/bmri/2015/605427/
39. Feroz J, Hershenson S, Mansoor AK, Martin-Moe S. Quality by design for biopharmaceutical drug product development. AAPS Advances in the Pharmaceutical Sciences Series. London: Springer; 2015.
40. ICH. International Conference on Harmonization. ICH Q8/Q9/Q10; 2014 [citado 22 de marzo de 2017]. Disponible en: http://www.ich.org
41. Agarabi CK, Mansoor A, Shah RB. Challenges and opportunities for biotech quality by design. AAPS advances in the pharmaceutical sciences series 18. Springer; 2015. DOI 10.1007/978-1-4939-2316-81.
42. González D, Delgado M, Fontanet L, Vallín A. Liberación de lotes para productos en desarrollo. Ing Industr. 2012 [citado 30 de enero de 2017];XXXIII(1):31-40. Disponible en: http://rii.cujae.edu.cu/index.php/revistaind/article/view/318
43. Ramos F, Fontanet L, Delgado M. Gestión de la validación de métodos analíticos de control de calidad del Centro de Inmunología Molecular. Ing Industr. 2010 [citado 31 de enero de 2017];XXXI(2):1-6. Disponible en: http://rii.cujae.edu.cu/index.php/revistaind/article/view/300
44. Delgado M, Busutil Y. Ingeniería de la calidad en productos biofarmacéuticos comerciales. Ing Industr. 2007 [citado 12 de enero de 2017];XXVIII(2):9-15. Disponible en: http://rii.cujae.edu.cu/index.php/revistaind/article/view/297
45. Santaelena M, Delgado M, Busutil Y, Vallín A. Liberación en tiempo real de los productos comerciales del Centro de Inmunología Molecular. Ing Industr. 2010 [citado 12 de febrero de 2017];XXXI(2):1-7. Disponible en: http://rii.cujae.edu.cu/index.php/revistaind/article/view/297
46. Romero R, Lizette Y, Delgado M. Sistema de gestión de no conformidades para los productos comerciales del Centro de Inmunología Molecular. Ing Industr. 2011 [citado 28 de enero de 2017];XXXII(1):48-59. Disponible en: http://rii.cujae.edu.cu/index.php/revistaind/article/view/345
47. Delgado M, Vallín A, Bolaños Y, Cordovés D, Antúnez V, Busutil Y, et al. Gestión integrada calidad, medio ambiente, seguridad y salud del trabajo en la industria biofarmacéutica. Nueva Empresa. Rev Cubana Gest Empr. 2009 [citado 12 de febrero de 2017];5(1):18-21. Disponible en: https://qualitasbiblo.files.wordpress.com/2013/01/gestion-integrada-dra-mercedes-delgado-ispjae-msc-antonio-vallin-icm.pdf
48. Lage A. Balance del año 2016 del Centro de Inmunología Molecular. Re-encontrando el camino del crecimiento económico. Periódico Granma, 23 de marzo, La Habana, Cuba, 2016 [citado 30 de enero de 2017]. Disponible en: http://www.granma.cu/cuba/2016-12-29/re-encontrando-el-camino-del-crecimiento-economico-29-12-2016-23-12-52
49. Kannt A, Wieland T. Managing risks in drug discovery: reproducibility of published findings. Naunyn-Schmiedeberg's Arch Pharmacol. Springer; 2016 [citado 24 de febrero de 2017]. pp. 9. DOI 10.1007/s00210-016-1216-8. Disponible en: https://www.ncbi.nlm.nih.gov/pubmed/26883784
Recibido: 30 de marzo de 2017.
Aprobado: 20 de junio de 2017.