Introducción
Polylepis incana(Wesche et al., 2008), es una angiosperma, dicotiledónea (Renison y Cingolani 1998), tiene una gran diversidad de especies que están presentes en Sudamérica (Montesinos-Tubée et al., 2015; Abdellaoui et al., 2019) y distribuidas a lo largo de Los Andes (Vega-Krstulovic et al., 2007). La mayor diversidad de especies se encuentra entre las altitudes de 3 000 m s.n.m. (Kessler y Schmidt-Lebuhn, 2006) hasta 4 600 m s.n.m. (Domic y Capriles 2009), siendo árboles y algunos, arbustos (Mendoza y Cano 2011).
La especie P. incana, es endémica de Perú (Castro y Flores 2015), posee una altura de dos a cinco metros de altura (Seltmann et al., 2007), se caracteriza principalmente por presentar tallos torcidos (Argibay y Renison 2018) y de crecimiento lento (Domic et al., 2013), pero con adaptaciones a bajas temperaturas (Hidalgo et al., 2013).
Actualmente los bosques de Polylepis, constituyen uno de los ecosistemas más vulnerables del continente americano (Castro y Flores 2015), debido a los factores ambientales (Arana-Paredes et al., 2015), bajas tasas de regeneración (Argollo et al., 2004; Seltmann et al., 2007), uso intensificado del suelo (Argollo et al., 2004), cambio climático (Domic et al., 2013) , intensa presión por expansión de la agricultura (Domic et al., 2017) y degradación de su hábitat (Seltmann et al., 2007) .
Diversos esfuerzos se han realizado para promover su germinación y propagación de la especie P. incana, sin embargo, existen dificultades en procesos reproductivos genéticos, que son propios de la planta (Zutta et al., 2012), como restricciones a variaciones de temperatura (Landi y Renison 2010), escasa dispersión de semillas en forma natural (Wesche et al., 2008), esto provoca regeneración lenta de los bosques de Polylepis(Enrico et al., 2004). De las semillas coleccionadas en el medio natural, solo el 10 % son óptimas para el sembrío (Montesinos-Tubée et al., 2015), ellas son afectadas por la temperatura baja en su hábitat natural (Simoes y Renison 2015; Pulido y Ramos 2016), la evapotranspiración del suelo (Rosero et al., 2018), la variabilidad del clima (Zutta et al., 2012) con efectos impredecibles en la germinación de las semillas.
Diversos estudios han demostrado que la P. incana, posee bajo porcentaje de germinación pudiendo alcanzar sólo entre 3 % y 5 % (Enrico et al., 2004; Domic et al., 2017), con la posibilidad de germinar en distintos sustratos: arena, tierra, rocas y buen preparado de la tierra (Renison y Cingolani 1998, Olivera et al., 2018). El buen desarrollo de las semillas, depende de los parámetros de la calidad del agua que se utiliza para el riego (Torres et al., 2008); las condiciones ambientales en las que se encuentra (Renison et al., 2004) y los ajustes osmóticos de la semilla (Domic y Capriles 2009).
Las aguas tratadas, pueden ser utilizadas para riego de plantas (Passarini et al., 2012), asimismo el riego con aguas residuales, potencian la capacidad de germinación y fertilidad de la plántula (Cardonell et al., 2012), debido a que tiene gran cantidad de nutrientes como nitrógeno y fósforo (Beltrán et al., 2015). Por ejemplo, el agua de coco promueve la germinación a niveles máximos (Patiño et al., 2011), porque contiene hormonas con acción citoquinina del tipo isoprenoide, ello fomenta el proceso de la división celular, así influyendo en el proceso post germinativo (Del Pozo et al., 2005; Quinto et al., 2009), siendo el agua de coco promotor de la germinación, con temperaturas entre 16°C y 20°C (Arana et al., 2015) .
La importancia de investigar la viabilidad germinativa de la P. incana, está fundamentada por el uso que realizan las poblaciones locales (Capriles y Flores 2002), como, por ejemplo: uso como leña (Kessler y Schmidt 2006; Wesche et al., 2008) y medicinal, pues actúa como antihipertensivo (Daud et al., 2007), y también como forraje para los animales (Castañeda y Albán 2016). La protección y conservación de los bosques de P. incana, a partir de la siembra por semillas, es por la cobertura vegetal que proporciona en los ecosistemas andinos (Schmidt-Lebuhn et al., 2006), por su participación en la regulación de la escorrentía, control de la erosión (Delgado y León-Vargas 2017), su capacidad de retener y capturar agua, siendo el principal tipo de cobertura en las cuencas hidrográficas altoandinas (Enrico et al., 2004).
El frío perjudica a las semillas, provocando daños fisiológicos retardando el crecimiento, por tanto, es adecuada la propagación en primavera; los plantones germinados por semilla son más factibles que los plantones por estaca (Vasco 2010), las semillas de P. incana, poseen un alto grado de impureza (Vega et al., 2018). Las respuestas germinativas de las semillas de Polylepis incana, en condiciones de invernadero muestran mayor porcentaje de germinación de aproximadamente 19 %.
El objetivo de la investigación fue comparar el poder germinativo de Polylepis incana, con tratamientos de agua (residual, coco y pozo).
Materiales y métodos
Zona de estudio
La investigación se realizó en el invernadero de la Oficina de Gestión Ambiental de la Universidad Nacional del Altiplano de Puno, ubicado en 15°49'34" latitud sur, 70°00'19" longitud oeste y a una altitud de 3 816 m s.n.m. (Figura 1).
Diseño del experimento
La siembra se realizó in vitro, se sembraron 300 semillas de P. incana, en quince bandejas de plástico, se distribuyeron 20 semillas por bandeja con ayuda de pinzas de disección estériles. Se pusieron dentro de las bandejas de 100 g de sustrato tamizado de tierra negra, arena y estiércol de ovino; las bandejas con semillas se colocaron en una mesa bajo la intensidad luminosa del sol.
Para evaluar el efecto del tipo de agua, se utilizó agua de coco, habiéndose comprado 13 cocos para todo el proceso de la investigación; agua contaminada, se extrajo de la bahía interior de Puno y el agua de pozo de un manantial ubicado en la ciudad de Puno (Jr. Independencia y Av. La Torre). Asimismo, se registró la temperatura ambiental del invernadero donde se obtuvo un promedio de 25°C.
El experimento tuvo cinco dosis de riego con tres tratamientos; el primer tratamiento (T1), fue de agua de coco, la primera fue con dosis de riego de 5 ml, la segunda repetición fue con 10ml, la tercera fue de 15 ml, la cuarta fue con 20 ml y la quinta fue con 25 ml. Con el segundo tratamiento (T2) fue de agua residual y el tercer tratamiento (T3) con agua de pozo, las dosis fueron con las mismas cantidades de riego para los tres tratamientos.
De forma semanal, se monitoreó el pH, humedad y temperatura (°C) del sustrato; el pH y humedad se midieron con un pH metro HANNA, Checker, USA y la temperatura con un termómetro infrarrojo Oaklon, Mini infraPro 6, USA.
Evaluación de la germinación
Para evaluar la germinación in vitro se registró interdiario el número de semillas germinadas desde el tercer día posterior a la siembra, luego de se determinó el porcentaje de germinación, y se calculó teniendo en cuenta el número de semillas germinadas, respecto al número inicial de semillas puestas a germinar.
Análisis estadísticos
El diseño experimental fue completamente aleatorio con cinco dosis de agua y cada una con 20 semillas. Los datos fueron sometidos a una prueba estadística no paramétrica de Kruskal-Wallis, para contrastar la influencia de la cantidad de riego y número de semillas germinadas y también se aplicó la prueba de correlación para estimar el grado de asociación entre temperatura y pH del sustrato. El promedio de temperatura fue de 27,5°C y pH de 7,6. Los datos fueron analizados utilizando el programa INFOSTAT versión 2018.
Resultados
De 300 semillas sembradas de Polylepis incana, germinaron en total 17 semillas, de esta cantidad nueve semillas germinaron con riego de agua residual, cuatro semillas germinadas con riego de agua de coco y cuatro semillas germinadas con riego de agua de pozo.
Las semillas de P. incana, que fueron regadas con agua residual y en una mezcla de sustrato que fue de tierra negra, arena y como fertilizante estiércol de ovino, germinaron nueve semillas las cuales equivale al 9 % de un total de 100 semillas sembradas, mientras que las semillas regadas con agua de coco y pozo, germinaron cuatro semillas (4 %), respectivamente (Figura 2).
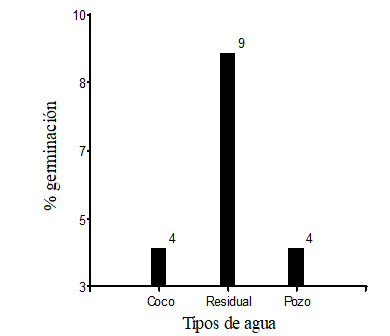
Fig. 2. - El número de semillas germinada sujeta a los diferentes tipos de agua (coco, residual y pozo)
Las diferentes cantidades de dosis de agua, aplicadas para el riego de las semillas sembradas en sustrato de tierra negra, arena y como fertilizante estiércol de ovino, no presentaron diferencias estadísticas en la germinación de semillas de P. incana (Hcalc (0,05) = 0,83; P = 0,85)
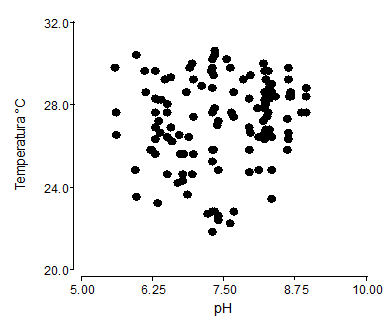
El análisis de correlación entre la temperatura y pH, fue de r=0,14, esto implica una baja correlación o afinidad entre estas dos variables dependientes para la germinación de la semilla, por tanto, las dos variables pueden actuar indistintamente, sin afectar el poder germinativo de la P. incana(Figura 3). Las variaciones de temperatura dentro del invernadero, tuvieron rangos de promedio de 22,67 a 31,13°C, siendo factores influyentes en la germinación de semillas. La temperatura del sustrato, donde se sembró la semilla de P. incana, que fueron regadas con agua residual, presentaron registros promedios de 27,5°C y pH de 7,6.
Discusión
Las diferentes de dosis de agua, aplicadas a la germinación de semillas, no influyen en la germinación de las semillas de P. incana, sin embargo, los tipos de agua de riego, sí influyen en el número de semillas germinadas. El poder germinativo de las plantas está limitado por las dificultades reproductivas por problemas genético propias de la planta (Zutta et al., 2012), es por eso que, en el tratamiento con agua de coco, solo hubo una germinación del 4 %, en el agua residual del 9 % y en el agua pozo de 4 %. Estos porcentajes son coincidentes con lo mencionado por (Argibay y Renison 2018), donde indica que tan solo el 10 % de las semillas coleccionadas de forma natural son óptimas para el sembrío y además la viabilidad de germinación, se deben también a las restricciones climáticas adversas (Pulido y Ramos 2016) y la escasa dispersión en forma natural (Wesche et al., 2008).
Asimismo, es importante mencionar que la temperatura influye en la germinación de la P. incana(Delgado y León 2017) y estas especies que se encuentran por encima de los 4 000 m s.n.m., son afectadas por la adversidad de las bajas temperaturas que se presentan en el lugar (Simoes y Renison 2015). En la investigación, el estar dentro de un invernadero, fue favorable para el porcentaje germinativo de las semillas de P. incana, debido a que los registros de temperatura fluctuaron entre un rango promedio de 22,67 a 31,13°C. El rango óptimo para la germinación de P. incana, según nuestra investigación, registra de 16,8 a 20,6°C, porque cuando la temperatura promedio del día llegaba a esos rangos, las semillas reaccionan óptimamente y también depende de la cantidad de riego que se realiza.
En el tratamiento con agua de coco, hubo una menor germinación que fue del 4 %, a pesar de presentar vitaminas y sustancias químicas con acción promotora sobre la germinación del más del 50 % (Santos et al., 2013), sin embargo, en el 100 % de las semillas sembradas, no fue favorable, es probable que pueda funcionar en otras especies, porque el agua de coco fue utilizada para promover la germinación de muchas especies, como el clavel, debido a que el agua de coco presenta aminoácidos y antioxidantes (Arana-Paredes et al., 2015). Según Quinto et al., (2009), indica que el agua de coco, puede ser promotor de la germinación, a temperaturas entre 16°C y 20°C (Arana-Paredes et al., 2015).
Sin embargo, en la investigación, con el riego con agua de coco, las temperaturas dentro del invernadero oscilaban de 22,67 a 31,13°C, por tal motivo, el agua de coco, comenzó a fermentarse, provocando la formación de hongos alrededor de las semillas y esta situación ha podido influir en la germinación, principalmente en las que fueron regadas con 10, 15, 20, 25 ml; en donde no hubo germinación, sin embargo, con 5 ml, si hubo germinación.
En el tratamiento de agua residual hubo un mayor porcentaje de germinación: del 9%, cabe resaltar que el desarrollo de las semillas depende de los parámetros de calidad de agua que influyen en la tierra (Torres et al., 2008) porque el agua residual tiene una demanda bioquímica (Cardonell et al., 2012) y además, posee una gran cantidad de nutrientes de nitrógeno y fósforo, principalmente, el agua que se utilizó, que fue de la Bahía interior de Puno (Beltrán et al., 2015) y en las semillas que fueron regadas con 5ml en forma diaria, se obtuvo un mejor rendimiento y mayor número semillas germinadas, pero las que fueron regadas con 10, 20, 25 ml no hubo germinación, entonces, a menor abundancia de agua dentro de los tratamientos, hay mayor número de semillas germinadas. Según Enrico et al. (2004) las plantas tienen la capacidad de retener y capturar agua en su organismo, esto demuestra que para P. incana, con mínima cantidad de agua puede germinar la semilla.
En esta investigación, se logró obtener un 9 % de poder germinativo de las semillas de P. incana, mientras que, en forma natural, sólo son viables hasta 3 % (Domic et al., 2017). Esta situación, es alentadora para nuestros resultados, debido a que las especies nativas poseen un bajo nivel de regeneración (Gutiérrez y Becerra 2018).
Con los resultados obtenidos de esta investigación, aportamos conocimiento para que las instituciones públicas y privadas, puedan promover la producción de plántulas de P. incana a partir de la germinación de semillas, regadas con agua residual tratada, pues estas aguas aún son adecuadas para el riego, debido a que contienen nitrógeno y fósforo. Luego, las plántulas pueden ser trasplantadas en su hábitat natural, evitando su proceso de disminución de los bosques relictos de Polylepis en la región alto andina peruana.
Conclusiones
Se ha registrado un 9 % de poder germinativo de las semillas de Polylepis incana sembradas en el tratamiento con riego de agua residual, siendo menores las semillas germinadas con riego de agua de coco y de pozo.
A un suministro de riego de 5 ml, existe un mayor número de semillas germinadas, por tanto, las semillas de Polylepis no necesitan abundante agua para su desarrollo.
Existe un bajo grado de afinidad entre la temperatura y pH del sustrato, esto implica no dependencia de estos parámetros para la germinación de la semilla de P. incana.
Agradecimientos
A la Oficina de Gestión Ambiental de la Universidad Nacional del Altiplano de Puno, por las facilidades brindadas para la realización de este estudio y al laboratorio de Ecología de la Facultad de Ciencias Biológicas; por facilitarnos el uso de diferentes equipos y materiales. Este estudio fue apoyado por la Oficina de Gestión Ambiental y fondos para investigación formativa de la Universidad Nacional del Altiplano de Puno.











 texto en
texto en