INTRODUCCIÓN
Los pinos en Cuba se distribuyen fundamentalmente en condiciones edáficas extremas, ya sea por las desfavorables características físico-químicas del sustrato o por aspectos orográficos (Samek y Del Risco-Rodríguez 1989; Farjon y Filter 2013). Estos hábitats de suelos muy pobres en nutrientes se acompañan, en muchos casos, con la baja disponibilidad de agua y regímenes de fuegos recurrentes, lo que implica una baja competencia con las angiospermas (Keeley 2012; Badik et al., 2018) y la formación de masas continuas donde constituyen la especie dominante (Samek y Del Risco-Rodríguez 1989).
En el occidente de Cuba, esta formación ocupa cerca del 50 % de la superficie forestal, concentrada en Pinar del Río e Isla de la Juventud y representada por Pinus tropicalis Morelet (pino hembra) y Pinus caribaea Morelet var. caribaea Barret y Golfari (pino macho).
P. tropicalis es un endemismo cubano del subg. Pinus subsect. Pinus en América (Geada-López et al., 2004; Gernandt et al., 2005), forma pinares continuos monotípicos en Pinar del Río y el centro de la Isla de la Juventud sobre sustratos oligotróficos de pizarra, arenisca y arenas cuarcíticas (Samek y Del Risco-Rodríguez 1989). P. caribaea var. caribaea por su parte, puede ocupar áreas simpátricamente con P. tropicalis y solo forma naturalmente masas puras en sustratos derivados de serpentina y rocas ultrabásicas en la meseta de Cajálbana (López-Almirall 1982; Samek y Del Risco-Rodríguez 1989; Farjon y Filter 2013). Desde el punto de vista evolutivo es una especie reciente y sus variedades se diferencian tanto desde el punto de vista morfológico como genético (Rebolledo-Camacho et al., 2018).
Variaciones en la morfología y la estructura anatómica de la acícula entre individuos y poblaciones obedece a diferencias en las condiciones del edátopo y los regímenes de humedad del hábitat donde crecen (Tiwari et al., 2013; Ghimire et al. 2014; Meng et al., 2018) y pueden ser usadas como un método rápido para explorar la variabilidad morfoanatómica entre poblaciones (Boratyñska et al., 2015; Zhang et al., 2017). Cambios en las dimensiones de los tejidos de la acícula han sido documentados para especies con rangos de distribución continental (Boratyñska et al., 2015; Jankowski et al. 2017; Jankowski et al. 2019, Köbölkuti et al., 2017) y ambientes contrastados (Boratyñska et al., 2015; Hodžiæ et al., 2020). Sin embargo, estudios como estos en especies insulares con distribución pequeña y condiciones climáticas aparentemente homogéneas son escasos.
Por otro lado, cabría esperar en especies filogenéticamente cercanas, dentro del subgénero Pinus y habitando en simpatría, un comportamiento similare en sus tejidos foliares como respuesta a las condiciones del ecótopo durante su adaptación. Por lo tanto, el objetivo de este estudio fue evaluar la respuesta anatómica de ambas especies en poblaciones naturales y en simpatría, ya que, para el éxito en los programas de manejo, principalmente en el diseño de estrategias de conservación, se debe partir del conocimiento de la variabilidad genética, la plasticidad fenotípica y las diferencias genéticas de la plasticidad de las especies forestales en caracteres adaptativos, entre y dentro de sus poblaciones.
MATERIALES Y MÉTODOS
Muestreo
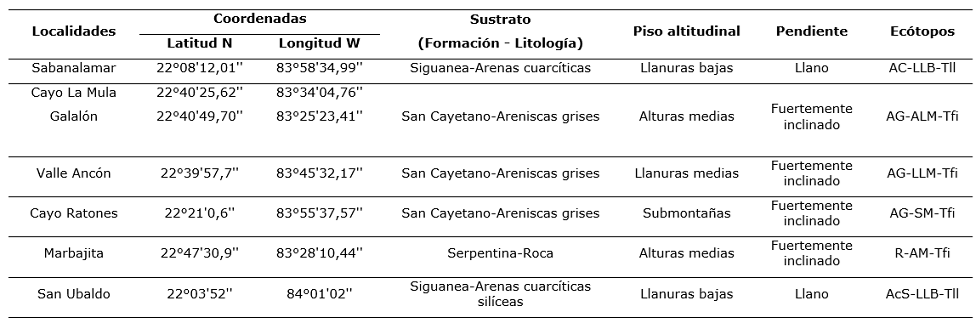
Las muestras fueron tomadas en pinares naturales donde se desarrollan Pinus caribaea var. caribaea (esta especie será tratada en lo adelante como Pinus caribaea) y Pinus tropicalis, en localidades de la provincia de Pinar del Río y Artemisa, Cuba donde habitan en simpatría (Figura 1). Estas localidades representan la mayoría de los hábitats en que están presentes estos taxones y se caracterizaron por su formación y litología, el piso altitudinal y la pendiente de acuerdo a Geada-López et al. (2021). La combinación de estas tres características es la base para identificar los ecótopos (Tabla 1), las localidades de Marbajita y San Ubaldo representan sitios donde se encuentran masas puras de Pinus caribaea y P. tropicalis, respectivamente.
Mediciones de rasgos en las acículas
En cada localidad, se recolectaron acículas de los ⅔ inferiores de la copa de 30 individuos seleccionados al azar en estado adulto. Para el estudio anatómico se eligieron diez acículas al azar de cada individuo muestreado en cada localidad. Se realizaron cortes transversales en la parte media de la acícula para las observaciones y mediciones con un microscopio óptico NLCD-307B. Todos los cortes fueron realizados a mano en tejido fresco y en preparaciones temporales.
Las variables anatómicas medidas, con un aumento de 400× fueron: el grosor de la cutícula (GC), el grosor de la epidermis (GEp), el grosor de la hipodermis (GH) y contadas el número de capas de células de la hipodermis (CH). Con un aumento de 100× fueron medidas el grosor del tejido de transfusión (PT), el grosor del parénquima clorofílico (PC), el ancho del canal resinífero izquierdo (DCi), el ancho del canal resinífero derecho (DCd), la alto del haz vascular (HHv) y el ancho del haz vascular (AHv) y contadas, con esta lente el número de estomas (NoE), el número de canales (NC). Todas las variables se definieron de acuerdo a Pérez-del Valle et al. (2020).
Análisis estadístico
Para este análisis se consideraron solamente los ecótopos de las localidades donde las especies habitan en simpatría. La comparación del comportamiento de las variables anatómicas entre especie se realizó mediante la prueba de inferencia basada en dos muestras de Mann-Whitney (U) (p < 0,05). Para la comparación entre especies en cada ecótopo donde habitan en simpatría (AC-LLB-Tll en Sabanalamar, AG-ALM-Tfi en Cayo La Mula y Galalón, AG-LLM-Tfi en Valle Ancón y AG-SM-Tfi en Cayo Ratones) se empleó la misma prueba.
Se confeccionó un diagrama según la metodología de Jentys-Szaferowa (1959) para distinguir la variación en la anatomía entre los ecótopos estudiados y de estos con respecto a la línea patrón para la especie, que se asume como los promedios de cada variable, representada en el diagrama por una línea a lo largo del valor de uno.
Con el objetivo de maximizar las diferencias entre las dos especies y distinguir la o las variables que más contribuyen a diferenciarlas se realizó un análisis de discriminante, como grupos a priori se consideraron las observaciones de las variables anatómicas por las combinaciones especie-ecótopo. En este análisis se incluyó las localidades donde ambas especies forman masas puras. Los análisis estadísticos fueron realizados con el programa Infostat ver. 15 (Di Rienzo et al., 2015).
RESULTADOS
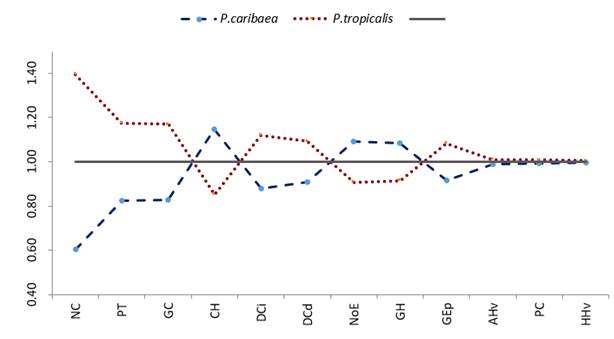
De acuerdo a los resultados de la Prueba Mann-Whitney, P. caribaea y P. tropicalis difieren significativamente en la mayoría de las variables anatómicas analizadas, en especial las mayores diferencias se observan en el número de canales (NC), el grosor del tejido de transfusión (PT) y el grosor de la cutícula (GC) mientras que las variables grosor del parénquima clorofílico (PC) y alto y ancho del tejido de conducción (HHv y AHv) no difieren significativamente (Tabla 2 y Figura 2).
Tabla 2. - Valores medios y desviación estándar de las variables anatómicas evaluadas de Pinus caribaea y Pinus tropicalis y los estadísticos de la prueba Mann-Whitney (U) (a=0,05)
| Variables | U | p | ||
| Número de estomas | 16,79 ± 2,91 | 13,94 ± 2,21 | 9817,0 | 0,000 |
| Número de canales | 2,99 ± 1,03 | 6,91 ± 1,39 | 20682,5 | 0,000 |
| Grosor de la cutícula | 1,73 ± 0,53 | 2,44 ± 0,87 | 17338,0 | 0,000 |
| Grosor de la epidermis | 13,15 ± 2,74 | 15,54 ± 3,21 | 16886,5 | 0,000 |
| Grosor de la hipodermis | 44,49 ± 10,79 | 37,55 ± 7,23 | 10875,5 | 0,000 |
| Número capas de células de la hipodermis | 2,76 ± 0,52 | 2,05 ± 0,26 | 9150,5 | 0,000 |
| Grosor del parénquima clorofílico | 134,36 ± 21,64 | 136,71 ± 19,5 | 14481,5 | 0,240 |
| Grosor del tejido de transfusión | 112,03 ± 19,26 | 159,71 ± 23,92 | 20160,0 | 0,000 |
| Diámetro del canal izquierdo | 80,77 ± 19,99 | 102,93 ± 24,04 | 17571,5 | 0,000 |
| Diámetro del canal derecho | 83,6 ± 20,95 | 100,78 ± 22,8 | 16921,5 | 0,000 |
| Altura del tejido de conducción | 311,99 ± 50,91 | 314,86 ± 38,9 | 13678,5 | 0,730 |
| Ancho del tejido de conducción | 480,41 ± 86,53 | 490,75 ± 67,73 | 14277,5 | 0,430 |
 GC: Grosor de la cutícula, GEp: Grosor de la epidermis, GH: Grosor de la hipodermis, CH: Número de capas de células de la hipodermis, NoE: Número de estomas, PT: Grosor del tejido de transfusión, NC: Número de canales, PC: Grosor del parénquima clorofílico, DCi: Diámetro del canal izquierdo, DCd: Diámetro del canal derecho, HHv: Altura del tejido de conducción, AHv: Ancho del tejido de conducción Tabla 3. Valores medios y desviación estándar de las variables anatómicas de P. caribaea y P. tropicalis en los ecótopos en simpatría y los estadísticos de la prueba Mann-Whitney (U) (a = 0,05).
GC: Grosor de la cutícula, GEp: Grosor de la epidermis, GH: Grosor de la hipodermis, CH: Número de capas de células de la hipodermis, NoE: Número de estomas, PT: Grosor del tejido de transfusión, NC: Número de canales, PC: Grosor del parénquima clorofílico, DCi: Diámetro del canal izquierdo, DCd: Diámetro del canal derecho, HHv: Altura del tejido de conducción, AHv: Ancho del tejido de conducción Tabla 3. Valores medios y desviación estándar de las variables anatómicas de P. caribaea y P. tropicalis en los ecótopos en simpatría y los estadísticos de la prueba Mann-Whitney (U) (a = 0,05).Fig. 2. - Diagrama de Jentys-Szaferowa (1959) de la variabilidad anatómica de las acículas de P. caribaea y P. tropicalis
Tabla 3. - Valores medios y desviación estándar de las variables anatómicas de P. caribaea y P. tropicalis en los ecótopos en simpatría y los estadísticos de la prueba Mann-Whitney (U) (a = 0,05)
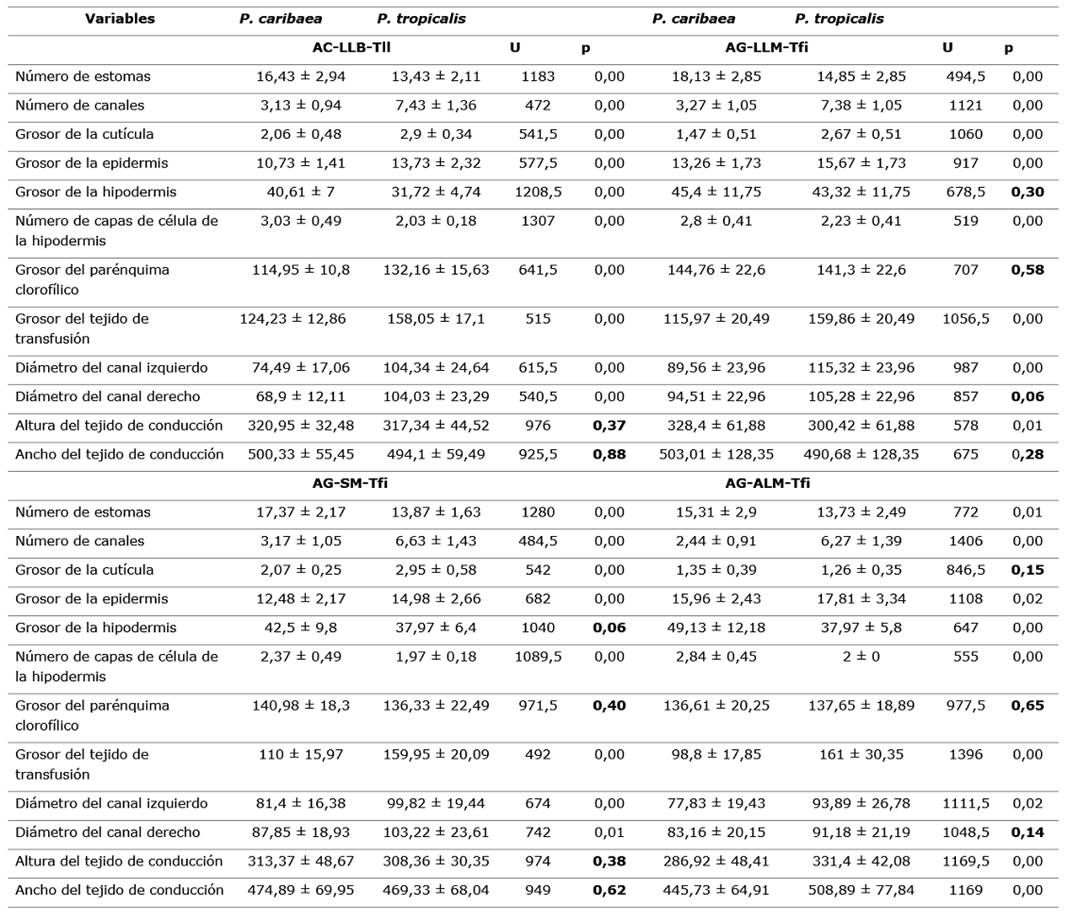
AC-LLB-Tfi: Arenas cuarcíticas-llanuras bajas-terrenos llanos, AG-LLM-Tfi: Areniscas grises-llanuras medias-terrenos fuertemente inclinados, AG-SM-Tfi: Areniscas grises-submontañas-terrenos fuertemente inclinados, AG-ATM-Tfi: Areniscas grises-alturas medias-terrenos fuertemente inclinados.
Existe una respuesta diferencial en la anatomía foliar de cada especie para un mismo ecótopo (Tabla 3 y Figura 3), fundamentalmente en variables como el número de estomas (NoE), el número de canales (NC), el grosor de la epidermis (GEp), el número de capas de células de la hipodermis (CH), el grosor del tejido de transfusión (PT), todas estas relacionadas con la regulación hídrica. Este análisis muestra que varias de estas características anatómicas y las diferencias entre las dos especies son independientes de las condiciones ambientales. No obstante, hay variables que tienen respuestas asociadas a las características del ecótopo, como es el caso del grosor del parénquima clorofílico (PC) que no difiere estadísticamente en los ecótopos cuya litología son las areniscas grises (Figura 3).
Los diagramas de Jentys-Szaferowa (1959) confirman claramente la variabilidad de las dos especies en los cuatro ecótopos y sus diferencias aún en simpatría.
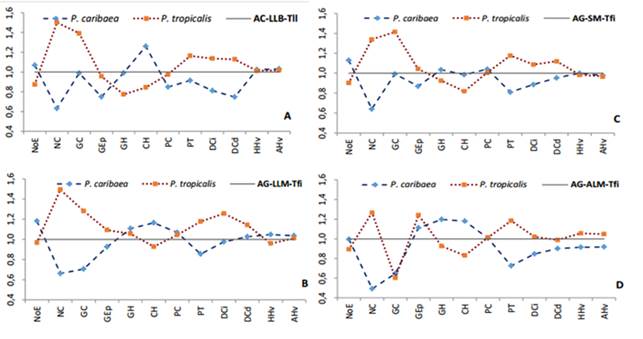 A: Arenas cuarcíticas-llanuras bajas-terrenos llanos, B: Areniscas grises-llanuras medias-terrenos fuertemente inclinados, C: Areniscas grises-submontañas-terrenos fuertemente inclinados, D: Areniscas grises-alturas medias-terrenos fuertemente inclinados GC: Grosor de la cutícula, GEp: Grosor de la epidermis, GH: Grosor de la hipodermis, CH: Número de capas de células de la hipodermis, NoE: Número de estomas, PT: Grosor del tejido de transfusión, NC: Número de canales, PC: Grosor del parénquima clorofílico, DCi: Diámetro del canal izquierdo, DCd: Diámetro del canal derecho, HHv: Altura del tejido de conducción, AHv: Ancho del tejido de conducción.
A: Arenas cuarcíticas-llanuras bajas-terrenos llanos, B: Areniscas grises-llanuras medias-terrenos fuertemente inclinados, C: Areniscas grises-submontañas-terrenos fuertemente inclinados, D: Areniscas grises-alturas medias-terrenos fuertemente inclinados GC: Grosor de la cutícula, GEp: Grosor de la epidermis, GH: Grosor de la hipodermis, CH: Número de capas de células de la hipodermis, NoE: Número de estomas, PT: Grosor del tejido de transfusión, NC: Número de canales, PC: Grosor del parénquima clorofílico, DCi: Diámetro del canal izquierdo, DCd: Diámetro del canal derecho, HHv: Altura del tejido de conducción, AHv: Ancho del tejido de conducción.Fig. 3. - Diagrama de Jentys-Szaferowa de la variabilidad anatómica de Pinus caribaea var. caribaea y Pinus tropicalis en ecótopos en simpatría
Análisis de discriminante
En la Tabla 4, se presentan los resultados del análisis de discriminantes, las dos primeras funciones explican el 88,15 % de las variaciones entre especies por ecótopo. De acuerdo a los coeficientes estandarizados las variables más importantes en la discriminación en la primera función son número de estomas y canales y el grosor de la cutícula y la epidermis en la segunda.
Tabla 4. - Resultados del análisis de discriminante, coeficientes estandarizados de cada variable y centroides de los ecótopos en simpatría en las dos funciones discriminantes
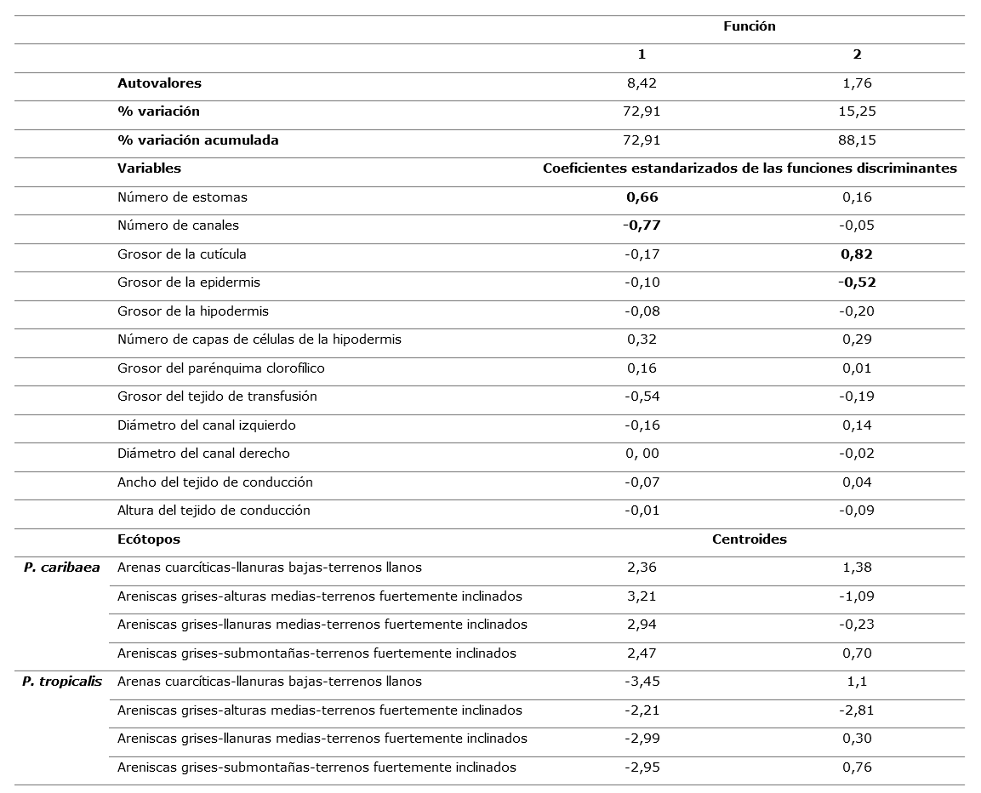
 GC: Grosor de la cutícula, GEp: Grosor de la epidermis, GH: Grosor de la hipodermis, CH: Número de capas de células de la hipodermis, NoE: Número de estomas, PT: Grosor del tejido de transfusión, NC: Número de canales, PC: Grosor del parénquima clorofílico, DCi: Diámetro del canal izquierdo, DCd: Diámetro del canal derecho, HHv: Altura del tejido de conducción, AHv: Ancho del tejido de conducción. Ecótopos: AC-LLB-Tfi: Arenas cuarcíticas-llanuras bajas-terrenos llanos, AG-LLM-Tfi: Areniscas grises-llanuras medias-terrenos fuertemente inclinados, AG-SM-Tfi: Areniscas grises-submontañas-terrenos fuertemente inclinados, AG-ATM-Tfi: Areniscas grises-alturas medias-terrenos fuertemente inclinados
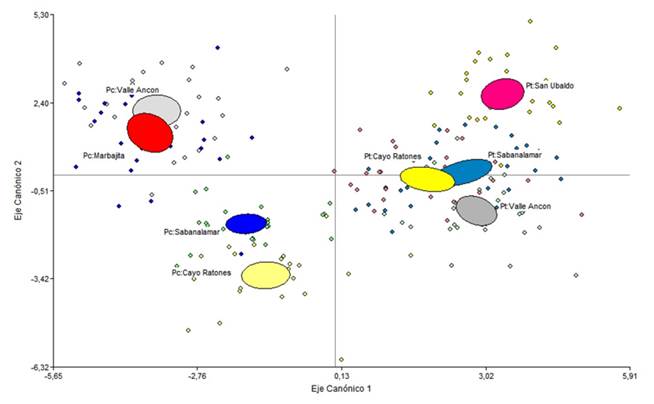
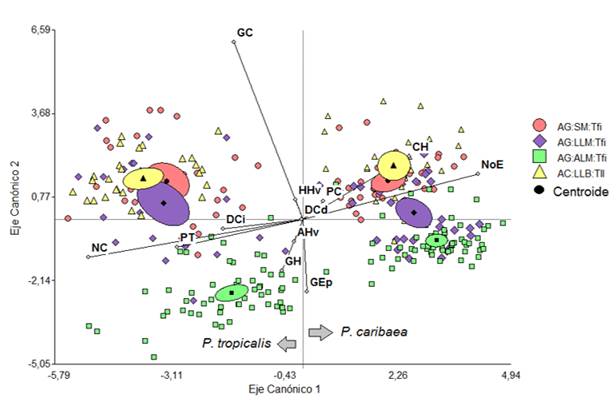
GC: Grosor de la cutícula, GEp: Grosor de la epidermis, GH: Grosor de la hipodermis, CH: Número de capas de células de la hipodermis, NoE: Número de estomas, PT: Grosor del tejido de transfusión, NC: Número de canales, PC: Grosor del parénquima clorofílico, DCi: Diámetro del canal izquierdo, DCd: Diámetro del canal derecho, HHv: Altura del tejido de conducción, AHv: Ancho del tejido de conducción. Ecótopos: AC-LLB-Tfi: Arenas cuarcíticas-llanuras bajas-terrenos llanos, AG-LLM-Tfi: Areniscas grises-llanuras medias-terrenos fuertemente inclinados, AG-SM-Tfi: Areniscas grises-submontañas-terrenos fuertemente inclinados, AG-ATM-Tfi: Areniscas grises-alturas medias-terrenos fuertemente inclinadosFig. 4. - Ordenación de las especies P. caribaea y P. tropicalis en los ecótopos que habitan en simpatría de acuerdo a dos primeras funciones discriminantes y basado en variables anatómicas de las acículas
De acuerdo a los valores de los centroides, (Tabla 4) la primera función maximiza las diferencias entre las dos especies, hacia el extremo negativo del eje canónico 1 se ubica P. tropicalis y hacia el extremo positivo P. caribaea en ambos casos independientemente del ecótopo (Figura 4). De acuerdo a las dos variables de mayor peso en esta función y el signo, mayor número de estomas (NE) en P. caribaea y mayor número de canales (NC) en P. tropicalis son las variables que más discriminan ambas especies.
La segunda función sugiere un gradiente en la ubicación de las especies de acuerdo a las características del ecótopo, las variables grosor de la cutícula y de la epidermis oponen en el caso de P. tropicalis el ecótopo de AG-ALM-Tfi, ubicado hacia la parte negativa del eje, a los otros tres dispuestos en la parte positiva, y en el caso de P. caribaea los ecótopos AG-ALM-Tfi y AG-LLM-Tfi se ubican hacia la parte negativa del eje y AC-LLB-Tll y AG-SM-Tfi hacia la positiva de este (Figura 4 y 5).
De igual manera, cuando se incluye en el análisis las dos localidades donde se hayan en masas puras. Cada especie se ubica en el plano de la función discriminante de manera opuesta y en posiciones similares a los ecótopos donde habitan en simpatría (Figura 5). Por lo tanto, el comportamiento de la variación anatómica es una característica de la especie.
DISCUSIÓN
El estudio muestra claramente las diferencias anatómicas entre las dos especies bajo un mismo ambiente (Tabla 2, 3, Figura 2 y 3), es decir cada especie ha desarrollado sus propios mecanismos anatómicos y funcionales para contrarrestar iguales condiciones. Estructuras con reforzamiento en los tejidos epidérmicos e hipodérmicos, tanto de cutículas gruesas como la presencia de elementos del tejido de sostén (esclereidas) en la hipodermis se reportan como adaptaciones del género a ambientes extremos (Dörken y Stützel 2012; Grill et al., 2004). Estas características son comunes para ambas especies. La diferencia entre ambas especies radica que en P. caribaea desarrolla mayor número de capas y grosor de la hipodermis (tipo multiforme) como adaptación a iguales condiciones. Por otro lado, P. tropicalis desarrolla la cutícula algo más gruesa acompañada de mayor cantidad de esclereidas. Es comportamiento en la estructura de P. tropicalis fue primeramente reportado para la especie por Pérez-del Valle et al. (2020) y es similar a lo documentado en especies de la subsect. Pinus como: P. taboliformis(Zhang et al., 2017), P. thunbergii (Ghimire et al., 2014), P. roxburghii(Tiwari et al., 2013) o especies de su sección que habitan ambientes muy secos: P. canariensis(Grill et al., 2004), P. heldreichii (Nicholiæ et al., 2016).
La presencia de tejido mecánico (esclerénquima) en la hipodermis y de este entre los haces vasculares en Pinus tropicalis, contribuye a aumentar la resistencia a la sequía edáfica y a conferir rigidez a las largas acículas en la especie. Similares adaptaciones y disminución en el número de estomas, fueron reportadas en P. canariensis(Grill et al., 2004, López et al., 2010, P. tabuliformis (Meng et al., 2018) y P. sylvestris (Köbölkuti et al., 2017) para enfrentar ambientes muy secos. Este elemento que parece estar relacionado con la economía hídrica en especies asiáticas, en particular la disminución del número de estomas y su densidad en comparación con especies de Pinus subsect. Trifoliae como es el caso P. cariabea(Tiwari et al., 2013;Donnelly et al., 2016; Galdina y Khazova 2019).
Los resultados de amplios y números canales resiníferos de P. tropicalis sobre P. caribaea en cualquier ecótopo confirma la productividad de la primera sobre la segunda especie (Tabla 3). Estas características en los canales de P. tropicalis en comparación con P. caribaea aunque fue documentada por López-Almirall y Albert-Puente (1982) en un estudio anatómico foliar para detectar diferencias entre las cuatro especies cubanas y más tarde reconocida por Pérez-del Valle et al. (2020) en un estudio anatómico comparativo, pero no fue posible llegar a conclusiones precisas debido a la naturaleza del estudio y limitaciones en el muestreo.
López-Almirall (1982) reconoció la gran variabilidad en las características morfológicas, reproductivas entre rodales naturales puros de Pinus caribaea y la existencia de discretas diferencias entre las poblaciones en P. tropicalis. Posteriormente, Pérez-del Valle et al. (2020) documentó las diferencias entre ambas especies cuando habitaban en dos ecótopos simpátricamente, pero por la finalidad descriptiva del estudio no permitió profundizar en la magnitud del efecto del ecótopo. En presente estudio son más notables las diferencias entre los ecótopos (Figuras 4 y 5,Tabla 3), lo que demuestra su gran plasticidad fenotípica, buena capacidad competitiva con relación a P. tropicalis.
Además, este resultado concuerda con la idea propuesta por Pérez-del Valle et al. (2020) y Geada-López et al. (2021) acerca del origen de las diferencias entre procedencias dentro del ensayo de estas para la especie P. caribaea(García-Quintana et al., 2007) con relación iguales ensayos en P. tropicalis (Mercadet-Portillo et al., 2001). Todo esto, además se relaciona con las grandes diferencias en la estructura anatómica foliar en función del sustrato que son más pronunciadas en P. caribaea (Figura 4 y 5).
Tanto el análisis de comparación de medias como el de clasificación (Tabla 2, 4, Figuras 4 y 5) demuestran que el sustrato tiene una marcada influencia en la anatomía de las acículas al diferenciarse cada ecótopo dentro de cada especie. Así, por ejemplo, la litología de arenas cuarcíticas que representan uno de los ecótopos más extremos desde el punto de vista hídrico por su alta infiltración y muy baja retención de humedad, determinan un comportamiento más singular en la anatomía.
Por otro lado, en ambas especies dentro de sus ecótopo y en particular para Pinus tropicalis, la estabilidad en las características anatómicas sugiere la existencia de una adaptación a más largo plazo en la especie (López-Almirall 1982; Geada-López 2003). Si bien este marcado efecto del ecótopo sobre la anatomía foliar en el género es reconocido, este aparece documentado para especies con amplios rangos de distribución (Zhang et al., 2017; Jankowski et al. 2017; Köbölkuti et al., 2017; Tyukavina et al., 2019). Sin embargo, en especies una reducida área de distribución y sin grandes contrastes en clima y vegetación pudieran no estar sujetas a tanta variabilidad foliar. Los resultados obtenidos reflejan que, en especies insulares, en especial las cubanas, las condiciones del sitio o su origen geológico hace que desplieguen una variación fenotípica, que determina su adaptación a ecótopos diferentes (Pérez-del Valle et al., 2020; Geada-López et al., 2021; Geada-López et al., 2022).
Resumiendo, bajo el mismo ecótopo cada taxón tiene una respuesta diferencial adaptativa opuesta en todas sus variables anatómicas. Además, existe variación en la anatomía dentro de ambas especies en función del sustrato.











 texto en
texto en