INTRODUCCIÓN
La COVID-19 es una enfermedad proinflamatoria sistémica aguda, inmunológicamente mediada, con afectación predominantemente endotelial. Aunque la clínica fundamental de la enfermedad por COVID-19 es respiratoria, también hay complicaciones neurológicas, renales, digestivas y de otros órganos.1
Fue identificada en la Ciudad de Wuhan, Provincia de Hubei, China, en personas con neumonía grave que asistieron a un mercado de animales vivos y declarada pandemia global el 11 de marzo de 2020. La enfermedad es provocada por un betacoronavirus monocatenario envuelto, con alto poder mutacional y recombinante, íntimamente relacionado con el síndrome respiratorio agudo severo (SARS), conocido por su gran capacidad infecciosa y su rápida transmisión y por manifestarse clínicamente, entre otros síntomas, como un síndrome respiratorio.2 Este nuevo virus fue llamado primeramente 2019-nCoV y posteriormente SARS-CoV-2.2,3
El reservorio del SARS-CoV 2 parecen ser los murciélagos y existe la hipótesis de que en la transmisión inicial hacia los humanos probablemente participa como hospedero intermediario el pangolín debido a la presencia de virus relacionados con el SARS-CoV-2 en pangolines malasianos, el polimorfismo del receptor ACE 2 y las similitudes de secuencias entre el receptor de enlace dominante (Receptor Binding Domain, RBD) de las células del pangolín y de las humanas hacia los Sarbecovirus; sin embargo, más tarde se informó que la afinidad de unión del receptor ACE 2 del pangolín por SARS-CoV-2 es baja, lo que pudiera exonerar a este animal acusado de ser el hospedero intermediario. Además, los datos disponibles no se ajustan al modelo de desbordamiento que se propone actualmente para la zoonosis emergente.4
DESARROLLOFigura 14 Tabla 7 Figura 21
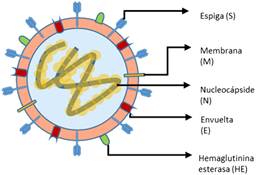
Este nuevo virus tiene forma esférica, con un diámetro de 60 a 140nm, con picos en su membrana de aproximadamente 9 a 12nm, que le confieren la característica más destacada de los coronavirus: la apariencia de corona solar que ha generado el nombre de este grupo y, además, viriones esféricos de 125nm de diámetro.2,5
Como el resto de los coronavirus, el SARS-CoV-2 contiene cuatro proteínas estructurales principales: proteína espiga (S), proteína de membrana (M), proteína de envoltura (E) y proteína de nucleocápside (N). Una quinta proteína estructural, la hemaglutinina-esterasa, está presente en un subconjunto de β-coronavirus (Figura 1).5,6,7,8
La proteína S es una glucoproteína que media la unión al receptor del huésped. La proteína M es la proteína estructural más abundante, tiene tres dominios transmembranales y se cree que le da forma al virión. Estudios recientes refieren que las proteínas M pueden adoptar dos conformaciones diferentes, lo que les permite unirse a la nucleocápside. La proteína E, de igual manera, una proteína transmembrana, se encuentra en pequeñas cantidades dentro del virión. Tiene actividad de canal iónico que facilita el ensamblaje y la liberación del virus, lo que es importante para la patogénesis de la enfermedad. Por último, la proteína N es la única proteína presente en la nucleocápside, se compone de dos dominios separados, ambos capaces de unirse al ARN in vitro; sin embargo, cada dominio utiliza diferentes mecanismos para unirse al ARN. Se cree que para la adecuada unión se requiere la contribución de ambos dominios y se ha sugerido que la fosforilación de la proteína N desencadena un cambio estructural que mejora la afinidad por el ARN viral en vez del ARN no viral. A su vez, se piensa que la proteína N, en conjunto con la proteína M, interacciona para empaquetar el genoma encapsulado en partículas virales. Una quinta proteína estructural, la hemaglutinina-esterasa, presente en un subconjunto de β-coronavirus, permite la unión de las glucoproteínas de superficie. Se piensa que mejora la entrada hacia las células mediadas por la proteína S y la propagación del virus a través de la mucosa.6
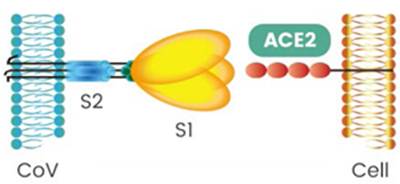
El receptor del SARS-CoV-2 es la enzima conversora de angiotensina 2 (ACE 2), una proteína de membrana presente sobre todo en el pulmón, los riñones, el corazón y el tejido adiposo; su expresión determina el tropismo viral.7,9,10
La infección de las células ocurre a través de la unión de la proteína espicular “S” del virus a los receptores de la ACE 2. La entrada del virus al citosol de la célula huésped requiere que la serina-proteasa transmembranaria de tipo 2 se adhiera al receptor de la ACE 2 y active la proteína espicular del virus, lo que permite la fusión de la membrana viral y la celular. Una serie de divisiones en la proteína S permite la formación y liberación del genoma viral al citoplasma. El siguiente paso después de infectar las células del huésped es la replicación de las proteínas virales, el que comienza con la traducción del ARN genómico del virión. Los coronavirus contienen los genomas de cadenas ARN de sentido positivo de una sola hebra más grande que se conoce en la actualidad. Una vez que logra la entrada celular el virión arroja su envoltura para comenzar su replicación en el citoplasma de la célula huésped. Se une a los ribosomas celulares y la polimerasa viral liberada comienza el ciclo de replicación del ARN. Las nucleocápsides recién formadas continúan su ensamblaje con la adquisición de nuevas envolturas mediante la gemación a través de las membranas del retículo endoplásmico de la célula. Luego, los viriones se liberan en la circulación sanguínea y linfática general, listos para infectar nuevas células, otros órganos y nuevos huéspedes (Figura 2 y Figura 3).6
 ARA-II: antagonistas del receptor de la angiotensina II; AT-1: receptor tipo 1 de la angiotensina II; ECA: enzima de conversión de la angiotensina I; ECA2: enzima de conversión de la angiotensina II; IECA: inhibidores de la ECA; MAS: receptor acoplado a proteína G; SARS-CoV-2: coronavirus 2 del síndrome respiratorio agudo grave; SRAA: sistema renina-angiotensina-aldosterona; TMPRSS2: proteasa transmembrana de serina 2 asociada con la superficie del huésped
ARA-II: antagonistas del receptor de la angiotensina II; AT-1: receptor tipo 1 de la angiotensina II; ECA: enzima de conversión de la angiotensina I; ECA2: enzima de conversión de la angiotensina II; IECA: inhibidores de la ECA; MAS: receptor acoplado a proteína G; SARS-CoV-2: coronavirus 2 del síndrome respiratorio agudo grave; SRAA: sistema renina-angiotensina-aldosterona; TMPRSS2: proteasa transmembrana de serina 2 asociada con la superficie del huéspedFigura 3 Relación entre el SARS-CoV-2 y el SRAA10
La infección ocurre primero en las células epiteliales nasales y bronquiales y secundariamente en los neumocitos. La aceleración de la replicación viral y la alteración de la integridad de la barrera epitelio-endotelial en los primeros estadios provoca una respuesta inflamatoria incontrolable y un estado de hipercoagulabilidad. La alteración del sistema renina-angiotensina-aldosterona también puede contribuir al daño tisular relacionado con la infección.1,5,8
La enfermedad tiene un período corto de incubación de 2 a 14 días (media 4 a 6 días), incluso se manifiesta que puede llegar hasta 28 días pero con un curso largo de varias semanas hasta la recuperación o la muerte, se estima que una alta proporción de pacientes demoran 14 días o más en desarrollar síntomas.1,5,8
Su transmisión puede ser directa de persona a persona tanto por personas sintomáticas como asintomáticas que establecen un contacto estrecho (a una distancia menor de 6 pies), a través de gotículas o gotas respiratorias que se generan al hablar, toser o estornudar, indirecta por el contacto con superficies contaminadas por estas secreciones.1,5,8,12
La vida media estimada del SARS-CoV-2 fue de aproximadamente 6,8 horas en plástico; 5,6 horas en acero inoxidable; en cobre, no se midió SARS-CoV-2 viable después de 4 horas; en cartón, no se midió ningún SARS-CoV-2 viable después de 24 horas.13 También puede trasmitirse por vía aérea, por la inhalación de aerosoles que quedan suspendidos en el aire y posiblemente a través del contacto con los fómites, ya que el virus puede permanecer viable e infeccioso en aerosoles durante horas y en superficies hasta días.1,5,13 Esta transmisión comienza desde 2 a 3 días antes del inicio de los síntomas y desciende significativamente después de 7 a 8 días.8
La transmisión no es homogénea y depende de un factor de dispersión (K). El número básico de reproducción se denomina Ro e indica cuantos casos secundarios puede generar un caso índice o caso primario. El Ro se ha calculado entre 1,5 y 6,5 con promedio de 4 casos por infectado. El por ciento de población que debe estar inmunizada para conseguir un Ro<1 se conoce como umbral de inmunidad de rebaño (UIR) y se calcula como UIR=1-1/Ro (si Ro es igual a 4 como promedio, entonces UIR será 1-¼=0,75, lo que significa que el 75% de la población debe ser inmune para que la pandemia se pueda controlar y probablemente se mantenga de forma endémica).8
Para no estar confundidos debemos saber que un modelo matemático para la propagación de la epidemia espaciotemporal de COVID-19 fue publicado tan temprano como el 23 de marzo de 2020.14
Deben limitarse o evitarse el transporte y el movimiento de pacientes con enfermedad respiratoria viral sospechosa, incluidos pacientes con COVID-19, sospechoso o confirmado, pues puede resultar en oportunidades para su transmisión.15 Tanto la población inmunocompetente, como la inmunocomprometida, son susceptibles.5
Se ha informado transmisión vertical en 2,9% de los neonatos nacidos de madres con COVID-19.16
Factores de riesgo:
- Contacto cercano (<6 pies) prolongado (≥15 minutos) con una persona con COVID-19 sintomática o asintomática desde 48 antes del inicio de los síntomas hasta que se cumplan los criterios de descontinuación del aislamiento domiciliario.17
- Viaje o residencia en zonas con alta o creciente transmisión comunitaria.18
- El personal de salud que está en la primera línea de atención al paciente tiene mayor riesgo de contraer COVID-19 con necesidad de ingreso hospitalario que la población general trabajadora o el personal de salud que no está en la primera línea de atención al paciente.19
- La convivencia con niños y adolescentes está asociada con un mayor riesgo de infección por SARS-CoV-2 y hospitalización en adultos ≤65 años, así como un mayor riesgo de infección, ingreso en unidad de cuidados intensivo (UCI) y muerte por esta causa en adultos >65 años.20
La enfermedad cursa por tres fases:8,21
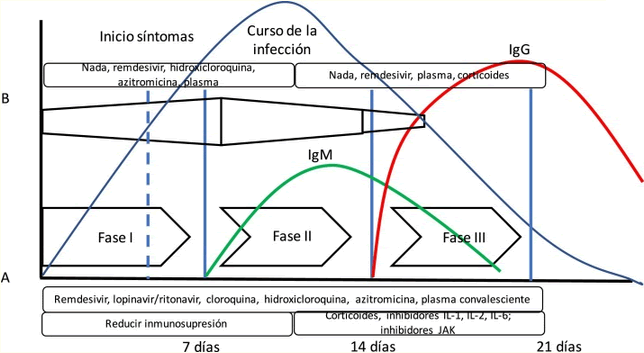
- Fase I o infección temprana: ocurre durante la primera semana, es de réplica viral, con aumento exponencial de la carga viral, síntomas clínicos variables, leves a severos de 2 a 14 días después de la exposición, con un período de incubación de 5 días. RT-PCR+; al final pueden detectarse AC. IgM+.
- Fase II o pulmonar: ocurre en la segunda semana, hay predominio de la lesión pulmonar, con la aparición de infiltrados pulmonares (IIA no hipoxemia, IIB hipoxemia, RT-PCR+/-, IgM+, IgG-).
- Fase III o hiperinflamatoria: se manifiesta en pacientes graves con presencia de tormenta de citoquinas o síndrome de activación macrofágica. Principales implicados: IL-6; IL-10; Interferón (IFN); proteína quimiotáctica de monocitos 1 (MCP-1) y el factor estimulante de colonias de granulocitos-macrófagos (GM-CSG); sin embargo, puede producirse una infección asintomática hasta en un 30% de los pacientes.12,22
La viremia alcanza su punto máximo en la primera semana de la infección, los pacientes generalmente desarrollan una respuesta inmunológica primaria, que es efectiva entre 10 y 14 días posteriores a la infección, seguida de la eliminación del virus. Durante la tercera semana se considera que el deterioro clínico y el daño tisular es el resultado del proceso inflamatorio y/o hiperinmune causado por la infección.5
En la Figura 4 se puede apreciar la disposición del curso de la infección por SARS-CoV-2 y la respuesta inmune mediada por anticuerpos. Además, se ha añadido (A) la propuesta de Siddiqi y Mehra21 de los estadios clínicos y la evolución de la respuesta inmune adaptativa mediada por la producción de anticuerpos y la evolución de una infección viral común. Siddiqi y Mehra proponen un sistema de estadificación clínica en 3 fases para facilitar el uso de una nomenclatura uniforme: fase I o fase de infección temprana, fase II o fase pulmonar y fase III o fase hiperinflamatoria, junto con un tratamiento potencial en cada fase. Sin embargo, esto difiere en algo de la respuesta inmune del cuerpo a la infección viral (B). En la respuesta a la infección vírica, la respuesta inmune innata se inicia justo al principio de la infección hasta que, tras unos días, se produce la respuesta inmune adaptativa con la producción de anticuerpos. Así, algunos fármacos utilizados para tratar COVID-19 pueden bloquear la interleuquina-1, que activa células T, o la interleuquina-6, que participa en la maduración de las células B que serán las que formarán los anticuerpos.23
Métodos de diagnóstico de COVID-19:
Clínicos: síntomas / Rx tórax, oximetría, parámetros sanguíneos (leucopenia, trombocitopenia, proteína C reactiva). Otras pruebas: IL-6, Dímero D
Sospechoso: fiebre, tos, zona de riesgo o contacto claro
Probable: sintomatología clara, RX +
Confirmado: por test diagnósticos (Figura 5)
Gene: TR-PCR: búqueda del virus / carga viral
Anticuerpos IgM / IgG: Inmunocromatografía lateral / ELISA
Proteínas virales: IFA / EIA
Aislamiento del virus en cultivos celulares: células vero
Se ha informado una alta tasa de falsos negativos en los resultados de COVID-19 mediante el uso de RT-PCR, que es el método diagnóstico de elección.24
Yang y colaboradores describieron 213 pacientes hospitalizados con COVID-19, de los que 37 estaban críticamente enfermos. Tomaron 205 muestras faríngeas, 490 nasales y 142 muestras de esputo (en promedio, 3 por paciente) y usaron RT-PCR entre los días 1 hasta el 7 después del comienzo de la enfermedad; 11% de los esputos, 27% de las muestras nasales y 40% de las faríngeas fueron consideradas falsas negativas.25
Además, los pacientes pueden experimentar un falso negativo o aclaramiento viral prolongado, por lo que se declaran no infecciosos siempre que el virus se elimine por completo de su sistema.26
La RT-PCR ha mostrado sensibilidad imperfecta comparada con la radiografía de tórax, de manera que PCR negativo pero Rx de tórax con lesiones alveolo intersticiales, en el contexto actual de la pandemia ¡es COVID-19!27
La infección en viajeros asintomáticos puede no ser diagnosticada basándose en los síntomas o aún si son estudiados con PCR a causa de la imperfecta sensibilidad de la misma.27
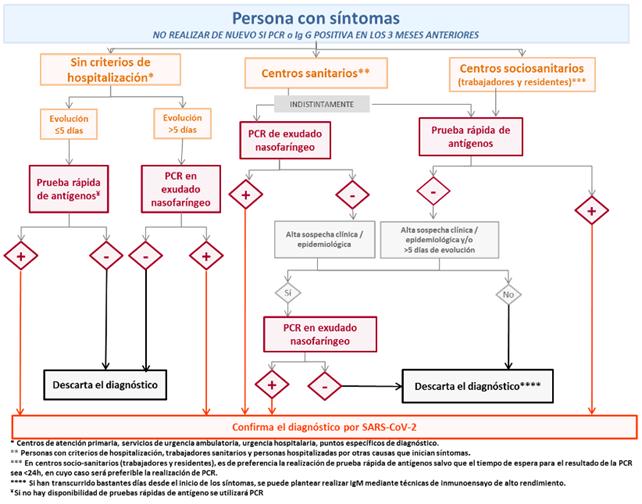
Ruta asistencial para la COVID-1912
1.La ruta asistencial (Figura 6) debe utilizarse para atender a los pacientes una vez que se les hayan aplicado pruebas de cribado para COVID-19 sobre la base de una definición normalizada de caso, después de haber valorado los síntomas con los que cursan y tras determinar que se ajustan a la definición de caso presunto.
• En determinadas circunstancias puede utilizarse el término “personas o pacientes en estudio” para referirse a los casos presuntos.
• Los casos probables son los casos presuntos para los que no se dispone de pruebas de detección del SARS-CoV-2 o en los que los resultados de estas no son concluyentes. O en cualquiera de las situaciones siguientes:
1.Los criterios para dar por terminado el aislamiento de los pacientes (es decir, suspender las precauciones para evitar la transmisión) sin necesidad de volver a hacerles pruebas son:
• En el caso de los pacientes sintomáticos que hayan transcurrido 10 días después de la aparición de los síntomas, más un mínimo de tres días adicionales sin presentar síntomas (esto incluye la fiebre y los síntomas respiratorios).
• En el caso de los pacientes asintomáticos que hayan transcurrido 10 días desde que dieron positivo en la prueba de determinación del SARS-CoV-2.
2.Por ejemplo, si un paciente cursó con síntomas durante dos días puede darse por terminado el aislamiento al cabo de 10+3=13 días tras la fecha de la aparición de los síntomas, en el caso de un paciente que haya cursado con síntomas durante 14 días puede ponerse fin al aislamiento al cabo de 14+3=17 días después de la fecha del inicio de los síntomas y en el caso de un paciente que haya cursado con síntomas durante 30 días puede darse por terminado el aislamiento al cabo de 30+3=33 días tras la fecha de aparición de los síntomas.
3.Los países tienen la posibilidad de optar por seguir utilizando pruebas analíticas como parte de los criterios para poner fin al aislamiento. De hacerlo, puede recurrirse a la recomendación inicial de dos pruebas de determinación mediante PCR que hayan dado negativo y se hayan realizado con al menos 24 horas de diferencia entre ellas.
4.Es posible que algunos pacientes cursen con síntomas incluso después de que haya transcurrido el período de contagiosidad.
5.Los países deben definir claramente la ruta asistencial que debe seguirse en el caso de cada paciente hasta que se llegue a un desenlace clínico, incluido el restablecimiento total. En los criterios para dar de alta de la atención clínica especializada deben tenerse en cuenta el estado del paciente, la manera en la que vivió la enfermedad y otros factores, NO UN PCR NEGATIVO.
6.Dejar de aplicar el algoritmo asistencial para COVID-19 no equivale a dar el alta hospitalaria de un establecimiento ni a trasladar a los pacientes de una sala a otra. Por ejemplo, en función de las necesidades de asistencia que se hayan satisfecho para la COVID-19 es posible que, tras haber suspendido la aplicación del algoritmo, determinados pacientes requieran más sesiones de rehabilitación o algún otro tipo de atención. En el caso de que la suspensión de la aplicación del algoritmo asistencial para COVID-19 coincida con el alta hospitalaria deben tenerse en cuenta varios aspectos de carácter médico, por ejemplo, la conciliación de la medicación, el plan de seguimiento con el médico tratante o la verificación de las vacunas que se han aplicado al paciente con arreglo al calendario de vacunación.
• Los casos confirmados son aquellos en los que la infección por el SARS-CoV-2 se ha confirmado mediante pruebas de laboratorio: prueba de amplificación de ácidos nucleicos positiva por SARS-CoV-2, persona sintomática que reúna las condiciones de caso sospechoso o probable MÁS prueba de antígenos positiva por SARS-CoV-2, persona asintomática con prueba de antígenos positiva por SARS-CoV-2 MÁS se conoce que es contacto de un caso probable o sospechoso.29 Las muestras que se emplean con más frecuencia son los hisopos nasofaríngeos, los del cornete nasal medio o los nasales.
2.Todos los casos presuntos, probables o confirmados de infección por el SARS-CoV-2 deben colocarse en aislamiento inmediatamente con el fin de contener la transmisión del virus.
3.En el marco de la ruta asistencial para COVID-19 debe tenerse en cuenta la posibilidad de que los pacientes presenten simultáneamente infecciones (por ejemplo, gripe, paludismo o tuberculosis) o enfermedades crónicas. Debe asegurarse que se prescriba tratamiento para las demás enfermedades con arreglo a los protocolos nacionales o locales.
4.Deben realizarse pruebas a todos los casos presuntos con el fin de determinar si es necesario considerarlos casos confirmados. Hasta que no se obtengan determinaciones negativas en las pruebas analíticas debe prestarse asistencia a todos los casos presuntos de conformidad con el algoritmo asistencial para COVID-19. Si no se dispone de pruebas debe considerarse que los pacientes son casos probables (con base en la sospecha clínica) y se les debe proporcionar asistencia de conformidad con la ruta asistencial para COVID-19.
5.Es recomendable realizar PCR a los pacientes inmunocomprometidos que requieren ingreso antes de la introducción de nuevos inmunosupresores o la introducción de nuevos procedimientos.
Factores de riesgo para el desarrollo de la enfermedad grave y complicaciones (Tabla 1):
Relación linfocitos/neutrófilos
Se han observado diferencias significativas en los recuentos tanto de leucocitos (9,8x109/l vs 5,2x109/l) como de linfocitos (0,6x109/l vs 1,1x109/l) en no sobrevivientes vs sobrevivientes respectivamente.
Según un estudio de Liu J y colaboradores una RLN <3,13 era indicador de bajo riesgo y ≥ de 3,13 era un indicador de alto riesgo.31
El polimorfismo genético en el gen de la ACE 2 está asociado con diabetes32 e hipertensión,33, está por ser probado si existe vínculo entre los resultados clínicos y una predisposición genética para una enfermedad más severa.
Un grupo de investigadores del Instituto Nacional de Rehabilitación y de la Universidad Anáhuac, México, se han dado a la tarea de comprender el posible efecto de la infección por SARS-CoV-2 en la población que padece sobrepeso u obesidad. Las hipótesis generadas (revisión sistémica de la literatura) contribuyeron fuertemente a entender, a nivel molecular, como el estado inflamatorio sistémico de bajo grado que padecen los pacientes con obesidad y el síndrome metabólico influye en el desenlace de COVID-19. Los resultados se difundieron a finales de 2020 en la revista Frontiers Immunology bajo el título de “NLRP3 Inflammasome: The Stormy Link Between Obesity and COVID-19”.34 En ese texto los autores resaltan que el complejo protéico del inflamasoma NLRP3, que se encuentra activo en los pacientes obesos, es sobre activado por el SARS-CoV-2 y desencadena la tormenta de citoquinas inflamatorias característica de los pacientes COVID-19 con mal pronóstico. Esta hipótesis ha sido estudiada y probada en pacientes de otros países a los que han administrado medicamentos que disminuyen la actividad del inflamasoma observando una mayor sobrevivencia, así como una fase clínica menos agresiva de la enfermedad.
Los principales hallazgos de la infección por COVID-19 son los de una neumonía atípica caracterizada por:35
1) Opacidad intersticial: opacidades lineales pequeñas, focales o difusas, causadas por la ocupación parcial del espacio aéreo, engrosamiento intersticial apreciado como opacidades tenues, predominantes en la periferia pero que pueden extenderse a la región hiliar, unilaterales en un principio, bilaterales y difusas en una etapa más avanzada.
2) Opacidad alveolar multifocal: causada por la ocupación de exudados en los alveolos pulmonares. Se ven como opacidades homogéneas, con mayor atenuación que las intersticiales, con márgenes borrosos, mal definidos, que pueden mostrar broncograma aéreo.
3) Opacidades intersticio-alveolares: imágenes mixtas de infiltrado intersticial al que se agregan opacidades alveolares.
4) Efusión pleural: difícil de identificar con el paciente en decúbito, que aparece generalmente hacia la segunda o tercera semana (en casos complicados).
5) Prominencia hiliar: generalmente asociada a patología linfática, vascular o tromboembolismo pulmonar, en ocasiones a hipertrofia ganglionar en ocasión de infección bacteriana.
6) Consolidación focal: única en la neumonía bacteriana.
La resolución del estado de infección COVID-19 puede ser considerada cuando las siguientes condiciones se cumplan:36
Que al menos 7 días hayan pasado desde que los primeros síntomas aparecieran y que al menos 3 días (72 horas) hayan pasado desde la resolución de la fiebre (sin uso de medicación antipirética) y mejoramiento de los síntomas respiratorios (por ejemplo, tos, dificultad respiratoria) y
Mejoría en el Rx de tórax
Índice de saturación (SaO2/FiO2) mayor de 350
Que dos hisopados nasofaríngeos tomados con una separación de ≥24 horas resulten negativos por PCR:
Al evaluar la eliminación de la infección espere los resultados de la primera prueba antes de enviar la segunda prueba.
Si el primer o segundo hisopado nasofaríngeo es positivo mantenga las protecciones y repita el hisopado nasofaríngeo después de 72 horas o más. La eliminación de la infección requiere de dos pruebas consecutivas negativas espaciadas por ≥24 horas.
Se procede entonces a aislamiento por 14 días y se realiza PCR cada 3er día.
Los criterios a considerar para que un caso posible, probable o confirmado sea dado de alta, se describen en la Tabla 2. El alta epidemiológica no debe confundirse con el alta clínica.
Reinfección:38
Solo se han descrito casos esporádicos.
Tener una PCR positivo ≥90 días después de la infección inicial independientemente de los síntomas o
Tener una PCR positiva de 45 a 89 días después de la infección inicial y tener síntomas compatibles con COVID-19 (sin una explicación alternativa o datos exposición reciente)
Para confirmar la infección en estos casos es importante: la CT viral <33, secuenciación genética del virus (se confirmen dos cepas diferentes) y anticuerpos IgG indetectables.
Características clínicas
La presentación inicial de COVID-19 es poco específica. No hay un solo síntoma presente en la mayoría de los casos. La fiebre es el más común, pero está presente en menos de la mitad de los casos al momento de buscar ayuda médica.39
Los síntomas asociados con la COVID-19 se resumen en la Tabla 3. La mayoría de los pacientes con COVID-19 confirmada tienen fiebre o síntomas de enfermedad respiratoria agua (o ambas); sin embargo, se han asociado otros síntomas con COVID-19 (esta lista no incluye todos los síntomas informados). Estos síntomas tampoco son específicos de COVID-19 y el valor predictivo de un solo síntoma en el diagnóstico de COVID-19 es incierto.40
Los principales síntomas que se presentan cuando se afecta el tracto respiratorio superior son: rinorrea, estornudos, dolor de garganta. Mientras que las manifestaciones del tracto respiratorio inferior son: neumonía, opacidades en vidrio despulido y síndrome de dificultad respiratoria aguda. Por otro lado, los síntomas más frecuentes de afección sistémica son: fiebre, tos, fatiga, esputo productivo, cefalea, disnea y linfopenia. En menor frecuencia: hemoptisis, daño cardíaco agudo y diarrea (Figura 7).5
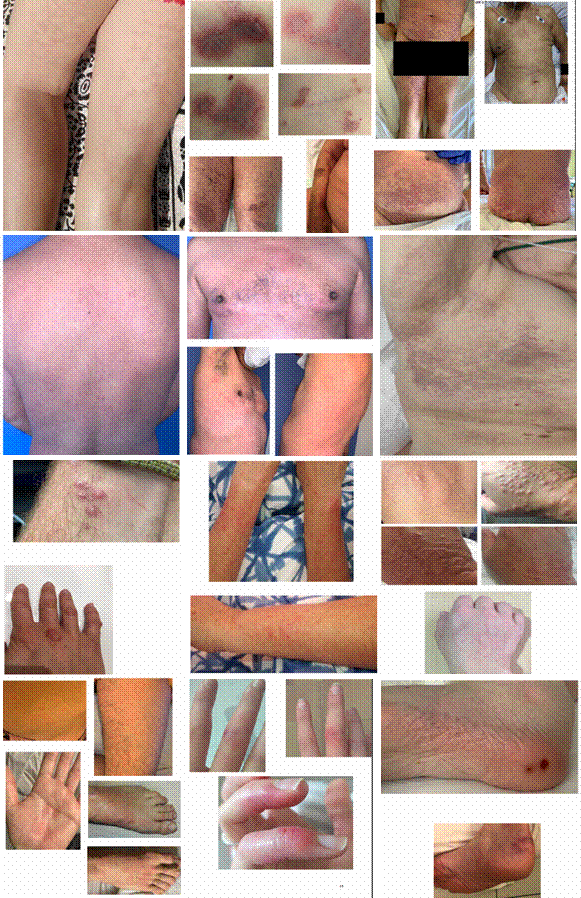
En la Figura 8 se muestran alteraciones dermatológicas variadas, desde rash y erupciones urticariformes hasta lesiones purpúricas o ampollosas.8
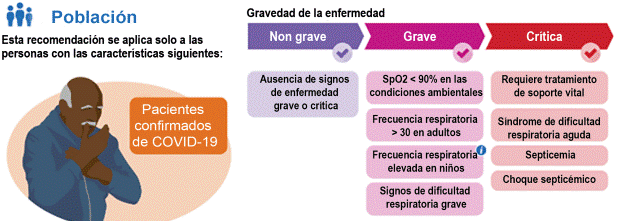
Gravedad de la enfermedad (Figura 9):
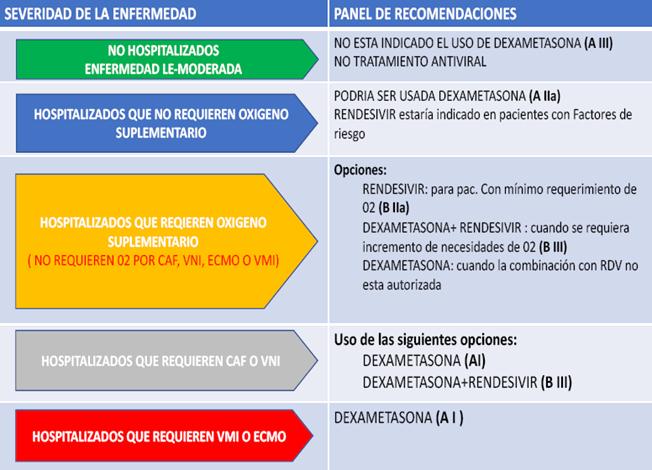
Los pacientes con una enfermedad leve (ausencia de neumonía viral o hipoxia) no necesitan hospitalización y no se recomienda en ellos el uso de dexametasona u otros corticosteroides a menos que sean necesarios por alguna otra indicación clínica. Los pacientes ambulatorios deben ser instruidos acerca de los signos y síntomas de complicación que provocarían una atención urgente, no se recomienda ninguna terapia antiviral ni inmunomoduladora específica, incluyendo los corticosteroides si no se requiere oxígeno suplementario, aunque se puede valorar el uso de anticuerpos monoclonales como inhibidores de la proteína espicular en pacientes con COVID-19 de intensidad leve a moderada con alto riesgo de progresión clínica (sin un fundamento científico demostrado).
Los pacientes con una enfermedad de intensidad moderada necesitan hospitalización sobre la base de las comorbilidades y el riesgo de progresión clínica. Si se requiere suministro de oxígeno a través de un dispositivo de alto flujo o ventilación no invasiva, pero no ventilación mecánica invasiva ni OMEC, es fuertemente recomendable tratar al paciente con 6mg de dexametasona por vía IV u oral durante 10 días como máximo o hasta el día del alta.
Las manifestaciones graves requieren hospitalización y atención complementaria. Se estima que aproximadamente del 5 al 15% de los pacientes hospitalizados con COVID-19 desarrollarán enfermedad crítica. Las características de la enfermedad crítica asociada con COVID-19 incluyen hipoxemia, falla respiratoria, síndrome de dificultad respiratoria aguda tipo ARDS, choque (tanto distributivo y en algunos casos cardiogénico) y síndrome de falla multiorgánica.39 Se puede valorar en estos pacientes la inclusión de 8mg de tocilizumab por kg de peso corporal total por vía IV (800mg como máximo) o 4mg de baricitinib por vía oral durante 14 días o hasta el día del alta con dexametasona (con o sin remdesivir) en pacientes con muestras de progresión clínica o aumento de los marcadores de inflamación. Se puede administrar dexametasona y corticosteroides alternativos como la prednisona, la metilprednisolona o la hidrocortisona a los pacientes hospitalizados que reúnan los criterios si la dexametasona no está disponible.
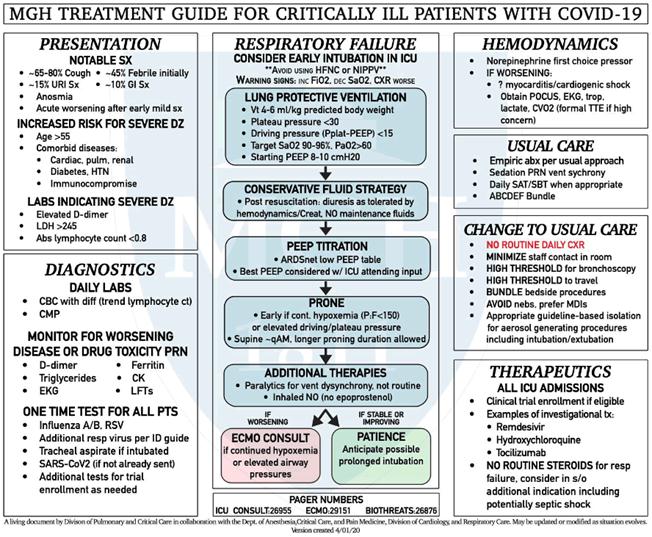
El manejo en la UCI deberá enfocarse en un régimen de ventilación que proteja los pulmones, medidas para evitar el exceso de fluidos, y apoyo de la función de órganos mientras se minimiza el riesgo de transmisión con el aislamiento apropiado.39
Además, se deberá intentar minimizar el número de personal que provee cuidados, reducir el número de pruebas diagnósticas de baja utilidad clínica como placa de tórax diaria y evitar procedimientos que generan aerosoles como la broncoscopia sin indicaciones importantes. Las medidas para apoyar la función de órganos incluyen proveer oxígeno suplementario, intubación y ventilación mecánica. La posición de decúbito prono ha sido benéfica para pacientes con síndrome de dificultad respiratoria aguda y existe algo de experiencia con brindar esta terapia a pacientes no intubados. Tomando en cuenta que existan los recursos adecuados actualmente se prefiere la intubación en vez del uso de oxígeno por cánula nasal o la ventilación de presión positiva no invasiva. Ha habido informes del deterioro clínico acelerado después del inicio de la hipoxemia. Por lo tanto, un aumento en la necesitad de oxígeno en cualquier paciente con COVID-19 debe llevar a considerar traslado a la UCI e intubación. La decisión de intubar debe hacerse lo más temprano posible para facilitar la planeación deliberada, minimizar la generación de aerosoles y prevenir la propagación del daño pulmonar asociado con presiones transpulmonares elevadas generadas espontáneamente.39
La manifestación severa más común de COVID-19 en la UCI es el síndrome de dificultad respiratoria aguda (ARDS, en inglés). El manejo de ARDS en el contexto de COVID-19 no varía significativamente del manejo por otras causas. La ventilación deberá brindarse en el modo de control de volumen con un volumen tidal bajo. La PEEP (presión positiva al final de la espiración) se debe ajustar de acuerdo con el protocolo de la unidad. Se deberá considerar la ventilación en decúbito prono tan pronto sea posible si PaO2/FiO2 es menor de ~150 a 200 después de 12 horas de ventilación mecánica y ajuste de la PEEP, en dependencia en la trayectoria de la enfermedad (se puede considerar el decúbito prono más temprano si hay deterioro rápido). Si los pacientes no responden a estas medidas, ya sea por hipoxemia persistente o presiones de aire muy altas, y si no hay contraindicaciones, es apropiado considerar la oxigenación de membrana extracorpórea (ECMO, en inglés).39
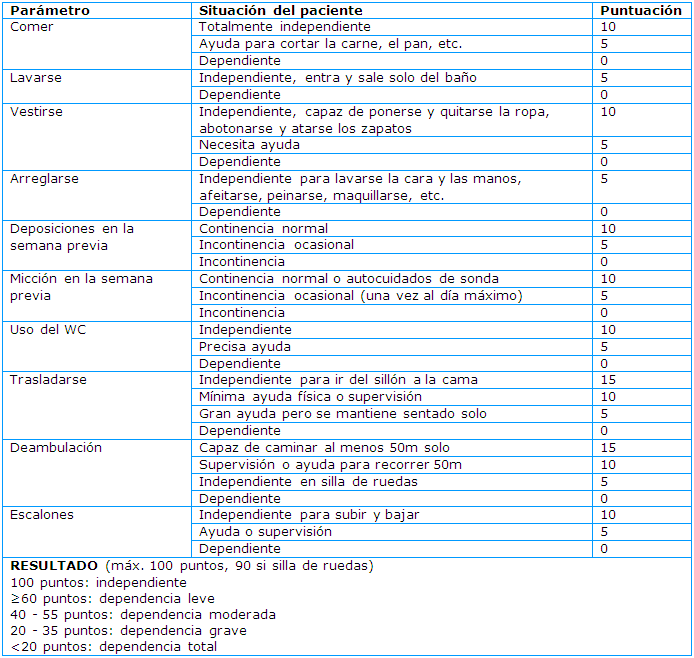
Desde el inicio de los síntomas hasta la admisión hospitalaria transcurre un tiempo promedio de siete días. Posteriormente, con el paso de 24 horas entre cada manifestación clínica, se comienza a presentar disnea, síndrome de dificultad respiratoria aguda y en un promedio de 10,5 días, la admisión a la unidad de terapia intensiva (Figura 10).5
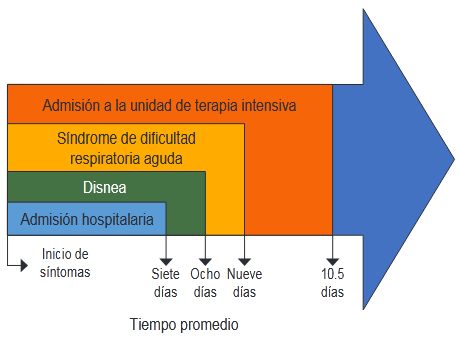
Figura 10 Tiempo promedio en días desde la admisión hospitalaria hasta el ingreso a la unidad de terapia intensiva en la infección por SARS-CoV-25
En una serie de pacientes publicada el tiempo promedio del inicio de síntomas al traslado a la UCI fue de aproximadamente de 7 a 10 días. La mortalidad es alta, con estimados entre 20 y 60% de los pacientes en la UCI. Las razones más comunes para el traslado a la UCI son la hipoxemia y la falla respiratoria. Las características de los pacientes que se asocian con la necesidad de recibir cuidados críticos incluyen edad avanzada (>60 años), sexo masculino y comorbilidades (enfermedad cardiovascular, diabetes y enfermedad pulmonar crónica). En una serie publicada los valores de laboratorio que se asocian significativamente con la necesidad de ventilación mecánica incluyen linfopenia, troponina elevada, creatinina elevada, LDH elevada y aumento del dímero-D. La procalcitonina usualmente es normal y la cuenta de células blancas puede ser normal. La mayoría, pero no todos los pacientes, presentan anormalidades en la placa de tórax. Estas incluyen las opacidades en parches bilaterales, opacidades en vidrio esmerilado y consolidaciones.39
Triage
Los pacientes con COVID-19 en la UCI que requieren procedimientos que generan aerosoles como la broncoscopia y la intubación, que pueden tener que realizarse de forma emergente, deben ser tratados con precauciones de aislamiento apropiadas para reducir el riesgo de transmisión hospitalaria. Ha habido informes de deterioro rápido en pacientes con hipoxemia (PaO2:FiO2 <300, saturación de oxígeno al aire libre <93%). El traslado a la UCI debe considerarse para cualquier paciente con necesidad de oxígeno en aumento. Los signos de aviso de deterioro incluyen linfopenia, aumento de lactato, aumento de CRP y progresión de anormalidades en la placa de tórax.39
Cuidados generales de UCI
Es muy importante proveer el cuidado médico de forma que se minimice el riesgo al personal y se elimine la posibilidad de transmisión nosocomial. Por eso, los pacientes deben ser tratados bajo precauciones de aislamiento apropiadas como se indica en los documentos de protocolo de control de infecciones. Se deberá hacer un esfuerzo para minimizar el número de personal que entre y salga de los cuartos de pacientes. Al pasar visita, no es necesario que todo el equipo de la UCI entre al cuarto.39
Resucitación con fluidos: los pacientes con falla respiratoria hipoxémica deben ser manejados con una estrategia de conservación de fluidos. Esa estrategia solo se debe implementar después de la resucitación inicial cuando el paciente no tiene falta de volumen intravascular y/o se encuentra en choque. Los pacientes con fiebre alta tienen perdidas insensibles que no serán reflejadas en las mediciones del balance corporal total de fluidos. La resucitación de pacientes en choque con fluidos debe ser limitada a los que tengan indicaciones que responden al volumen. La respuesta a fluidos en pacientes con choque puede ser evaluada por una variedad de métodos incluyendo elevar las piernas de forma pasiva, la variación en la presión de pulso y la evaluación de la distensibilidad de la vena cava inferior con uso de ultrasonido. El comportamiento de la PVC o los valores extremos de PVCP pueden brindar información adicional. Después de la resucitación, una estrategia para conservar los fluidos incluye evitar los fluidos de manutención y comienzo temprano de la diuresis como sea tolerado por la hemodinámica y la función renal. Se deberá evitar un balance de fluidos positivo.39
Terapia antimicrobiana empírica: se desconoce la incidencia de sobreinfección bacteriana en pacientes con COVID-19. El inicio de antibióticos empíricos debe seguir la práctica usual con desescalado rápido, como se describe en las guías ATS/IDSA4, para el manejo de pacientes con neumonía adquirida en la comunidad severa (o neumonía adquirida en el hospital si >48 horas después de la hospitalización). Los niveles elevados de procalcitonina han sido descritos en la ausencia de sobreinfección bacteriana en pacientes con COVID-19 y es por eso que pueden no ser de utilidad para tomar decisiones sobre el uso de terapia antimicrobiana. Las técnicas de diagnóstico invasivo como la broncoscopia o mini-BAL no ofrecen beneficio mayor que la succión traqueal ciega usando un catéter en línea y aumentan el riesgo al personal dramáticamente. La broncoscopia diagnóstica se debe evitar en general en pacientes con COVID-19 dado a su poca ayuda y alto riesgo para el personal.39
Imagen: no se ha demostrado un efecto benéfico del uso de la placa de tórax diaria en el resultado clínico de los pacientes en la UCI y por ende debe ser evitada en el cuidado de pacientes con COVID-19. Indicaciones probables para una placa de tórax después de la admisión a la UCI incluyen hemoptisis, sospecha de atelectasias asociadas a tapones mucosos e hipoxemia progresiva rápida. Varios patrones (principalmente opacidades en vidrio y/o consolidaciones) en la tomografía (TAC) de tórax se han asociado con COVID-19, pero no son específicas y no se espera que sirvan para informar el manejo diario del paciente. El transporte de pacientes a la sala de tomografía representa un riesgo para el personal y para otros pacientes, al igual que al paciente crítico que se transporta. Hacer imágenes de TAC en pacientes con COVID-19 también requiere cerrar la sala de tomografía por varias horas después del estudio para que la sala sea limpiada correctamente. Por estas razones, la TAC se debe ofrecer solo cuando se sospecha otro diagnóstico (por ejemplo, un émbolo pulmonar).39
Laboratorios diagnósticos: se recomiendan estudios de laboratorio diarios incluidos hemoleucograma con diferencial (para monitoreo de cuenta total de linfocitos), química sanguínea completa, CPK y LDH. La elevación progresiva de la PCR (proteína C reactiva) se ha asociado con malos desenlaces clínicos. Existe preocupación sobre la polifarmacia dado el gran interés en usar terapias antivirales nuevas. Por eso se recomienda monitoreo diario de enzimas hepáticas y monitoreo periódico de CPK tanto como un electrocardiograma diario para monitoreo de posible prolongación del intervalo QTc. Los pacientes con falla respiratoria frecuentemente necesitan niveles altos de sedación. Para pacientes que reciben propofol se recomienda monitoreo de triglicéridos. En el evento de deterioro clínico se pueden considerar estudios que incluyen dímero-D, saturación de oxígeno venoso central, PCR, lactato y LDH. La sobreinfección bacteriana o por hongos ha sido informada en unos pocos casos, así que es razonable obtener cultivos de esputo y sangre al ser admitido a la UCI.39
Terapias que generan aerosoles: procedimientos como broncoscopia, intubación endotraqueal, extubación, administración de nebulizaciones y cambio de traqueostomía son asociadas con un alto riesgo de aerosolización y subsecuente transmisión viral. Estos procedimientos deben ser realizados con todo el personal, con un respirador N95 y el resto del equipo de protección personal apropiado. La decisión para intubar debe hacerse temprano en el proceso de deterioro clínico, con el objetivo de que el personal esté preparado con los medios de protección ante la necesidad de intubar al paciente. Muestras respiratorias para el diagnóstico de sobreinfección bacteriana deben ser obtenidas en ese momento a través de un aspirado endotraqueal con sistema cerrado. Los medicamentos inhalados deberán darse por inhalador de dosis medida en vez de nebulización cuando sea posible para disminuir el riesgo de transmisión viral. Los ventiladores deberán incluir uso de adaptadores en el circuito para facilitar uso subsecuente de inhaladores sin abrir el circuito.39
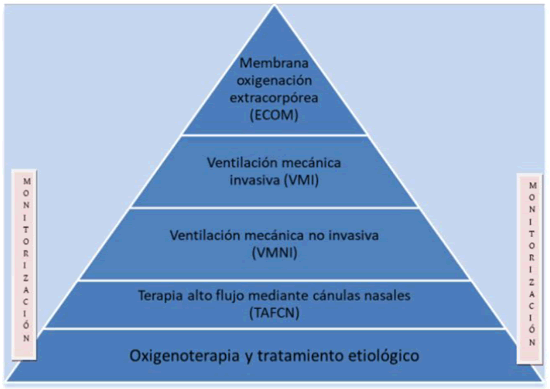
Apoyo respiratorio no invasivo39
En publicaciones de series de pacientes en China y otros países se describió un número importante de pacientes que fueron tratados con oxígeno a través de cánula nasal de alto flujo (high-flow nasal cannula, HFNC) y ventilación no invasiva de presión positiva (non-invasive positive pressure ventilation, NPPV). Ha existido preocupación acerca del uso de estos métodos porque datos sugieren que pueden generar aerosoles infecciosos y que las partículas virales pueden persistir por bastante tiempo después de los procedimientos generadores de aerosoles.
Oxigenoterapia convencional:28
Se deben evitar mascarillas ventimask. Si es necesario su uso, colocar una mascarilla quirúrgica sobre el ventimask y utilizar la menor FIO2 posible.
Se utilizarán preferentemente gafas nasales (tenedor nasal) con flujo máximo de 6 l/min, colocando una mascarilla quirúrgica sobre ellas.
En caso de necesitar mayor flujo de oxígeno para mantener saturaciones óptimas, utilizar mascarilla reservorio a 10-12-15 l/min.
Oxigenoterapia de alto flujo y dispositivos de soporte respiratorio:28
Cánulas de alto flujo: se realizará preferentemente en habitaciones de presión negativa (mientras exista disponibilidad), colocando una mascarilla quirúrgica al paciente. Se realizará con monitorización por pulsioximetría y por los Especialistas en Neumología.
CPAP/Boussignac: se realizará principalmente en habitaciones de presión negativa (mientras exista disponibilidad). Se realizará con monitorización por pulsioximetría.
Ventilación mecánica no invasiva: debido al mayor riesgo de contaminación con este soporte se valorará individualmente cada caso.
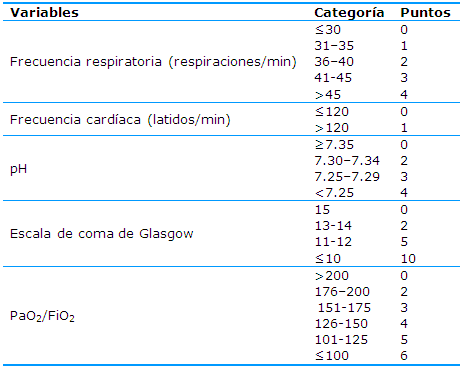
Escalas para predecir la respuesta a oxigenoterapia de alto flujo y soporte ventilatorio no invasivo (Figura 11). Escala HACOR, permite identificar de forma precoz el fracaso de la ventilación no invasiva (VNI) en base a una serie de puntos. Tras 1 hora de inicio de la VNI, un score HARCOR > 5 predice la necesidad de intubación (Tabla 4).28
 IROX: Índice ROX, se calcula mediante la fórmula (SatO2/FiO2)/frecuencia respiratoria, a las 2, 6 y 12 horas de inicio de cánulas de alto flujo y predice la respuesta al tratamiento
IROX: Índice ROX, se calcula mediante la fórmula (SatO2/FiO2)/frecuencia respiratoria, a las 2, 6 y 12 horas de inicio de cánulas de alto flujo y predice la respuesta al tratamientoFigura 11 Escalas para predecir la respuesta a oxigenoterapia de alto flujo y soporte ventilatorio no invasivo28
Donde exista acceso a ventilación mecánica este es el método preferido de apoyo respiratorio para pacientes con falla respiratoria asociada a COVID-19. En pacientes con otras etiologías de falla respiratoria, HFNC y NPPV se pueden ofrecer de acuerdo con las indicaciones usuales. En particular, se debe continuar ofreciendo NIPPV para pacientes con falla respiratoria hipercárbica y EPOC previamente diagnosticado. Si existe la necesidad de usar NIPPV o HFNC para pacientes con COVID-19 posible o confirmado, estas terapias se deberán ofrecer en el contexto de aislamiento estricto previo a la consulta con el médico encargado de la UCI y el grupo de liderazgo de cuidados respiratorios. En el caso de COVID-19, la ventilación mecánica que resulta con el paciente respirando en un circuito cerrado y filtrado que puede reducir el riesgo de transmisión viral.39
Decisión para intubar
La decisión para intubar debe ser tomada de forma deliberada, consultando al equipo, y debe ser hecha de acuerdo con las guías de control de infecciones más recientes. Además, la intubación no emergente permite que el personal tenga el tiempo adecuado para equiparse con equipo de protección personal (EPP) y prepararse para el procedimiento. Por eso, conforme existan los recursos, se prefiere la intubación temprana. El momento preciso de la intubación debe ser a juicio del clínico tratante. Indicaciones para la intubación incluyen aumento en el trabajo para respirar (uso de músculos accesorios, taquipnea) e hipoxemia persistente o que empeora rápidamente. Como se mencionó más arriba algunos pacientes se deterioran rápidamente.39
En la presencia de infiltrados bilaterales e hipoxemia la ventilación mecánica con volumen tidal bajo puede ser menos dañina que la respiración espontanea vigorosa con o sin apoyo no invasivo pero este beneficio tiene que ser medido contra la necesidad de sedación que usualmente se asocia con la ventilación mecánica. El principio que debe guiar el manejo es llegar a un balance apropiado entre limitar presiones transpulmonares (incluidas presiones transpulmonares espontáneas) y el riesgo de sedación profunda que usualmente se asocia con la ventilación mecánica de pacientes en falla respiratoria hipoxémica. En pacientes con escalamiento moderado de FiO2 que aún no han desarrollado un aumento severo del trabajo de respiración, se puede considerar la posición en decúbito prono antes de la intubación. Esto se implementa mejor como lo explica el protocolo de MGH para la posición en decúbito prono en pacientes no intubados.39
Se deberán utilizar las siguientes recomendaciones (Figura 12) para guiar la sedación de pacientes con COVID-19 usando ventilación mecánica.
Escala terapéutica en el tratamiento de la IRA41 (Figura 13) y criterios para iniciar el soporte respiratorio en la IRA secundaria a COVID-19:42
Disnea moderada-grave con signos de trabajo respiratorio y uso de musculatura accesoria o movimiento abdominal paradójico.
Taquipnea mayor de 30 rpm.
PaO2/FiO2<200 (o la necesidad de administrar una FiO2 superior a 0,4 para conseguir una SpO2 de al menos 92%).
Fallo ventilatorio agudo (pH< 7,35 con PaCO2>45 mm Hg).
Manejo de la falla respiratoria39
La mayoría de los pacientes con COVID-19 que sufren de falla respiratoria hipoxémica desarrollan ARDS. El manejo de ARDS en el contexto de COVID-19 no difiere significativamente del manejo de ARDS estándar. Los pacientes deben comenzar con ventilación controlada de volumen asistido con un volumen tidal menor o igual a 6ml/kg del peso corporal ideal (calculado basado en la altura: peso corporal predicho=peso predicho (Kg)=alt. [cm]-152,4x0,91+50 [hombre] o +45 [mujer]), un ritmo de hasta 35 respiraciones por minuto y presión positiva al final de la espiración (PEEP) moderada (8-10cmH2O). Se recomienda un PEEP inicial moderado en vez de recurrir inicialmente a los procedimientos usuales de titulación de PEEP o tablas de PEEP/FiO2. La presión meseta de la vía aérea (Pplat, medida durante una pausa final inspiratoria) deberá ser mantenida debajo de 30cmH2O y la presión de distensión (Pplat-PEEP) deberá ser mantenida <15cmH2O. La hipercapnea se permite (hipercapnea permisiva). Si no hay evidencia de presión intracraneal elevada la meta deberá ser mantener un pH arterial >7,25.
Ajuste de parámetros de ventilación mecánica: Los pacientes con ARDS podrán no responder a los parámetros de ventilación iniciales ya sea a través de presiones de vía aérea persistentemente altas (Pplat >30 cmH20 y/o presión de distensión >15cmH2O) o hipoxemia persistente. La severidad de la hipoxemia podrá ser evaluada por medio de la relación PaO2/FiO2. Aunque la saturación de oxígeno ideal deberá mantenerse superior a 90%, se cree generalmente que es más importante minimizar las presiones de la vía aérea. Los índices de oxígeno meta son SpO2 >90%, PaO2/FiO2 >150mmHg. Los siguientes pasos se podrán tomar para optimizar los parámetros de ventilación mecánica:
Volumen tidal: si Pplat es superior a 30cmH20 y/o la presión de distensión >15cmH2O se debe considerar reducir el Vt por debajo de 6ml/kg hasta tan bajo como 4ml/kg. El límite inferior en la habilidad de disminuir el volumen tidal es determinado por la disminución asociada con la ventilación por minuto y, por tanto, la hipercapnea. La frecuencia respiratoria podrá aumentarse tanto como sea necesario para compensar siempre y cuando esto no resulte en una auto-PEEP significativa. La auto-PEEP se valora por una curva de flujo espiratorio en la pantalla del ventilador que no regresa a cero antes de que la siguiente inspiración se inicie.
Optimización PEEP: en la presencia de hipoxemia persistente en los parámetros iniciales de ventilación (SpO2 <90%, PaO2:FiO2 <150mmHg) necesitando FiO2 elevada (~0,6 o más), se deberá intentar optimizar formalmente la opción de PEEP. No existe un método de optimización de PEEP que sea claramente superior a cualquier otro y la optimización de PEEP deberá efectuarse basado en los protocolos de rutina de la UCI. Los protocolos usuales de la UCI pueden incluir maniobras de reclutamiento y una prueba de decremento de PEEP con PEEP seleccionada basado en la mejor compliancia/cumplimiento tidal. Sin embargo, las maniobras de reclutamiento podrán ser asociadas con daño y en general deberán ser hechas con sumo cuidado. Particularmente, se deberán evitar múltiples maniobras de reclutamiento en una cantidad corta de tiempo.
Ventilación en decúbito prono: se recomienda enfáticamente la ventilación en posición decúbito prono para pacientes con ARDS basado en las guías de manejo actuales y deberá ser implementada de forma temprana en pacientes con COVID-19. Las indicaciones actuales para la ventilación en decúbito prono son la hipoxemia persistente definida como PaO2/FiO2 <150 durante 12 horas (algunos clínicos prefieren <200 y una iniciación más temprana de la posición en decúbito prono) después de optimizar la PEEP. La ventilación decúbito en prono resulta en una variedad de mejoras a la mecánica pulmonar y podrá realizarse en la cama del paciente y requiere poco equipo adicional. Las contraindicaciones absolutas para la ventilación en decúbito prono incluyen la inhabilidad de mover el cuello (por ej., columna cervical fija o inestable) e inestabilidad esternal. Las líneas de acceso vascular, los tubos de tórax y las líneas de CV no son contraindicaciones al uso de la ventilación prono.
Contraindicaciones absolutas: inestabilidad vertebral, fracturas faciales o pélvicas, tórax abierto o tórax inestable.
Contraindicaciones relativas: delirium, confusión, incapacidad para cambiarse de posición de manera independiente, náuseas o vómito reciente, embarazo avanzado.
La inestabilidad hemodinámica extrema es una contraindicación relativa, aunque también se deberá dar consideración a la posibilidad de que los parámetros hemodinámicos puedan mejorar con la resolución de la hipoxemia. El procedimiento de posición en decúbito prono deberá ser hecho con el personal apegado a las guías de control de infecciones actuales, incluidas las relacionadas a EPP descritas en documentos de control de infecciones por separado. Un bolo de un agente paralítico deberá darse antes de mover a la posición decúbito prono (lo mismo aplica para regresar a la posición decúbito supina). No hay necesidad para el bloqueo neuromuscular persistente después de hacer la maniobra para la posición decúbito prono, excepto conforme sea necesitado basado en la asincronía ventilatoria. El paciente deberá mantenerse en la posición de decúbito prono por lo menos hasta la mañana después de realizar la maniobra de posicionamiento.
Equipo: almohada, oxígeno suplementario a necesidad, vendajes o apósitos de espuma para proteger (si es indicado), monitor continuo de O2.
Acciones de enfermería/Consideraciones especiales
Evaluación: 1. Evaluar movilidad, 2. Evaluar el estado mental y 3. Evaluar las contraindicaciones absolutas y relativas.
Monitoreo del paciente: 1. Los electrodos del EKG deben permanecer en la pared anterior del tórax para monitoreo continuo (si clínicamente está indicado) y 2. El sensor de SpO2 (continuo) debe posicionarse en el paciente si este no está ya en uso.
Orden del procedimiento: 1. Al ser admitido, un paciente que esté experimentando síntomas respiratorios o que requiera oxígeno suplementario debe recibir inicialmente un período de una hora de posicionamiento en prono, 2. Los electrodos del EKG deben permanecer en la pared anterior del tórax y 3. En la posición prono el paciente debe acostarse sobre su abdomen, soportado por sus brazos y una almohada, de manera que la tubería del suministro de oxígeno no se obstruya. Antes de invitar al paciente a adoptar la posición en prono debe evaluarse la capacidad del paciente para cambiarse de posición en la cama de manera independiente. Para minimizar las interrupciones durante el posicionamiento en prono los pacientes deben considerar estrategias de confort como por ejemplo, usar el baño.
Documentación: SpO2 del paciente, dispositivo de oxígeno (cánula nasal, máscara facial simple, máscara de no re-inhalación), l/min de O2, la frecuencia respiratoria y la disnea deben ser evaluadas antes de posicionamiento en prono y una hora después de estar en prono. Documentar la respuesta una hora en posición prono (SpO2, dispositivo de oxígeno, l/min de O2, la frecuencia respiratoria, los signos y los síntomas de dificultad respiratoria) ayudará a identificar a los pacientes que más se beneficiarán del posicionamiento en prono en caso de necesitarse como terapia de rescate.42
En la experiencia del Massachusetts General Hospital hasta la fecha ha sido aparente que los pacientes con ARDS relacionado a COVID-19 responden muy bien a la PEEP debido a que el primer mecanismo de hipoxemia es un “shunt” que puede ser reducido a través del reclutamiento apropiado.39
Se recomienda un enfoque cuidadoso al disminuir los parámetros del ventilador y conducir pruebas de respiración espontánea y que el cambio de control de volumen a soporte de presión no deberá ocurrir hasta que el paciente tenga una PaO2/FiO2 mayor de 200 con una PEEP de 8cmH20 o menos de manera segura. Se recomienda un umbral PaO2:FiO2 de 230.39
En ausencia de obesidad la PEEP deberá reducirse a 5cmH20 antes de proceder con una prueba de respiración espontánea en un período de dos horas. Una vez que la prueba de respiración espontánea sea superada será posible extubar al paciente.39
No existe un beneficio en hacer una traqueotomía temprana en pacientes con COVID-19. No deben realizársele antes de los 14 días para disminuir el riesgo de procedimientos innecesarios que generan aerosoles.39
Manejo hemodinámico
El SARS-CoV-2 ingresa a los neumocitos tipo 2, los cardiomiocitos, las células endoteliales, los macrófagos y los pericitos mediante la ECA 2 y la proteína transmembrana serina 2 (PTMS2) -Figura 15-.43
 ACE2: enzima conversina con angiotensina 2; S proteína: proteína de punta; TMPRSS2: Tipo 2 Transmembrane Serine protease
ACE2: enzima conversina con angiotensina 2; S proteína: proteína de punta; TMPRSS2: Tipo 2 Transmembrane Serine proteaseFigura 15 Representación simplificada del síndrome respiratorio agudo grave Coronavirus 2 (SARS-COV-2) ciclo de vida viral y objetivos potenciales de drogas. El esquema representa la respuesta del sistema inmunológico del huésped inducido por el virus y el procesamiento viral dentro de las células diana. Se observan objetivos propuestos de selectos reutilizados e investigados productos de investigación44
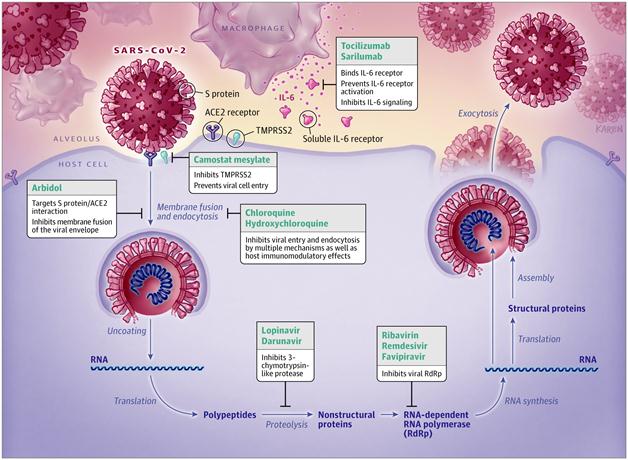
La infección pulmonar desencadena una respuesta inflamatoria sistémica mediada por linfocitos T y macrófagos. A nivel local produce un síndrome de distrés respiratorio agudo (ARDS) con hipoxemia severa. El proceso inflamatorio, en ocasiones, genera una respuesta exagerada y descontrolada del sistema inmune que termina con la liberación de gran cantidad de citoquinas (interleucina-6, interleucina-7, interleucina-22 y proteína 10 inducible por interferón), fenómeno que se conoce como tormenta de citoquinas y que es responsable de muchas de las complicaciones de la enfermedad.43
En el corazón el SARS-CoV-2 es capaz de producir daño cardíaco directo y miocarditis fulminante, mediado por el proceso inflamatorio sistémico y la tormenta de citoquinas. El incremento del metabolismo basal y de la actividad del sistema nervioso simpático son otros de los determinantes. El daño cardíaco se expresa como miocarditis, insuficiencia cardíaca, choque cardiogénico, síndrome coronario agudo y arritmias cardíacas y se detecta por elevación de los biomarcadores cardíacos (troponinas, CK-MB y LDH).43
En los vasos sanguíneos el virus penetra las células endoteliales y causa una disfunción macro y microvascular que conduce a isquemia miocárdica. En presencia de ateroesclerosis coronaria el cuadro puede ser más grave. La disfunción endotelial, la inflamación sistémica y la tormenta de citoquinas pueden causar desestabilización de placas coronarias y producir síndromes coronarios agudos. A la disminución del aporte miocárdico de oxígeno por el defecto de perfusión se suma la hipoxemia en el contexto del distrés respiratorio y el aumento del consumo miocárdico de oxígeno, secundario al incremento del metabolismo basal y la activación simpática.43
Existen informes variados de miocarditis viral tardía que se asocia con choque cardiogénico. El deterioro súbito de un paciente con COVID-19 en la UCI debe llevar a una evaluación de falla cardíaca. Esa evaluación deberá incluir electrocardiograma, troponina, saturación de oxígeno venoso central (en caso que esté disponible), lactato y ultrasonido.39
Arritmias cardíacas
Las manifestaciones cardiovasculares, en especial las arritmias cardíacas, pueden ser secundarias a la enfermedad pulmonar causada por la COVID-19. La lesión pulmonar aguda, en sí misma, conduce a un mayor trabajo cardíaco, con incremento del consumo miocárdico de oxígeno. Por otra parte, la hipoxemia propia del daño pulmonar propicia la disminución del aporte miocárdico de oxígeno. El desbalance demanda/aporte es una situación compleja, especialmente en pacientes con insuficiencia cardíaca preexistente.43
El daño cardíaco y sus manifestaciones clínicas pueden ser un fenómeno primario. El daño miocárdico directo por el SARS-CoV-2, la respuesta inflamatoria sistémica y la intervención del virus en la función fisiológica del sistema renina angiotensina (SRA)/enzima convertidora de agiotensina-2 (ECA2) son las hipótesis más aceptadas.43
En los pacientes con COVID-19 la infección es una condición suficiente para causar arritmias cardíacas en ausencia de cardiopatía estructural previa. El daño cardíaco directo, la miocarditis, la isquemia miocárdica y la insuficiencia cardíaca son escenarios favorables para el desarrollo de fibrilación auricular (FA) y arritmias ventriculares (Figura 16).43
 IL-6: Interleucina-6; IL-7: interleucina-7; IL-22: interleucina-22; CXCL10: proteína 10 inducible por interferón
IL-6: Interleucina-6; IL-7: interleucina-7; IL-22: interleucina-22; CXCL10: proteína 10 inducible por interferónFigura 16 Arritmias cardíacas causada por la COVID-1943
Los sustratos, los disparadores y los moduladores para la génesis y la perpetuación de la FA en este contexto son múltiples, complejos, solapados y de difícil control. Destacan: lesión miocárdica, hipoxia, isquemia, inflamación, hipokalemia e hipomagnesemia, acidosis metabólica, uso de agentes inotrópicos (dobutamina, dopamina y norepinefrina), disincronía del ventilador, sobrecarga de volumen, aumento del tono simpático y la infección bacteriana concomitante.43
Los pacientes con HTA, cardiopatía isquémica, miocardiopatías, DM, obesidad y canalopatías son, per se, un subgrupo de alto riesgo de complicaciones cardíacas que se incrementa en el contexto de la COVID-19. Las citadas comorbilidades se asocian con mayor incidencia de FA, flutter auricular (FLA) y TV (Figura 17).43
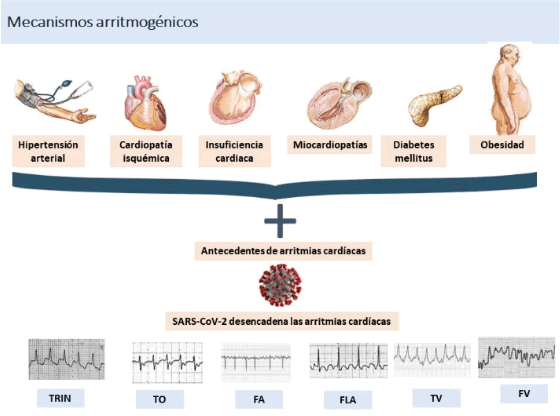 TRIN: taquicardia por reentrada intranodal; TO: taquicardia ortodrómica; FA: fibrilación auricular; FLA: flutter auricular; TV: taquicardia ventricular; FV: fibrilación ventricular
TRIN: taquicardia por reentrada intranodal; TO: taquicardia ortodrómica; FA: fibrilación auricular; FLA: flutter auricular; TV: taquicardia ventricular; FV: fibrilación ventricularFigura 17 Antecedentes de arritmias cardíacas en pacientes con la COVID-1943
El protocolo cubano aplica cloroquina a los pacientes hospitalizados en sala abierta y en unidades de atención a pacientes graves y críticos.45
La cloroquina es un fármaco antipalúdico y también se ha usado para tratar enfermedades del tejido conectivo como el lupus eritematoso sistémico y la artritis reumatoide. Se ha encontrado que inhibe el crecimiento del SARS-CoV-2 in vitro.43
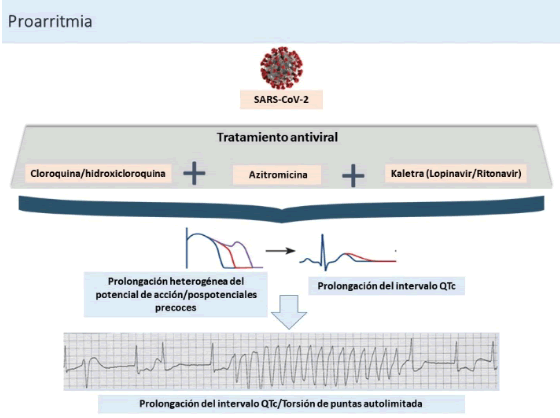
La hidroxicloroquina es un análogo de la cloroquina que tiene menos interacciones con otros fármacos y además mejor tolerancia digestiva. Una preocupación que atañe a la utilización de estos fármacos es que puede producir prolongación del IQTc (intervalo QT corregido), con lo que incrementa la posibilidad de taquicardia ventricular polimórfica tipo torsión de puntas (TdP) y muerte súbita (Figura 18). Otro efecto sobre el sistema cardiovascular que preocupa es la disminución de la velocidad de conducción intracardíaca que se hace evidente con trastornos de la conducción de diferentes grados. Los efectos adversos sobre el corazón son raros y están asociados con el tratamiento a largo plazo; no obstante, se les debe prestar atención por sus implicaciones en término de mortalidad.43
El riesgo de proarritmia (generación de una nueva arritmia o el agravamiento de una preexistente a causa de fármacos usados en dosis consideradas no tóxicas) por el uso de estos fármacos es bajo cuando se usan de forma individual; sin embargo, en el contexto de la COVID-19 casi siempre se incluyen varios a la vez. Además, se debe prestar especial atención a los pacientes bajo tratamiento con fármacos antiarrítmicos por el riesgo de arritmias ventriculares secundarias a proarritmia debido a la interacción con los medicamentos incluidos en el protocolo de tratamiento para la COVID-19.43
El electrocardiograma de superficie refleja el proceso de repolarización ventricular. Las variables electrocardiográficas intervalo QT corregido (IQTc), intervalo T pico-T final, así como sus dispersiones y alternancias son herramientas útiles para evaluar la repolarización ventricular.43
Hay muy pocos datos disponibles sobre el tratamiento antiarrítmico en pacientes con COVID-19. Por lo tanto, la evidencia es limitada y las interacciones farmacológicas, incluidos los antivirales, antiarrítmicos y anticoagulantes, deben considerarse antes de la administración. Las arritmias cardíacas se han identificado como una complicación importante asociadas a daño cardíaco e incremento de la mortalidad en los pacientes con COVID-19, por lo que su tratamiento debe ser resolutivo.43
En los pacientes con FA/FLA algunos de los pilares del tratamiento son el control de la respuesta ventricular, el control del ritmo y la profilaxis tromboembólica. El primer elemento que se debe tener en cuenta ante pacientes con arritmias de nueva aparición para determinar su tratamiento es la estabilidad hemodinámica. En pacientes con inestabilidad hemodinámica debido a FA o FLA de nuevo inicio se debe considerar la cardioversión eléctrica. En los pacientes con FA/FLA algunos de los pilares del tratamiento son el control de la respuesta ventricular, el control del ritmo y la profilaxis tromboembólica.43
En este escenario la amiodarona endovenosa es la opción de medicación antiarrítmica para el control del ritmo pero, su combinación con hidroxicloroquina o azitromicina (o ambas) debe evitarse. En caso de administrarse el beneficio del tratamiento debe equilibrarse con el riesgo proarrítmico debido a la prolongación del intervalo IQTc.43
En pacientes con insuficiencia respiratoria aguda grave es poco probable que la cardioversión proporcione un beneficio sostenido sin un tratamiento intensivo concomitante de la hipoxemia subyacente, inflamación y otros desencadenantes reversibles como hipokalemia e hipomagnesemia, acidosis metabólica, infusión de catecolaminas, sobrecarga de volumen, aumento del tono simpático e infección bacteriana concomitante.43
En pacientes hospitalizados bajo tratamiento antiviral que desarrollan FA/FLA de nueva aparición, sin inestabilidad hemodinámica, pero con respuesta ventricular rápida, se prefiere el inicio del tratamiento para control de la respuesta ventricular con betabloqueantes, bloqueadores de los canales de calcio o digoxina. Esta estrategia es preferible para permitir el uso seguro de medicamentos antivirales. La cardioversión espontánea al ritmo sinusal puede ocurrir en pocas horas o días en pacientes con COVID-19 estables y presentación clínica con gravedad de leve a moderada (Figura 19).43
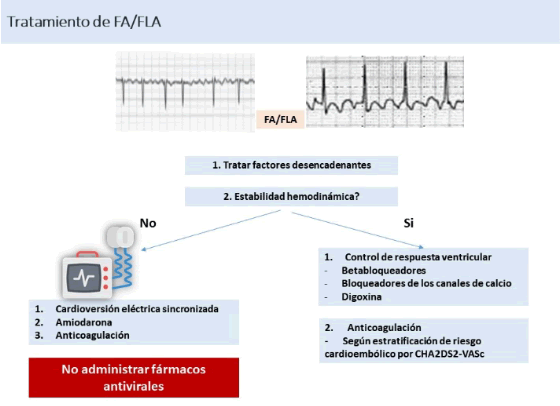 FA: fibrilación auricular; FLA: flutter auricular
FA: fibrilación auricular; FLA: flutter auricularFigura 19 Tratamiento de la fibrilación auricular y el flutter auricular43
La anticoagulación para prevenir el accidente cerebrovascular relacionado con la FA debe guiarse por la puntuación CHA2DS2-VASc (y no por el tipo clínico de FA o el estado del ritmo actual). La anticoagulación terapéutica debe considerarse en pacientes masculinos y femeninos con puntaje CHA2DS2-VASc ≥1 y ≥2, respectivamente, y está indicado en pacientes masculinos y femeninos con puntaje CHA2DS2-VASc ≥2 y ≥3, respectivamente. En pacientes con inestabilidad hemodinámica por FV se debe realizar desfibrilación eléctrica y por TV cardioversión eléctrica sincronizada.43
En presencia de TV monomórfica sostenida (TVMS), con estabilidad hemodinámica, se puede considerar el tratamiento con procainamida o lidocaína endovenosa. El tratamiento con antivirales combinados se debe suspender, en casos con IQTc prolongado, por el riesgo de TdP debido a la interacción con los fármacos antiarrítmicos. En los que tienen IQTc dentro de los valores normales se debe realizar seguimiento con electrocardiogramas seriados para monitorizar el IQT e identificar la necesidad de suspensión de los fármacos antivirales. Se recomienda la cardioversión eléctrica en pacientes que toman medicamentos antivirales combinados que prolongan el intervalo QTc, especialmente en el caso de que el paciente ya esté ventilado. La decisión de suspender los antivirales por el tratamiento con los antiarrítmicos en pacientes con intervalo QTc, en el caso de que el paciente ya esté ventilado, debe ser individualizada sobre la base del riesgo/beneficio de ambos tratamientos.43
Se justifica la implantación de marcapaso (MP) temporal para la terminación de la tormenta arrítmica por sobre estimulación cuando se trata de TV. Siempre se debe valorar el equilibrio entre el posible beneficio terapéutico frente a la invasividad que supone colocar el electrodo y el riesgo de contagio para el personal médico. En pacientes con insuficiencia respiratoria aguda grave la corrección de los desencadenantes reversibles subyacentes (hipoxia, hipovolemia, alteraciones electrolíticas como hipocalemia e hipomagnesemia, acidosis metabólica, infusiones de catecolaminas, sobrecarga de volumen, aumento del tono simpático, taponamiento, neumotórax, isquemia, superinfección bacteriana y drogas proarrítmicas) es imprescindible.43
Hay informes variados de pacientes con choque cardiogénico secundario a miocarditis que ocurrió tarde en su curso clínico. Por eso, un alto índice de sospecha deberá mantenerse para el posible desarrollo de choque cardiogénico y miocarditis viral. Además de los hallazgos físicos (hipotensión, extremidades frías, retraso del relleno capilar), los pacientes con sospecha de choque cardiogénico deberán tener niveles de lactato, saturación de oxígeno venoso central y un electrocardiograma. Un ecocardiograma formal se puede obtener (Figura 20), aunque la miocarditis asociada con COVID-19 principalmente se maneje médicamente. Es razonable tratar a estos pacientes con los protocolos usuales de choque distributivo (norepinefrina/vasopresina como vasopresores iniciales, titulados a una PAM>65mmHg, resucitación de fluidos a medida y monitoreo de CVO2 y lactato. Se deberá poner en una balanza el riesgo adicional de exposición al personal contra cualquier cambio terapéutico. Se podrá requerir la suma de inotrópicos (epinefrina, dobutamina) para lograr la estabilidad hemodinámica. La presencia posible o confirmada de miocarditis deberá ser discutida con el equipo OMEC (oxigenación de membrana extracorpórea) en caso de que los pacientes sean considerados para apoyo extracorpóreo porque podrá tener implicaciones para la elección del tipo de terapia OMEC (veno-arterial o veno-venosa).39
Monitoreo de la coagulación y estrategias de anticoagulación
En muchos casos los pacientes con COVID-19 en la UCI tienen dímero-D elevado y alteraciones no específicas en la cascada de coagulación. Todos los pacientes en la UCI deberán tener dímero-D, TP, TPT, fibrinógeno, hemoleucograma con diferencial cada dos días. Los pacientes con COVID-19 deberán recibir anticoagulación profiláctica con HBPM en ausencia de sangrado profundo o plaquetas <25,000.39
Para la decisión de la pauta de tratamiento profiláctico, se recomienda considerar la gravedad del cuadro clínico de COVID-19 y los factores de riesgo individuales que favorezcan la aparición de complicaciones trombóticas (Tabla 5).
Tabla 5 Factores de mayor riesgo trombótico en pacientes con COVID-1940

a: La terapia hormonal de la menopausia o la anticoncepción hormonal combinada aumentan el riesgo de tromboembolismo venoso. Se ha elaborado una nota informativa sobre el manejo en mujeres con infección o sospecha de infección por SARS-CoV-2 tratadas con estos medicamentos.
Se recomienda emplear HBPM (Heparina de Bajo Peso Molecular) en dosis profiláctica baja en todos los pacientes sin factores de mayor riesgo antitrombótico, HBPM en dosis profiláctica intermedia en pacientes con factores de mayor riesgo trombótico y HBPM en dosis terapéutica en pacientes con enfermedad tromboembólica (Tabla 6).
Tabla 7 Dosis y recomendaciones de anticoagulación23
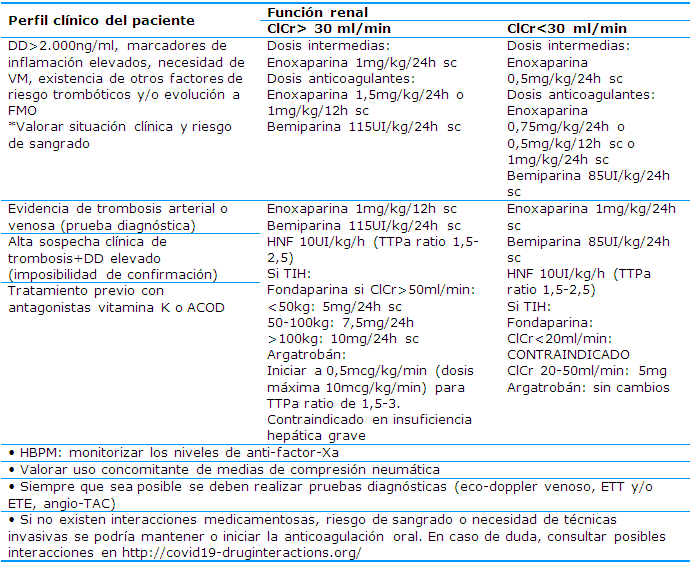
ClCr: aclaramiento de creatinina; DD: dímero D; ETE: ecocardiografía transesofágica; ETT: ecocardiografía transtorácica; FMO: fracaso multiorgánico; HBPM: heparina de bajo peso molecular; HNF: heparina no fraccionada; sc: subcutánea; TAC: tomografía axial computarizada; TIH: trombocitopenia inducida por heparina; TTPa: tiempo de cefalina; VM: ventilación mecánica
Clínicamente, muchos pacientes tienen elevados niveles de dímero D, así como lesiones cutáneas en sus extremidades que sugieren microangiopatía trombótica, coagulación intravascular difusa y trombosis de grandes vasos relacionadas al fallo de múltiples órganos.47 Los cambios pulmonares periféricos están menos caracterizados; sin embargo, la vasculopatía afecta el intercambio gaseoso y la relación ventilación perfusión y contribuye a la hipoxemia y al efecto de la posición prono en la oxigenación.48
Tromboprofilaxis28
A. Anticoagulación profiláctica, se recomienda la siguiente pauta en todos los pacientes ingresados por infección COVID-19 (salvo contraindicación expresa):
• Peso <80Kg: enoxaparina 40mg sc/24h
• Peso 80-100Kg: enoxaparina 60mg sc/24h
• Peso >100Kg: enoxaparina 40mg sc /12h.
B. En pacientes con elevado riesgo de trombosis; es decir, pacientes con infección severa que cumplan al menos tres de los siguientes parámetros: PCR>15, IL-6>40, ferritina >1 000, dímero-D >1 500 o linfopenia <800, o pacientes con dímero-D ≥3 000 (≥6 veces el límite del valor normal). En estos pacientes valorar profilaxis antitrombótica a dosis intermedias:
Una vez se produzca mejoría clínica y analítica desescalar a dosis profilácticas.
C. En pacientes con sospecha de TEP/TVP:
Si hay datos clínicos sugestivos de TEP/TVP subir a dosis anticoagulantes plenas: enoxaparina 1mg/kg/12h o 1,5mg/kg/día
D. Continuación de anticoagulación profiláctica al alta: valoración individualizada de la indicación si persistencia de alto riesgo de trombosis: enoxaparina 40mg sc/24h durante siete días tras el alta y fomentar la deambulación en domicilio.
• Si es posible realizar prueba de imagen para descartarlo. Si no se confirma TEP/TVP valorar desescalar a la dosis de profilaxis previa.
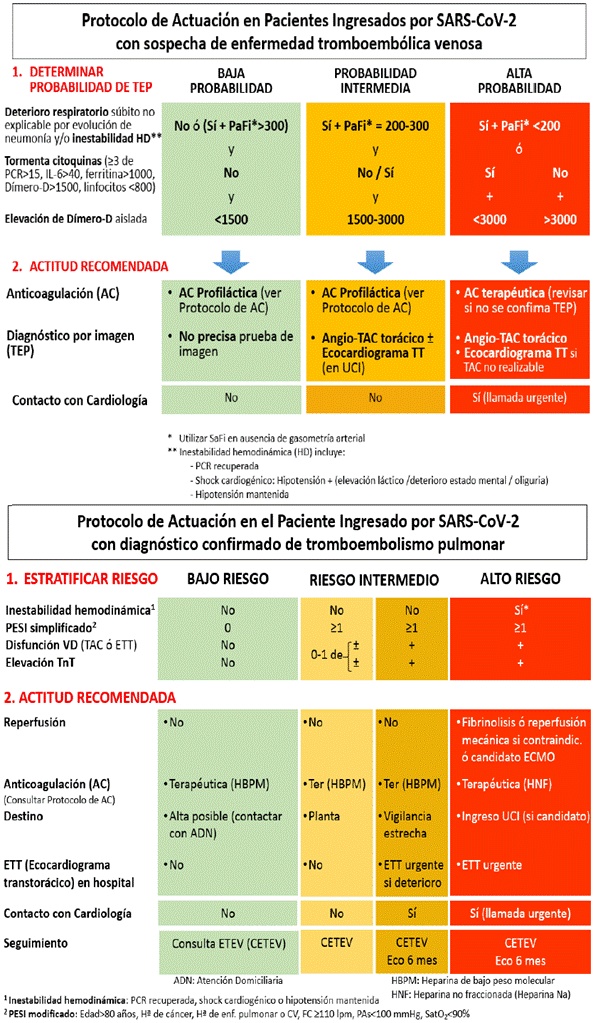
Figura 21 Protocolo de actuación en pacientes ingresados por SARS-CoV-2 sospechosos de enfermedad tromboembólica venosa o confirmados de TEP (28
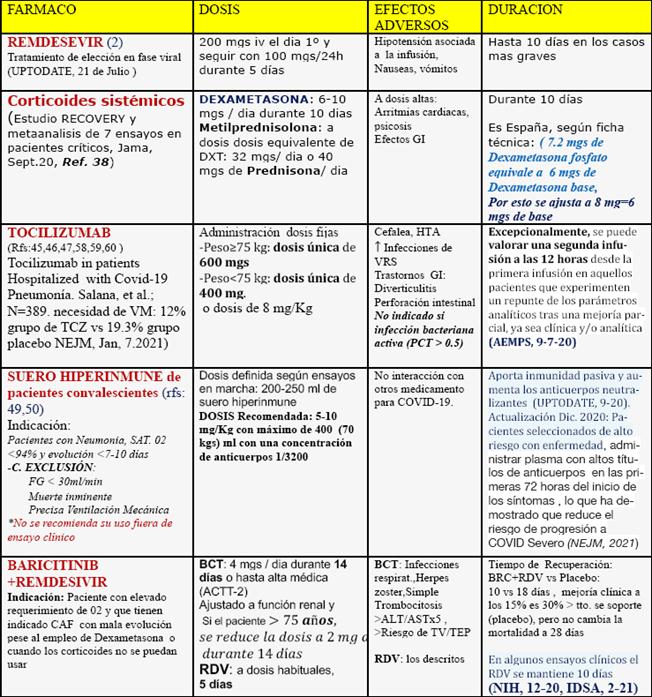
Tratamiento medicamentoso en pacientes ingresados por SARS-CoV-2 (Tabla 8)
No existen terapias antivirales específicas que tengan beneficio confirmado en pacientes con COVID-19. Los tratamientos que se han propuesto son: inhibidores de la ARN polimerasa dependiente de ARN (remdesivir, favipiramir), inhibidores de la neuraminidasa (oseltamivir), inhibidores de la proteasa (lopinavir/ritonavir, desulfura), inhibidores de la enzima convertidora de Angiotensina 2, inhibidores de quinasa (imatinib, baricitinib, ribavirin), inmunomoduladores (plasma de convalesciente, anticuerpos anti receptores de IL-6 tocilizumab y otros, interferón, glucocorticoides umifenovir, cloroquina, hidroxicloroquina, etc.), Antibióticos empíricamente, ante la sospecha de coinfección o superinfección bacteriana.
Tabla 8 Fármacos para el tratamiento específico de pacientes adultos con neumonía moderada-grave por coronavirus SARS-CoV-2 confirmada. Cuadro clínico: neumonía moderada-grave (alteración radiológica con infiltrados pulmonares y SaO2 <95%)40
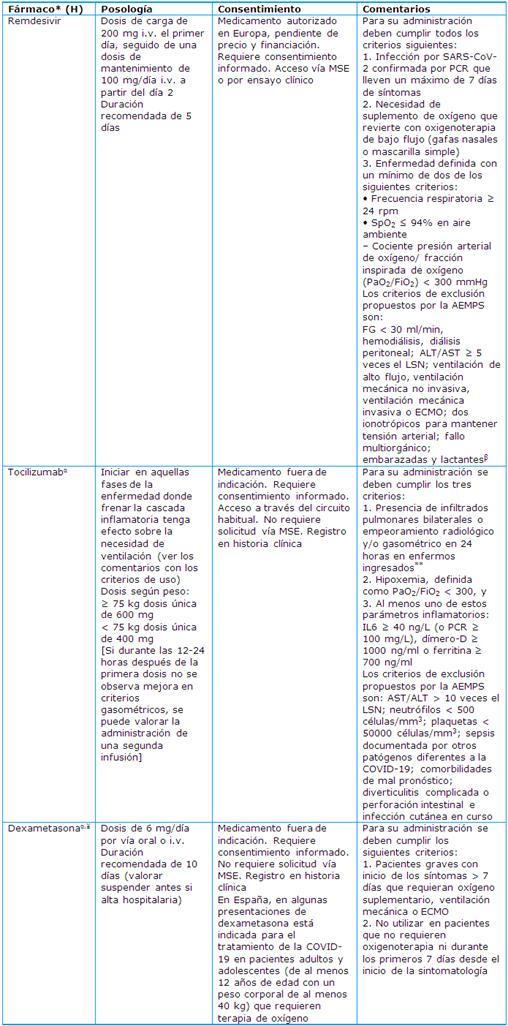
ECMO: oxigenación por membrana extracorpórea; H: dispensación ámbito hospitalario; LSN: límite superior de la normalidad; MSE: medicamentos en situaciones especiales.
*Antibioterapia solo si se sospecha sobreinfección bacteriana. Se recomienda la utilización de betalactámicos, salvo en caso de sospecha o confirmación de infección por otros gérmenes donde se pueden utilizar otros antibióticos.
**Tocilizumab: Si el enfermo viene directamente de urgencias y tiene infiltrados, PAFI < 300 y cumple los criterios del punto 3, no hace falta esperar más.
β: El acceso de remsdemivir durante el embarazo y para los menores de 12 años, que no cumplen los criterios definidos en el protocolo farmacoclínico, se realiza a través de un programa específico de uso compasivo.
α: Si no se dispone de dexametasona, considerar el uso de metilprednisolona 32 mg/día o prednisona 40 mg/día.
¥: Los datos sobre la administración conjunta de tocilizumab y dexametasona son escasos; ambos fármacos se administran con el objetivo de reducir la respuesta inflamatoria.
Tanto la sobreinfección bacteriana y por hongos, específicamente por Aspergillus, han sido informadas.49
La procalcitonina no necesita ser ordenada de rutina para todos los pacientes con COVID-19. La procalcitonina es un biomarcador que tiene cierta utilidad en ayudar a distinguir las infecciones bacterianas de las virales, particularmente del tracto respiratorio bajo. En los estudios COVID hasta la fecha la procalcitonina se mantiene baja en los primeros siete a 10 días de síntomas y luego puede elevarse, aún sin sobreinfección bacteriana. Puede ser útil en por lo menos dos situaciones: primero, si el paciente con COVID-19 se presenta con una duración corta de síntomas y hay sospecha de neumonía bacteriana, un valor bajo puede reasegurar que no se necesitan antibióticos sistémicos en ese momento. Adicionalmente, si un paciente tiene progresión clínica o empeora, un valor bajo (<0,25) en el contexto de deterioro clínico haría la sobreinfección bacteriana menos probable; sin embargo, un valor más alto tiene una especificidad menor más adelante en la enfermedad porque puede ser consistente con progresión de COVID o sobreinfección con neumonía bacteriana.50
Los antibióticos no están recomendados de inicio. La prescripción excesiva o inadecuada de antibióticos en el contexto de la COVID-19 podría facilitar el desarrollo de resistencias bacterianas y reducir la eficacia de futuros tratamientos; por eso hay que hacer un uso responsable.40
La proteína C reactiva es un biomarcador bien conocido de la inflamación, la infección y la lesión tisular, detectable seis horas después del estímulo inicial, con un pico a las 48 horas. Un nivel por encina de 100mg/l está relacionado con una infección bacteriana severa indicando la necesidad de antibióticos. Niveles entre 20 y 100mg/l indican infección viral o ligera y autolimitada; no obstante, la decisión de antibioticoterapia debe ser valorada por la clínica.51 (Tabla 9).
Las terapias de inmunomoduladores como anti-IL6 deberán administrarse en el contexto de ensayos clínicos.39
Los pacientes con indicaciones basadas en guías de práctica clínica para estatinas son los que tienen enfermedad coronaria conocida, con hiperlipidemia con un puntaje ACC/AHA de 10 años >10% y diabetes. Factores de riesgo adicionales para enfermedad cardiovascular en los que las estatinas pueden ser usadas incluyen hipertensión, tabaquismo, historia familiar de enfermedad cardíaca prematura, insuficiencia renal crónica, obesidad, VIH, u otras infecciones crónicas.50
Mientras que no hay datos clínicos sobre el rol protector de las estatinas en contra de la infección COVID-19, hay datos que sugieren que se puede asociar con neumonía viral menos severa.53 Si un paciente tiene seguimiento planeado con un médico de cabecera las estatinas pueden ser continuadas.50
Un metaanálisis coordinado por la OMS ha analizado datos del subgrupo de pacientes con ventilación mecánica del ensayo RECOVERY junto con los datos de otros seis ensayos clínicos que han incluido pacientes críticos de COVID-19. Ha concluido que la administración de corticoides sistémicos, en comparación con la atención habitual o el placebo, se asocia a una mortalidad menor a los 28 días.40
En otra revisión sistemática y metaanálisis de ensayos aleatorizados que evaluaron intervenciones para COVID-19, los glucocorticoides fueron la única intervención para la que hubo, al menos, una certeza moderada en una reducción de la mortalidad o riesgo de ventilación mecánica en comparación con la atención estándar.40
La mayoría de los datos de eficacia de la dexametasona en estos metaanálisis proceden del ensayo RECOVERY. Los científicos que diseñaron el ensayo eligieron la dexametasona porque conlleva un riesgo menor de retención de sodio y agua que otros corticoides. Los datos sobre la eficacia de otros corticoides se limitan a ensayos más pequeños, varios de los que se interrumpieron antes de tiempo debido a los resultados del ensayo anterior. Aunque los datos que respaldan el uso de estas son más limitados, se han propuesto como alternativa a dosis equivalentes en caso de que la dexametasona no esté disponible (p. ej., hidrocortisona 150mg, metilprednisolona 32mg o prednisona 40mg).40
En cuanto a la seguridad es importante tener en cuenta diferentes aspectos que limitan su utilización solo a partir de la semana del inicio de los síntomas para pacientes graves o en progresión de requerimientos de oxígeno, a dosis reducidas y durante un tiempo limitado. Fuera de este contexto, el uso de corticoides podría conllevar riesgos de seguridad.40
Indicación terapéutica de tocilizumab, sobre todo en pacientes que progresen a pesar del tratamiento con dexametasona:28
a) Neumonía grave con sat.02 <92% con PCR >7,5mg/dl
b) Mala evolución clínica en los primeros días de ingreso con deterioro oximétrico progresivo con PaO2/FiO2: 200-300 o sat.02 <92% pese a dexametasona y/o remdesivir
Indicación autorizada por parámetros de laboratorio, deterioro clínico y/o oximétrico (PaO2/FiO2 entre 200-300), al ingreso del paciente:
Tocilizumab contraindicado si se inició previamente baricitinib
Dosis recomendada de tocilizumab: 8mgs/kg y repetir a las 12 a 48h después, a criterio del clínico tratante (en función de las nuevas evidencias publicadas). Contraindicado cuando los valores de AST/ALT sean superiores a 10 veces el límite superior de la normalidad, neutropenia y/o coinfecciones. Se recomienda despistaje de VHB.
El tratamiento con plasma convaleciente (PC) se ha utilizado clásicamente para la prevención y el tratamiento de enfermedades infecciosas. Fue utilizado con éxito en el tratamiento de SARS, MERS y la pandemia de H1N1 de 2009. En un metaanálisis de 32 estudios de infección por SARS coronavirus y virus influenza, se demostró una reducción estadísticamente significativa de la mortalidad de pacientes con tratamiento con PC al compararlo con placebo y sin tratamiento (OR: 0,25; IC 95%: 0,14-0,45).23
Duan y colaboradores midieron la efectividad del tratamiento con PC en 10 pacientes con COVID-19 grave. Utilizaron una transfusión de 200ml de plasma de pacientes recuperados con títulos de anticuerpos altos (1:640). Los efectos que observaron con la transfusión de PC fueron: 1) mejoría de los síntomas clínicos y en los parámetros de oxigenación, permitiendo desescalar de VM a OAF y de OAF a oxigenoterapia convencional, 2) reducción de las lesiones pulmonares, 3) mejoría de los parámetros de laboratorio (linfopenia, PCR, transaminasas), 4) incremento del título de anticuerpos y desaparición del ARN del SARS-CoV-2 y 5) mejor pronóstico (tres altas hospitalarias y siete pacientes con mejoría clínica) al compararlo con el grupo control (tres muertes, seis casos de estabilización y uno de mejoría clínica) (p <0,001). No hubo reacciones adversas graves en ningún paciente. Concluyen que el tratamiento con PC podría ser una opción de tratamiento de rescate seguro y fácilmente accesible para pacientes con COVID grave. La dosis óptima y el momento de transfusión quedan por definir en estudios aleatorizados más potentes. Shen y colaboradores obtuvieron resultados similares en la recogida de cinco casos de pacientes graves con COVID-19 en VM. En global, las dos series presentan un 0% de mortalidad en el grupo de transfusión por un 30% en el grupo control y sin efectos adversos.23
Basados en las series de Duan y colaboradores y Shen y colaboradores la Infectious Diseases Society of America (IDSA) recomienda la transfusión de PC en el contexto de un ensayo clínico.23
Según las Guías de la IDSA en este momento se desconoce la posible utilidad de la IgIV para el tratamiento del SARS-CoV-2. La SSC avisa contra el uso rutinario de las IgIV. No existe suficiente evidencia para indicar o recomendar el uso indiscriminado de inmunoglobulinas.23
Los protocolos de tratamiento farmacológico para el SARS-CoV-2 incluyen una combinación de drogas que buscan un efecto sinérgico. A pesar de existir evidencia limitada sobre la eficacia de muchas de ellas.45
Las terapias basadas en virus incluyen anticuerpos monoclonales y péptidos antivirales que se dirigen a la glicoproteína de la punta viral, inhibidores de enzimas virales, inhibidores de la síntesis viral de ácido nucléico e inhibidores de otras proteínas virales estructurales y accesorias. Las terapias basadas en el huésped incluyen agentes que potencian la respuesta al interferón o afectan las vías de señalización del huésped involucradas en la replicación viral.54
La vitamina C puede ser una terapia efectiva en el tratamiento del SARS-CoV-2 debido a su capacidad antioxidante, sus propiedades antivirales, la mejora del sistema inmunológico y sus propiedades antiinflamatorias. Además, la vitamina C también puede ayudar a eliminar el líquido alveolar acumulado en el distress al prevenir la activación y la acumulación de neutrófilos al reducir el daño causado a nivel del epitelio alveolar. Su administración es segura por infusión i.v. a dosis máximas de 100g, siempre que se tomen las precauciones descritas.55 En la Tabla 10 se recoge el protocolo de administración diseñado.
Tabla 10 Protocolo para la administración de vitamina C iv en la infección por COVID-1955

Proteger de la luz el sistema de administración ya que es fotosensible y se oxida con facilidad.
a: Precaución con dosis y duración de la infusión si Creatinina > 175 μmol/L (1,98 mg/dL).
b: Una tendencia de ferritina decreciente que se torna ascendente debería obligarnos a reducir las dosis de vitamina C.
c: Si paciente en estado muy crítico doblar dosis diaria (0,4-1 g/kg).
d: El efecto quelante de la vitamina C puede causar hipocalcemia e hipomagnesemia.
e: 220 mg de sulfato de zinc contiene 50 mg de zinc elemental.
f: Objetivo nivel plasmático de 25-OH 80-90 nmol/L.
Escenarios terapéuticos45
El protocolo cubano ha definido seis escenarios terapéuticos. Los tres primeros: población de la comunidad, centros de vigilancia de viajeros y centros de aislamiento de contactos; aplican medidas profilácticas con la administración de prevengo vir y biomodulina T a los pacientes vulnerables de mayor riesgo. En los centros de atención a los sospechosos se les trata con oseltamivir, azitromicina e interferón alfa 2b. A los pacientes hospitalizados en sala abierta se les administra kaletra (lopinavir-ritonavir), cloroquina e interferón alfa 2b. En unidades de atención a pacientes graves y críticos se les trata con kaletra, cloroquina, tocilizumab, eritropoyetina, surfacén y plasma. Estos tratamientos forman parte se ensayos clínicos pues, hasta el momento, no existe un tratamiento específico para la COVID-19. Su aplicación se realiza sobre la base de la individualización en cada caso.
A continuación se ofrece un resumen de terapias y fármacos para el tratamiento de la COVID-19 según la severidad de la enfermedad (Figura 22, Figura 23 y Figura 24).
Rehabilitación para pacientes con COVID-1912
Tanto en los entornos hospitalarios como en los extrahospitalarios en los que se preste asistencia a pacientes con COVID-19, a las personas se les debe proporcionar formación y apoyo para que gestionen por sí mismos la disnea y retomen sus actividades:
1. La formación centrada en el control de la respiración puede resultar útil tanto para los pacientes de COVID-19 como para quienes se restablezcan de enfermedades respiratorias, especialmente las personas que cursan con disnea. Con el fin de controlar la disnea puede recomendarse a los pacientes que se coloquen en determinadas posiciones, por ejemplo, en decúbito lateral con elevación del torso o en sedestación con inclinación anterior, o que utilicen técnicas de respiración tales como la respiración con los labios fruncidos y la técnica del cuadrado (Figura 25). Se recomienda que el ritmo de la marcha se regule de manera adecuada con el fin de reducir la disnea y evitar la desaturación en esfuerzo. Es necesario que un médico valore a los pacientes que cursan con disnea intensa que no cede a los cambios de posición y la realización de técnicas de respiración.
2. Debe capacitarse a todos los pacientes en rehabilitación con el fin de que reanuden sus actividades cotidianas con cautela y a un ritmo apropiado que sea seguro y que puedan gestionar con los niveles de energía de los que disponen dentro del límite de los síntomas con los que cursan en ese momento y no deben forzarse hasta cursar con agotamiento posterior a un esfuerzo. La intensidad del ejercicio debe aumentarse sobre la base de los síntomas.
3. En el caso de los pacientes con COVID-19 que también presenten enfermedades cardiovasculares o pulmonares previas el ejercicio debe reanudarse previa consulta con los profesionales sanitarios adecuados. A los pacientes con COVID-19 en los que se haya confirmado que presentan afectación cardíaca se les debe realizar una valoración cardiológica antes de que reanuden el ejercicio.
4. Además, los profesionales sanitarios adecuados deben orientar la reanudación paulatina de los deportes; como ejemplo puede consultar las orientaciones para volver a practicar deporte tras presentar miocarditis.
En el caso de los pacientes que han sido dados de alta hospitalaria o los que han recibido atención en su domicilio que cursen con síntomas crónicos o limitaciones funcionales deben hacerse pruebas con el fin de detectar alteraciones físicas, cognitivas y psiquiátricas y proporcionar la atención correspondiente.12
1. Es posible que los pacientes con COVID-19, independientemente de la gravedad de la enfermedad, cursen con síntomas crónicos y deterioro funcional que podría no ser evidente (por ejemplo, deterioro cognitivo). Debe consultarse a los miembros de la familia o a los cuidadores sobre las alteraciones funcionales relacionadas con la salud con las que el paciente cursaba antes de la COVID-19 y compararlas con el padecimiento actual.
2. En la valoración puede incluirse una anamnesis completa, la evaluación de las enfermedades preexistentes, una observación de cómo el paciente realiza tareas funcionales y un cuestionario basado en síntomas o un instrumento de detección que pueda aplicarse fácilmente (por ejemplo, la prueba Timed up and go para valorar la capacidad física, las preguntas de Whooley para evaluar la depresión, el Generalized Anxiety Disorder 2-item para valorar la ansiedad y el Mini-Cog para evaluar las funciones intelectuales). En el caso de que el valor de la pulsioximetría en reposo sea <96% no deben llevarse a cabo pruebas rápidas de esfuerzo para cuantificar la desaturación en esfuerzo en entornos en los que no se disponga de asistencia y supervisión.
3. Siempre que los recursos lo permitan deben definirse y valorarse clínicamente los tipos de deterioro por dominios funcionales, incluida la función respiratoria (por ejemplo, mediante espirometría, la capacidad de los pulmones para difundir el monóxido de carbono o la escala de disnea del Medical Research Council), la función cardiovascular (por ejemplo, al caminar durante seis minutos), la función de la deglución (por ejemplo, mediante la escala de intensidad de la disfagia), la función osteomuscular (por ejemplo, mediante la fuerza de prensión de la mano o la escala del Medical Research Council) y la función cognitiva (por ejemplo, mediante la evaluación cognitiva de Montreal o el Miniexamen Cognoscitivo), y la función psiquiátrica (por ejemplo, mediante la escala hospitalaria de ansiedad y depresión, la lista de verificación 5 para el trastorno por estrés postraumático o la escala de impacto de eventos revisada). Pueden solicitarse pruebas complementarias para valorar el dolor, la astenia y la dificultad para llevar a cabo las actividades de la vida cotidiana.
4. Es posible que el estado clínico de los pacientes de COVID-19 empeore tardíamente y se ha notificado la aparición de complicaciones inflamatorias, tromboembólicas y neurovegetativas de inicio tardío, incluida la tromboembolia pulmonar, los infartos de miocardio, la insuficiencia cardíaca y los accidentes cerebrovasculares. De ser el caso, debe alertarse a los fisioterapeutas o al personal sanitario y debe derivarse al paciente con un especialista en el marco de una ruta asistencial multidisciplinaria y coordinada.
Escalas de fragilidad del paciente (Tabla 11, Tabla 12 y Tabla 13):
Tabla 13 Índice PROFUND. Estratificación del riesgo de muerte de pacientes pluripatológicos a 12 meses28
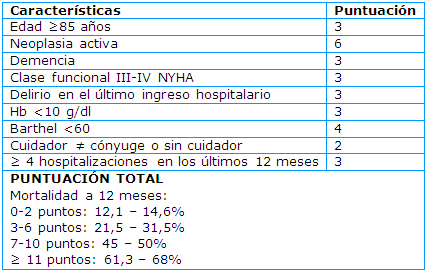
Codificación en la CIE-11 para los trastornos que se produzcan en el marco de la COVID-1912
RA02 Enfermedad posterior a la COVID-19
RA03 Síndrome inflamatorio multisistémico asociado a la COVID-19
QC42/RA01 Antecedentes personales de COVID-19
Al consignar una defunción se recomienda que los códigos de emergencia de la Clasificación Internacional de Enfermedades (CIE) se utilicen tal como se indica en el documento titulado International guidance for certification and coding of COVID-19 as cause of death:57
1. El objetivo principal es reconocer todas las defunciones secundarias a la COVID-19. A efectos de vigilancia las defunciones secundarias a la COVID-19 se definen como las resultantes de una enfermedad clínicamente compatible con un caso de COVID-19, presunto o confirmado, a menos que haya otra causa de muerte que sea clara y que no pueda relacionarse con la COVID-19 (por ejemplo, un traumatismo). No debe haberse presentado un período de restablecimiento total de la COVID-19 entre la enfermedad y la muerte. Las defunciones secundarias a la COVID-19 no pueden atribuirse a otras enfermedades (por ejemplo, el cáncer) y deben computarse independientemente de las enfermedades preexistentes que se sospeche que puedan desencadenar un agravamiento de la COVID-19.
2. Es importante que en la parte 1 del certificado de defunción se especifique la secuencia causal que condujo a la muerte. Por ejemplo, en los casos en los que la COVID-19 provoca neumonía, síndrome séptico y síndrome de dificultad respiratoria aguda esas complicaciones deben registrarse en la parte 1 junto con la COVID-19. Los encargados de llenar el certificado deben consignar la información con el mayor detalle posible sobre la base del conocimiento que tengan del caso, el historial clínico o las pruebas analíticas.
3. La terminología oficial, es decir, COVID-19, debe utilizarse para llenar todos los certificados relacionados con esa causa de defunción. En el certificado médico debe registrarse “COVID-19” como la causa de defunción de todos los casos en los que la enfermedad haya causado la muerte o se suponga que la haya causado o contribuido a ella. Esto contribuirá a reducir la incertidumbre relativa a la clasificación o la codificación y a vigilar adecuadamente esa causa de defunción.12
Mecanismos de inmunización frente al COVID-19 (Figura 26):
Resumen de los aspectos más importantes
Al momento no existe ningún medicamento específico, efectivo y probado para el tratamiento de la COVID-19.
Debe tenerse cuidado al interpretar el resultado de la RT-PCR para la infección de SARS-CoV-2. Particularmente si la sospecha clínica es alta, la infección debe ser considerada cuidadosamente. La reacción en cadena de la polimerasa con transcriptasa inversa (RT-qPCR) se lleva a cabo en laboratorios nivel BSL II; asimismo, los principales blancos moleculares para la detección viral son el gen E (envoltura) y el gen RdRP (ARN polimerasa dependiente de ARN). Los falsos negativos en este diagnóstico se deben a la calidad y a la cantidad de la muestra, a las condiciones de transporte y de almacenamiento y a su manejo antes y después de la extracción (el ARN es termolábil y abundantes las RNasas), a la fase de la infección, a las mutaciones del virus y a la presencia de inhibidores de la PCR. En estos casos se recomienda una nueva toma de muestra, especialmente de vías respiratorias bajas, para aumentar la carga viral. Se debe tener en cuenta la sensibilidad analítica de la RT-qPCR (5,2 copias de ARN/reacción) y que, una vez el RNA se extrae, se va degradando progresivamente y afecta la sensibilidad diagnóstica de la prueba. Un diagnóstico oportuno permite optimizar el manejo (aislamiento y tratamiento) y la monitorización de los pacientes, así como la aplicación de medidas de prevención y control de la expansión y la vigilancia epidemiológica de la enfermedad.58
Están descritas mutaciones de los genes: ACE2, ACE1, TMPRSS2, TLR7, así como haplotipos HLA asociadas a la susceptibilidad genética a la COVID-19. Variantes de los genes: SLC6A20, LZTFL1, CCR9, FYCO1, CXCR6 y XCR1; así como de los que codifican para el receptor de la Vitamina D y las citoquinas proinflamatorias (como las IL-1, IL-6, IL-12, IFN-γ, y TNF-α), pudieran también estar relacionadas con un incremento de la susceptibilidad al SARS-CoV-2. Ante la posibilidad de transmisión vertical de la COVID-19 y su posible papel teratogénico, las embarazadas constituyen un grupo de riesgo.59
La evidencia actual es limitada para determinar el impacto del uso de los inhibidores de la enzima convertidora de angiotensina (IECA) en la predisposición al empeoramiento de la enfermedad del coronavirus 2019 (COVID-19). Inicialmente se informó que en los pacientes con progresión grave de la COVID-19 existía una mortalidad elevada, los que tenían antecedentes de hipertensión arterial, diabetes mellitus, enfermedad cardiovascular y enfermedad renal crónica. Parte de estos pacientes también tenía en común que utilizaban IECA, lo que alertó a la comunidad médica sobre su riesgo potencial en coexistencia con COVID-19. Sin embargo, estudios más recientes de casos-controles encontraron que los inhibidores del sistema renina-angiotensina, incluyendo los IECA, no incrementan el riesgo de COVID-19 o de requerir admisión hospitalaria por esta causa.60
El análisis crítico de los presentes antecedentes permite concluir que no existe evidencia clínica sólida que permita afirmar que el uso de medicamentos antihipertensivos genere una mayor vulnerabilidad a la infección con SARS-CoV-2. Por lo tanto no se debe descontinuar su uso en pacientes hipertensos en riesgo de infección a SARS-CoV-2 o que padezcan COVID-19.
Los cuadros severos de la enfermedad se asocian con arritmias cardíacas, en especial, los pacientes que desarrollan miocarditis, insuficiencia cardíaca o síndrome coronario agudo.
La hidroxicloroquina o la cloroquina no son medicamentos eficaces para reducir la mortalidad en pacientes con COVID-19.61
El tratamiento con remdesivir dentro de los primeros 10 días de iniciados los síntomas se asoció con una reducción de cinco días en la mediana del tiempo hasta la mejoría clínica. El remdesivir es un fármaco que no ayuda al tiempo de eliminación del virus en pacientes con COVID-19; sin embargo, es el único medicamento aprobado por la FDA. Las recomendaciones sobre su uso varían de una organización profesional a otra.62
La eficacia del medicamento lopinavir/ritonavir para tratamiento de COVID-19 no está comprobada; sin embargo, las Guías de Práctica Clínica de España lo incluyen.
Entre las terapias que han recibido la autorización de uso de emergencia de la Administración Federal de Medicamentos (FDA) se puede encontrar:
Plasma de convaleciente
Sistema de purificación sanguínea para el tratamiento de adultos ingresados en la UCI con insuficiencia respiratoria confirmada o inminente.
De acuerdo con el estudio RECOVERY de Reino Unido las dosis bajas de dexametasona desempeñan un papel importante en el manejo de COVID-19 grave. En este estudio abierto aleatorizado la dexametasona oral o intravenosa redujo la mortalidad a 28 días, beneficio que no se observó en pacientes que no requerían oxígeno o apoyo ventilatorio y fue mayor el beneficio en los pacientes con ventilación mecánica invasiva u oxigenación por membrana extracorpórea. Es importante recalcar que no se deben administrar esteroides a pacientes con COVID-19 con presentaciones clínicas leves sin requerimiento de oxígeno.63
La atención médica de apoyo puede ayudar a aliviar los síntomas y debe incluir apoyo al funcionamiento de los órganos vitales en casos graves.
Se necesita un mejor conocimiento de las implicaciones de la Covid-19 en pacientes con enfermedades inmunomediadas y los efectos de las terapias inmunosupresoras y anticitokinas.64
El mundo científico, el mediático y el político se encuentran inmersos en una sobreproducción de información, que en muchos casos es incierta, interesada o en el mejor de los casos, de relevancia científica escasa.
El objetivo es:
1) Enlentecer y detener la transmisión;
2) Proporcionar cuidado optimizado para todos los pacientes y
3) Minimizar el impacto de la epidemia en los servicios de salud, los servicios sociales y la actividad económica.
La respuesta inmune a SARS-CoV-2 aún está en estudio. No se conoce la respuesta inmune a largo plazo, pero en base a información de inmunidad a corto plazo de otros coronavirus, la reinfección precoz parece poco probable. Existen informes aislados en China y Japón de pacientes que, tras recuperarse, volvieron a tener PCR de SARS-CoV-2 positiva, lo que fue interpretado como posibles casos de recontagio (personas que adquieren nuevamente el SARS-CoV-2); sin embargo, esto no está confirmado. Una posible explicación que se ha planteado es que exista un grupo de pacientes que mantenga excreción viral prolongada a pesar de cumplir criterios de resolución. Se requiere mayor investigación para caracterizar a estos pacientes, para definir si existe posibilidad de reinfección y para conocer el rol que podrían tener en la transmisión.
CONCLUSIONES
No hay ningún beneficio garantizado en prescribir fármacos de forma compasiva y los riesgos de su utilización pueden ser desconocidos.
Se deben adaptar las medidas que sabemos que sí funcionan para evitar la propagación de la enfermedad.
La evidencia científica más valiosa que tenemos en este momento y sabemos que funciona, consiste en las medidas para prevenir la dispersión de esta infección.
Las orientaciones para la comunidad en general incluyen el lavado frecuente de las manos con jabón o gel desinfectante, el cual debe contener al menos 60% de alcohol, abstenerse de tocarse los ojos, la nariz, la boca con las manos sin lavar, evitar el contacto estrecho (mantener una distancia mayor a 6 pies entre las personas que no son del mismo núcleo familiar), cubrirse la boca y la nariz con una mascarilla de tela cuando se encuentren rodeados de otras personas, cubrirse en el momento de toser y estornudar; limpiar y desinfectar las superficies que tocamos frecuentemente a diario y observar el estado de salud y seguir los consejos de los proveedores de salud.
Para uso comunitario se pueden utilizar mascarillas de tela, de ser posible con 2 capas, que al menos una incluya fibras de algodón en áreas donde no se puede mantener una sana distancia.
Es aconsejable reducir la densidad de trabajadores en los centros de trabajo cronometrando la presencia de estos y animando los programas de trabajo remotos y trabajo-de-casa con diferentes días para cada equipo.
Los médicos debemos enfatizar en la importancia de estas medidas preventivas que pueden salvar vidas.
Temas específicos sobre la COVID-19 disponibles gratuitamente:
COVID-19 y pacientes pediátricos (COVID-19 and Pediatric Patients)
COVID-19 y poblaciones especiales (COVID-19 and Special Populations)
COVID-19 y pacientes con cáncer (COVID-19 and Patients With Cancer)
COVID-19 y pacientes con enfermedades cardiovasculares (COVID-19 and Cardiovascular Disease Patients)
COVID-19 y pacientes con enfermedad renal crónica (ERC) y enfermedad renal terminal (ERT) (COVID-19 and Patients with Chronic Kidney Disease (CKD) and End-stage Renal Disease (ESRD))
COVID-19 y pacientes embarazadas (COVID-19 and Pregnant Patients)
Coagulopatía asociada a la COVID-19 (COVID-19-associated Coagulopathy)
Otros resúmenes relacionados con el tema:
Síndrome respiratorio agudo severo (SRAS) (Severe Acute Respiratory Syndrome (SARS))
Síndrome respiratorio por coronavirus de Oriente Medio (MERS-CoV) (Middle East Respiratory Syndrome Coronavirus (MERS-CoV))
Síndrome de dificultad respiratoria aguda (SDRA) (Acute Respiratory Distress Syndrome (ARDS))
Sepsis en los adultos (Sepsis in Adults)
Sepsis en los niños (Sepsis in Children)
Infección respiratoria alta en adultos y adolescentes (Upper Respiratory Infection (URI) in Adults and Adolescents)
Neumonía adquirida en la comunidad en adultos (Community-acquired Pneumonia in Adults).