INTRODUCCIÓN
La Pseudomonas aeruginosa (P. aeruginosa) es, en la sepsis, uno de los agentes etiológicos de mayor importancia en el medio hospitalario tanto en los servicios clínicos como en los quirúrgicos, es responsable de las infecciones asociadas a la asistencia sanitaria (IAAS) en los Estados Unidos (7,1%), en Europa (8,9%) y en México (19,9%), es una de las principales bacterias gram negativas causante de bacteriemias y puede producir infecciones difíciles de controlar, e incluso, mortales para el enfermo.1
Es un patógeno oportunista que afecta, sobre todo, al huésped con defensas comprometidas. Para que ocurra la infección es necesaria la presencia de factores predisponentes como las enfermedades malignas, las quemaduras y las instrumentaciones; también infecta a pacientes con procesos crónicos, como los que padecen fibrosis quística (FQ).2
En los últimos años se ha añadido otro problema, el aumento de la resistencia bacteriana frente a todos los antibióticos antipseudomónicos conocidos, incluidos los carbapenémicos con actividad frente a diferentes especies de Pseudomonas (imipenem, meropenem y doripenem); por lo que la búsqueda de nuevas drogas químicamente más específicas y que burlen los mecanismos de resistencia bacterianos no constituye una excepción en este caso. Esta bacteria se caracteriza por su baja susceptibilidad intrínseca a muchos antibióticos y su capacidad para adquirir mecanismos adicionales de resistencia frente a drogas usualmente activas debido a la baja permeabilidad de la membrana externa y a la presencia de numerosas bombas de expulsión de drogas; ha adquirido resistencia cromosómica y mediada por plásmidos que son las responsables de esta alarmante situación.3
Las infecciones que produce prolongan el período de hospitalización e incrementan los costos médicos, particularmente en pacientes inmunocomprometidos o críticamente enfermos, y son difíciles de tratar debido a que las cepas responsables pueden ser resistentes a múltiples antibióticos (resistencia intrínseca), incluidas las cefalosporinas de primera, segunda y tercera generación (excepto la ceftazidima), las tetraciclinas, el cotrimoxazol y la rifampicina; puede ocurrir resistencia antibiótica durante o después del tratamiento.4
En países europeos,5,6 si bien la resistencia global de P. aeruginosa suele superar el 10%, la resistencia a la piperacilina-tazobactam ha sido mayor al 20%, superior al 26% para la ceftazidima y por encima del 30% para ciprofloxacino e imipenem; sin embargo, baja para la amikacina (8%), mientras que supera el 17% para la gentamicina y la tobramicina.
En el Hospital Provincial General “Camilo Cienfuegos” de Sancti Spíritus se ha observado un incremento en la incidencia y la resistencia de este patógeno, que ocupa el primer lugar en los aislamientos en muestras clínicas de pacientes con IAAS ingresados en la Sala de Angiología en el año 2016.7
La realización de este estudio estuvo motivada por el incremento de la resistencia microbiana a nivel mundial, el no disponer de una actualización sobre infección por P. aeruginosa en este hospital y la creciente necesidad de un informe microbiológico rápido, de elevada sensibilidad y que ofrezca al médico de asistencia herramientas tales como la respuesta al antibiograma, que incluya la concentración mínima inhibitoria (CMI) y los mecanismos de resistencia microbiana. Este trabajo tiene los objetivos de enumerar los factores de riesgo conocidos de los pacientes y describir la resistencia de Pseudomonas aeruginosa frente a los antimicrobianos testados.
MÉTODOS
Se realizó un estudio descriptivo, de corte transversal, en la Sala de Angiología del Hospital Provincial General “Camilo Cienfuegos” de la Ciudad de Sancti Spíritus, de la provincia del mismo nombre, desde el primero de julio hasta el 31 de diciembre de 2017 de aislamientos de Pseudomonas aeruginosa en muestras purulentas como herida quirúrgica, punción de absceso, úlcera cutánea y secreciones que drenan a piel de pacientes con las IAAS. La población quedó formada por 47 muestras.
Como principales variables se analizaron los factores de riesgos conocidos en los pacientes y la susceptibilidad antimicrobiana.
Al total de muestras se le realizó el cultivo en medios convencionales como Agar sangre y Agar MacConkey, incubación a 37ºC por 18 a 24 y 48 horas y lectura de colonias redondas, lisas, alargadas, de bordes regulares de color verdoso, con un brillo metálico y olor dulzón, algunas cepas presentaron actividad hemolítica en Agar sangre, con diámetros de dos milímetros. A las colonias se les realizó la prueba de oxidasa (se utilizaron las tirillas comerciales oxidase test Stick de la comercializadora Liofilchem, Italy) y catalasa con peróxido de hidrógeno 3%; ambos resultados fueron positivos.
La confirmación de la identificación de P. aeruginosa se realizó empleando el sistema automatizado Vitek® 2 Compact, mediante tarjetas de identificación de gram negativa (GNI), que se basó en la inoculación de una suspensión de los microorganismos en paneles de reacciones bioquímicas. La susceptibilidad antimicrobiana se llevó a cabo en forma similar a través de tarjetas AST GN272 que contienen diluciones estandarizadas en 64 pocillos de distintos antibióticos correspondientes a los puntos de corte de susceptibilidad establecidos por el Clinical and Laboratory Standards Institute (CLSI)8 y basado en la técnica de CMI. Según los resultados de la concentración se le asignaron criterios de interpretación como: sensible, sensibilidad intermedia y resistente. En todo el proceso se llevó a cabo control de la calidad.
Los datos necesarios para la caracterización según los factores de riesgo conocidos de los pacientes se obtuvieron de la planilla recolectora de datos recibida junto a la muestra.
Todos los resultados obtenidos se incorporaron a un sistema de recogida de datos del programa Microsoft Excel 2013 para procesamiento posterior a través del programa EPINFO 6.0.
Para el análisis estadístico se utilizaron distribuciones de frecuencia con valores absolutos (número de casos) y relativos (por cientos).
Este estudio no requirió del consentimiento informado de los pacientes porque no procede. Se mantuvo la confidencialidad de las cepas y su procedencia y se garantizó su uso únicamente con fines científicos y previo consentimiento informado del Jefe de Servicio de Angiología y la aprobación por el Comité de ética de la Institución.
RESULTADOS
La Tabla 1 muestra los factores de riesgo presentes en los pacientes con aislamientos de P. aeruginosa en la Sala de Angiología. Del total de pacientes estudiados el 87,2% presentó como factor de riesgo la diabetes mellitus tipo 2, el 63,8% la insuficiencia arterial crónica y el 23,4% los traumas que llevaron a lesiones en miembros inferiores.
Tabla 1 Factores de riesgo presentes en los pacientes con aislamientos de P. aeruginosa en muestras purulentas

FA: Frecuencia absoluta; FR: Frecuencia relativa
La resistencia antimicrobiana a cefalosporinas en aislamientos de P. aeruginosa se aprecia en la Tabla 2. El por ciento de resistencia más elevado fue frente a cefotaxima/ceftriaxona -47 cepas aisladas y estudiada la resistencia a estas cefalosporinas de tercera generación (100%)-, seguido de cefoxitín (74,4%) y ceftazidima (48,9%).
Tabla 2 Resistencia antimicrobiana a cefalosporinas en aislamientos de P. aeruginosa

FA: Frecuencia absoluta; FR: Frecuencia relativa
Fuente: Registro de Microbiología
En la Tabla 3, al analizar la resistencia antimicrobiana de P. aeruginosa a los aminoglucósidos y carbapenémicos, se puede observar que la mayor resistencia mostrada en el caso de los aminoglucósidos estuvo representada por la gentamicina (38,2%). Al analizar los carbapenémicos se puede observar que el mayor por ciento de resistencia correspondió a meropenem (55,3%), mientras que el imipenem mostró una resistencia de un 46,8%.
Tabla 3 Resistencia antimicrobiana a aminoglucósidos y carbapenémicos en aislamientos de P. aeruginosa
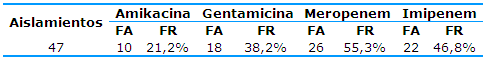
FA: Frecuencia absoluta; FR: Frecuencia relativa
Fuente: Registro de Microbiología
En cuanto a la resistencia antimicrobiana de las cepas en estudio a otros antimicrobianos la resistencia a ampicilina/sulbactam estuvo presente en el 100% de P. aeruginosa aisladas, seguida por piperazilina/tazobactam (57,4%) y ciprofloxacino (31,9%) -Tabla 4-.
DISCUSIÓN
Múltiples son los factores predisponentes para que ocurra la infección por P. aeruginosa: enfermedades malignas, quemaduras, diabetes mellitus, procesos crónicos, pacientes con defensas comprometidas, pacientes sometidos a instrumentación o manipulación (cateterizaciones uretrales, traqueostomía, punciones lumbares, infusiones intravenosas de medicamentos y líquidas), pacientes con FQ y otros.9
Los datos de la Tabla 1 se correspondieron con la bibliografía revisada, que muestra diversos factores de riesgo presentes en los pacientes atendidos en Servicios de Angiología. Los factores de riesgo asociados a los pacientes ingresados en el Servicio de Angiología en los que se aisló P. aeruginosa son: neuropatías, isquemias, antecedentes de diabetes mellitus, edad avanzada y lesiones crónicas que reciben tratamientos con antibióticos frecuentes, todo lo que crea un escenario propicio para la sepsis.10
Una de las misiones fundamentales del sistema inmunitario es la defensa contra las infecciones. Las inmunodeficiencias primarias o secundarias, así como el uso de inmunosupresores, alteran la normal producción de anticuerpos y su funcionamiento adecuado y aumentan la sensibilidad a las sepsis. P. aeruginosa se destaca por su elevada frecuencia de aislamiento y severidad en cuadros clínicos producidos a pacientes inmunocomprometidos porque la mayoría de las infecciones causadas por esta bacteria ocurren en pacientes hospitalizados con debilidad general o depresión de la inmunidad.11
En España, en un hospital de tercer nivel, se evalúan aislamientos procedentes de muestras clínicas y se indica que el 43,4% de los aislados proceden de pacientes con antecedentes de diabetes mellitus.12 Resultados similares son encontrados en Brasil, en un estudio que se realizó en un hospital privado de pacientes con pie diabético, en los que el germen más aislado es la P. aeruginosa (42,7%).13
P. aeruginosa tiene como característica especial su capacidad de desplegar resistencia a toda clase de antibióticos, expresada por una resistencia natural (intrínseca) a diversos antibióticos y por su capacidad para desarrollar resistencia a los agentes antimicrobianos durante el tratamiento mediante la adquisición de genes de resistencia situados en elementos genéticos móviles (plásmidos, integrones) o a través de mutaciones que alteran la expresión o la función de mecanismos de codificación cromosómica.9
Las mutaciones que determinan la desrrepresión de la B-lactamasa cromosómica AmpC determina resistencia a las cefalosporinas (Tabla 2), así como otras familias de antibióticos en este microorganismo. En P. aeruginosa el mecanismo más importante de resistencia adquirida a los antibióticos betalactámicos se debe a la producción de B-lactamasas (OXA 1 y 2). En este microorganismo se pueden encontrar los cuatro tipos de enzimas descritos según la clasificación molecular de Ambler: A, C, D (serina-b-lactamasas) y B (metalo-b-lactamasas). Las B-lactamasas de espectro extendido (BLEE) de clase A pertenecen al grupo funcional 2b’. Su presencia es responsable de la resistencia a carboxipenicilinas, ureidopenicilinas, ceftazidima, cefepima, cefpiroma y aztreonam.14
Otro mecanismo de resistencia tipo cromosómico que puede desarrollar este microorganismo que le confiere resistencia a B-lactámicos es la hiperexpresión de las bombas de expusión Mex AB OprM.15
En países europeos, si bien la resistencia global de P. aeruginosa suele superar el 10%, la resistencia a la ceftazidima ha sido mayor al 26%, superior al 30% para la ceftriaxona y por encima del 33% para el cefoxitín.5
En estudio de Zambrano y colaboradores,16 en Chile, la mayoría de los pacientes tienen alguna condición predisponente a la infección y el 48% una infección grave, las cepas muestran mayor resistencia a los antimicrobianos que lo informado en trabajos nacionales previos y son altamente resistentes a ceftriaxona y cefotaxima (36,8%), ceftazidima (36,8%), mientras que eran escasamente resistentes a cefepime (15,8%).
Un estudio descriptivo de corte transversal realizado a pacientes ventilados en las Unidades de Cuidados Intensivos (UCI) del Hospital Clínico Quirúrgico “Hermanos Ameijeiras”, de la Ciudad de La Habana,17 durante el período de junio a diciembre del año 2011, mostró que en P. aeruginosa las 23 (100%) cepas fueron resistentes a cefoxitín, ceftriaxona y cefotaxima y 11 aislamientos a ceftazidima y cefepime (47,82%).
Los datos expresados en la Tabla 3 se corresponden con estudios realizados a nivel mundial en los que se han informado elevadas tasas de resistencia a los aminoglucósidos en P. aeruginosa. En Nigeria18 aislamientos de la bacteria en heridas quirúrgicas muestran una elevada resistencia a gentamicina (80%), amikacina (72%) e imipenem (60%) y se detectaron plásmidos en el 80% de las cepas evaluadas.
En el estudio realizado por Medell y colaboradores17 son aisladas 23 cepas de P. aeruginosa, 12 (52,17%) fueron resistentes a la gentamicina y 11 (47,82%) a la amikacina; no se encontró resistencia a la tobramicina.
El mayor por ciento de resistencia frente a la gentamicina mostrado en este estudio y en los referidos a otros países está relacionado con el mayor uso de la gentamicina en IAAS por cepas de P. aeruginosa con respecto a la amikacina.
El mecanismo más importante de resistencia a los aminoglucósidos en P. aeruginosa es la modificación enzimática del antibiótico, con la consiguiente disminución de la afinidad del antibiótico por la subunidad ribosómica 30S. Las enzimas responsables están codificados por genes de localización plasmídica y, según el radical sobre el que actúan, se denominan: fosforiltransferasas (APH), adenililtransferasas o nucleotidiltrans-ferasas (AADoANT) y acetiltransferasas (AAC). La metilación de la subunidad 16S del ácido ribonucleico (ARN) ribosómico se debe a la acción de una enzima localizada en un transposón insertado en un plásmido.
Este nuevo mecanismo de resistencia se describe por primera vez en una cepa aislada en Japón y confiere resistencia de alto nivel a amikacina, tobramicina, netilmicina y gentamicina. Es muy probable que en algunas cepas también se produzca la suma de otros mecanismos no enzimáticos como la síntesis del lipopolisacárido (LPS), en los que se demuestra un aumento gradual de la resistencia a aminoglucósidos, además de la alteración de la permeabilidad de la membrana y las bombas de expulsión Mex AB OprM.12
Al analizar los carbapenémicos (Tabla 3) vale la pena aclarar que, de forma general, en este estudio la resistencia a ellos es elevada, lo que sugiere que el abanico terapéutico para P. aeruginosa se estrecha cada día más, algo que constituye una preocupación no solo en esta institución sino también en Europa, donde el por ciento medio de resistencia aumentó desde un 16,8% en 2011 a un 18,3% en 2014. Este aumento se ha constatado también en España según los datos del European Centre for Disease Prevention and Control (ECDC), para un 18,5% en 2014.19
En un trabajo realizado en 2015 en el que se evalúan los factores de riesgo asociados a la adquisición de P. aeruginosa en pacientes críticos se observó que el tratamiento previo con carbapenemas estaba asociado, de forma independiente, a la resistencia a los mismos.20
Un estudio realizado en un hospital privado de Brasil informa una alta resistencia al imipenem (82,7%) y al meropenem (56,6%) y que, entre las cepas resistentes a estos dos antibióticos, el 56,4% son productoras de metalo-β-lactamasas; se detecta, además, el gen blaSPM-1 en el 73,4% de éstas.13
En estudio de Cobo y colaboradores12 se evalúan aislamientos procedentes de muestras clínicas y se indican por cientos de resistencia relativamente bajos a imipenem (9,6%) y a meropenem (6,1%); en el caso de los aislamientos de la UCI la resistencia a imipenem se elevó a un 20%. Resultados similares fueron obtenidos en el estudio de Minchella y colaboradores,21 en Francia, en el que se observó una resistencia moderada a imipenem (15,6%).
La resistencia a carbapenemas está mayoritariamente causada por mutaciones que inactivan la porina OprD y afectan el imipenem. La hiperexpresión de bombas de expulsión, que afectan el aztreonam, el meropenem y la cefepima, y la producción de carbapenemasas, se encuentran entre otros mecanismos responsables de la resistencia de P. aeruginosa a esta familia de antimicrobianos.
En países europeos5 la resistencia a la piperacilina-tazobactam ha sido mayor al 20% y por encima del 30% para el ciprofloxacino; no obstante, en Francia11 la resistencia a las penicilinas se mantiene constante en la última década, mientras que desciende la resistencia a las fluoroquinolonas y a los monobactámicos (Tabla 4).
En estudio de Minchella y colaboradores21 se evalúan cepas asociadas a IAAS y hospitalarias y se observa una resistencia moderada a piperacilina/tazobactam (14,8%).
La resistencia a fluorquinolonas en P. aeruginosa se debe, sobre todo, a cambios estructurales en la diana (ADNgirasa y topoisomerasa IV) o la reducción de la permeabilidad de la membrana (sistemas de expulsión activa o pérdida de las porinas). Mutaciones puntuales en el gen gyrA localizado en la región determinante de la resistencia a quinolonas (QRDR) da lugar a la síntesis de un ADNgirasa o topoisomerasa II con baja afinidad por las fluoroquinolonas. Un único cambio en un aminoácido sería responsable de un nivel de resistencia moderado, mientras que mutaciones que afectan al gen gyrA y al gen parC (subunidad A de la topoisomerasa IV) condicionaría un elevado grado de resistencia.22
En P. aeruginosa la resistencia de alto nivel a las fluoroquinolonas se debe a la participación conjunta de los sistemas de expulsión activa y a las mutaciones en los genes que codifican la ADNgirasa y la topoisomerasa IV.22,23 En este estudio la resistencia a fluoroquinolonas (ciprofloxacino) estuvo presente en 15 cepas de las 47 estudiadas, lo que representó un 31,9%.
La resistencia antimicrobiana en P. aeruginosa se torna cada día más preocupante porque con todos los antimicrobianos enfrentados hubo al menos una cepa resistente (los mayores por cientos de resistencia ya fueron expuestos anteriormente).
El menor por ciento de resistencia fue aportado por la colistina, con solo una cepa resistente (2,12%), por lo que podría ser un arma terapéutica importante en estos momentos y ha empezado a utilizarse como terapéutica de elección en pacientes graves y con bacteriemia por P. aeruginosa cuando hay comprobación microbiológica del microorganismo.
La aparición de bacilos gram negativos multirresistentes, principalmente P. aeruginosa y complejo Acinetobacter baumannii calcoaceticus y la carencia de nuevos antimicrobianos, ha conducido al resurgimiento de las polimixinas, que son un grupo de antibióticos polipeptídicos que fueron utilizados durante la década de los 60 y los 70, pero fueron gradualmente abandonadas durante la década del 80 debido a publicaciones sobre nefrotoxicidad y neurotoxicidad desarrolladas durante el tratamiento con las polimixinas. Los principales representantes de este grupo de antimicrobianos son colistín (polimixina E) y polimixina B.24
La mayoría de los patógenos multirresistentes responsables de infección adquiridas en la UCI son sensibles a colistina, que es un antimicrobiano a considerar en el tratamiento de rescate de patógenos multirresistentes, sobre todo activo, contra el complejo Acinetobacter baumannii calcoaceticus, P. aeruginosa y Klebsiella pneumoniae.25
En una revisión que se realizó en un hospital de Colombia26 con el objetivo de ilustrar la eficacia terapéutica de la colistina en infecciones por P. aeruginosa extenso resistente (XDR) en pacientes ingresados en UCI, se evaluaron las posibles alternativas terapéuticas y se concluyó que la colistina en monoterapia debe ser el tratamiento de primera línea, aunque la multiterapia ha demostrado eficacia, pero se necesita mayor evidencia sobre su utilidad y su manejo clínico; no obstante, posee graves efectos nefrotóxicos.
CONCLUSIONES
La diabetes mellitus tipo 2 constituyó el principal factor de riesgo en pacientes ingresados en el Servicio de Angiología para contraer una IAAS por Pseudomonas aeruginosa. Los B-lactámicos presentaron resistencia en más de la mitad de los aislamientos; la colistina puede ser una posible opción de tratamiento.















