INTRODUCCIÓN
El esófago de Barrett (EB) se define como la sustitución del epitelio escamoso estratificado esofágico (de color rosado) de cualquier extensión por una mucosa reconocida endoscópicamente, de color rojo salmón (epitelio de tipo columnar), y confirmado por la presencia de metaplasia intestinal en la biopsia (estudio histológico), que se precisa por la existencia de células caliciformes o gobletcells.
Desde 1970 es ampliamente aceptado desde que la enfermedad por reflujo gastroesofágico (ERGE) es el principal factor de riesgo para el EB y que el material refluido puede ser ácido o básico. La ERGE es una condición muy común, con tasas de prevalencia que van desde el 8 al 40% en todo el mundo.1
Una revisión de 28 estudios de diferentes países en la población adulta informa una prevalencia de EB en Norte América de un 9 a un 26%, en Europa del este de un 9 a un 33% y en el este de Asia de un 2,5 a un 8%. Esta prevalencia se ha incrementado en un 50% en los últimos 20 años, aunque las verdaderas tasas son difíciles de estimar porque muchos de los pacientes están asintomáticos y requieren de evaluación endoscópica y confirmación histológica; lo que es mayor en países occidentales con respecto a Asia. La relación hombre mujer es de aproximadamente 2:1.2
Su incidencia entre los pacientes con ERGE a los que se les practica endoscopía y biopsia oscila entre el 6 y el 12%; sin embargo, solo del 20 al 25% de los pacientes con EB son diagnosticados.3
Se ha debatido si ha existido un aumento de su incidencia o si es secundario a una mayor conciencia de los peligros de la progresión de la enfermedad y un mayor uso de la endoscopia para evaluar pacientes con síntomas de reflujo.4
Otros factores de riesgo para el desarrollo de EB incluyen la edad mayor de 50 años, el género masculino, la asociación de obesidad central (más asociado con el índice cintura cadera que con el índice de masa corporal), el hábito de fumar, la historia familiar de EB o de adenocarcinoma esofágico (ACE) en familiares de primer grado y la hernia hiatal.5 Estudios consultados han incluido como factor de riesgo adicional al síndrome metabólico, a la diabetes mellitus tipo 2 y a la apnea del sueño.6
El EB es la única condición premaligna identificable para el ACE, su incidencia ha aumentado seis veces en las últimas tres décadas, con tasas de sobrevida de <20% a los cinco años,7 y un riesgo de padecerlo de 30 a 125 veces en los que padecen EB.8 La edad mayor de 65 años, la obesidad central, el tabaquismo y la longitud del EB favorecen la progresión a la displasia y al ACE.9) El riesgo de progresión al cáncer en pacientes sin displasia asociada es de 0,2 a 0,5% por año. En los pacientes con displasia de bajo grado (DBG) el riesgo anual es de aproximadamente 0,7% por año, para la displasia de alto grado (DAG) es del 7% anual.10El largo del segmento también es proporcional a esta progresión.11
El conocimiento de la fisiopatogenia del esófago de Barrett no está bien definido hasta la actualidad, en la que se proponen una serie de factores que son de vital importancia.
El objetivo de esta investigación es hacer un resumen de lo expuesto por la literatura que valga de herramienta de consulta.
MÉTODOS
Se realizó una búsqueda bibliográfica a través de PubMed y Google Académico en inglés y español. Se consultaron, fundamentalmente, revistas científicas de los últimos años contenidas en la base de datos Medline, otras de similar calidad, pero que no son parte de Medline y algunas tesis.
DESARROLLO
En un inicio se pensaba que la esofagitis producida por la ERGE estaba mediada por la activación de neutrófilos y eosinófilos, pero estudios realizados a partir del año 2009 demostraron que existe mayor mediación de citoquinas (IL8) que de estos granulocitos.12
La transformación de un epitelio escamoso normal a uno columnar es provocada por el daño crónico producido por episodios recurrentes de reflujo.
La oncogénesis, desde el EB sin displasia al ACE in situ, ha estado considerada tradicionalmente por una progresión paso a paso, su trasformación maligna está directamente relacionada con el mayor grado de displasia.
El primer paso consiste en la transformación de la mucosa escamosa esofágica normal a un epitelio cilíndrico simple llamado mucosa del cardias, este proceso se produce con relativa rapidez y secundario al reflujo continuo sobre la mucosa escamosa esofágica; el segundo paso es el desarrollo de células caliciformes, es indicativo de metaplasia intestinal (MI) y es una evolución más lenta, que puede tardar de cinco a 10 años.13) En este paso se produce una interposición de una zona de unión o transición de mucosa columnar entre la mucosa oxíntica secretora de ácido y la mucosa esofágica escamosa sensible al ácido. Esta mucosa de la unión puede ser normal hasta 2cm en la unión gastroesofágica (UGE) y presenta características particulares:
• Histológicamente distinta del epitelio gástrico normal fúndico y pilórico
• No secreta ácido o pepsina, pero es resistente a ambos
• No es congénita, sino adquirida
• Es móvil y varía su longitud y se elonga proximalmente, cada vez más en el esófago, cuando existe RGE continuo
• Es potencialmente reversible con la corrección del reflujo.14
El fenotipo de glándulas más comúnmente asociada al EB es una mezcla de epitelio con células caliciformes sobre células columnares que son indistinguibles de las células gástricas foveolares. Este patrón dual de diferenciación epitelial se refleja por la expresión de la mucina y la expresión del factor Trefoil (TFF). Las células caliciformes producen la mucina de tipo intestinal (MUC2 y TFF3) y las células foveolares la mucina tipo gástrica (MUC5AC y TFF1). La mucina contiene abundantes cadenas laterales de oligosacáridos y crea una cubierta viscosa sobre el epitelio. Las células columnares de la base también expresan MUC6 y segregan gran cantidad de bicarbonato, que sirve como búfer que protege las células metaplásicas de la superficie.
Hay un pequeño número de tipos de glándulas que también constituyen el mosaico metaplásico en el esófago (glándulas cardiales o glándulas no gobletcell) y que contienen (MUC5AC y TFF1). Estas glándulas cardiales contienen solo células fobeolares a lo largo del compartimiento superficial de las criptas y células mucosas que segregan MUC6 y TFF2 a nivel de la base.
La distribución espacial de estos fenotipos glandulares no está clara, se cree que podría ser el resultado de una selección local para sobrevivir a un medio ácido-biliar rudo. El fenotipo intestinal se encuentra, con mayor frecuencia, hacia la unión escamo columnar, mientras que las cardiales y las oxíntica cardiales hacia la unión gastroesofágica (Figura 1).15
Los progenitores de las células metaplásicas en esta enfermedad no son bien conocidos. Existen varios candidatos, pudiera ser a partir de las células maduras del epitelio escamoso que cambian a columnar debido a la exposición crónica al reflujo ácido-biliar, a través de un proceso denominado transdiferenciación. Las células cambian de fenotipo a un tipo distinto del que presentaban durante su desarrollo embrionario sin necesidad de división celular. Podría ser también a partir de células progenitoras inmaduras, células madre o stencell (SC por sus siglas en inglés), que tienen la capacidad de producir y mantener diferentes tipos de células.12
Basado en diferentes estudios existen cuatro posibles fuentes de SC o progenitora del EB:
Células madre del tejido escamoso esofágico
Células madre encontradas en los ductos o acinos de las glándulas submucosas profundas del epitelio escamoso
Células madre provenientes de la medula ósea que migran para reparar el tejido dañado
Células madre del tejido de la unión o el cardias que migran en sentido proximal y experimentan una diferenciación intestinal.16,17
En el intestino delgado y el colon las células madre residen estrictamente en la base de las glándulas y se mueven hacia arriba a lo largo de la cripta para diferenciarse en madura, en cambio en el esófago de Barrett se encuentran en el tercio superior de la glándula y migran de forma bidireccional hacia la luz y la base.
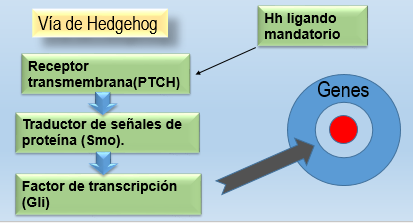
Para explicar la transformación a tejido metaplásico se ha manejado otra teoría, el transcompromiso, en el que el reflujo provoca la liberación de factores de transcripción.18 Se describe la vía de Hedgehog, activada por (Hh), un ligando mandatorio de un receptor transmembrana llamado patched (PTCH). En ausencia del Hh el PTCH inhibe un traductor de señales de proteína (Smo). Siguiendo el mandato de Hh, el Smo es liberado del PTCH, que inhibe la activación de un factor de trascripción (Gli), que actúa sobre los genes. Actuar sobre esta vía podría ser un futuro tratamiento de esta afección (Figura 2).
Las células escamosas expuestas al reflujo expresan la señal del Hh que, a su vez, facilita la expresión del factor de transcripción columnar SOD9 (superóxido dismutasa) y el gen de transcripción relacionado con el desarrollo mesodérmico del aparato digestivo (FOXA2), que hacen que las células escamosas expresen los genes que influyen sobre la diferenciación en células columnares y caliciformes.18,19
Se sugiere que el riesgo a desarrollar EB es multifactorial y que influyen los factores medioambientales que precipitan el daño sobre una predisposición genética intrínseca encontrada en alelos genéticos involucrados en el desarrollo embrionario.20
Genética
Se han detectado más de 20 variantes genéticas que predisponen al EB en poblaciones europeas.21,22
Estudios recientes han investigado el rol de la disfunción mitocondrial en la progresión hacia el cáncer en esta enfermedad. En células normales esta juega algunos roles en las vías anabólicas y catabólicas que incluyen la homeostasis de calcio, la síntesis de ATP, la regulación de los procesos redox en el citosol y en la apoptosis. Es mediante estos mecanismos que se logra la progresión desde la displasia a la neoplasia. Existen genes relacionados con estos mecanismos: con la fisión mitocondrial (FIS1), con la apoptosis (bcl-2 o BAK1) y con la supresión tumoral (SFN).23
Los genes p16 y p53 están relacionadas con la regulación del ciclo celular y funcionan como supresores tumorales.24 Ross, en su artículo, comenta sobre la presencia de otros marcadores en menor proporción: ARID1A, SMARCA4, SMAD4 y SYNE.25 Weaver demostró mutaciones en ARID1A y SMARCA4 en pacientes que nunca mostraron evidencia de displasia dentro del segmento de Barrett después de cinco años de seguimiento.26
Microbiota intestinal
La microbiota intestinal esofágica no es suficientemente conocida. Estudios realizados han identificado seis filus: firmicutes (70%), bacteroides (20%), actinobacteria (4%), proteobacteria (2%), fusobacteria (2%) y TM7 (1%) y 95 especies, entre las más comunes, Streptococcus (39%), Prevotella (17%) y Veilonella (14%).
Se han propuesto varios mecanismos mediante los que se favorece la inflamación:
Acción directa sobre el esfínter esofágico inferior (EEI) mediante lipopolisacáridos (LPS) que favorecen el reflujo o contribuyen a la inflamación y a la malignidad
Los productos del metabolismo bacteriano, así como también la respuesta inmunológica mantenida, ejercen un efecto proinflamatorio en la mucosa esofágica
A través de la activación de los receptores Toll-like, los que median la interacción entre el sistema inmune y la microbiota
La producción epitelial de IL-18, una citoquina proinflamatoria que ha mostrado tener acción sobre la proliferación tumoral
Los LPS producen una sobreexpresión de los genes de la vía del TLR-4 (receptores tipo Toll-like) y del NFkB (factor nuclear potenciador de las cadenas ligeras kappa de las células B activadas), que incrementan la expresión de las citoquinas proinflamatorias, la inducción de la síntesis de óxido nítrico con relajación del EEI y la demora en el vaciado gástrico por la producción de cicloxigenasa.27,28
Obesidad
El tejido adiposo es considerado como un órgano endocrino.
Un estudio realizado en residentes del estado de Washington encontró una mayor relación entre el índice cintura cadera con el EB que con el índice de masa corporal (IMC). En otros estudios la adiposidad central y la circunferencia abdominal mostraron también mayor relación con esta enfermedad.29
La obesidad central o abdominal provoca la relajación del EEI por dos mecanismos: mecánico y humoral. El primero logra el aumento de la presión intraabdominal, de la intragástrica y del gradiente del EEI, lo que favorece la aparición de hernia hiatal y enlentecimiento del tiempo de transito esofágico, que facilita el reflujo. Mediante el humoral se induce la secreción de varias citoquinas proinflamatorias en el tejido adiposo (IL-8, IL-6, IL-1, NF-Kappa y TNF-alpha) que provocan relajación de la musculatura del EEI e inducen la insulinoresistencia.30
El metaanálisis realizado por Hoyo y su equipo propone una teoría no mecánica y plantea que la obesidad favorece el aumento de factores proliferadores (Insulin-likeGrowth Factor, IGF, por sus siglas en inglés) y leptina y la disminución de factores antiproliferadores (adiponectina).31
La asociación entre obesidad y ACE es independiente de los síntomas de ERGE.32
Un estudio sobre síndrome metabólico (MetS, por sus siglas en inglés) encontró una asociación proporcional entre la cantidad de componentes de este síndrome (obesidad abdominal, hipertensión, hiperglicemia, aumento de los triglicéridos y disminución del HDL-C) y el reflujo.33
Óxido nítrico
El óxido nítrico (ON) es generado en bajas concentraciones por la enzima óxido nítrico sintetasa para modular la función muscular y la vascular. Altas concentraciones son generadas por inducción enzimática ante respuesta inflamatoria e inmune. Las altas concentraciones de ON se forman a partir de los nitratos de la dieta, que son absorbidos en el intestino delgado y resecretados por las glándulas salivares y transformados por las bacterias del dorso de la lengua en nitritos que, al ser deglutidos y ponerse en contacto con el ácido estomacal y el ácido ascórbico contenido en sus secreciones, se transforma en ON en el estómago.
Los niveles de óxido nítrico generado son máximos a nivel de la unión esófago gástrica (UEG) y potencialmente mutagénicos y pueden desempeñar un papel en la destrucción del EEI.34) El ON puede estar relacionado con la regulación de genes que regulan la diferenciación del epitelio escamoso tales como el SOD2 y el P63.12
La exposición al ON causa una S-nitrosilación de la proteínakinasa B (PKB oAkt), lo que bloquea su activación e interfiere en la reducción de la expresión del SOD2 a nivel del epitelio escamoso.35
Helicobacter Pylori
La teoría del por qué el Helicobacter Pylori (HP) reduce el riesgo de desarrollo de EB no está bien probada. Se plantea que el efecto sobre la mucosa gástrica disminuye la producción de ácido y, por lo tanto, el daño sobre el esófago distal. Fischbach y colaboradores describieron otra teoría que ayuda a explicar esta relación inversa: la infección por HP reduce el riesgo de obesidad, que no solo disminuye el reflujo, sino los niveles de insulina en sangre, lo que provoca una disminución de la producción de IGF, que normalmente actúa como un agente que potencia la proliferación del EB.36
Hábitos tóxicos
Es probable que el mecanismo por el que el tabaco induce la relajación del EEI sea por el bloqueo de los receptores colinérgicos que producen la relajación de las fibras musculares circulares. Se asocia también con prolongación del aclaramiento ácido debido a la reducción de la secreción salival y la disminución de la concentración de bicarbonato. En el estudio de Norway, con 43 363 participantes, se encontró asociación entre el hábito de fumar y el desarrollo de ERGE; no así para el alcohol y en el estudio de cohorte de Norwegian, con 14 916 participantes, encontró similares resultados en relación con el alcohol.37
Elementos adicionales
La metaplasia intestinal especializada aumenta la expresión de la ciclooxigenasa (COX), la inhibición de la COX-2 ha mostrado que tiene efectos antiproliferativos y proapoptóticos en líneas celulares de ACE del EB, de ahí la posible aplicación de los antinflamatorios no esteroideos (AINEs) en su tratamiento.
El reflujo ácido no solo tiene efectos inflamatorios, sino que provoca la liberación de especies de radicales de oxígeno (ROS) que, a su vez, provocan daño en las cadenas de ácido desoxirribonucleico (ADN).38
Algunos ácidos biliares son más tóxicos que otros, en específico el ácido desoxicólico (DCA), y producen también daño en el ADN y la activación de la vía del NFκB; esta última previene la apoptosis. Esta activación del NFκB hace que las células con ADN dañado perduren y se tornen potencialmente carcinogénicas.
En pacientes sometidos a tratamiento coninhibidores de la bomba de protones (IBP) existe un crecimiento de bacterias en el estómago que puede producir DCA a partir del ácido cólico (AC) y desconjugar el DCA. El ácido ursodesoxicólico (UDCA) reduce el stress oxidativo, el daño del ADN y la activación del NF-κB, además de las enzimas antioxidantes como la glutatión peroxidasa1 (GPX1), la catalasa y el superóxido dismutasa de los tipos SOD1 y SOD2. Esto sugiere que el UDCA pudiera ser una alternativa terapéutica en estos casos con predominio del reflujo biliar.12
CONCLUSIONES
La comprensión de la fisiopatogenia, si se tiene en cuenta que las células que originan la metaplasia intestinal y la identificación temprana de los estados de progresión al ADC, ha ganado una significativa atracción en la investigación a través de modelos humanos y animales durante los últimos años. El conocimiento de la respuesta inmune y el medioambiente luminar sobre una base genética permitirá colocar los recursos en los pacientes con alto riesgo y evitar procedimientos innecesarios a pacientes de menor riesgo.