INTRODUCCIÓN
La percepción del dolor es una experiencia personal, multidimensional, subjetiva, compleja y única para cada paciente. La Asociación Internacional para el estudio del dolor (IASP) lo define como “una experiencia sensorial y emocional desagradable, con lesión tisular real o potencial y descrito en términos de tal lesión”.1,2
El tratamiento satisfactorio del dolor postoperatorio es un reto muy importante en el ámbito quirúrgico, su control eficaz se ha convertido en una parte esencial de los cuidados perioperatorios porque existe evidencia de que su adecuado control no solo aumenta el confort y la satisfacción de los pacientes, sino que al mismo tiempo contribuye a disminuir la morbilidad postoperatoria y a reducir la estancia hospitalaria;3
sin embargo, en la actualidad, el dolor postoperatorio constituye un problema no resuelto, el 70% de los pacientes operados experimentan dolor severo y un 30% dolor moderado.4 Dadas las condiciones que anteceden, durante las últimas dos décadas se han producido avances considerables referentes al conocimiento de la fisiopatología del dolor agudo, la farmacología de los analgésicos y el desarrollo de técnicas efectivas para disminuir su incidencia.5,6
A partir de las alternativas farmacológicas actuales surgen la anestesia y la analgesia libres de opioides, que logran estabilidad hemodinámica y supresión de la respuesta simpática y analgesia, considerados pilares fundamentales de todo manejo anestésico y solo alcanzables en el pasado siglo con opiaceos.6,7
Tal como se ha visto, la sola idea de una anestesia-analgesia libre de opiodes representa un cambio de paradigma porque las últimas generaciones de Especialistas en Anestesiología han concebido a los opioides como indispensables para alcanzar estas metas.7,8 Según informa la literatura entre los medicamentos utilizados para reemplazar a estos se encuentran la dexmedetomidina, la lidocaína, el sulfato de magnesio, la ketamina, el esmolol, los antiinflamatorios no esteroideos y el paracetamol.9,10 Los antagonistas de receptores de N-metil-D-aspartato (NMDA), como el sulfato de magnesio y la ketamina, han motivado a realizar nuevas técnicas analgésicas, con múltiples beneficios para el paciente, como la disminución de la intensidad del dolor en el postoperatorio inmediato, así como un menor número de efectos secundarios. El sulfato de magnesio ha sido utilizado para potencializar el bloqueo neuromuscular, disminuir el reflejo a la laringoscopia y manejar las crisis convulsivas en la eclampsia, la hemorragia subaracnoidea, el asma severa, la neuroprotección y la prevención de arritmias; también se ha valorado la influencia de este fármaco en la analgesia postoperatoria.10,11 Con el objetivo de evaluar la utilidad de los antagonistas de receptores NMDA en la analgesia postoperatoria de la cirugía proctológica se realiza la presente investigación.
MÉTODOS
Se realizó un estudio cuasi experimental en el Servicio de Anestesiología y Reanimación del Hospital Universitario Clínico Quirúrgico “Arnaldo Milián Castro” de la Ciudad de Santa Clara, Provincia de Villa Clara, durante el período comprendido de septiembre de 2016 a septiembre de 2018, para evaluar la utilidad de los antagonistas de receptores NMDA en la analgesia postoperatoria de la cirugía proctológica.
El universo quedó conformado por los 327 pacientes intervenidos de cirugía proctológica en el lugar y período antes mencionado. La muestra estuvo constituida por 100 pacientes seleccionados por muestreo intencional no probabilístico que se asignaron a dos grupos de 50 pacientes cada uno y que cumplieron los siguientes criterios de inclusión y exclusión.
Criterios de inclusión:
Pacientes conformes con participar en la investigación y que dieron su aprobación a través del consentimiento informado.
Pacientes con edades comprendidas entre 18 y 75 años con diagnóstico de enfermedad proctológica y estado físico I, II y III según la clasificación de la American Society of Anesthesiologists (ASA).
Criterios de exclusión:
Pacientes con contraindicaciones absolutas o relativas para realizar anestesia espinal
Pacientes con contraindicaciones absolutas o relativas para el uso de los fármacos programados a utilizar en el estudio
Pacientes que hayan usado opiáceos en las últimas 24 horas
Pacientes con trastornos mentales que impidan la evaluación del dolor.
Se evaluaron las variables edad, sexo, estado físico según la clasificación de la ASA, peso, tiempo quirúrgico, diagnóstico operatorio, tensión arterial media (TAM), frecuencia cardíaca (FC), saturación pulsátil de oxígeno (SpO2), nivel de sedación, intensidad del dolor, analgesia de rescate y efectos adversos.
Procedimientos
Los pacientes se asignaron a cada uno de los grupos de tratamiento.
Grupo K (n=50): este grupo quedó constituido por los pacientes sometidos a cirugía proctológica a los que se les administró ketamina como analgesia postoperatoria, en dosis inicial de 0,25mg/kg, en bolo endovenoso, y se continuó con infusión a 0,2mg/kg/hora, inmediatamente tras la finalización de la intervención quirúrgica.
Grupo KS (n=50): este grupo quedó constituido por los pacientes sometidos a cirugía proctológica a los que se les administró como analgesia postoperatoria ketamina asociada con sulfato de magnesio. La dosis inicial de ketamina fue de 0,125mg/kg y la infusión continua fue de 0,1mg/kg/hora, mientras que de sulfato de magnesio se administraron 15mg/kg en bolo y se continuó con infusión de 5mg/kg/hora, inmediatamente tras finalizar la intervención quirúrgica.
En la Sala de preoperatorio se canalizó una vena periférica con trocar 18G en cualquier brazo y se comenzó a administrar solución salina al 0,9% a 10ml/kg/h, además de la medicación preoperatoria, que consistió en midazolam a 0,03mg/kg, utilizando como dosis máxima 2,5mg y cefazolina 1g por vía endovenosa, 30 minutos antes de la intervención quirúrgica.
En el quirófano se procedió a la monitorización del paciente y se constataron la frecuencia cardíaca, la frecuencia respiratoria, el electrocardiograma continuo, la tensión arterial no invasiva y la saturación de O2 por pulsioximetría.
Posteriormente se realizó la técnica anestésica que consistió en anestesia espinal en el interespacio L4-L5 o L5-S1 (se utilizó un trocar Sprotte calibre 25G), se le administraron 50mg de lidocaína hiperbárica y se le mantuvo sentado por 15 minutos tras la administración del anestésico, para después colocarlo en posición de navaja sevillana para el procedimiento quirúrgico, y se le suministró O2 por mascarilla facial a tres litros/minutos.
En el transoperatorio se realizó la monitorización de los parámetros hemodinámicos y respiratorios, con control de la tensión arterial no invasiva cada cinco minutos y monitorización continua de frecuencia cardíaca, electrocardiograma (EKG) y SpO2. Al finalizar la intervención quirúrgica, en el quirófano, se inició inmediatamente el manejo del dolor postoperatorio con ketamina en el grupo K y ketamina más sulfato de magnesio en el grupo KS; posteriormente fueron trasladados a la Unidad de Cuidados postanestésicos (UCPA).
En la UCPA se registraron los valores de tensión arterial sistólica y diastólica cada 15 minutos en las primeras cuatro horas y después cada una hora por las restantes ocho. Se monitorizaron, de forma continua, la frecuencia cardíaca y la SpO2 y, con fines investigativos, se tomaron los valores a la llegada a la UCPA y a las dos, a las cuatro, a las ocho y a las 12 horas.
Se evaluó la intensidad del dolor mediante la aplicación de la escala analógica visual (EAV), la que fue explicada a los pacientes en la Consulta preanestésica: el cero significaba ausencia de dolor y 10 el máximo dolor imaginable. El dolor fue evaluado de ausente (cero), leve (entre 1 y 3), moderado (entre 4 y 7) y severo (entre 8 y 10) a la llegada a la UCPA y a las dos, a las cuatro, a las ocho y a las 12 horas. El nivel de sedación fue medido en los mismos períodos de tiempo y se utilizó la siguiente escala:
Paciente ansioso, agitado, impaciente
Paciente cooperativo, orientado, tranquilo
Paciente somnoliento
Paciente dormido, fácilmente despertable
Paciente dormido, difícilmente despertable
Paciente dormido, no despertable.
Se valoró la necesidad de analgesia de rescate y se explicó a los pacientes que podían solicitar la aplicación de analgesia suplementaria, con ketamina en dosis de 0,1mg/kg a intervalo nunca menor de una hora y, como segundo rescate, diclofenaco de sodio, un ámpula de 75mg en 100ml de solución salina al 0,9%, por vía intravenosa, a durar 20 minutos, si el dolor, según la EAV, era moderado o severo (puntuación en la EAV≥4).
Se determinó la presencia de efectos adversos relacionados con el uso de los antagonistas de receptores de NMDA.
Recolección de los datos
Las fuentes de información fueron la historia clínica general y la historia clínica anestésica, la información se incluyó en una planilla de recolección de datos en la que se archivó toda la información relacionada con el estudio.
La información se introdujo en una base de datos utilizando el Microsoft Office Excel 2010 y se procesó por medios y métodos computarizados.
Procesamiento de los datos
Se elaboró una base de datos automatizada en el programa estadístico SPSS 20.0 y se resumieron los datos en números absolutos y por cientos para las variables cualitativas y cuantitativas. Los resultados se representaron en tablas estadísticas y se determinaron distribuciones de frecuencia absolutas y relativas, expresadas en números absolutos y por ciento. Se utilizó la prueba de Chi cuadrado para comprobar diferencias entre las modalidades analgésicas y la de Friedman para determinar las diferencias en los parámetros hemodinámicos y respiratorios; se consideraron un nivel de confiabilidad del 95% y los resultados de los valores de la significación de las pruebas (p) se interpretaron de la siguiente forma: si p≥0,05 no existen diferencias estadísticas significativas, si p<0,05 y ≥0,01 existen diferencias estadísticas significativas y si p<0,01 existen diferencias estadísticas muy significativas. Las tablas estadísticas, junto con la redacción del informe final, se realizaron mediante el editor de texto Word y Excel para Windows 7.
RESULTADOS
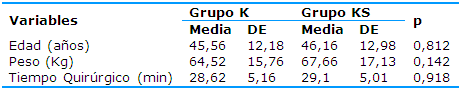
La Tabla 1 representa la caracterización estadística de las variables edad, peso y tiempo quirúrgico. La edad media en el grupo K fue 45,56 años y en el KS 46,16 años, el peso medio de los pacientes del grupo K estuvo en 64,52kg y en el KS en 67,66kg y el tiempo quirúrgico medio fue 28,62 minutos para el grupo K y 29,10 minutos para el KS. El análisis estadístico no reveló diferencias estadísticas significativas.
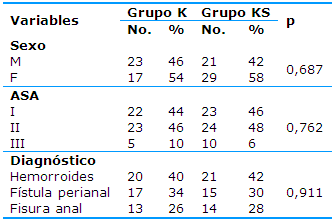
En cuanto a la distribución de los pacientes según el sexo, la clasificación de la ASA y los diagnósticos operatorios se observa una distribución similar entre ambos grupos; no hubo diferencias estadísticas significativas (Tabla 2).
Tabla 2 Distribución de los pacientes según el sexo, la clasificación de la ASA y el diagnóstico operatorio
El comportamiento de la TAM en el postoperatorio se representa en la Tabla 3. Se puede apreciar que, en los tiempos establecidos, este parámetro se comportó de forma estable en ambos grupos y que se encontraron cifras de TAM medias inferiores en los pacientes del grupo KS, en el que se pudieron demostrar diferencias estadísticas significativas a las cuatro horas y diferencias estadísticas muy significativas a las ocho y a las 12 horas.
La frecuencia cardíaca siguió un comportamiento similar a la TAM y exhibió estabilidad en ambos grupos; se encontraron cifras inferiores en los pacientes del grupo KS (Tabla 4).
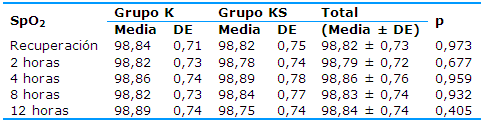
El comportamiento de la SpO2 se caracterizó por una marcada estabilidad en ambos grupos, entre los que hubo una gran similitud clínica (Tabla 5); no existieron diferencias estadísticas significativas.
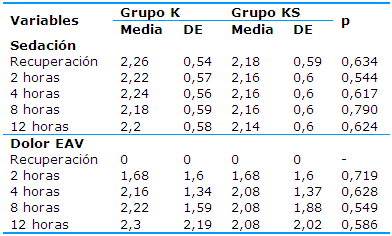
Las puntuaciones medias del nivel de sedación y la interpretación del dolor según la EAV se representan en la Tabla 6. Todos los pacientes incluidos en el estudio estaban en el nivel 2 y 3 de la escala de sedación, lo que se corresponde con pacientes cooperativos, orientados y tranquilos para el nivel 2 y somnolientos para el nivel 3. En todos los momentos del estudio se pudo observar un nivel de sedación ligeramente superior en los pacientes del grupo K, pero no se demostró una asociación estadística significativa entre el nivel de sedación y el uso de antagonistas del receptor NMDA (p>0,05). En relación con el dolor postoperatorio, a la llegada a la UCPA, el 100% de los pacientes de ambos grupos negaban la existencia de dolor y ubicaban esta condición en el nivel cero de la EAV. A las dos horas la interpretación del dolor fue igual en ambos grupos y en las horas cuatro, ocho y 12 se encuentran valores medios de la EAV siempre menores en el grupo KS, sin poder demostrar diferencias estadísticas significativas.
La Tabla 7 representa la distribución de los pacientes según el número de bolos suplementarios recibidos para analgesia de rescate. En el grupo K 40 pacientes (80%) no recibieron bolos suplementarios, condición que cumplieron 42 pacientes (84%) en el grupo KS, seis pacientes (12%) del grupo K recibieron un bolo de analgesia suplementaria y cuatro (8%) admitieron dos bolos y en el grupo KS cuatro pacientes recibieron un bolo de analgesia de rescate e igual número dos, para un 8% respectivamente. Al comparar estadísticamente ambos grupos, en relación al número de bolos suplementarios utilizados, no se demostraron diferencias estadísticas significativas (p=0,799).
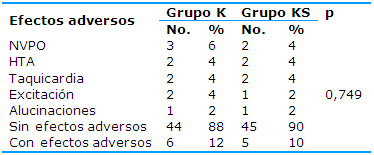
Los efectos adversos atribuibles al uso de los antagonistas de los receptores NMDA se presentan en la Tabla 8. En el grupo K se informaron dos pacientes que padecieron hipertensión arterial, dos taquicardia, tres náuseas y vómitos postoperatorios, dos enfermos presentaron excitación y uno alucinaciones; 44 no presentaron efectos adversos. En el grupo KS dos experimentaron hipertensión arterial, dos taquicardia, dos náuseas y vómitos postoperatorios, uno excitación y uno afectado con alucinaciones; 45 no tuvieron efectos adversos. Al comparar la utilización de la ketamina con la asociación de este fármaco al sulfato de magnesio y relacionarlo con la aparición de efectos adversos no se demostraron diferencias estadísticas significativas (p=0,749).
DISCUSIÓN
En esta investigación las variables edad, sexo, peso, clasificación del estado físico según la ASA, tiempo quirúrgico y diagnósticos operatorios fueron similares estadísticamente, por lo que se puede afirmar que ambos grupos son homogéneos.
Los cambios cardiovasculares que se producen en el período postoperatorio están relacionados con la activación del sistema simpático y del eje renina-angiotensina-aldosterona como parte de la respuesta neuroendocrina a la agresión. Los principales desencadenantes de estos cambios son el dolor postoperatorio, la ansiedad, la hipoxia, la hipercapnia, la hipovolemia, la acidosis y la hipotermia.12
Las respuestas reflejas supra segmentarias contribuyen a aumentar el tono simpático general, lo que da lugar a un mayor consumo de oxígeno, a hiperventilación y al aumento de la secreción de hormonas catabólicas como las catecolaminas, el cortisol, la ACTH, la ADH, el glucagón, la renina, la angiotensina y la aldosterona y se frena la producción de hormonas anabólicas como la insulina y la testosterona.12
La liberación de catecolaminas de las terminales nerviosas simpáticas y de la médula suprarrenal, la liberación de cortisol y de aldosterona de la corteza suprarrenal, la liberación de ADH del hipotálamo y la activación del sistema renina-angiotensina desencadenan los efectos cardiovasculares atribuibles al dolor. Estas hormonas tienen efectos directos sobre el miocardio y la vasculatura e incrementan la retención de agua y sodio, lo que confiere una enorme carga al sistema cardiovascular.12
La angiotensina II causa vasoconstricción generalizada, mientras que las catecolaminas aumentan la frecuencia cardíaca, la contractilidad miocárdica y la resistencia vascular sistémica. La liberación simpático-adrenal de catecolaminas y los efectos de la angiotensina pueden producir hipertensión arterial, taquicardia y arritmias.12
La ketamina interactúa con el receptor NMDA, produce un antagonismo no competitivo e inhibe la actividad del glutamato, considerado un neurotransmisor excitatorio que bloquea la producción de óxido nítrico e inhibe la liberación intracelular de GMPc.13
Tras la introducción de la ketamina en la práctica clínica, en el momento de pensar en su elección para su uso en anestesia, aparecieron cuatro preocupaciones fundamentales dependientes de su farmacocinética y su farmacodinamia:14
Efectos hemodinámicos como hipertensión arterial y taquicardia
Efectos sobre el sistema nervioso central, particularmente el aumento de la presión intracraneana
La calidad del despertar, fundamentalmente por los efectos psicotrópicos acompañantes
Su uso como droga recreativa.
La forma de utilización, al manejar la ketamina en dosis subanestésica, ha permitido el resurgir de este fármaco, condición que ha estado relacionada con la desaparición de sus efectos más desagradables.
La ketamina en dosis bajas ha demostrado su utilidad en anestesia, en las Unidades de Cuidados Intensivos y en el tratamiento del dolor agudo y crónico y esto ha permitido estudiar y destacar interesantes propiedades de este versátil fármaco:14,15
Disminución de la adhesión de leucocitos y plaquetas
Antagonismo no competitivo de los receptores NMDA
Reducción de la liberación presináptica de glutamato y aspartato
Antagonismo de los receptores muscarínicos y nicotínicos de la acetilcolina
Inhibición de la formación de factor de crecimiento neural
Inhibición de la formación de óxido nítrico
Disminuye la recaptación de catecolaminas
Disminuye la activación de los granulocitos
Supresión de la producción de citoquinas proinflamatorias
Inhibición de reflejos polisinápticos espinales
Efecto discutido sobre los receptores GABA.
La ketamina tiene su ventana terapéutica, solo que esa ventana, a diferentes concentraciones, pondrá de manifiesto diferentes efectos, los que transitan por cuatro zonas diferentes:14
Zona muda o sin efecto (concentración plasmática menor de 0,1mcg/ml)
Zona de analgesia o de efecto pseudonarcótico (concentración plasmática entre 0,1 y 0,35mcg/ml)
Zona de anestesia disociativa (concentración plasmática entre 0,36 y 0,49mcg/ml)
Zona de saturación y aparición de efectos adversos (concentración plasmática de 0,5mcg/ml en adelante).
En este estudio no se encontró que la ketamina, en las dosis utilizadas, se asociara a efectos hiperdinámicos cardiovasculares, hubo una tendencia a la estabilidad y a la normalidad clínica de la tensión arterial y la frecuencia cardíaca, lo que se explica por el efecto analgésico obtenido. Las dosis de ketamina administradas se encuentran en el rango de analgésicas, por lo que las concentraciones plasmáticas alcanzadas a partir de esta dosificación se enmarcan entre 0,1 y 0,35mcg/ml, las que se sitúan en la ventana terapéutica analgésica o la zona de analgesia, en la que son escasos los efectos adversos derivados de la administración de este fármaco. Los efectos cardiovasculares clínicamente significativos relacionados con la ketamina se obtienen con dosis mayores, para las que se alcanzan concentraciones plasmáticas superiores a 0,35mcg/ml y se consiguen efectos disociativos, hemodinámicos y neurológicos de significación.
La ketamina demostró sus excelentes posibilidades en la analgesia postoperatoria porque, además de aportar un adecuado control del dolor postoperatorio, su utilización se acompañó de escasos efectos colaterales. Varios autores16,17,18,19 informan resultados formidables con ketamina en la analgesia postoperatoria; otros20 señalan una buena analgesia postoperatoria cuando utilizan ketamina, pero informan una elevada incidencia de náuseas y vómitos postoperatorios y otro21 hace referencia a la utilidad de la ketamina para el dolor postoperatorio solo cuando es utilizada de forma preventiva.
El magnesio es un bloqueador de los canales de calcio y se le reconoce como un regulador del calcio intracelular. El mecanismo analgésico del magnesio no es totalmente comprendido, pero se piensa que la regulación del calcio y el bloqueo del receptor NMDA juegan un papel fundamental. Una posible explicación en los efectos analgésicos del magnesio radica en el antagonismo fisiológico del calcio a través del bloqueo de los receptores NMDA. Este receptor está involucrado en la transmisión del dolor y la habilidad del magnesio para bloquearlo ha creado interés por su uso potencial en el tratamiento del dolor perioperatorio El glutamato es un neurotransmisor que facilita las señales de la transmisión nociceptiva en el dolor agudo y crónico. En la transmisión del dolor el glutamato se une al receptor NMDA, lo activa y permite el flujo subsecuente de calcio y la consiguiente despolarización de la membrana. Los impulsos nociceptivos son transmitidos desde el asta dorsal de la médula espinal a través de las vías ascendentes al cerebro, en el que se percibe el dolor.22
La ketamina, junto al magnesio, ha demostrado ser beneficiosa en el tratamiento del dolor postoperatorio, en la reducción del uso de opioides postoperatorios y en el control de la hiperalgesia y la tolerancia inducidas por los opiáceos.22
Otra razón para el uso del magnesio es que la elevación de sus concentraciones extracelulares inhibe la respuesta inflamatoria por reducción de las citoquinas inflamatorias. A través del antagonismo fisiológico del ion calcio, el bloqueo no competitivo del receptor NMDA y la inhibición de la respuesta inflamatoria por reducción de las citoquinas proinflamatorias se considera que el magnesio limita la percepción y la duración del dolor.22
La utilización de los antagonistas del receptor NMDA ha demostrado su utilidad en la analgesia postoperatoria y, en este sentido, el sulfato de magnesio ha sido un coadyuvante que ha aportado excelentes resultados.23,24,25,26
En el presente artículo no se registraron incrementos significativos de la TAM y la FC en los dos grupos de estudio, lo que se explica por los niveles de las puntuaciones obtenidas en la EAV, las que fueron predominantemente bajas, lo que se traduce en un adecuado alivio del dolor postoperatorio en la cirugía proctológica y en un excelente control de la respuesta simpática desencadenada por el dolor.
La ketamina y el sulfato de magnesio en las dosis utilizadas en este estudio no producen efectos depresivos respiratorios, de ahí la estabilidad en el comportamiento de la SpO2.
La tolerancia a los opiáceos es un tema de controversia y los mecanismos moleculares implicados no han sido esclarecidos en su totalidad, aunque en este fenómeno se involucran diversos sistemas. Uno de los más acertados implica a los receptores NMDA y se ha sugerido que tanto la hiperalgesia consecutiva a una agresión tisular como la aparición de la tolerancia aguda a opiáceos implican la activación del receptor NMDA, lo que puede generar cambios en la neuroplasticidad del sistema nervioso central, englobados sobre el concepto de señalización central. Ambos fenómenos, hiperalgesia y tolerancia, comparten la activación de los mismos receptores, lo que implica que los antagonistas de los receptores NMDA como ketamina y sulfato de magnesio podrían prevenir estos fenómenos e intensificar la analgesia producida por opioides.27
En esta investigación no fue necesaria la utilización de opioides para el dolor postoperatorio y las dosis de analgesia de rescate fueron reducidas, lo que demostró la utilidad de los antagonistas de los receptores NMDA en la analgesia postoperatoria. Una investigación demuestra la disminución del consumo de analgésicos postoperatorios tras la administración perioperatoria de ketamina y ratifica su utilidad en la prevención del dolor crónico postquirúrgico.28
La incorporación del sulfato de magnesio al protocolo de tratamiento del dolor postoperatorio posibilitó la utilización de la mitad de la dosis de ketamina y, aunque sin diferencias estadísticas significativas, los resultados fueron más favorables en el grupo KS.
La combinación de ketamina y sulfato de magnesio puede describirse como una interacción sinérgica, en la que se alcanzaron los objetivos analgésicos con un comportamiento hemodinámico mejor y menor incidencia de efectos colaterales.
Los efectos adversos fueron escasos en ambos grupos y se considera que las dosis utilizadas y el modo de administración de los fármacos fueron factores determinantes en los resultados alcanzados.
El sulfato de magnesio, un antagonista no competitivo de los receptores NMDA, demostró ser un coadyuvante efectivo cuando fue utilizado junto a la ketamina en el alivio del dolor postoperatorio.
CONCLUSIONES
La ketamina como analgésico único y asociada al sulfato de magnesio demostró su utilidad en la analgesia postoperatoria de la cirugía proctológica y aportó una adecuada estabilidad hemodinámica y respiratoria, niveles adecuados de sedación, puntuaciones bajas en la EAV, poca necesidad de analgesia de rescate y escasos efectos adversos. La asociación ketamina-sulfato de magnesio aportó mejores resultados.