INTRODUCCIÓN
La COVID-19 es una enfermedad causada por un coronavirus tipo 2 (SARS-CoV-2) que fue declarada como pandemia en marzo de 2020, se extendió rápidamente al mundo y es de fácil propagación.1 La mayoría de las personas infectadas experimentan una enfermedad respiratoria de ligera a moderada; sin embargo, algunas enferman gravemente. Ha tenido un impacto desfavorable en la salud de las personas que transitan con enfermedades respiratorias graves, gran angustia asociada y otras complicaciones.2
La respuesta exacerbada del hospedero involucra una tormenta de citocinas en la COVID-19 severa2 como consecuencia de la entrada del virus SARS-CoV-2 en las células alveolares, en las que se infiltra un número considerable de neutrófilos3 que liberan mieloperoxidasa que, en presencia de Cl-, cataliza la generación de ácido hipocloroso (HOCl) a partir de peróxido de hidrógeno o agua oxigenada (H2O2) importante oxidante antimicrobiano como parte de la respuesta del sistema inmunológico.4
Una afectación significativa de la proliferación de HOCl es la función de la hemoglobina, que puede estar relacionada con la hipoxia observada en la COVID-19. Se ha informado que muchos pacientes con la COVID-19 tenían oxígeno periférico bajo.5
Por otro lado, la activación de neutrófilos se correlacionó con 17 genes asociados a las trampas extracelulares de neutrófilos (NET) en pacientes con la COVID-19.6 Cuando no se regulan adecuadamente, los NET tienen el potencial de propagar la inflamación y la trombosis microvascular incluso en los pulmones de pacientes con síndrome de dificultad respiratoria aguda.7 Relacionado con lo anterior se encontraron niveles elevados en el suero de pacientes con la COVID-19 de dos marcadores séricos de NET: la mieloperoxidasa (MPO)-ADN y la histona citrulinada. Estas NET son responsables del inicio y la acreción de eventos trombóticos en arterias, venas y, particularmente pertinente a la COVID-19, en la microvasculatura, en la que la enfermedad trombótica puede producirse e impulsar el daño de los órganos terminales en los pulmones, el corazón, los riñones y otros órganos.7
La enzima mieloperoxidasa juega un rol preponderante en la fisiopatología de la COVID-19. En el Departamento de Investigaciones Biomédicas de la Universidad de Ciencias Médicas de Villa Clara se aplica un método espectrofotométrico para determinar la actividad de la mieloperoxidasa y garantizar resultados confiables. Se hacen necesarios la implementación de una estrategia de validación8 y la estimación de los valores de referencia, dos de los aspectos fundamentales para evaluar los niveles de la esta enzima.
Se hace pertinente la aplicación de un protocolo de validación que permita demostrar la veracidad y la robustez del método enzimático para la estimación de la actividad de la mieloperoxidasa en una muestra de referencia. Estos parámetros serán útiles para su determinación en pacientes enfermos o en seguimiento de COVID-19 como una señal de alarma de su deterioro clínico.
MÉTODOS
Se realizó un estudio cuantitativo, descriptivo, transversal como parte de la estimación de los valores de referencia de la enzima mieloperoxidasa en una muestra de pacientes supuestamente sanos procedentes del Banco de Sangre Provincial de la Provincia de Villa Clara entre los meses de octubre de 2019 y marzo de 2020. La inclusión de los individuos de referencia se hizo de acuerdo con las normativas para la aceptación de donantes de esa institución.
Previamente se realizó la validación de un método analítico para determinar la actividad enzimática de mieloperoxidasa en muestras de suero o plasma sanguíneo humano; se tuvieron en cuenta las recomendaciones del Centro para el Control Estatal de Medicamentos, Equipos y Dispositivos Médicos (CECMED) y de otras autoridades en el tema.9,10,11,12,13,14
Se emplearon los siguientes reactivos:
Solución amortiguadora o tampón fosfato (KH2PO4, K2HPO4) 0,05 M; pH 6,0
Peroxidasa de rábano (siglas del inglés, HRP) (EC: 1.11.1.7): liofilizado comercial de HRP (BDH Chemicals Ltd; 820 U/mg): se pesa 6 mg y se reconstituye con tampón fosfato 0,05 M; pH 6,0 hasta 25 ml. La solución resultante tiene una actividad de 19,68 U/ml. Con ésta última se preparan los diferentes patrones con actividades asignadas de 0,125-2 U/ml.
Solución de o-DA (0,65 mM) tamponada con tampón fosfato 0,05 M; pH 6,0. Esta solución debe prepararse diariamente y deberá conservarse en frasco ámbar.
Solución tamponada de H2O2 (30 mM): para la titulación del peróxido del frasco originario se toman 40 µl de H2O2 (30%) y disolver hasta 25 ml con tampón fosfato 0,05 M, pH 6,0. Calcular la concentración molar por método espectrofotométrico a 240 nm. A partir de este resultado preparar una solución stock de H2O2 a 30 mM. Mantener los frascos con tapa. Debido a la inestabilidad del H2O2 este procedimiento debe repetirse de un día a otro.
La obtención de la muestra de sangre la realiza el técnico del banco de sangre. De los plasmas remanentes de los donantes, posterior a los exámenes que se les realiza, se toman una alícuota de 1ml y se almacena a -70°C hasta su posterior análisis.15 Estas muestras estaban libres de hemólisis, lipemia e íctero.
El método analítico empleado para la determinación de mieloperoxidasa fue el de Graff y colaboradores (1998),16 con ligeras modificaciones. Es un ensayo cinético continuo que utiliza como sustrato peróxido de hidrógeno (30 mM) y o-dianisidina (0,65 mmol/l), ambos en tampón fosfato 0,05 M; pH 6,0. Se basa en la oxidación de la o-dianisidina mediada la reducción del peróxido de hidrógeno, que forma un compuesto de color pardo con intensidad acorde a la actividad enzimática de la muestra. Para la determinación de la actividad se toman 100 µl de suero y se añade a 2 850 µl de la solución de o-dianisidina tamponada y seguidamente 50 µl de H2O2 (30 mM). Se lee en el espectrofotómetro a 460 nm a tiempo cero y tres minutos contra blanco de agua. Para la estandarización de la actividad mieloperoxidasa en unidades internacionales se requiere previamente realizar una curva patrón de peroxidasa de rábano picante (HRP) liofilizada, en iguales condiciones del ensayo, pero sustituyendo la muestra de plasma por el patrón enzimático. Las muestras de referencia se procesan de igual modo. La actividad enzimática se expresó en μmoles de peróxido/min/ml de suero, lo que equivale a U/ml.
La curva patrón de peroxidasa de rábano (HRP) fue realizada por triplicado en el rango de actividades entre 0,125 y 2kU/l.
Evaluación de parámetros del desempeño de la técnica
Para los estudios de linealidad se realizaron tres curvas de calibración en tres días diferentes. Teniendo en cuenta todos los valores experimentales se determinó el valor promedio de cada punto y se trazó la curva de mejor ajuste. Se hallaron los coeficientes de correlación y de determinación, así como la homogeneidad de varianzas y el coeficiente de variación de los factores de respuesta (CVf). Se evaluaron también la varianza de la pendiente de la línea de regresión, la desviación estándar, la desviación estándar relativa, los límites de confianza de la pendiente y el grado de significación y se verificó la proporcionalidad.
Además, se calculó el límite de detección mediante la realización de réplicas de un blanco del tampón mediante la expresión (a+3S1), que es el promedio de las absorbancias obtenidas por el blanco y S1=√Sx/y.2 El valor obtenido se expresó en concentración a través de la ecuación de la recta. De modo similar se halló el límite de cuantificación, pero mediante la expresión: (a+10S1).
Para los estudios de precisión se mezclaron varias alícuotas de suero sanguíneo de pacientes supuestamente sanos.17 Esta mezcla se dispensarizó en alícuotas de 1,5ml que se almacenaron a -70°C, a partir de las que se calcularon: la repetibilidad (CVr%), la reproducibilidad intermedia (CVRi%) y la reproducibilidad (CVR%), esta última de forma teórica por Horwitz: CV Teo %= 2 (1−0,5logC) ; donde C (valor de concentración media de todos los días).
Para analizar la veracidad se determinó la recuperación mediante la siguiente expresión:
/
Donde:
Valorverdadero (valor de concentración supuestamente real)
Valorexperimental (valor de concentración calculado mediante la ecuación de la recta con la absorbancia obtenida en ese punto).
La selección de los individuos de referencia y los procedimientos bioestadísticos se llevaron a cabo según las recomendaciones de la Federación Internacional de Química Clínica (IFCC), adoptadas de igual manera por la Asociación Americana de Química Clínica (AACC) y la Sociedad Española de Química Clínica y Biología Molecular (SEQC).18
Para los cálculos y el análisis estadístico se utilizó el programa Microsoft® Office Excel 2013.
RESULTADOS
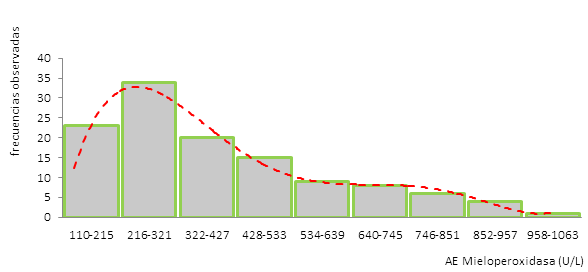
El ensayo de la actividad enzimática a las concentraciones ensayadas se ajustó a un modelo lineal con una R2=0,9948 (Figura 1).
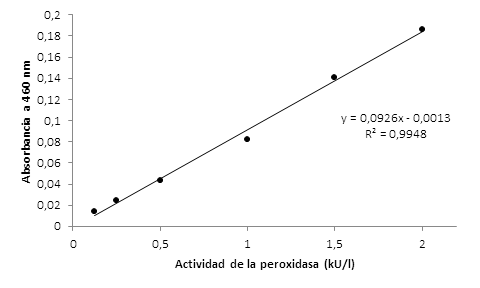
Figura 1 Curva de calibración de mieloperoxidasa para niveles de actividad comprendidos entre 0,125 y 2 kU/l (125U/l y 2 000 U/l, respectivamente)
Se obtienen los siguientes parámetros de linealidad:
Coeficiente de correlación: 0,9973
Coeficiente de determinación: 0,9948
Análisis de varianza mediante la prueba de homogeneidad de Cochran: Gexp=0,232
Prueba de linealidad mediante el coeficiente de variación de los factores respuesta (CVf ) fue de 3,51%; la desviación estándar de la pendiente (Sb) de 2,42.10-5 y la desviación estándar relativa (Sb rel.%) fue igual a 0,97%
Los límites de confianza se encontraron entre 0,0917 y 0,0921 para ttab= 2,447; con n-2 grados de libertad y α= 0,05; además, la texp fue de 103,207
Prueba de proporcionalidad, mediante el cálculo de los límites de confianza del intercepto (a) se encontraron entre -0,0024 y 0,0002, para ttab= 2,447 (n-2; α= 0,05). Se obtuvo, además, una texp= 0,44.
Por lo anterior se establece como intervalo de linealidad entre 0,125 y 2,000 kU/l (125 U/l y 2 000 U/l, respectivamente), según el sistema analítico empleado.
Los límites de detección y cuantificación fueron 9 U/l y 30 U/l, respectivamente.
En el estudio de precisión los coeficientes de variación indicaron una repetibilidad de 2,30%, una reproducibilidad intermedia de 3,56% y una reproducibilidad de 6,09%. El por ciento de recobrado fue de 98,62%.
La muestra de referencia quedó conformada por 123 individuos supuestamente sanos, con edades comprendidas entre 18 y 65 años (Figura 2).
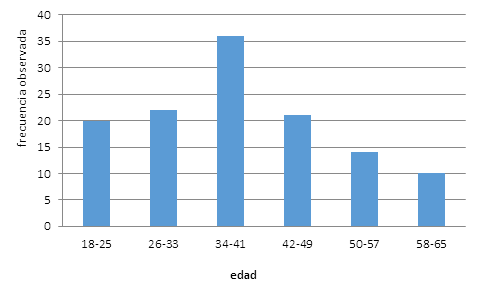
Fuente: datos de la investigación aportados por el Banco de Sangre Provincial de Villa Clara
Figura 2 Distribución de frecuencia de los grupos etáreos incluidos en el grupo de referencia
Se obtuvieron valores de referencia para la población estudiada en el rango entre 110-960 U/l (Figura 3).
DISCUSIÓN
Para la implementación de un método en el laboratorio es esencial el análisis de la respuesta físico-química que se mide respecto al analito que se cuantifica. La linealidad obtenida en la curva de calibración de la mieloperoxidasa (Figura 1) se corrobora con la obtención de un coeficiente de correlación superior a 0,990 y un coeficiente de determinación que supera el valor 0,98, por lo que existe una correlación positiva entre la concentración y la absorbancia, superior al 99,7%.19,20,21
Lo anterior se corresponde con el análisis de varianza en el que la Gexp<Gtab, para una Gtab= 0,515. Esto se significa que las varianzas de las concentraciones son homogéneas, es decir, el factor concentración no influyó en la variabilidad de los resultados en el rango de actividades enzimáticas entre 0,125 y 2,00 mU/l, criterio que refuerza la linealidad del método.19,20,21
La validación del método demuestra su eficacia con respecto a las condiciones óptimas escogidas y demuestra que puede ser empleado con seguridad porque cumple con los requisitos de calidad.19,20,21
La prueba de linealidad permitió corroborar estadísticamente la evaluación visual de la curva de calibración; así, el CVf inferior al 5% fue indicativo de que existe linealidad en los datos obtenidos. Para la pendiente de la recta se obtuvieron parámetros en el rango de lo normado: Sb rel.%≤2% y los límites de confianza para texp entre 0,0917 y 0,0921 (sin incluir el cero); así como una texp>ttab, lo que se corresponde con una probabilidad de que b sea diferente de cero, superior al 95%.19,20,21
Hasta este nivel la linealidad del método enmarca un amplio rango de actividades enzimáticas, lo que es utilitario desde el punto de vista práctico porque no requiere hacer diluciones de muestras de modo frecuente.
La prueba de proporcionalidad también fue favorable porque los límites de confianza del intercepto (a) incluyeron al valor cero, lo que se corrobora con el cálculo del estadígrafo t, donde la ttab fue mayor a la texp, condición para que se aceptara la hipótesis nula H0: a=0. Se puede aseverar que los parámetros calculados para evaluar la calidad de la regresión cumplieron con los criterios de aceptación correspondientes, lo que indicó que la curva de calibración de mieloperoxidasa es lineal en el intervalo de concentraciones estudiado.19,20,21
El hallazgo experimental de límites de detección y cuantificación de 9 U/l y 30 U/l, respectivamente, redimensionan la linealidad del método desde 30-2000 U/l. De esta manera, valores inferiores a 30 U/l deben informarse como <30 U/l y en los valores que sobrepasen el rango informado debe repetirse el ensayo, pero a partir de diluciones de la muestra de suero originaria, con el diluyente adecuado, bien solución salina al 0,9% o la solución tampón.
En el estudio de precisión se obtuvieron valores de repetibilidad, reproducibilidad intermedia y reproducibilidad en correspondencia con los supuestos teóricos: CVr%<CVRi%<CVR%.19,20,21
De acuerdo con el resultado promedio de recuperación se puede afirmar que el método es veraz porque el por ciento de recobrado obtenido de 98,62% se encontró entre el 98 y el 102%. Es importante resaltar que se realizaron ensayos de recuperación porque no se tienen muestras certificadas en las que se refiera la actividad de la mieloperoxidasa.
La validación del método demuestra su eficacia con respecto a las condiciones óptimas escogidas y demuestra que puede ser empleado con seguridad porque cumple con los requisitos de calidad.19,20,21
La distribución asimétrica de los valores de actividad enzimática de la mieloperoxidasa en los individuos del grupo de referencia (Figura 3) orienta hacia el cálculo de los valores de referencia mediante el empleo de métodos no paramétricos, por lo que se empleó la determinación de los límites interfractílicos inferior y superior entre los percentiles 2,5 y 97,5, respectivamente.
La estimación de la mieloperoxidasa es muy importante en la evaluación de la sepsis, lo que está en correspondencia con informes que confirmaron la factibilidad de su uso, incluso para evaluar sus complicaciones. Una investigación en un grupo de conejos infectados con Lagovirus europaeus/GI.1ª, un organismo patógeno que causa gran mortalidad en breve tiempo, revelaron cifras entre 1 070 y 2 340 U/l, mientras que el grupo control tuvo actividades enzimáticas entre 1 010 y 1 270 U/l, pero emplearon como cromógeno bencidina en lugar de o-dianisidina.22 Esto concuerda con el hecho de que la mieloperoxidasa sea considerada una enzima marcadora de sepsis y predictora de mortalidad, como plantean Schrjver y colaboradores.23
Un estudio realizado en mujeres informó un grupo control con niveles de mieloperoxidasa (121,5±36,3 U/l) que coinciden con una zona de la presente investigación (de 110 a 215 U/l), en la que se enmarca una alta frecuencia de valores.24
Otro estudio refiere actividades mieloperoxidásicas del grupo control entre 34 y 324 U/l, con edades que circundan los 37 años como promedio, correspondiente con el mayor grupo etáreo (de 34 a 41 años) (Figura 2).25
Estos resultados son importantes para evaluar los niveles enzimáticos de mieloperoxidasa en pacientes que transitan con desbalance en los radicales libres y el consecuente estrés oxidativo, además de ser un excelente biomarcador de procesos inflamatorios, eventos que se manifiestan en pacientes con COVID-19.26
La formación de NET, en la que la MPO tiene un papel importante, ha aparecido en numerosos informes de enfermedades y morbilidades. Se observó formación de NET y complemento (C3, C5) en pacientes con COVID-19 y se asoció con la gravedad de la enfermedad. Los niveles de MPO-DNA fueron significativamente más altos en los casos graves de COVID-19 que en los leves.27 Un estudio que investigó los mecanismos de trombosis en pacientes con COVID-19 informó una mayor formación de NET circulantes en estos pacientes, incluido un aumento de los complejos MPO-ADN (MPO asociada con NET).28 Como catalizador de eventos trombóticos en COVID-19 se informó que los NET son una interacción entre plaquetas y neutrófilos en esta enfermedad.29
Los NET pueden ser desencadenados por citocinas, plaquetas, óxido nítrico y peroxinitrito, inductores de NET como IL-6 and TNFα.29
Cuando se emplea un ensayo de laboratorio en apoyo al diagnóstico médico es importante la determinación de los valores de referencia que incluyan pacientes de la población en los que se aplicará el mencionado ensayo; la llamada población de referencia. Cuando se evalúa un paciente enfermo cualquier resultado fuera del rango de referencia puede considerarse como alterado.30
CONCLUSIONES
La determinación de mieloperoxidasa es muy oportuna desde el punto de vista clínico por el vínculo de parámetros inmunológicos e inflamatorios que caracterizan a la COVID-19: la tormenta de citoquinas, la generación de trampas extracelulares de neutrófilos y la liberación consecuente de la enzima. Se obtiene un intervalo de valores de referencia muy útil para la evaluación de la mieloperoxidasa durante la enfermedad o como biomarcador pronóstico de gravedad, en el que la validación analítica del procedimiento experimental debe cumplir con los requisitos de calidad.