INTRODUCCIÓN
El carcinoma de células renales (CCR) es un tumor que surge de las células del túbulo renal. Hasta hace poco se consideraba una neoplasia poco frecuente, pero en las últimas décadas su incidencia ha experimentado un incremento llamativo.1,2
El cáncer de riñón suma un 80 a un 85% de los tumores malignos renales, es el más agresivo de los cánceres urológicos y supone, además, el 3% de los tumores del adulto.3 La proporción por sexos se sitúa en 1,5 varones por cada mujer y por edades su máxima incidencia se encuentra entre los 50 y los 70 años.4,5 De forma global, el CCR representa la sexta causa de muerte por cáncer y se estima que es la causa de 95 000 decesos por año en el mundo.6 La tasa de supervivencia general en cinco años varía de 34 a 71%.7,8 En las últimas cinco décadas se ha apreciado un constante incremento de su incidencia, que está en torno a un dos y un 4% por año.3 Diversos factores pueden explicar este fenómeno: la mejora de las técnicas de imagen con la incorporación y la accesibilidad de la ecografía y la tomografía axial computadorizada o la resonancia magnética nuclear que facilitan una detección más temprana del tumor. Con esas herramientas el hallazgo fortuito de un CCR en pacientes asintomáticos ha pasado de un 13% durante la década de 1970 a un 60% en la de los años 1990.9 Muchos de esos casos asintomáticos se diagnostican con enfermedad localizada, pero otros se detectan con enfermedad avanzada, lo que hace suponer que hay factores ambientales adicionales que influyen en el aumento de su incidencia.10,11
En el pasado las opciones de tratamiento para el CCR han sido extremadamente limitadas. La cirugía radical supone el único tratamiento eficaz potencialmente curativo del cáncer de riñón localizado.12,13 También está indicada en estadios regionalmente más avanzados; por ejemplo, en los tumores que invaden la vena cava o que presentan mínima enfermedad adenopática.14,15
La mayoría de los tipos de cáncer de riñón son resistentes a la quimioterapia. En algunos pacientes la combinación de gemcitabina con capecitabina o fluorouracilo reduce temporalmente el tamaño del tumor.16,17 La radioterapia no es efectiva como tratamiento primario del cáncer de riñón y rara vez se la utiliza sola debido al daño que le produce al riñón sano, solo se emplea en un paciente que no puede someterse a la intervención quirúrgica e, incluso, en esas circunstancias suele utilizarse solamente en áreas por las que el cáncer se ha diseminado, no en el tumor primario del riñón.18
En las formas avanzadas de la enfermedad (estadios III y IV según la Sociedad de Cáncer Americana, 2019) se prefiere la nefrectomía radical. La nefrectomía parcial no suele ser adecuada, aunque en pacientes seleccionados podría llevarse a cabo si es factible. Una vez realizada la intervención quirúrgica en muchos pacientes con CCR localizado no está establecido un tratamiento adyuvante; sin embargo, los enfermos en los que el cáncer se encuentra en estadio III, con histología de células claras y con alto riesgo de desarrollar recidivas, se puede administrar alguna terapia diana como tratamiento adyuvante durante un año con el fin de disminuir el riesgo de que recurrencia. En el estadio IV disminuye, en gran medida, la tasa de supervivencia, y la enfermedad es incurable en muchos casos, por lo que el tratamiento se basa, principalmente, en prolongar la vida del paciente, así como en mejorar su calidad.
El objetivo principal de este estudio es ofrecer una actualización sobre el tratamiento farmacológico actual en pacientes con cáncer renal avanzado, en especial en el tratamiento que se administra a pacientes con enfermedad metastásica. Debido a que los tratamientos utilizados en los estadios avanzados no suelen ser curativos, se pretende informar sobre los nuevos tratamientos que actualmente se encuentran en fase clínica de experimentación para pacientes con este tipo de cáncer.
MÉTODOS
Para la realización de la presente actualización se priorizaron los artículos publicados entre los años 2018 y 2021, excepto uno de 2017 que se incluyó por su importancia. Se revisaron artículos en los idiomas español, inglés, francés, alemán y portugués. La revisión de la literatura se ejecutó con los siguientes descriptores: cáncer renal, inmunoterapia y terapia dirigida. Se realizó una búsqueda en las bases de datos Medline, Web of Science, LILACS y la Biblioteca Cochrane hasta febrero de 2022; además en fuentes de literatura gris (registros de ensayos clínicos y conferencias de cáncer). Se identificaron 117 artículos que fueron seleccionados con el propósito de conservar solo los que describieran mejor los elementos de la revisión, en idiomas español e inglés. De esta manera el estudio se circunscribió a 37 artículos: 17 artículos originales, ocho artículos de revisión, seis páginas web, tres tesis doctorales, dos informes de caso y una tesis de especialidad.
DESARROLLO
La quimioterapia convencional (cisplatino, metotrexato, melfalán, ciclofosfamida, etc.) puede producir lesiones renales como necrosis tubular aguda y microangiopatía trombótica, entre otras. Existen otras opciones terapéuticas que se dirigen a una diana concreta (targeted therapy). Este tratamiento se enfoca en moléculas que son esenciales para la supervivencia de las células cancerígenas. Su principal ventaja es la selectividad dela diana terapéutica, lo que la diferencia de la quimioterapia y la radioterapia porque no afectan al tejido sano circundante, lo que reduce significativamente el riesgo de que se produzcan eventos adversos.
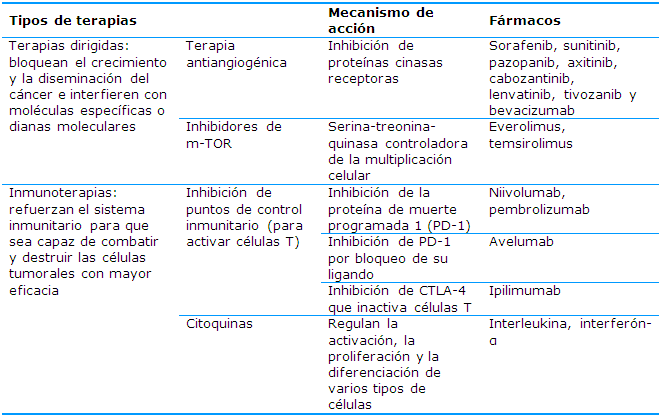
En la Tabla 1 se recogen estas variantes terapéuticas, los fármacos que se emplean para lograr respuesta y su mecanismo de acción de forma simple. Después de descubrirse que los inhibidores de puntos de control y las terapias antiangiogénicas dirigidas mejoraban los desenlaces se estudió, en ensayos clínicos, la combinación de estos dos abordajes y se demostró que producen una supervivencia global más prolongada en comparación con la monoterapia.
Terapias dirigidas
Es una de las principales modalidades de tratamiento médico para el cáncer. Como una forma de medicina molecular es dirigida por bloques de terapia en el crecimiento de las células cancerosas al interferir con moléculas dirigidas específicas necesarias para la carcinogénesis y el crecimiento tumoral, en lugar de simplemente interferir con todas las células que se dividen rápidamente (por ejemplo, con la quimioterapia tradicional).
A.1. Terapiaantiangiogénica:
Los fármacos antiangiogénicos son la base fundamental del tratamiento del CCR avanzado y su empleo en los últimos años ha aumentado las medianas de supervivencia. Su mecanismo de acción se basa en detener el proceso de angiogénesis, es decir, el proceso de formación de nuevos vasos sanguíneos a partir de capilares preexistentes. El gen más comúnmente mutado en el CCR es el gen VHL,19 esta mutación hace que se produzca una cantidad excesiva de factor de crecimiento del endotelio vascular (VEGF). La unión del VEGF con sus receptores (VEGFR), de tipo tirosina cinasa, activa diversas vías de señalización intracelular que conducen a la activación de algunos procesos celulares como la angiogénesis y la proliferación celular, entre otros.20 El aumento en la producción de VEGF lleva a la neoformación de vasos sanguíneos, lo que se ha demostrado imprescindible para la proliferación tumoral. Los fármacos inhibidores de la angiogénesis pueden bloquear el VEFG y, por tanto, el proceso de angiogénesis de dos formas:
Inhibiendo proteínas cinasas receptoras como el VEGFR, el receptor del factor de crecimiento de fibroblastos (FGFR) o el receptor del factor de crecimiento de hepatocitos (MET). Los fármacos aprobados con esta función son: sorafenib, sunitinib, pazopanib, axitinib, cabozantinib, lenvatinib y tivozanib.
Mediante el uso de un anticuerpo monoclonal, en este caso solo está aprobado un fármaco: bevacizumab.20,21
El modo de acción de estas terapias se muestra esquemáticamente en la Figura 1.
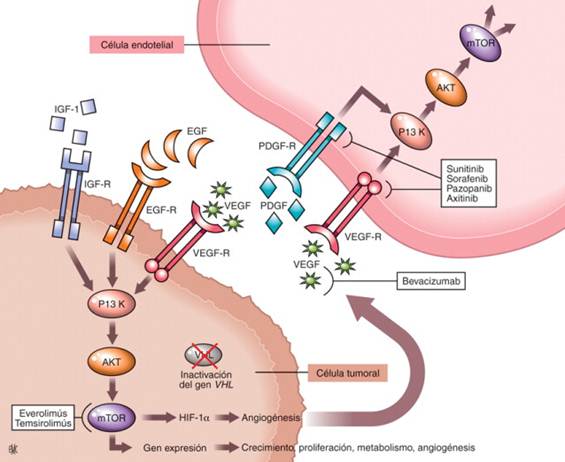
Figura 1 Modo de acción de las terapias dirigidas a las vías moleculares principales de carcinogénesis del carcinoma de células renales (de células claras): la vía VHL/factor inducible por hipoxia (HIF)/factor de crecimiento endotelial vascular (VEGF), y fosfoinositol 3-cinasa (PI3K)/proteína cinasa B (AKT)/diana de rapamicina en células de mamífero (mTOR).22
Sorafenib: inhibidor multicinasa con actividad tanto antiangiogénica como antiproliferativa. Fue el primer inhibidor tirosin quinasa del VEGF en obtener la aprobación de la Food and Drug Administration (FDA) en 2005. Está indicado en el tratamiento de pacientes con CCR avanzado en los que el tratamiento previo con interferón-α o interleukina-2 ha fracasado o los que se consideran inapropiados para este tratamiento. Los efectos adversos más comunes de este fármaco son cansancio, diarrea, aumento de la presión arterial, irritaciones de la piel y síndrome de pies y manos (dolor, hinchazón, enrojecimiento y ampollas en las manos y los pies).23
Sunitinib: inhibidor multicinasa dirigido a varios receptores de tirosina cinasas. Inhibe la angiogénesis y la proliferación celular, lo que explica su actividad antitumoral.23 Fue aprobado en 2006 en Estados Unidos. Está indicado como tratamiento de primera línea en pacientes adultos con CCR metastásico y en todos los grupos de riesgo pronóstico. También ha demostrado actividad antitumoral sustancial en la terapia de segunda línea del CCR metastásico tras la progresión en la terapia con citosinas.24 Entre los efectos adversos más comunes que produce sunitinib se incluyen náuseas, diarrea, úlceras en la boca, cambios de color del cabello o la piel, debilidad, bajos niveles de glóbulos blancos y rojos y síndrome de pies y manos.23
Pazopanib: mecanismo de acción similar al sunitinib. Está indicado en el tratamiento de primera línea del CCR metastásico en pacientes de cualquiera de los tres grupos de riesgo pronóstico. Algunos ensayos clínicos realizados también aseguran la eficacia de pazopanib en el tratamiento de segunda línea del CCR metastásico tras tratamiento previo con citosinas.24 Tanto el pazopanib como el sunitinibson actualmente los tratamientos más comúnmente utilizados en pacientes con un pronóstico intermedio o bueno.25 Algunos de los efectos secundarios más comunes de pazopanib son hipertensión arterial, náuseas, diarrea, dolor de cabeza, problemas hepáticos y alteraciones en la coagulación y la curación de heridas.23
Axitinib: es un inhibidor potente y selectivo de los receptores del VEGF. Inhibe la supervivencia y la proliferación celular de las células endoteliales mediada por VEGF. Está indicado para el tratamiento de primera línea del CCR avanzado para su uso en determinadas circunstancias en pacientes de cualquier grupo de riesgo pronóstico y para el tratamiento de segunda línea tras fracaso de un tratamiento previo con sunitinib o citosinas.24 Como terapia de segunda línea el tratamiento con axitinib ha demostrado claramente superioridad clínica frente a sorafenib.23,26 Algunos efectos secundarios comunes de axitinib son hipertensión arterial, cansancio, náuseas, vómitos, diarrea, poco apetito, pérdida de peso, síndrome de pies y manos y estreñimiento. Es posible que también provoque que la glándula de tiroides se vuelva hipofuncionante.23
Cabozantinib: es una molécula pequeña que inhibe múltiples receptores tirosincinasa implicados en la angiogénesis, el crecimiento tumoral y la progresión metastásica del cáncer. Inhibe los receptores de MET y VEGF, entre otros. Está indicado para el tratamiento de primera línea del CCR metastásico en adultos de cualquier grupo de riesgo pronóstico y para el tratamiento de segunda línea después del tratamiento con una terapia dirigida al VEGF.24 Los efectos adversos comunes incluyen diarrea, cansancio, náuseas, vómitos, hipertensión arterial, síndrome de pies y manos, estreñimiento, falta de apetito y pérdida de peso.23
Lenvatinib: este fármaco también es un inhibidor de los receptores tirosina cinasa. Inhibe selectivamente la actividad de los receptores del VEGF, además de otros como son los FGFR y el receptor del factor de crecimiento derivado de las plaquetas (PDGF), también relacionado con las vías oncogénicas y proangiogénicas. Está indicado en combinación con everolimus como tratamiento de segunda línea en adultos con CCR avanzado.24 Levantinib presenta como efectos adversos comunes: diarrea, cansancio, náuseas y vómitos, úlceras en la boca, hipertensión arterial, pérdida de apetito y de peso, dolor en articulaciones y músculos e hinchazón en los brazos o piernas.23
Tivozanib: bloquea de forma potente los tres receptores del VEGF, lo que permite su actividad antiangiogénica y antitumoral. Ha sido aprobado por la Agencia Europea de Medicamentos (EMA, por sus siglas inglés) para el tratamiento de primera línea en adultos con CCR avanzado. También está indicado para el tratamiento de segunda línea tras la progresión del cáncer después de un tratamiento con citosinas.24 Se ha demostrado que tivozanib mejora la supervivencia libre de progresión (SLP) y la tasa de respuesta frente a sorafenib, especialmente en pacientes del grupo de pronóstico bueno.25,27 Las reacciones adversas más frecuentes incluyen hipertensión, disfonía, cansancio y diarrea.23
Bevacizumab: a diferencia de todos los anteriores, bevacizumab es un anticuerpo monoclonal. Su mecanismo de acción consiste en unirse a la proteína VEGF circulante y neutralizarla. Esta neutralización produce una regresión de la vascularización de los tumores, normaliza la vasculatura residual del tumor e inhibe la neovascularización tumoral; de esta forma, el crecimiento tumoral queda inhibido.28 Actualmente la única combinación aprobada es bevacizumab+interferón-α.29 Entre los efectos secundarios que produce bevacizumab se incluyen hipertensión arterial, cansancio y dolores de cabeza.23
El tratamiento con inhibidores de receptor de proteínas cinasas ha experimentado un auge en los últimos veinte años, al margen de consideraciones de seguridad para los pacientes. Si bien los resultados de efecto (supervivencia y respuesta objetiva) son favorables y están avalados por muchos estudios clínicos, los eventos adversos no son de despreciar y suceden para todas las opciones terapéuticas descritas, lo que conlleva a ajustes frecuentes de dosis o interrupciones de los tratamientos. Los ensayos clínicos en curso con estas terapias diana empleadas como monoterapia son pocos (Tabla 2) y no se auguran nuevos fármacos con estos mecanismos de acción para el carcinoma renal.
A.2. Inhibidores de mTOR
La proteína mTOR es una serina-treonina-quinasa con actividad desregulada en algunos cánceres humanos y es más activa en algunos tipos de células cancerosas que en las células sanas. Esta proteína ayuda a controlar ciertas funciones celulares, entre ellas la multiplicación celular. Su inhibición permite bloquear la proliferación tumoral.27
Everolimus: este fármaco se une a la proteína intracelular FKBP-12 y forma un complejo que inhibe a mTOR, lo que reduce la actividad de varias proteínas implicadas en el ciclo celular, la angiogénesis y la glucólisis. Everolimus es un potente inhibidor de la proliferación de las células tumorales y, además, ha demostrado que reduce la glicolisis en tumores sólidos. Está indicado como tratamiento de segunda línea del CCR avanzado, después del tratamiento con otros medicamentos como sunitinib o sorafenib.23,24 Entre los efectos secundarios más frecuentes se encuentran un mayor riesgo de infecciones, náuseas, aumento de los niveles de colesterol y azúcar en sangre, diarrea, cansancio y acumulación de líquido.23
Temsirolimus: el mecanismo de acción de este fármaco es similar al de everolimus. Se utiliza para el tratamiento de primera línea del CCR avanzado en pacientes con al menos tres factores de riesgo pronóstico. Los efectos secundarios más comunes de este fármaco son muy similares a los que provoca everolimus.23
Los autores señalan que se encuentra en curso un único ensayo clínico que involucre un inhibidor de mTOR, en este caso con everolimus, lo que evidencia que el interés en estas opciones terapéuticas decae. Este hecho parece deberse a la aparición de opciones más recientes, con mejor perfil de seguridad y evidencias de efecto terapéutico.
Inmunoterapias
Las células cancerosas son reconocidas por las células del sistema inmunitario como extrañas y desencadenan lo que se conoce como respuesta inmunitaria con el fin de destruirlas; sin embargo, en el cáncer renal, es frecuente que el control por parte del sistema inmune de la generación y la proliferación de los tumores esté desregulado. Estas terapias pueden ser muy útiles porque se basan en el uso de medicamentos que refuerzan el sistema inmunitario.21,23 Existen varias formas de conseguir este objetivo utilizando inhibidores de los puntos de control inmunitario o inmune checkpoint inhibitors (ICIs) ocitocinas.
B.1. Inhibición de puntos de control inmunitario
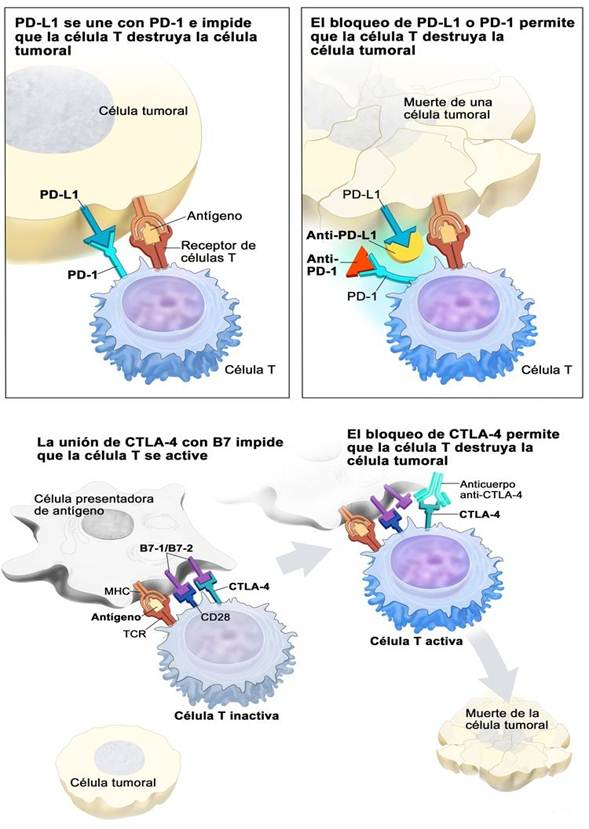
Los puntos de control inmunitario son proteínas que se encuentran en la superficie de las células y controlan la respuesta inmunitaria desactivando las células T hasta que sean necesarias para que no ataquen a las células normales; sin embargo, las células cancerosas pueden utilizar estos puntos de control para evitar ser atacadas por el sistema inmunitario. Los ICIs son medicamentos que bloquean los puntos de control inmunitario y consiguen que las células T no se desactiven y puedan atacar a las células cancerosas;27 sin embargo, la acción de los ICIs puede provocar que el sistema inmunitario ataque también a otras células y genere efectos adversos que podrían llegar a ser graves.23 Un esquema del mecanismo de acción de estos fármacos se muestra en la Figura 2.
Nivolumab: es un inhibidor de PD-1, se une a PD-1 y bloquea su interacción con PD-L1. La interacción de PD-1 con su ligando provoca la inhibición de la proliferación de las células T y de la secreción de citocinas. Por esta razón la inhibición de esta interacción potencia las respuestas de las células T, que atacarán a las células tumorales. Se incluye a nivolumab como una opción de tratamiento de segunda línea del CCR avanzado.31 Recientemente se ha aprobado la combinación nivolumab/ipilimumab como tratamiento de primera línea preferido en pacientes con CCR avanzado de los grupos de pronóstico intermedio y malo. Con respecto a la utilización de la combinación nivolumab/ipilimumab en la segunda línea de tratamiento se ha demostrado que esta combinación es segura y ofrece una respuesta duradera en pacientes con CCR avanzado de cualquier grupo de riesgo pronóstico.32
Pembrolizumab: también es un inhibidor de PD-1, recientemente se han obtenido resultados de la combinación pembrolizumab/axitinib frente a sunitinib. Se ha podido observar que la supervivencia sin progresión de la enfermedad y la tasa de respuesta eran superiores al administrar la combinación en cualquiera de los tres grupos de riesgo pronóstico. Se ha aprobado el uso de pembrolizumab/axitinib como terapia de primera línea del CCR.33
Avelumab: es un inhibidor de PD-L1 y bloquea la interacción entre PD-1 y su ligando PD-L1, pero los hacen uniéndose a PD-L1 en lugar de a PD-1. Se utiliza en combinación con axitinib en el tratamiento de primera línea y algunos de los efectos adversos que produce la combinación con más frecuencia son cansancio, diarrea, hipertensión arterial, tos, respiración entrecortada y dolor abdominal.34
Ipilimumab: es un inhibidor de CTLA-4 (CTLA-4 es una proteína de la superficie de las células T que se une a otra proteína que recibe el nombre de proteína B7). Esta unión provoca que las células T se mantengan inactivas y que no ataquen a las células cancerosas. Los inhibidores de CTLA-4 se unen a CTLA-4 y bloquean esta unión, activando las células T, que destruirán las células cancerosas. Este anticuerpo monoclonal se administra en combinación con nivolumab.31 Algunos de sus efectos adversos más comunes son diarrea, picor, cansancio o erupciones en la piel.23
En la última década el desarrollo de inhibidores de puntos de control ha revolucionado el tratamiento de los pacientes con carcinoma de células renales avanzado, se posicionan como una indicación de primera línea y se valora su asociación a otras terapias dirigidas, lo que conllevaría a posibles cambios en el escenario terapéutico. Sería conveniente realizar estratificaciones de riesgo en los pacientes con cáncer renal avanzado, tributarios de tratamientos monoterapia o combinaciones de fármacos, para proponer terapias personalizadas que permitan un mejor manejo individual.
B.2. Citocinas
Las citocinas son proteínas que regulan y coordinan el comportamiento del sistema inmunitario. Son capaces de mejorar la actividad antitumoral, por lo que se utilizan para tratar cáncer. La interleucina-2 y el interferón-α son ejemplos de citocinas utilizadas en la inmunoterapia. Las citocinas como interferón-α e interleucina-2 (Il-2) en dosis altas han demostrado tener eficacia clínica desde los años noventa para tratar el CCR metastásico; sin embargo, ambos fármacos ofrecen beneficios a un reducido grupo de pacientes (los que tienen una biología favorable de la enfermedad) y, además, están asociados con una elevada toxicidad, sobre todo en el caso de Il-2 en dosis altas.20 Actualmente su uso ha sido desplazado por nuevos tratamientos con mayor eficacia y menor toxicidad.
Interleucina-2: es una citocina elaborada por los linfocitos T y su uso en altas dosis había sido el pilar de la terapia para el CCR metastásico hasta la aparición de los inhibidores del VEGF en 2005.35 Actualmente se administra mediante vía intravenosa a pacientes altamente seleccionados en centros que tienen experiencia con este tipo de tratamiento.24,27 Las altas dosis de Il-2 producen gran cantidad de efectos secundarios: cansancio extremo, presión arterial baja, acumulación de líquido en los pulmones, dificultad para respirar, ataques cardíacos, daño al riñón, sangrado intestinal, cambios mentales, fiebre alta y escalofríos, entre otros.23
Interferón-α: los IFNs fueron los primeros reguladores endógenos con una demostrada acción anti-angiogénica. Los IFNs tipo I regulan negativamente la expresión de moléculas pro-angiogénicas tales como el factor de crecimiento de fibroblastos (bFGF), las interleuquinas (IL)-8 y las matrix metaloproteinasas (MMP)-2 y MMP-9.36,37 El IFN-( bloquea la división de los monocitos promovida por CSF-1,inhibe la traducción de la señal mediada por PDGF en los fibroblastos y reduce la expresión de EGFR y la expresión de VEGF.38,39 Actualmente se utiliza en el tratamiento de primera línea del CCR avanzado en combinación con bevacizumab.24
La terapia con citocinas fue iniciada hace más de 20 años y es el único tratamiento disponible hasta 2005; despertó muchas esperanzas y alcanzó respuestas objetivas en alrededor del 20% de los pacientes con metástasis, pero su tasa de respuesta objetiva es baja. Las investigaciones con estos productos son prácticamente inexistentes, aunque los autores consideran que deberían retomarse debido a los costos elevados de otras terapias y a evidencias de que los resultados obtenidos en investigaciones clínicas a menudo no se corresponden con los que se generan en la práctica médica habitual. Una variante sería la politerapia con algunos de los fármacos detallados anteriormente.
Investigaciones clínicas
Es notable la cantidad de ensayos clínicos que se encuentran en ejecución para tratar el CCR avanzado, en especial con numerosas combinaciones de fármacos. La Tabla 2 muestra algunos ejemplos con medicamentos ya descritos.27
Cuando se concluyan estas investigaciones se habrá conformado un nuevo escenario para el tratamiento del cáncer renal avanzado o metastásico, quizás un paso más cerca de la medicina personalizada tan añorada por los pacientes; no obstante, hay que considerar los precios, en ocasiones privativos, de estas variantes farmacológicas.
Desde 2011 se ejecuta en el Hospital Provincial Clínico Quirúrgico Universitario “Arnaldo Milián Castro” de la Ciudad de Santa Clara, Provincia de Villa Clara, un proyecto de investigación para evaluar la efectividad y la seguridad de la aplicación de una combinación de interferones en pacientes con tumores renales en estadios avanzados. Hasta la fecha los resultados han sido favorables y han llevado a considerar en el futuro esta variante farmacológica como una posible nueva línea de tratamiento.
CONCLUSIONES
El uso de terapias dirigidas configura el pilar fundamental del tratamiento del CCR avanzado o metastásico y su implementación ha permitido aumentar la supervivencia. Los inhibidores de puntos de control inmunológico transforman el tratamiento farmacológico del CCR y en ellos se basan, principalmente, la mayoría de las investigaciones de los últimos años. Ambas opciones terapéuticas no están libres de riesgos porque se informan eventos adversos más o menos intensos en todas las variantes farmacológicas descritas. Se ejecutan numerosos ensayos clínicos que en el futuro proveerán de nuevas herramientas terapéuticas de la enfermedad, en especial en lo que a combinaciones de terapias dirigidas con inmunoterapia se refiere.