Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Hematología, Inmunología y Hemoterapia
versión impresa ISSN 0864-0289versión On-line ISSN 1561-2996
Rev Cubana Hematol Inmunol Hemoter v.16 n.3 Ciudad de la Habana sep.-dic. 2000
Artículos de Revisión
Instituto de Hematología e InmunologíaMetabolismo del hierro
MC. Mariela Forrellat Barrios, Dra. Hortensia Gautier du Défaix Gómez y Dra. Norma Fernández DelgadoRESUMEN
Se hace una revisión sobre el metabolismo del hierro en la que se abordan su absorción y los factores que la afectan, su transporte, captación celular, almacenamiento y excreción. Se tratan los mecanismos que intervienen en la homeostasis intracelular de este mineral y se exponen los requerimientos nutricionales de los principales grupos de riesgo que desarrollan una deficiencia de este micronutriente.Descriptores DeCS: TRASTORNOS DEL METABOLISMO DEL HIERRO; HOMEOSTASIS; HIERRO/metabolismo.
El hierro es un elemento esencial para la vida, puesto que participa prácticamente en todos los procesos de oxidación-reducción. Lo podemos hallar formando parte esencial de las enzimas del ciclo de Krebs, en la respiración celular y como transportador de electrones en los citocromos. Está presente en numerosas enzimas involucradas en el mantenimiento de la integridad celular, tales como las catalasas, peroxidasas y oxigenasas1. Su elevado potencial redox, junto a su facilidad para promover la formación de compuestos tóxicos altamente reactivos, determina que el metabolismo de hierro sea controlado por un potente sistema regulador.2
Puede considerarse que el hierro en el organismo se encuentra formando parte de 2 compartimientos: uno funcional, formado por los numerosos compuestos, entre los que se incluyen la hemoglobina, la mioglobina, la transferrina y las enzimas que requieren hierro como cofactor o como grupo prostético, ya sea en forma iónica o como grupo hemo, y el compartimiento de depósito, constituido por la ferritina y la hemosiderina, que constituyen las reservas corporales de este metal.3
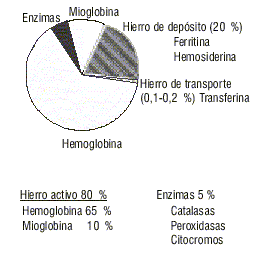
El contenido total de hierro de un individuo normal es aproximadamente de 3,5 a 4 g en la mujer y de 4 a 5 g en el hombre.4 En individuos con un estado nutricional óptimo alrededor del 65 % se encuentra formando parte de la hemoglobina, el 15 % está contenido en las enzimas y la mioglobina, el 20 % como hierro de depósito y solo entre el 0,1 y 0,2 % se encuentra unido con la transferrina como hierro circulante (fig. 1).5
Fig. 1. Distribución del hierro en el organismo.
La circulación del hierro entre estos 2 compartimientos se produce a través de un ciclo prácticamente cerrado y muy eficiente (fig. 2). Del total del hierro que se moviliza diariamente, sólo se pierde una pequeña proporción a través de las heces, la orina y el sudor. La reposición de esta pequeña cantidad se realiza a través de la ingesta, a pesar de que la proporción de hierro que se absorbe de los alimentos es muy baja, entre 1 y 2 mg (aproximadamente el 10 % de la ingesta total). En un adulto normal, la hemoglobina contiene aproximadamente 2 g de hierro (3,4 mg/g de hemoglobina), que luego de los 120 días de vida media de los eritrocitos, son cedidos a los fagocitos del sistema retículo endotelial (SRE) a razón de 24 mg/día, de los cuales, 1 mg en los hombres y 2 mg en las mujeres son excretados diariamente. El SRE recibe también un remanente de hierro que proviene de la eritropoyesis ineficaz (aproximadamente 2 mg). De los 25 mg contenidos en el SRE, 2 mg se encuentran en equilibrio con el compartimiento de depósito y 23 mg son transportados totalmente por la transferrina hasta la médula ósea para la síntesis de hemoglobina. Para cerrar este ciclo, la médula requiere diariamente 25 mg, de los cuales 23 mg provienen del SRE y de 1 a 2 mg de la absorción intestinal. Aproximadamente 7 mg se mantienen en equilibrio entre la circulación y los depósitos (fig. 2).6
Fig. 2. Esquema del ciclo del hierro en el hombre.
La principal diferencia entre el metabolismo del niño y del adulto está dada por la dependencia que tienen los primeros del hierro proveniente de los alimentos. En los adultos, aproximadamente el 95 % del hierro necesario para la síntesis de la hemoglobina proviene de la recirculación del hierro de los hematíes destruidos. En contraste, un niño entre los 4 y 12 meses de edad, utiliza el 30 % del hierro contenido en los alimentos con este fin, y la tasa de reutilización a esta edad es menos significativa.7
Absorción
En un individuo normal, las necesidades diarias de hierro son muy bajas en comparación con el hierro circulante, por lo que sólo se absorbe una pequeña proporción del total ingerido. Esta proporción varía de acuerdo con la cantidad y el tipo de hierro presente en los alimentos, el estado de los depósitos corporales del mineral, las necesidades, la actividad eritropoyética y una serie de factores luminales e intraluminales que interfieren o facilitan la absorción.8La absorción depende en primer lugar del tipo de compuesto de hierro presente en la dieta, en dependencia de lo cual van a existir 2 formas diferentes de absorción: la del hierro hemo y la del hierro inorgánico.
Absorción de hierro inorgánico
El hierro inorgánico por acción del ácido clorhídrico del estómago pasa a su forma reducida, hierro ferroso (Fe2+), que es la forma química soluble capaz de atravesar la membrana de la mucosa intestinal. Algunas sustancias como el ácido ascórbico, ciertos aminoácidos y azúcares pueden formar quelatos de hierro de bajo peso molecular que facilitan la absorción intestinal de este.1
Aunque el hierro puede absorberse a lo largo de todo el intestino, su absorción es más eficiente en el duodeno y la parte alta del yeyuno.9 La membrana de la mucosa intestinal tiene la facilidad de atrapar el hierro y permitir su paso al interior de la célula, debido a la exitencia de un receptor específico en la membrana del borde en cepillo. La apotransferrina del citosol contribuye a aumentar la velocidad y eficiencia de la absorción de hierro.10
En el interior del citosol, la ceruloplasmina (endoxidasa I) oxida el hierro ferroso a férrico para que sea captado por la apotransferrina que se transforma en transferrina.8 El hierro que excede la capacidad de transporte intracelular es depositado como ferritina, de la cual una parte puede ser posteriormente liberada a la circulación.3
Absorción de hierro hemo
Este tipo de hierro atraviesa la membrana celular como una metaloporfirina intacta, una vez que las proteasas endoluminales o de la membrana del enterocito hidrolizan la globina. Los productos de esta degradación son importantes para el mantenimiento del hemo en estado soluble, con lo cual garantizan su disponibilidad para la absorción.11 En el citosol la hemoxigenasa libera el hierro de la estructura tetrapirrólica y pasa a la sangre como hierro inorgánico, aunque una pequeña parte del hemo puede ser transferido directamente a la sangre portal.12,13Aunque el hierro hemínico repre-senta una pequeña proporción del hierro total de la dieta, su absorción es mucho mayor (20-30 %) y está menos afectada por los componentes de ésta.14 No obstante, al igual que la absorción del hierro inorgánico, la absorción del hemo es favorecida por la presencia de carne en la dieta, posiblemente por la contribución de ciertos aminoácidos y péptidos liberados de la digestión a mantener solubles, y por lo tanto, disponibles para la absorción, ambas formas de hierro dietético.11 Sin embargo, el ácido ascórbico tiene poco efecto sobre la absorción del hemo, producto de la menor disponibilidad de enlaces de coordinación de este tipo de hierro.15 Por su parte el calcio disminuye la absorción de ambos tipos de hierro por interferir en la transferencia del metal a partir de la célula mucosa, no así en su entrada a esta.16,17
Factores que afectan la absorción de hierro
El enterocito desempeña un papel central en la regulación de la absorción de hierro, debido a que los niveles intra-celulares adquiridos durante su formación determinan la cantidad del mineral que entra a la célula.18 El hierro del enterocito ingresa a la circulación de acuerdo con las necesidades, y el resto permanece en su interior hasta su decamación. De este modo, las células mucosas protegen al organismo contra la sobrecarga de hierro proveniente de los alimentos, al almacenar el exceso del mineral como ferritina, que es posteriormente excretada durante el recambio celular normal.5La absorción de hierro puede ser ajustada dentro de ciertos límites para cubrir los requerimientos de este metal. De este modo, condiciones como la deficiencia de hierro,19 la anemia, la hipoxia, conllevan un aumento en la absorción y capacidad de transporte, aunque es bueno destacar que el incremento en la absorción de hierro hemo es de menor proporción,5 debido posiblemente a que la superficie absortiva de la célula intestinal no reconoce al hemo como hierro, por lo que el incremento de su absorción se deberá solamente a la pérdida de la saturación de los receptores dentro de la célula y en las membranas basolaterales.11
La absorción del hierro puede ser también afectada por una serie de factores intraluminales como la quilia gástrica, el tiempo de tránsito acelerado y los síndromes de malabsorción.1 Además de estos factores, existen sustancias que pueden favorecer o inhibir la absorción. Así por ejemplo, el hierro hemo proveniente de las carnes y los pescados es más fácil de absorber que el hierro inorgánico de los vegetales, los que en muchos casos, contienen concentraciones más elevadas del metal. Sin embargo, la adición de pequeñas porciones de carnes o pescados puede aumentar la absorción del hierro presente en los vegetales, fundamentalmente por su contenido de aminoácidos. Existen además otras sustancias que favorecen la absorción de hierro, como son los agentes reductores, especialmente el ácido ascórbico.20,21
Entre los inhibidores de la absorción de hierro tenemos la ingesta crónica de alcalinos, fosfatos, fitatos y taninos. La absorción disminuye proporcionalmente con el volumen de té o café consumidos, así se ha determinado que en presencia de té la absorción de este mineral disminuye hasta el 60 % mientras que en la de café la absorción se reduce hasta el 40 %.22
Por su parte los fitatos (hexafosfatos de inositol) que se localizan en la fibra del arroz, el trigo y el maíz, y la lignina de las paredes de las células vegetales, constituyen potentes inhibidores de la absorción de hierro, debido a la formación de quelatos insolubles.23 En este sentido, se ha calculado que de 5 a 10 mg de fitatos pueden reducir la absorción del hierro no hemo a la mitad, lo que puede ser evitado por el consumo de pequeñas cantidades de carne y vitamina C que impiden la formación de estos quelatos, lo que provoca un aumento de la absorción aún en presencia de los inhibidores de ésta.24 El contenido de sustancias favorecedoras e inhibidoras de la absorción va a determinar la biodisponibilidad del hierro presente en la dieta.
El conocimiento de los mecanismos que regulan la absorción de hierro permite determinar el valor nutricional de los alimentos y la forma de mejorar su biodis-ponibilidad, pero también permite seleccionar apropiadamente los compues-tos de hierro mejores y más seguros que respeten el papel regulador de la mucosa intestinal.8
Transporte
El hierro es transportado por la transferrina, que es una glicoproteína de aproximadamente 80 kDa de peso molecular, sintetizada en el hígado, que posee 2 dominios homólogos de unión para el hierro férrico (Fe3+).25 Esta proteína toma el hierro liberado por los macrófagos producto de la destrucción de los glóbulos rojos o el procedente de la mucosa intestinal, se ocupa de transportarlo y hacerlo disponible a todos los tejidos que lo requieren.5Se le denomina apotransferrina a la proteína que no contiene hierro, transferrina monoférrica cuando contiene un átomo de hierro y diférrica cuando contiene 2 átomos. Cuando todos los sitios de transporte están ocupados se habla de tranferrina saturada y se corresponde con alrededor de 1,41 µg/mg de transferrina.26 En condiciones fisiológicas, la concentración de transferrina excede la capacidad de unión necesaria, por lo que alrededor de dos tercios de los sitios de unión están desocupados.5 En el caso de que toda la transferrina esté saturada, el hierro que se absorbe no es fijado y se deposita en el hígado.
La vida media normal de la molécula de transferrina es de 8 a 10 días, aunque el hierro que transporta tiene un ciclo más rápido, con un recambio de 60 a 90 minutos como promedio.27
Del total de hierro transportado por la transferrina, entre el 70 y el 90 % es captado por las células eritropoyéticas28 y el resto es captado por los tejidos para la síntesis de citocromos, mioglobina, peroxidasas y otras enzimas y proteínas que lo requieren como cofactor.
Captación celular
Todos los tejidos y células poseen un receptor específico para la transferrina, a través de cuya expresión en la superficie celular, regulan la captación del hierro de acuerdo con sus necesidades. La concentración de estos receptores es máxima en los eritroblastos (80 % del total de los receptores del cuerpo), donde el hierro es captado por las mitocondrias para ser incluido en las moléculas de protoporfirina durante la síntesis del grupo hemo. A medida que se produce la maduración del glóbulo rojo, la cantidad de receptores va disminuyendo, debido a que las necesidades de hierro para la síntesis de la hemoglobina son cada vez menores.29El receptor de la transferrina es una glicoproteína constituida por 2 subunidades, cada una de 90 kDa de peso molecular, unidas por un puente disulfuro. Cada subunidad posee un sitio de unión para la transferrina. Estos receptores se encuentran anclados en la membrana a través de un dominio transmembrana, que actúa como péptido señal interno, 30 y poseen además un dominio citosólico de aproximadamente 5 kDa.18 Se ha observado la presencia de moléculas de receptor circulando en el plasma sanguíneo, que son incapaces de unir transferrina, puesto que carecen de sus porciones transmembranosa y citosólica; a estos receptores se les conoce como receptor soluble. No obstante su incapacidad de unir transferrina, se ha encontrado una relación directa entre la concentración de receptor circulante y el grado de eritropoyesis, así en la deficiencia de hierro hay un aumento de la concentración de receptores solubles.31,32
El receptor de transferrina desempeña un papel fundamental en el suministro de hierro a la célula, puesto que la afinidad del receptor por el complejo hierro-transferrina al pH ligeramente alcalino de la sangre, depende de la carga de hierro de la proteína. La afinidad máxima se alcanza cuando la transferrina está en su forma diférrica.5
El complejo hierro-transferrina-receptor es internalizado en la célula a través de un proceso de endocitosis. El cambio del pH ligeramente alcalino al pH ácido del endosoma provoca un cambio en la estabilidad del complejo que ocasiona la disociación espontánea de los átomos de hierro; por su parte, la transferrina se mantiene unida al receptor hasta que un nuevo cambio de pH, en sentido contrario, al nivel de la membrana, provoca la ruptura del complejo y la consiguiente liberación de la transferrina que queda nuevamente disponible para la captación y transporte del hierro circulante.5
La liberación dentro de la célula del hierro unida a la transferrina es secuencial. La primera molécula es liberada por el pH ácido del citosol, mientras la segunda requiere ATP para su liberación.
Depósitos
El exceso de hierro se deposita intracelularmente como ferritina y hemosiderina, fundamentalmente en el SRE del bazo, el hígado y la médula ósea. Cada molécula de ferritina puede contener hasta 4 500 átomos de hierro, aunque normalmente tiene alrededor de 2 500, almacenados como cristales de hidróxido fosfato férrico [(FeOOH8). FeO. PO3H2].5,33La molécula de apoferritina es un heteropolímero de 24 subunidades de 2 tipos diferentes: L y H, con un peso molecular de 20 kDa cada una, formadas por 4 cadenas helicoidales. Las variaciones en el contenido de subunidades que componen la molécula determinan la existencia de diferentes isoferritinas, las que se dividen en 2 grandes grupos: isoferritinas ácidas (ricas en cadenas H) localizadas en el corazón, los glóbulos rojos, los linfocitos y los monocitos, y las isoferritinas básicas (ricas en cadenas L) predominantes en el hígado, el bazo, la placenta y los granulocitos.18
Las subunidades se organizan entre sí de manera tal que forman una estructura esférica que rodea a los cristales de hierro. Esta cubierta proteica posee en su entramado 6 poros de carácter hidrofílico y tamaño suficiente para permitir el paso de monosacáridos, flavinmononucleótidos, ácido ascórbico o desferroxamina. Se plantea que estos poros tienen una función catalizadora para la síntesis de los cristales de hierro y su incorporación al interior de la molécula de ferritina.33
La función fundamental de la ferritina es garantizar el depósito intracelular de hierro para su posterior utilización en la síntesis de las proteínas y enzimas. Este proceso implica la unión del hierro dentro de los canales de la cubierta proteica, seguido por la entrada y formación de un núcleo de hierro en el centro de la molécula. Una vez formado un pequeño núcleo de hierro sobre su superficie, puede ocurrir la oxidación de los restantes átomos del metal a medida que se incorporan.34
Se han observado diferencias entre la velocidad de captación de hierro por las diferentes isoferritinas; así las isoferritinas ricas en cadenas H tienen una mayor velocidad de captación y se ha demostrado que ésta es precisamente la función de este tipo de subunidad.35 No obstante, las cadenas H y L cooperan en la captación del hierro, las subunidades H promueven la oxidación del hierro y las L, la formación del núcleo.36 Tanto el depósito de hierro como su liberación a la circulación son muy rápidos, e interviene en este último proceso el flavinmononucleótido. El hierro es liberado en forma ferrosa y convertido en férrico por la ceruloplasmina plasmática, para que sea captado por la transferrina que lo transporta y distribuye al resto del organismo.
La hemosiderina está químicamente emparentada con la ferritina, de la que se diferencia por su insolubilidad en agua. Aunque ambas proteínas son inmunológicamente idénticas, la hemosiderina contiene un por ciento mayor de hierro (30 %) y en la microscopia se observa como agregados de moléculas de ferritina con una conformación diferente de los cristales de hierro.37
El volumen de las reservas de hierro es muy variable, pero generalmente se considera que un hombre adulto normal tiene entre 500 y 1 500 mg y una mujer entre 300 y 1 000 mg, aunque estos valores dependen grandemente del estado nutri-cional del individuo.27
Regulación de la captación y almacenamiento de hierro
La vía fundamental de captación celular de hierro es la unión y subsecuente internalización de la transferrina cargada con hierro por su receptor. La cantidad de hierro que penetra a la célula por esta vía está relacionada con el número de receptores de transferrina presentes en la superficie celular. Una vez dentro, el hierro es utilizado para sus múltiples funciones o almacenado en forma de ferritina o hemosiderina. Por lo tanto, cuando las necesidades de hierro de la célula aumentan, se produce un incremento en la síntesis de receptores de transferrina y, en el caso contrario, cuando hay un exceso de hierro, ocurre un aumento de la síntesis de ferritina. Esto se logra mediante un estricto sistema de control al nivel postranscripcional.38Tanto la expresión del receptor de transferrina como de la ferritina son reguladas en función de la disponibilidad y demanda de hierro para asegurar la homeostasia celular. En esta regulación está implicada una proteína citosólica de aproximadamente 98 kDa de peso molecular, altamente conservada a lo largo de la evolución,39 conocida como factor regulador de hierro (IRF) o proteína de unión al elemento de respuesta al hierro (IRE-BP).40,41 Esta proteína posee un centro 4Fe-4S que le permite cambiar entre 2 actividades diferentes en dependencia del nivel de hierro celular;1 así cuando los niveles de hierro son bajos, el centro se disocia y la apoproteína se une a una estructura tallo-lazo específica en el RNA mensajero (mRNA) del receptor de transferrina y de la ferritina, conocida como elemento de respuesta al hierro (IRE). Esta misma proteína se convierte en una aconitasa citosólica con un centro 4Fe-4S en células cargadas de hierro.42-44
Existe un IRE localizado cerca del extremo 5´terminal, de la región 5´no traducida de los mRNA de las cadenas L y H de la ferritina. La unión del IRF a este IRE inhibe la traducción del mRNA de la ferritina por interferencia en el orden de unión de los factores de iniciación de la traducción.45
Por su parte, la región 3´no traducida del mRNA del receptor de transferrina contiene 5 IREs;46 en este caso, la unión del IRF protege los mRNA de la degradación, con lo cual estimula la expresión del receptor.47
Cuando los niveles intracelulares de hierro están elevados, el IRF se disocia de los IREs, con lo que aumenta la traducción del mRNA de la ferritina y se acelera la degradación del mRNA de los receptores de transferrina. Así la interacción del IRF/IRE regula la expresión de estas proteínas en direcciones opuestas por 2 mecanismos diferentes, con lo cual se logra mantener el equilibrio entre la captación y almacenamiento intracelular del hierro.2 Mecanismos similares están implicados en la regulación de otras proteínas que participan en el metabolismo del hierro.
Excreción
La capacidad de excreción de hierro del organismo es muy limitada. Las pérdidas diarias de hierro son de 0,9-1,5 mg/día (0,013 mg/kg/día) en los hombres adultos. De éstos, 0,35 mg se pierden en la materia fecal, 0,10 mg a través de la mucosa intestinal (ferritina), 0,20 mg en la bilis, 0,08 mg por vía urinaria y 0,20 mg por decamación cutánea.48Las mujeres en edad fértil están expuestas a una depleción adicional de hierro a través de las pérdidas menstruales que incrementan los niveles de excreción diarios a 1,6 mg/día como mínimo.18
Los cambios en los depósitos de hierro del organismo provocan variaciones limitadas en la excreción de hierro, que van desde 0,5 mg/día en la deficiencia de hierro a 1,5 mg/día en individuos con sobrecarga de hierro. Aunque hay pocos estudios en lactantes y niños, se plantea que en éstos las pérdidas gastrointestinales pueden ser mayores que en los adultos.48 Algunos investigadores plantean que las pérdidas promedio son de aproximadamente 2 mg/día en los lactantes y de 5 mg/día en los niños de 6 a 11 años de edad.14 Otras causas importantes de pérdidas son las donaciones de sangre y la infestación por parásitos.18
Necesidades de hierro en los principales grupos de riesgo
Los requerimientos de hierro en cada etapa de la vida están determinados por los cambios fisiológicos a que se enfrenta el organismo durante su desarrollo.Al nacer, el niño sustituye el suministro seguro de hierro aportado por la placenta por otro mucho más variable y con frecuencia insuficiente, proveniente de los alimentos. Durante el primer año de la vida el niño crece rápidamente, como resultado de lo cual al cumplir el año, debe haber triplicado su peso y duplicado su hierro corporal.33 En este período se estima que las necesidades de hierro son de 0,7 a 1,0 mg/kg/día (15 mg/d).49
Durante esta etapa de la vida pueden distinguirse 3 períodos característicos, en dependencia del estado nutricional en hierro. El primer período comprende las primeras 6 a 8 semanas, durante las cuales se produce una declinación progresiva de los niveles de hemoglobina, de 170 g/L al nacer a 110 g/L, como consecuencia de la disminución de la eritropoyesis producto del aumento del tenor de oxígeno en la vida extrauterina. El hierro liberado producto de la destrucción de los eritrocitos es suficiente para cubrir las necesidades durante este tiempo y el que no se utiliza se almacena para satisfacer las demandas de las siguientes etapas de desarrollo. Durante estas semanas, la cantidad de hierro absorbido a partir de los alimentos no es significativa.50
El segundo período se caracteriza por el inicio de la eritropoyesis, a expensas fundamentalmente del hierro almacenado como producto de la destrucción de los hematíes en la etapa anterior, que se traduce en un incremento de los niveles de hemoglobina.
El tercer período comienza alrededor del cuarto mes y se caracteriza por un incremento progresivo de la dependencia del hierro alimentario para garantizar una eritropoyesis eficiente. Esto hace que sea necesario asegurarle al lactante una dieta rica en hierro, que garantice un suministro adecuado de este metal para cubrir sus requerimientos.33
En el caso de los niños prematuros y bajo peso al nacer, la susceptibilidad de desarrollar una deficiencia de hierro es mucho mayor, ya que sus reservas corporales son menores unido a un crecimiento posnatal más acelerado.51 Esto hace que las reservas se agoten más tempranamente, por lo que se hace necesario el suministro de hierro exógeno antes de los cuatro meses de vida.
Durante la infancia, las necesidades de hierro para el crecimiento son menores, alrededor de 10 mg/día, pero continúan siendo elevadas en términos de ingesta relativa, cuando se comparan con las del adulto, por lo que no desaparece el riesgo de desarrollar una deficiencia de hierro. En este período es importante evitar los malos hábitos dietéticos que limitan la ingesta de hierro o alteran su biodisponibilidad.49
En la adolescencia se produce nuevamente un incremento de las demandas de hierro, como consecuencia del crecimiento acelerado. Durante el desarrollo puberal un adolescente aumenta unos 10 kg de peso, que debe acompañarse de un incremento de unos 300 mg de su hierro corporal para lograr mantener constante su hemoglobina, que en este período aumenta a razón de 50-100 g/L/año. En consecuencia, un adolescente varón requiere alrededor de 350 mg de hierro por año durante el pico de crecimiento de la pubertad.3
Las necesidades de hierro en las hembras son más altas, pues aunque su velocidad de crecimiento es menor, se adicionan las pérdidas menstruales.49 El aumento de unos 9 kg de peso de una adolescente durante la pubertad, representa la necesidad de un aporte de unos 280 mg de hierro para el mantenimiento de la concentración de hemoglobina. Un sangramiento menstrual promedio de unos 30 mL de sangre implica la pérdida de unos 75 mg de hierro. En consecuencia, una adolescente en pleno pico de crecimiento requiere alrededor de 455 mg de hierro por año.
En las mujeres en edad fértil los requerimientos son similares a los de la adolescente, fundamentalmente debido a las pérdidas menstruales. Estos requerimientos pueden verse aumentados por el uso de dispositivos intrauterinos, que provocan aumentos imperceptibles de las pérdidas, unido en ocasiones a una dieta inadecuada; los embarazos y la lactancia pueden agravar la situación.52
.
SUMMARY
A review is made on iron metabolism in which iron absorption, factors affecting this process, iron transportation, cell uptake, storage and excretion are dealt with. The mechanisms acting in the intracellular homeostasis of this mineral and the nutritional requirements of the main risk groups that develop an iron deficiency are set forth.Subject headings: IRON METABOLISM DISORDERS; HOMEOSTASIS; IRON/metabolism.
REFERENCIAS BIBLIOGRÁFICAS
1. Andrews NC, Bridge KR. Disorders of iron metabolism and sideroblastic anemia. En: Nathan and Oski's Hematology of infancy and childhood. 5th ed. Philadelphia: WB Saunders, 1998:423-61.
2. Hentze MW. Iron regulatory factor - the conductor of cellular iron regulation. 27th Annual Course. Advan Haematol 1993:36-48.
3. Lanzkowski P. Metabolismo del hierro y anemia ferripriva. En: Hematología pediátrica. 3a ed. La Habana: 1985:121-93. (Edición Revolucionaria).
4. Refsun AB, Schreiner BBI. Regulation of iron balance by absorption and excretion. Scand J Gastroenterol 1984;19:867-74.
5. Wick M, Pinggera W, Lehmann P. Iron metabolism, diagnosis and therapy of anemias. 3th ed. New York: Springer, 1996.
6. Fairbanks V, Klee G. Biochemical aspects of hematology. En: Textbook of clinical chemistry. Tietz. Philadelphia: WB Saunders, 1986.
7. Dallman P, Siimes M. Iron deficiency in infancy and childhood. Report of the International Nutritional Anemia Consultative Group (INACG). Library of Congress, 1985.
8. Maeyer E de. Preventing and controlling iron deficiency anemia through primary health care. Geneva: 1989. World Health Organization.
9. Muir A, Hopfer U. Regional specificity of iron uptake by small intestinal brush-border membranes from normal and iron deficient mice. Gastrointestinal Liver Pathol 1985:11:6376-83.
10. Huebers A, Huebers E, Csiba E, Rummel W. Finch CA. The significance of transferrin for intestinal iron absorption. Blood 1983;61:283-8.
11. Uzel C, Conrad ME. Absoption of heme iron. Semin Hematol 1998;35:27-34.
12. Raffin SB, Woo CH, Roost KT, Price DC, Schmid R. Intestinal absoption of hemoglobin iron. Heme cleavage by mucosal heme oxigenase. J Clin Invest 1974;54:1344-50.
13. Bothwell TH. Overview and mechanism of iron regulation. Nutr Rev 1995;53:237-45.
14. Dallman PR. Hierro. En: Conocimientos actuales sobre Nutrición. 6ta ed. Washington DC: OPS, ILSI, 1991:277-88.
15. Hallberg L, Sölvell L. Absoption of hemoglobin iron in man. Acta Med Scand 1965:181:335-54.
16. Hallberg L, Brune M, Erlandsson M, Sandberg AS, Rossander-Hulthen L. Calcium: effect of different amounts on non heme and heme iron absorption in humans. Am J Clin Nutr 1991:53:112-9.
17. Hallberg L, Rossander-Hulthen L, Brune M. Inhibition of heme-iron absorption in man by calcium. Br J Nutr 1993;69:533-40.
18. Worwood M. Regulación del metabolismo del hierro. An Nestlé 1995;53:1-11.
19. Finch C. Regulators of iron balance in human. Blood 1994;84:1697-700.
20. Sharma DC, Mathur R. Correction of anemia and iron deficiency in vegetarians by administration of ascorbic acid. Indian J Physiol Pharmacol 1995;39:403-6.
21. Conrad ME. Umbreit JN. A concise review: iron absorption the mucin mobiliferrin integrin pathway. A competitive pathway for metal absoption. Am J Haematol 1993;42:67-9.
22. Brune M, Rossander L. Hallberg L. Iron absorption and phenolic compounds, importance of different phenolic structures. Eur J Clin Nutr 1989;43:547-58.
23. Gillooly M, Bothwell TH. Factors affecting the absorption of iron from cereals. Br J Nutr 1984;51:37-9.
24. Hallberg L, Rossander L, Skauberg AB. Phytates and the morbility effect of bran on iron absorption in man. Am J Clin Nutr 1987;45:988-96.
25. Huebers HA, Finch CA. The phisiology of transferrin and transferrin receptor. Physiol Rev 1987;67:520-6.
26. Haupt H, Baudner S. Chemie und Klinische bedentung der human. Plasma Proteine. (resumen en Inglés) Behring Institut Mitteilungen 1990;86:1-66.
27. Lee GR, Herbert V. Nutritional factors in the production and function of erythrocytes. En: Wintrobe's Clinical Hematology. 10th ed. Baltimore: William and Wilkins, 1998:228-66.
28. Finch C, Huebers H Eng M, Miller L. Effect of transfused reticulocytes on iron exchange. Blood 1982;59:364-9.
29. Gimferrer E, Ubeda J, Royo MT. El Receptor de la transferrina. Bioferrum 1996;1:49-50.
30. Pomka P. Cellular iron metabolism. Kidney Int 1999;55 (Suppl 69):2-11.
31. Cook JD, Skikne BS, Baynes RD. Serum transferrin receptor. Annu Rev Med 1993:44:63-74.
32. Thorstensen K, Romslo Y. The transferrin receptor its diagnostic value and its potential as therapeutic target. Scand Clin Lab Invest 1993;53(Suppl 215):113-20.
33. Dallman PR, Yip R, Oski FA. Iron deficiency and related nutritional anemias. En: Nathan and Oski's Hematology of infancy and childhood, 4th ed. Philadelphia: WB Saunders, 1993:413-50.
34. Andrews SC, Arosio P, Bottke W. Structure function and evolution of functions of ferritins. J Inorg Biochem 1992;47:161-74.
35. Wagstaff M, Worwood M, Jacobs A. Properties of human tissue isoferritins. Biochem J 1978;173:969-77.
36. Levi S, Yewdall SJ, Harrison PM. Evidence of H-and L-chains have to cooperative roles in the iron uptake mechanisms of human ferritin. Biochem J 1992;288:591-6.
37. Finch CA, Huebers HA, Cazzila M, Bergamaschi G, Belloti V, Storage iron. En: Albertini A, Arosio P, Chiancone E, Drysdale J, eds. Ferritins and isoferritins as biochemical markers. Amsterdam: Elsevier, 1984:3-21.
38. Mattia E, Rao K, Shapiro DS, Sussaman HH, Klausner RD. Biosynthetic regulation of the human transferrin receptor by deferroxamine in K563 cells. J Biol Chem 1984;259:2689-92.
39. Rothenberger S, Müllner EW, Kühn C. The mRNA binding protein which controls ferritin and transferrin receptor expression is conserved during evolution. Nucleic Acids Res 1990;18:1175-9.
40. Leibold EA, Munro HN. Cytoplasmic protein binds in vitro to a highly conserved sequence in the 5' untranslated region of ferritin heavy -and - light -subunit mRNAs. Proc Nat Acad 1988;85:2171-5.
41. Yu Y, Radisky E, Leibold EA. The iron-responsive element binding protein. Purification, cloning and regulation in rat liver. J Biol Chem 1992;267:1905-10.
42. Leibold EA, Landano A, Yu Y. Structural requirements of iron-responsive elements for binding of protein involved in both transferrin receptor and ferritin mRNA post - transcriptional regulation. Nucl Acids Res 1990;18:1819-20.
43. Rouault TA, Stout CD, Kaptain S, Harford JB, Klausner RD. Structural relationship between an iron - regulated RNA - binding protein (IRE-BP) and aconitase: functional implications. Cells 1991;64:881-3.
44. Hentze MW, Argos P. Homology between IRE-BP, a regulatory RNA - binding protein, aconitase and isopropylmalate isomerase. Nucl Acids 1991;19:1739-40.
45. Melefors Ö, Hentze MW. Translational regulation by mRNA/protein interactions in eukaryotic cells: Ferritin and beyond. Bio Essays 1993;15:85-90.
46. Müllner EW. Newpert B, Kühn LC. The mRNa - binding protein which controls ferritin and transferrin receptor expression is conserved during evolution. Nucleic Acid Res 1989;18:1175-9.
47. Case JL, Koeller DM, Ramin VC, Klausner RD, Harford JB. Iron regulation of transferrin receptor mRNA levels requires iron responsive -elements and a rapid turnover determinant in the 3' untranslated region of the mRNA. EMBO J 1989;8:3693-9.
48. Bothwell TH, Charlton RW, Cook JD, Finch CA. Iron metabolism in man. London: Blackwell Scientific, 1979.
49. Lönnerdal B, Dewey KG. Epidemiología de la deficiencia de hierro en lactantes y niños. An Nestlé 1995;53:12-9.
50. The Nutritional Foundation. Iron Deficiency in infancy and childhood. A report of the International Nutritional Anemia Consultative Group. New York, 1979.
51. Lundström U, Siimes MA, Dallman PR. At what age does iron supplementation become necessary in low birth-weight infants? J Pediatr 1977;91:878-83.
52. Bentley DP. Iron metabolism and anemia in pregnancy. Clin Haematol 1985;14:613-28.
MC. Mariela Forrellat Barrios. Instituto de Hematología e Inmunología. Apartado, 8070, CP 10800, Ciudad de La Habana, Cuba. Teléf: (537) 578268. Fax: (537) 338979. e-mail:ihidir@hemato.sld.cu.