Introducción
Morus alba L. (morera) es una planta forrajera originaria del Himalaya, que ha demostrado excelentes cualidades para la alimentación de diferentes especies de animales, cuyo valor nutricional es uno de los más altos entre los forrajes tropicales no leguminosos (Martín et al., 2017). Además, constituye la fuente exclusiva para la alimentación del gusano de la seda (Bombyx mori L.), al contener compuestos bioquímicos únicos en sus hojas, como morin y beta-sitosterol, que le confieren una función excepcional en la biosíntesis de la seda (Sarkar et al., 2018).
En algunos genotipos, es posible la propagación por semillas, pero la vía fundamental es mediante el empleo de estacas (Wani et al., 2019). Aunque esta última garantiza mayor homogeneidad de las plantaciones, requiere de seis a siete meses de madurez para realizar los cortes en las plantas donantes, y su uso limita la disponibilidad de alimento para los animales (Vijayan et al., 2014). Además, reduce el vigor de las plantas en las siguientes generaciones, con menor desarrollo del sistema radical, lo que conlleva a una reducida adaptabilidad de las plantas hijas y restringe el cultivo de variedades específicas de cada región (Wani et al., 2019).
Con las herramientas biotecnológicas actuales es posible obtener plantas in vitro en medios de cultivo líquidos, considerados más efectivos que los semisólidos, al permitir a las plantas mayor accesibilidad a los componentes del medio de cultivo y mayor ganancia en biomasa. También se reduce el tiempo de propagación, es posible el escalado y su automatización, y no se requiere de gelificantes, lo que disminuye los costos de producción en los laboratorios comerciales (Carvalho et al., 2019).
Entre las tecnologías que emplean medios de cultivo líquido se encuentran los sistemas de inmersión temporal (SIT), plataformas semiautomatizadas que permiten durante un período breve el contacto controlado del material a propagar con un medio líquido en un ambiente aséptico (Georgiev et al., 2014). En algunas especies, se ha logrado mejorar la respuesta fisiológica de las plantas e incrementar los índices de multiplicación (Businge et al., 2017; Sarkar et al., 2018; Gianguzzi et al., 2019).
Aunque la regeneración in vitro de M. alba ha sido descrita por diversos autores (Salas et al., 2005; Gogoi et al., 2017), en esta especie es limitada la información sobre el uso de metodologías con la utilización de los sistemas de inmersión temporal, que permiten el escalado a nivel comercial. Hasta la actualidad, se cuenta con el antecedente del trabajo de Salas et al. (2011), en el Instituto de Biotecnología de las Plantas (IBP) de Santa Clara, Cuba. Estos autores emplearon un biorreactor de inmersión temporal (BIT®), constituido por dos contenedores gemelos, conectados entre sí por una manguera de silicona.
Hoy se dispone de una variante comercial, conocida como SIT, denominada SETIS™ (Vervit, 2016). Se trata de una modificación de los sistemas basados en el flujo y reflujo, que constituye una simplificación del sistema de frascos gemelos (Georgiev et al., 2014). Está compuesto por dos recipientes horizontales de polipropileno, de forma rectangular, acoplados uno sobre el otro, lo que permite mayor aprovechamiento de la superficie (Vervit, 2016). Este tipo de sistema ha demostrado ser una herramienta eficaz para la micropropagación de diferentes especies vegetales de importancia económica de los géneros Saccharum, Musa, Solanum, Dioscorea, Phalenopsis, Stevia y de especies forestales como Eucaliptus y Paulownia, entre otras (Balogun et al., 2017; Rosales et al., 2018).
No obstante, las condiciones de cultivo no óptimas en los SIT pueden conducir a la formación de plantas hiperhídricas. Este tipo de planta desarrolla un grado de desorden morfoanatómico y fisiológico que afecta su capacidad regenerativa, la multiplicación in vitro y la supervivencia en determinadas condiciones ambientales (Quiala, 2012). Ello requiere del estudio de los principales indicadores que influyen en la micropropagación y su optimización en cada genotipo, para lograr su uso efectivo a escala comercial.
A partir de los elementos antes mencionados, este trabajo tuvo como objetivo evaluar la multiplicación in vitro de M. alba, variedad Criolla, en sistemas de inmersión temporal SETIS™.
Materiales y Métodos
Localización. La investigación se desarrolló en el Centro de Estudios de Biotecnología Vegetal (CEBVEG) de la Universidad de Granma, entre diciembre de 2018 y mayo de 2019.
Material vegetal. Se tomaron segmentos nodales de 1,0 cm de longitud, con una yema axilar, a partir de plantas in vitro en segundo subcultivo de multiplicación, en medio de cultivo semisólido de morera, variedad Criolla, según la metodología propuesta por Salas et al. (2005).
Medio de cultivo. Para la multiplicación en sistemas de inmersión temporal, se empleó el medio de cultivo propuesto por Sales et al. (2011). Para ello, se utilizaron las sales completas, incluidas las vitaminas en medio Murashige y Skoog (Murashige y Skoog, 1962) 4,40 g L-1 (Duchefa Biochemie B.V.), que contiene mio-inositol 100 mg L-1 y glicina 2,0 mg L-1; además de sacarosa 30 g L-1, 6-bencilaminopurina (6-BAP) 0,5 mg L-1 y ácido naftalenacético (ANA) 0,5 mg L-1. El pH se ajustó a 5,8 con soluciones de NaOH (0,1N) y HCl (0,1N), previo a la esterilización.
Las mangueras de silicona, los filtros hidrofóbicos (0,22 µm, MIDISART), los frascos SETIS™ y el medio de cultivo, se esterilizaron en autoclave vertical (BK75) a 121 °C y 1,2 kg cm-2 de presión durante 20 min. Después, en la cabina de flujo laminar, se añadió Vitrofural® (116 mg L-1) cuando el medio de cultivo tenía una temperatura aproximada de 80-90 °C. Al finalizar, se agitó hasta lograr la homogenización.
Condiciones de cultivo. Los explantes cultivados en sistemas de inmersión temporal SETIS™, se ubicaron en cámara de crecimiento con luz solar indirecta (Salas et al., 2011), con duración del fotoperíodo entre 11-12 h, densidad del flujo de fotones fotosintéticos de 60-70 µmol m-2 s-1 y temperatura de 26 ± 2,0 °C.
Cada sistema de inmersión temporal consiste en dos frascos superpuestos: uno para el crecimiento de las plantas y otro como reservorio del medio de cultivo (abajo). Ambos están acoplados con una manguera de silicona, de 6,0 mm de diámetro y 18,0 cm de longitud, a partir de los conectores ubicados en la parte inferior delantera de cada frasco. Además, se colocaron filtros hidrofóbicos de 0,2 µm para garantizar la esterilidad del aire dentro de los frascos (figura 1).

Figura 1 Sistemas de inmersión temporal SETIS™, utilizados en la multiplicación in vitro de brotes de morera, a los 28 días de cultivo.
El medio de cultivo circuló desde el frasco inferior al superior a través de una manguera, producto de la presión de aire emitido desde un compresor y regulado por un manómetro a 0,1 bar. Al concluir la presión de aire dentro de los frascos, el medio de cultivo retorna por gravedad al recipiente inferior. Entre inmersiones de medio de cultivo, se realiza el bombeo de aire al recipiente que contiene los tejidos vegetales para renovar la atmósfera gaseosa en su interior (Vervit, 2016; Balogun et al., 2017), reducir la humedad, evitar la hiperhidricidad y la acumulación de gases tóxicos (Rocano et al., 2017).
Se realizaron tres experimentos, con una secuencia consecutiva, que permitió fijar los factores estudiados en cada caso y resultaron significativos en los experimentos que se describen seguidamente.
Efecto del tiempo de inmersión. Se utilizaron tiempos de inmersión de 1,0; 3,0 y 5,0 min. de duración, que conformaron tres tratamientos. A partir de la literatura científica consultada, se fijó una frecuencia de cuatro inmersiones diarias, distribuidas cada seis horas (Salas et al., 2011), durante 28 días, en las condiciones y medio de cultivo antes descritos.
Efecto de la frecuencia de inmersión. Para el estudio se fijó el tiempo de inmersión que mejor resultó del experimento previo, que fue el de tres minutos, con diferentes frecuencias de inmersión. Se conformaron tres tratamientos: 1) tres inmersiones diarias cada ocho horas; 2) testigo, con cuatro inmersiones diarias cada seis horas, y 3) seis inmersiones diarias cada cuatro horas. Todos en condiciones y medios de cultivo similares al experimento anterior.
Efecto del tiempo de cultivo. Los brotes de morera se cultivaron en las mejores condiciones, determinadas en los experimentos previos. Se realizaron evaluaciones a los 28, 45 y 60 días de cultivo. Se realizó un subcultivo al medio de cultivo fresco, a los 28 días.
Diseño experimental. Se utilizó un total de tres sistemas de inmersión temporal SETIS™ por tratamiento y tres repeticiones, con un diseño experimental completamente al azar. Cada sistema contenía 1 000 mL de medio de cultivo de multiplicación con 30 explantes, a razón de 33,33 mL de medio de cultivo por explante de morera.
Variables cualitativas. Transcurrido el período de multiplicación de 28 días, se evaluaron las características cualitativas de color e hiperhidricidad de los brotes mediante la observación, y se documentaron a través de fotografías. El color se determinó según el código hexadecimal de colores (http:// www.cwp.linet.edu/cwis/cwp.html) y se consideraron brotes hiperhídricos los que presentaron una apariencia turgente y translúcida, en comparación con los brotes normales.
Variables cuantitativas. Se determinó el número de brotes, el número de yemas axilares y la longitud de los brotes (cm), a los 28 días de cultivo. Para la longitud de los brotes, se midió desde la base hasta el punto de inserción de la primera hoja, con ayuda de una regla milimetrada.
Procesamiento estadístico. Las variables cualitativas color e hiperhidricidad de los brotes se analizaron mediante estadística descriptiva. En el experimento uno, se evaluó el efecto del tiempo de inmersión, y en el dos la frecuencia de inmersión. Los datos cumplieron los supuestos de normalidad, según la prueba de Bartlett y la homogeneidad de varianza, de acuerdo con la prueba de Kolmogorov-Smirnov. Se procesaron estadísticamente mediante un análisis de varianza de clasificación simple, y la comparación de medias según Tukey (p < 0,05). Sin embargo, en el experimento tres, donde se evaluó el efecto del tiempo de cultivo, las variables no cumplieron los supuestos de normalidad y homogeneidad de varianza, por lo que se empleó la prueba no paramétrica de Friedman. Las diferencias entre tratamientos se determinaron según la prueba de Wilcoxon (p < 0,05). Se utilizó el programa estadístico SPSS (Statistical Package for the Social Sciences), versión PASW Statistics 18 para Windows.
Resultados y Discusión
Efecto del tiempo de inmersión. Los resultados mostraron diferencias significativas en las variables evaluadas para p < 0,05, excepto en el número de brotes. Se observó que el número de brotes de M. alba, variedad Criolla, en el sistema de inmersión temporal SETIS™, estuvo en correspondencia con cada una de las yemas previamente establecidas. Además, el número mayor de yemas axilares se obtuvo en el tratamiento 2 (tiempo de inmersión de tres minutos), con valor de 4,67. La longitud de los brotes en los tres tratamientos superó los 2,5 cm, pero el máximo valor se logró con dos minutos de inmersión, siendo superior a 3,0 cm, con diferencias significativas con respecto al resto (tabla 1).
Tabla 1 Efecto del tiempo de inmersión en la multiplicación de brotes de M. alba, variedad Criolla, en sistema de inmersión temporal SETIS™.
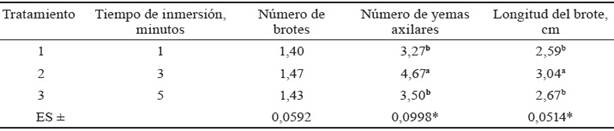
Letras diferentes en una misma columna difieren significativamente según la prueba de Tukey (p < 0,05)
La definición del tiempo de inmersión es un elemento vital para cada especie, si se pretende estandarizar una metodología que implique el uso de los sistemas de inmersión temporal. Al respecto, Berthouly y Etienne (2005) señalaron que la definición de este indicador contribuye a que los tejidos vegetales logren la máxima absorción de nutrientes, sin llegar a su hiperhidratación. Este es un desorden fisiológico perjudicial, que puede conducir a una pérdida irreversible de la capacidad de regeneración y multiplicación in vitro, debido al exceso de agua en los espacios intercelulares del tejido vegetal.
Las causas que generan la hiperhidricidad están relacionadas con varios factores del ambiente in vitro, como el pobre intercambio gaseoso y la alta humedad relativa en los frascos de cultivo, el bajo potencial osmótico de los medios de cultivo, así como las altas concentraciones de iones NH4 + y Cl- y de reguladores del crecimiento, principalmente citoquininas (Quiala, 2012).
En la literatura científica consultada se plantea que la inmersión no debe exceder de uno o dos minutos en especies leñosas, para evitar la presencia de brotes con síntomas de hiperhidricidad. Este tiempo es suficiente para producir incremento en la actividad de la superóxido dismutasa y una peroxidación de los lípidos, que desaparecen al terminar la fase de inmersión. Con ello se evita la muerte celular por estrés oxidativo, inducido por el tiempo prolongado de exposición de los explantes al medio de cultivo líquido (Salas et al., 2011).
El tiempo y la frecuencia de inmersión son dos factores fundamentales para lograr el mayor número de brotes y la mejor calidad de las plantas. Estos indicadores son recomendados por Castro y González (2002), quienes al evaluar diferentes frecuencias y tiempos de inmersión en Eucaliptus grandis Hill ex Maiden observaron que con tres minutos de inmersión, cada 12 h, se obtenía el mayor número de brotes (11,5) en comparación con frecuencias inferiores y un minuto de inmersión. Este resultado difiere del que se alcanzó en esta investigación, donde no hubo efecto del tiempo de inmersión en el número de brotes.
El número de brotes formados en este estudio también contrasta con los informados por Rocano et al. (2017) en Juglans neotrópica Diels. Estos autores, con el empleo de dos minutos de inmersión cada seis horas, pero en sistemas de inmersión temporal BIT®, obtuvieron brotes de 3,37.
En un trabajo con Stevia rebaudiana (Bert.) Bertoni, micropropagada en tres sistemas de inmersión (BIT®, SETIS™ y RITA®) con dos minutos de inmersión cada 12 h, y un volumen de medio de cultivo de 10 mL por explante, se lograron plantas vigorosas con niveles bajos de hiperhidricidad, mayor número promedio de hojas y brotes y, en general, mayor tasa de multiplicación que en explantes cultivados en medio semisólido (Rosales et al., 2018).
Es posible que la forma de los frascos haya tenido alguna influencia, al considerar que en los BIT® se usa un recipiente vertical, y el espacio entre los explantes y la parte superior del recipiente es mayor, en comparación con el disponible en los SETIS, lo que permite mayor disponibilidad de gases y espacio para la elongación de los explantes (Rosales et al., 2018).
En esta investigación, se incluyeron en el medio de cultivo 6-BAP y ANA, como reguladores del crecimiento. Sin embargo, Rosales et al. (2018) solo pusieron ácido giberélico (AG3), el cual induce una gran variedad de efectos fisiológicos; entre ellos, la elongación de los tallos, debido a la activación de los meristemos intercalares. Además, estos autores plantearon que en las pruebas iniciales la presencia de citoquininas causó efectos negativos, lo que parece indicar que la brotación se debe al sistema de inmersión temporal.
Según Vidal et al. (2015) en Castanea spp., cultivada en sistemas de inmersión temporal RITA®, con tres minutos de inmersión cada cuatro u ocho horas, se logró un coeficiente de multiplicación de 1,16, que es comparable con los resultados de este trabajo. En Eucalyptus camaldulensis Dehnh, hubo la mejor respuesta, al emplear 15 min. de inmersión cada dos horas. En estas condiciones, no se observó hiperhidricidad y se obtuvo un coeficiente de multiplicación 0,74 veces superior al del sistema con inmersión continua (Mendonça et al., 2016).
Con respecto al presente trabajo, no hubo síntomas de hiperhidricidad en los brotes formados en los diferentes tiempos de inmersión, con la mejor respuesta al emplear tres minutos de inmersión.
Efecto de la frecuencia de inmersión. Con el empleo de tres minutos de inmersión y diferentes frecuencias (cuatro, seis y ocho horas), se observó que los brotes mantuvieron las características típicas de la especie, con hojas expandidas de color verde, superficie lisa y borde ondulado. No fueron visibles cambios morfofisiológicos, atribuidos a las condiciones de cultivo, como presencia de brotes con síntomas de hiperhidricidad después de 28 días de cultivo (figura 2).

Figura 2 Brotes in vitro de morera, variedad Criolla, obtenidos con tres minutos de inmersión y frecuencias de inmersión cada ocho (A), seis (B) y cuatro (C) horas en sistema de inmersión temporal SETIS, a los 28 días de cultivo.
Al utilizar frecuencias de inmersión, cada seis u ocho horas diarias, con tres minutos de inmersión, se registraron valores promedio máximos en el número de yemas axilares, con diferencias significativas con respecto al tratamiento con frecuencia de inmersión cada cuatro horas (figura 3).
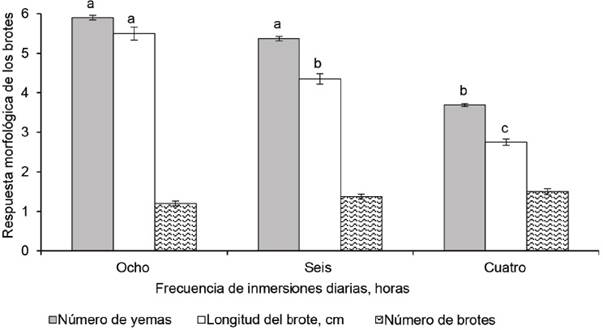
Figura 3 Efecto de la frecuencia de inmersión en la multiplicación de brotes de morera, variedad Criolla, a los 28 días de cultivo
En la variable longitud del brote, se evidenciaron diferencias significativas entre los tratamientos (p < 0,05). Los mayores valores se lograron con el menor número de inmersiones diarias y frecuencia cada ocho horas, tratamiento que difirió estadísticamente del resto. Por el contrario, en el número de brotes por explante, no hubo diferencias significativas entre los tratamientos (figura 3).
En este experimento también se pudo aumentar el número de yemas por brote (de 3,69 a 5,90) y la longitud de los brotes (de 2,75 a 5,50 cm), al cambiar la frecuencia de inmersión, de cuatro a cada ocho horas por día. Por el contrario, al disminuir el número de inmersiones se alargan las frecuencias o intervalos entre brotes, y se origina estrés en el material vegetal, lo que pudo haber estimulado la respuesta biológica de los brotes. Durante estas condiciones de estrés, es posible que el brote pase de una nutrición heterótrofa a mixotrófica, que estimule la producción de hormonas endógenas como el ácido abscísico y acelere los procesos de división y alargamiento celular.
González et al. (2011) demostraron que al existir un contacto más frecuente de los explantes de Eucalyptus globulus Labill. con el medio de cultivo, se produce mayor acidificación del medio de cultivo líquido. En bajas frecuencias de inmersión, se incrementa el intercambio gaseoso en la fotosíntesis y respiración, ya que durante la inmersión las tasas de difusión de gases en el aire son superiores que en el agua.
Estos resultados difieren de los informados por Salas et al. (2011), quienes obtuvieron 11,02 brotes por explantes, con longitud aproximada de 11,35 cm en morera, variedad Criolla, y la utilización del sistema de frascos gemelos, con un minuto de inmersión y frecuencia cada seis horas (cuatro inmersiones diarias). Sin embargo, una de las diferencias radica en el número de explantes. Según estos autores, emplearon diez explantes en 500 mL de medio de cultivo, a razón de 50 mL de medio de cultivo por explante. Mientras, en este trabajo se triplicó el número de explantes, con 33,33 mL de medio de cultivo por explante como promedio. Cuando hay un menor número de brotes, disminuye la competencia, lo que resulta en mayor disponibilidad de luz y nutrientes. Sin embargo, no hay un aprovechamiento del espacio dentro del frasco.
Esta diferencia en la respuesta de los brotes, al variar el número de explantes por frasco, también la demostró Salas et al. (2011), quienes observaron que al duplicar el número de explantes (20), disminuía significativamente el número de brotes y su longitud. Por tanto, en este trabajo, la baja respuesta de los tejidos se pudiera atribuir a que se triplicó el número de explantes por frasco, lo que pudo haber causado baja disponibilidad de nutrientes y oxígeno en el interior del recipiente. No obstante, existen factores que también pudieran influir en la respuesta de los tejidos, como el tipo de sistema de inmersión temporal empleado, la intensidad luminosa dentro de la cámara de crecimiento, el tamaño del explante, entre otros.
Businge et al. (2017), al emplear un sistema de inmersión temporal BIT® con un minuto de inmersión cada una hora, obtuvieron en el híbrido Eucalyptus urograndis (Eucaliptus grandis Hill ex Maiden × E. urophylla S.T. Blake) un coeficiente de multiplicación 5,75 veces mayor que en medio de cultivo semisólido, y un valor medio de 1,75 veces superior en Betula pendula Roth. Más recientemente, Rosales et al. (2018) encontraron que en Stevia rebaudiana (Bert.) Bertoni, variedad Morita II, al emplear el sistema de inmersión temporal BIT® se obtenían ocho brotes por planta, mientras que en los SETIS® solo tres. Estos autores observaron diferencias significativas entre los dos sistemas evaluados. Esto se pudiera deber a que la distribución del medio de cultivo es más homogénea en los BIT®, mientras que en los SETIS® la malla en que se colocan los explantes y su ligera inclinación hacia el frente, pudo haber disminuido el volumen del medio de cultivo en la parte posterior del frasco y su contacto con los explantes.
Esto corrobora que los tiempos y frecuencias de inmersión son muy variables, debido a la gran variedad de especies vegetales, los procesos de micropropagación y tipos de sistemas de inmersión temporal utilizados (Gianguzzi et al., 2019). Autores como Regueira et al. (2018), Carvalho et al. (2019) y Vidal y Sánchez (2019), refieren la importancia de comparar los resultados en diferentes tipos de sistemas de inmersión temporal y ciclos de inmersión, en aras de seleccionar para cada especie el mejor equipamiento y protocolo de investigación.
También es posible que la época del año haya influido en la respuesta de los brotes, pues el período de investigación coincidió con la fructificación de esta especie, lo que conlleva a un retardo de los procesos fisiológicos de los brotes de morera. Según Gogoi et al. (2017), de noviembre a febrero ocurre la floración in vitro en explantes de morera (Morus indica L.), período de cultivo que es similar al utilizado en esta investigación.
La literatura científica hace referencia a diferentes tipos de explantes, como ápices, brotes, embriones somáticos, segmentos nodales, medios y basales, utilizados en sistemas de inmersión temporal. Por ejemplo, en diferentes clones de Castanea sativa Mill, se informó que los explantes basales con callos produjeron mayor cantidad de brotes, y de mayor longitud que los obtenidos a partir de segmentos nodales y apicales (Vidal et al., 2015).
Palhares et al. (2018) demostraron que los mejores resultados en el híbrido E. urograndis se lograron cuando las plantas se cultivaron en sistemas de inmersión temporal, con alta intensidad luminosa (250 µmol m-2 s-1), superior a la utilizada en este estudio. Según los autores, esto se atribuye a que las plantas sometidas a un alto flujo de fotones fotosintéticos reducen, significativamente, la conductancia estomática, pero no modifican la transpiración, lo que resulta en un mayor número de estomas abiertos y en el aumento de la transpiración.
La longitud del explante inicial es otro aspecto a considerar, y que pudo haber influido en la longitud de los brotes regenerados. En este trabajo se emplearon segmentos nodales de 1,0 cm de longitud con una yema axilar, inferiores a lo informado por Salas et al. (2011), quienes se basaron en la metodología descrita por Salas et al. (2005), y utilizaron segmentos nodales de 2,0 a 3,0 cm de longitud con una yema axilar.
La integración de estos elementos se debe tener en cuenta en futuras investigaciones, por lo que al concluir este experimento se determinó que con el empleo de tres minutos de inmersión, con frecuencia diaria cada ocho horas, se logra mayor respuesta en las variables analizadas.
Efecto del tiempo de cultivo. Al analizar el efecto del tiempo de cultivo en la respuesta de los brotes de M. alba, variedad Criolla, cultivados en el sistema de inmersión temporal SETIS™, se observó que, al aumentar el tiempo de cultivo, se incrementó la respuesta de los brotes en todas las variables. Los valores mínimos se alcanzaron a los 28 días de cultivo, con diferencias estadísticas significativas en la longitud de los brotes con respecto al resto de los tiempos de cultivo (p < 0,05). No sucedió así en las evaluaciones a los 45 días de cultivo, en las variables número de brotes y número de yemas.
Aunque los mayores resultados se obtuvieron a los 60 días de cultivo, estos no mostraron diferencias estadísticas significativas con respecto a los valores promedio a los 45 días de cultivo en ninguna de las variables (figura 4).
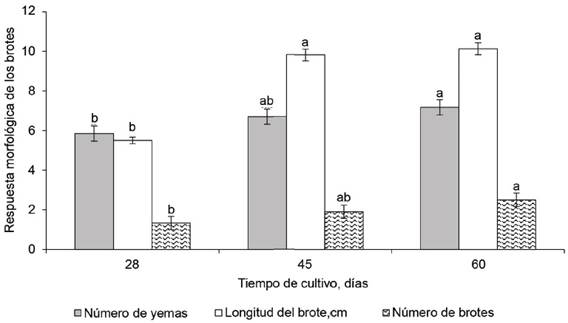
Figura 4 Efecto del tiempo de cultivo en la respuesta morfológica de los brotes de morera, variedad Criolla, cultivados en sistema de inmersión temporal SETIS™
Lo anterior se pudiera deber a que durante los primeros 28 días de cultivo, el tejido vegetal inicia un proceso de recuperación, producto al estrés que ocurre posterior al establecimiento de los explantes en el medio de cultivo líquido. La transferencia de los brotes a medio de cultivo fresco, a los 28 días de cultivo, permitió mantener los brotes por mayor tiempo, con mejor nutrición. Estos comenzaron a elongar con la consiguiente formación de yemas y hojas nuevas, lo que se traduce en un incremento en el desarrollo y multiplicación de nuevos brotes.
En la literatura consultada algunos autores demostraron que los períodos prolongados de cultivo afectaron el número de brotes. Sin embargo, Castro y González (2002) obtuvieron el mayor coeficiente de multiplicación de brotes en E. grandis a las seis semanas de cultivo, un período similar al usado en este estudio.
Al concluir este experimento, se determinó que el tiempo de cultivo en el sistema de inmersión temporal SETIS™ influyó en la multiplicación de los brotes in vitro de morera, variedad Criolla.
Conclusiones
Se demostró que es posible la multiplicación in vitro de morera, variedad Criolla, en sistemas de inmersión temporal SETIS™. Con el empleo de tres minutos de inmersión cada ocho horas, durante 45 días de cultivo, se obtiene la mayor respuesta en el número de yemas, número de brotes y longitud de los brotes, sin diferencias estadísticas significativas en comparación con 60 días de cultivo.














