Introducción
El Síndrome de Inmunodeficiencia Adquirida (SIDA) es uno de los problemas principales de salud en el mundo. Se estima que al cierre del 2018 existían 37,9 millones de personas viviendo con el VIH. El África subsahariana, que enfrenta la carga más grande del VIH/SIDA a nivel mundial, representa el 65 % de todas las nuevas infecciones. Otras regiones afectadas de manera significativa son Asia, el Pacífico, Latinoamérica, el Caribe, Europa Oriental y Asia Central.1
En los sistemas diagnósticos utilizando antígenos procedentes de virus se presentan dificultades para obtener una representatividad de cada proteína que lo compone, lo cual disminuye la sensibilidad y especificidad del análisis. El desarrollo de sistemas diagnósticos utilizando proteínas recombinantes, permite la manipulación de productos no infectivos, por lo tanto, no son necesarias etapas de inactivación que pueden afectar la reactividad del producto y la representatividad de los antígenos deseados. Además, por esta vía se pueden obtener con mayor facilidad los antígenos con un alto nivel de pureza.
E. coli ha sido ampliamente utilizada para el clonaje y expresión de genes de organismos procarióticos y eucarióticos debido a que se cuenta con gran información referente a sus características genéticas y fisiológicas.2-4 De igual manera el cultivo a templa de este microorganismo se utiliza de manera extendida en la producción de proteínas recombinantes, debido a que no se necesitan de sistemas de cultivos, ni equipamientos sofisticados.5,6
Diversas estrategias de adición han sido utilizadas en el desarrollo de cultivos incrementados de E. coli, entre las que se encuentran formas simples de adición constante de nutrientes 7,8). El desarrollo de los cultivos incrementados es de gran importancia, ya que con su aplicación se puede lograr el aumento de la concentración celular posible de alcanzar, así como la formación del producto de interés.1,7,9,10
La acción de los campos electromagnéticos sobre los sistemas biológicos es un hecho conocido, lo cual ha sido tratado por algunos científicos desde hace varios años. Aunque aún no han sido esclarecidos los mecanismos que expliquen su interacción con la materia viva, lo cierto es que se han creado amplias expectativas en cuanto a la utilización de las bondades del electromagnetismo respecto a los sistemas microbianos.11-15
En este artículo reportamos el desarrollo del proceso fermentativo a templa a nivel de zaranda y el escalado efectivo a nivel de laboratorio (1,5 L) para la producción de la proteína recombinante Gp-41 del VIH-1 expresada bajo el control del promotor triptofano. Posteriormente se desarrolló un proceso fermentativo a nivel de 1,5 L utilizando la técnica de cultivo incrementado y finalmente se estudió la influencia del campo electromagnético de extremada baja frecuencia durante la fisiología del proceso fermentativo incrementado.
Se describe un método eficiente para obtener grandes cantidades de la proteína recombinante Gp-41, la cual puede ser utilizada para el desarrollo de métodos de diagnósticos contra el HIV-1.
Materiales y métodos
Cepa de bacteria y plasmidio. La cepa de E. coli C-600 16, fue transformada con el plásmido pHIVTA, el cual tiene los genes que codifican para un péptido estabilizador y un segmento representativo de la proteína Gp-41 del VIH-1. La regulación de la expresión de este gen se encuentra bajo el control del promotor triptófano, y como señal de terminación de la transcripción se empleó la del fago T4.17
Preparación del inóculo. Las células de E. coli transformadas (0,1 mL), se cultivaron a nivel de zaranda (G-25 New Brunswick Scientific Co. INC, E.U.) durante 8 h a 37(C en 5 mL de medio L.B. suplementado con 100 µg/mL de ampicillina y 100 g/mL de triptofano. Las células se colectaron durante el principio de la fase logarítmica de crecimiento y se utilizaron como inóculo para todos los experimentos siguientes. La densidad óptica inicial (D.O.) de los cultivos se ajustó entre 0,05-0,1 unidades, medida a 530 nm en un espectrofotómetro Thermo Scientific (Alemania).
Producción de la proteína Gp-41 a nivel de zaranda
Los cultivos se realizaron a nivel de zaranda utilizando erlenmeyers de 100 mL, conteniendo el medio M9 (Na2HPO4 6 g, KH2PO4 3 g, NH4Cl 1 g, NaCl 0,5 g), suplementado con 1 % de hidrolizado ácido de caseína, 0, 5 % de glucosa, 0,1 % de extracto de levaduras, 50 µg/mL de ampicillina. En todos los casos se mantuvo una relación de volumen de 1/5 (volumen de cultivo/volumen total). Las condiciones de crecimiento utilizadas fueron: temperatura de 37 oC y agitación a 250 rpm. La derepresión del promotor triptofano se realizó mediante el consumo de la concentración inicial de triptófano, utilizada en el medio de cultivo. El cultivo se mantuvo en estas condiciones durante 12 h. Se realizó la cinética de fermentación tomándose muestras cada 4 h de cultivo.
Producción de la proteína Gp-41 a nivel de 1.5 L utilizando cultivo a Templa
El proceso de fermentación mediante cultivo a Templa se desarrolló en un fermentador Marubishi (Japón) de 1,5 L. La temperatura, el pH, y la agitación fueron controladas de manera automática a 37,0°C; 7,0 y 700 rpm respectivamente durante el proceso, mientras que el flujo de aire se mantuvo en 1 L/min. El tiempo total de fermentación fue de 12 h.
Las células utilizadas como inóculo (150 mL) se adicionaron a un fermentador de 1,5 L (1 L de volumen efectivo) conteniendo el siguiente medio de cultivo: M9 suplementado con 1 % de hidrolizado ácido de caseína, 0,5 % de glucosa, 0,1 % de extracto de levaduras, 50 µg/mL de ampicillina. Las condiciones de crecimiento fueron: 37 oC, 1 vvm y 350 rpm. La derepresión del promotor triptofano se realizó mediante el consumo de la concentración inicial de triptofano utilizada en el medio de cultivo. El cultivo se mantuvo en estas condiciones durante 12 h. Se realizó la cinética de fermentación tomándose muestras cada 4 h de cultivo.
Producción de la proteína Gp-41 a nivel de 1,5 L utilizando cultivo incrementado
El proceso de fermentación se desarrolló en el mismo fermentador y con las mismas condiciones de temperatura, pH, agitación y flujo de aire descritas previamente.
Las células utilizadas como inóculo (150 mL) se adicionaron a un fermentador de 1,5 L (1 L de volumen efectivo) conteniendo el siguiente medio de cultivo: M9 10X (Na2HPO4 60 g, KH2PO4 30 g, NH4Cl 10 g, NaCl 5 g y enrasar a 1000 ml con Agua Destilada) 130 ml, Extracto de Levadura 1,3 g (0,1%), Triptona 6,5 g (0,25 %), Hidrolizado de Caseína 13 g y Agua Destilada 1015 ml. Posteriormente, se adicionan al fermentador 32,5 ml de Glucosa (40 %), CaCl2 (0,01 M) 1,3 ml, MgSO4 (0,1 M) 1,3 ml, Ampicillina (100 µg/ml) 5,2 ml y Triptofano (100 µg/ml) 6,5 ml. Este medio de cultivo fue esterilizado a 1 atm y 121°C durante 15 min.
El medio del cultivo de incremento estuvo compuesto por: Extracto de Levadura 1,5 g, M9 10X 57 ml, Glucosa (40 %) 65 ml, CaCl2 0,6 ml, MgSO4 0,6 ml y Ampicillina (100 µg/ml) 5 ml. El medio fue esterilizado a 1 atm y 121°C durante 20 min. El incremento se comenzó a las 2 h con un flujo de 0,25 mL/min y a partir de las 5 h de fermentación se incrementó a 0,35 mL/min. Se realizó la cinética de fermentación duración de 12 h tomándose muestras cada 4 h de cultivo.
Producción de la proteína Gp-41 a nivel de 1,5 L utilizando cultivo incrementado con la aplicación del campo magnético de baja frecuencia
El medio de cultivo utilizado, así como las condiciones de cultivo fueron similares a cuando se realizó la producción de la proteína Gp-41 a nivel de 1,5 L utilizando cultivo incrementado, descrita en el acápite anterior.
Para el tratamiento electromagnético se utilizó un generador de campo magnético de baja frecuencia diseñado en el Centro Nacional de Electromagnetismo Aplicado (CNEA), el mismo consiste en un solenoide acoplado a una fuente de corriente directa, que tiene insertado en su centro un espiral de acero inoxidable por donde recircula la suspensión celular.
El estudio de la influencia del campo magnético sobre el cultivo, se realizó a una intensidad de 0,055 Tesla (550G) y con un tiempo de exposición de 6,5 h desde el inicio de la fermentación. Cada 4 h se tomaron muestras de cultivo hasta la hora final de fermentación (12 h).
Todos los reactivos utilizados en la preparación de las soluciones para los diferentes procesos fueron de calidad para análisis.
Métodos analíticos
Determinación del crecimiento celular. El crecimiento celular fue medido por de densidad óptica con ayuda espectrofotómetro Thermo Scientific (Alemania), realizando las lecturas a una longitud de onda de 530 nm. Los valores de peso seco reportados corresponden al factor de conversión (Densidad óptica x 0,3).
Determinación de la concentración de proteínas totales. Se utilizó el método descrito por Lowry y col. 18, empleando Albúmina de Suero Bovino (99 %), como proteína patrón (Merck, Alemania).
Estimación del nivel de expresión. Se utilizó la técnica de separación por electroforesis en gel de poliacrilamida (15 %), para determinar la cantidad de proteína recombinante en el cultivo. La estimación del nivel de expresión se realizó mediante densitometría de estos geles utilizando un densitómetro Laser (Pharmacia, Suecia)
Determinación de la concentración de acetato. La determinación de la producción de acetato en el medio de cultivo se realizó en un cromatógrafo de gases (Agilent, USA)
Resultados y discusión
Producción de la proteína Gp-41 a nivel de zaranda
La influencia de la concentración del inductor y el represor en el crecimiento celular, la expresión y la productividad del proceso fermentativo fue evaluada anteriormente.8 Por los resultados obtenidos se decidió realizar el proceso de producción de la proteína Gp-41 por derepresión del sistema de inducción en ausencia de triptofano.
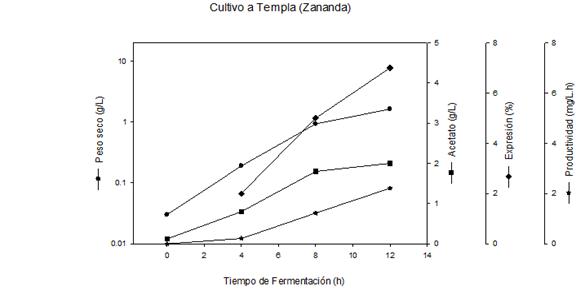
Los resultados de la evaluación del proceso productivo de la proteína recombinante Gp-41 a nivel de Zaranda, utilizando cultivo a Templa, se muestran en la figura 1. Los niveles de expresión de la proteína de interés se incrementan de forma lineal entre las 4 y 12 h de cultivo, obteniéndose un valor de 7 % a las 12 h, mientras que el peso seco se incrementó hasta las 8 h y a partir de ese momento el mismo disminuyó ligeramente hasta obtener 1,63 g/L a las 12 h de cultivo. Se observó que el nivel de acetato producido se encuentra asociado al crecimiento, con valores de 2 g/L a las 12 h.
La productividad de la proteína de interés se incrementa continuamente hasta el final del cultivo obteniéndose valores de 2,21 mg/L.h a las 12 h.
Producción de la proteína Gp-41 a nivel de 1,5 L utilizando cultivo a Templa
La figura 2A muestra que el crecimiento celular aumentó progresivamente hasta las 8 h alcanzando un valor de 1,29 g/L de peso seco, solo aumentando ligeramente hasta las 12 h (1,83 g/L). El comportamiento del porciento de CO2 producido y de O2 consumido se corresponde con el perfil del crecimiento celular presentando un valor máximo y mínimo respectivamente a las 8 h de cultivo. El nivel del metabolito acetato producido se corresponde con el obtenido a nivel de zaranda, asociado al crecimiento celular, observándose valores de 2,4 g/L a las 12 h.
El nivel de expresión de la proteína Gp-41, figura 2B, se incrementó con el tiempo de cultivo hasta las 12 h obteniéndose un valor de 8 %, mientras que la productividad de la proteína de interés presentó un comportamiento similar, obteniéndose valores de 3,03 mg/L.h al final del cultivo.

Fig. 2A Crecimiento celular y concentración de metabolitos en el proceso productivo de la proteína recombinante Gp-41 a nivel de 1,5 L, utilizando cultivo a Templa
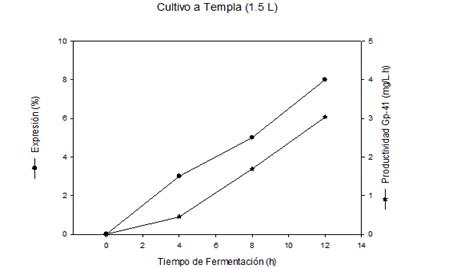
Fig. 2B Nivel de expresión y productividad del proceso de obtención de la proteína recombinante Gp-41 a nivel de 1,5 L, utilizando cultivo a Templa
Al comparar el proceso fermentativo a nivel de zaranda y de 1,5 L (figuras 1, 2A, 2B), se observó que el escalado del proceso a nivel de fermentación mejora los indicadores productivos en 1,3 veces respecto al peso seco y la productividad. Ello es debido fundamentalmente a un control constante del pH en condiciones favorables para las células, y a los altos niveles de agitación que aumentan el nivel de oxígeno en el cultivo, lo cual influye significativamente en el crecimiento celular y la producción de proteínas recombinantes.6,19) Estas condiciones también permiten mantener niveles de producción del metabolito acetato (2,4 g/L), por debajo del nivel crítico para cultivos de E. coli (5 g/L).6
El nivel de expresión se incrementa ligeramente al utilizar el sistema de inducción por derepresión del triptofano contenido en el medio de cultivo 8, ya que la expresión de la proteína de interés se realiza fundamentalmente en la fase logarítmica de crecimiento, lo cual garantiza que las células presenten suficientes niveles de energía y precursores metabólicos para la síntesis de las proteínas recombinantes.6,20
Los niveles de producción obtenidos en este trabajo fueron similares a los reportados anteriormente para la proteína la Gp-41 del VIH-1 utilizando la cepa C-600.5
Producción de la proteína Gp-41 a nivel de 1,5 L utilizando cultivo incrementado
Un cultivo incrementado típico, desarrollado para la proteína Gp-41 a nivel de 1,5 L, se muestra en la figura 3A. Se observó una alta velocidad de crecimiento celular durante las primeras 6 h de cultivo, hasta alcanzar un peso seco de 4,77 g/L, y en consecuencia el nivel de oxígeno disuelto disminuyó hasta un 16,43 % y el CO2 producido se incrementó paulatinamente hasta un valor de 3,85 %.
Posterior a las 6 h, la velocidad de crecimiento celular disminuye hasta el final del cultivo, donde se alcanza una concentración celular de 8,85 g/L de peso seco. En correspondencia con ese comportamiento el nivel de O2 disuelto comenzó a aumentar hasta valores de 18,45 % y el de CO2 disminuyó hasta 1,85 %.
La producción de acetato incrementó de forma asociada al crecimiento celular hasta las 8 h, momento en el cual alcanzó valores inhibitorios de 12,2 g/L. Por esta razón, la expresión de la proteína recombinante y el crecimiento celular se ven afectados, por lo que solo se incrementan ligeramente a partir de ese momento. A partir de las 8 h comenzó a disminuir paulatinamente el nivel de acetato hasta obtener 10 g/L a las 12 h.
La figura 3B muestra que el nivel de expresión de la proteína recombinante se incrementó rápidamente a 7,1 % a las 4 h de cultivo, y ligeramente hasta 9,2 % al final del cultivo. Al analizar la productividad del proceso fermentativo utilizando cultivo incrementado, se observó que existe un incremento hasta las 4 h de fermentación (50 mg/L.h) y a partir de ese tiempo ocurre una disminución lineal hasta obtener un valor de 20 mg/L.h a las 12 h de cultivo.
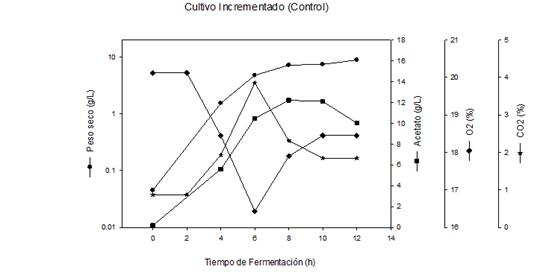
Fig. 3A Crecimiento celular y concentración de metabolitos en el proceso productivo de la proteína recombinante Gp-41 a nivel de 1,5 L, utilizando cultivo incrementado
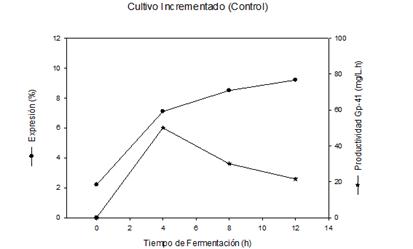
Fig. 3B Nivel de expresión y productividad del proceso de obtención de la proteína recombinante Gp-41 a nivel de 1.5 L, utilizando cultivo incrementado
Al desarrollar un proceso de fermentación mediante el sistema de cultivo incrementado es necesario tener en cuenta diferentes factores: características de la proteína exógena, la cepa hospedera, el promotor utilizado, el nivel de expresión y la localización de las proteínas recombinantes.9,10,21,22
El método de cultivo incrementado se basa en adicionar de forma escalonada la fuente de carbono (glucosa), inicialmente a un flujo de 0,25 mL/min a partir de las 2 h de cultivo, y a 035 mL/min después de las 5 h. De este modo se garantiza que la fuente de carbono sea añadida continuamente a bajos niveles para evitar que las altas concentraciones de glucosa inhiban el crecimiento celu
lar23, manteniendo la expresión de las proteínas recombinantes.6,24,25
La utilización del sistema de cultivo incrementado permitió obtener incrementos significativos en cuanto a los rendimientos productivos (4.8 veces el peso seco y 6.6 veces la productividad), manteniendo el nivel de expresión de la proteína recombinante.
La producción de acetato se incrementó a niveles inhibitorios del crecimiento celular (entre 10-12 g/L) a partir de las 6 h de cultivo, figura 3 A 6,26,27, por lo que el crecimiento se detiene a partir de ese momento, afectando además la productividad de la proteína de interés y la expresión de la proteína Gp-41 figura 3 B, al comparar estos valores con los obtenidos en el cultivo a templa figura 2 A y B. Resultados similares han sido reportados anteriormente para otras proteínas recombinantes expresadas en E.coli.6,19,20
La máxima productividad (50 mg/L.h) fue obtenida a las 4 h de cultivo figura 3 B, y después comienza a disminuir hasta el final del proceso fermentativo (20 mg/L.h). Sin embargo, el cultivo fue mantenido hasta las 12 h de fermentación, ya que está demostrado que este tiempo es necesario para lograr la total insolubilidad de la proteína recombinante, la cual se incrementa en función del tiempo de inducción y es necesaria para desarrollar el proceso de la purificación final de la proteína.5
Producción de la proteína Gp-41 a nivel de 1,5 L utilizando cultivo incrementado con la aplicación del campo magnético de baja frecuencia
Un cultivo incrementado similar al desarrollado en el acápite anterior fue estudiado, pero con la aplicación de un campo magnético de baja frecuencia (0,055 Tesla). Al aplicar esta nueva estrategia en el proceso productivo de la proteína recombinante, figura 4A, se observó una alta velocidad de crecimiento celular durante las primeras 8 h de cultivo, hasta alcanzar un peso seco de 7,29 g/L, y en consecuencia el nivel de oxígeno disuelto disminuyó hasta un 18,05 % y el CO2 producido se incrementó paulatinamente hasta un valor de 2,07%.
Posterior a las 6 h, la velocidad de crecimiento celular disminuye hasta el final del cultivo, donde se alcanza una concentración celular de 9,07 g/L de peso seco. En correspondencia con ese comportamiento el nivel de O2 disuelto comenzó a aumentar hasta valores de 19,24 % y el de CO2 disminuyó hasta 1,46 %.
La producción de acetato se incrementó de manera acelerada hasta las 8 horas de cultivo, como consecuencia de la alta velocidad de crecimiento celular, alcanzando valores de 6,8 g/L. A partir de ese momento disminuyó de forma rápida hasta 0,47 g/L a las 12 h.
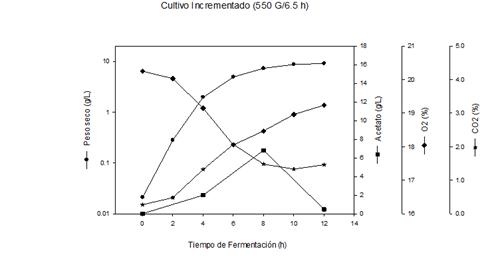
Fig. 4A Influencia del campo magnético, en el crecimiento celular y la concentración de metabolitos del proceso productivo de la proteína recombinante Gp-41, utilizando cultivo incrementado
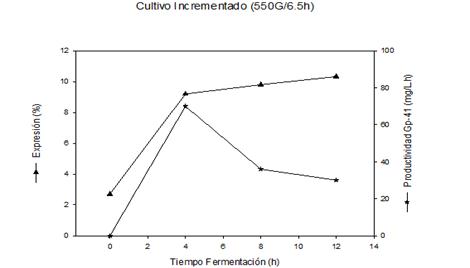
Fig. 4B Influencia del campo magnético, en el nivel de expresión y la productividad del proceso productivo de la proteína recombinante Gp-41, utilizando cultivo incrementado
En la figura 4B se observa que el nivel de expresión de la proteína recombinante se incrementó rápidamente a 9,2 % a las 4 h y aumentó solo ligeramente hasta 10,3 % al final del cultivo. La productividad del proceso fermentativo se incrementó hasta las 4 h de fermentación (70 mg/L.h) y a partir de ese tiempo, ocurrió una disminución brusca de 2,3 veces hasta obtener un valor de 30 mg/L.h a las 12 h de cultivo.
La aplicación del campo electromagnético de baja frecuencia, utilizando condiciones de inducción de 0,055 Tesla (550 G) y 6,5 h como tiempo de exposición, modifica la cinética de producción del metabolito acetato, reduciendo significativamente su formación figura 4A, si lo comparamos con el cultivo control figura 3A.
Se ha reportado que el acetato afecta la expresión de proteínas a concentraciones mayores de 5 g/L,. 6,27 Esto trae como consecuencia que al producirse las menores concentraciones de acetato (0,47 g/L) se alcancen los mejores rendimientos del proceso de producción.
Al ser comparado el cultivo incrementado donde se aplica el campo magnético figura 4ª, con el cultivo control figura 3ª, se observa un aumento del crecimiento celular de 2,3 %. Resultados similares han sido reportados por varios autores al evaluar el comportamiento del microorganismo E. coli no recombinante.28-30
De igual modo se comporta la expresión de la proteína de interés y la productividad del cultivo, con un aumento del 10 % y 66 % respectivamente, al comparar el cultivo donde se aplicó campo magnético figura 4B y el cultivo control figura 3B.
Los resultados obtenidos demuestran que los efectos del campo magnético de baja frecuencia sobre los cultivos celulares, dependen directamente del incremento en el tiempo de exposición y la magnitud de la inducción, ya que otros autores han reportado que la utilización de campos magnéticos homogéneos y no homogéneos entre 50 y 200 Gauss y tiempos de exposición menores (hasta 30 min) afectan negativamente la velocidad de crecimiento bacteriano.11,31
Estos efectos son debido a posibles modificaciones en la actividad de las enzimas o en el transporte de iones a través de la membrana celular y a cambios en la síntesis o transcripción del DNA y la formación de radicales libres producidos por la estimulación electromagnética.32,33
En los estudios realizados no se observaron efectos letales del campo electromagnético en condiciones de bajas frecuencias e inducción magnética aplicadas, demostrándose así que las mismas pueden ser utilizadas con buenos resultados en el aumento del rendimiento de los procesos fermentativos.
La tecnología desarrollada puede ser utilizada para la producción de proteínas recombinantes en E. coli, lo cual le confiere un carácter general.
Conclusiones
Se demostró que con la utilización del sistema de cultivo incrementado desarrollado, conjuntamente con la aplicación del campo magnético de extrema baja frecuencia, a una intensidad de 0,055 Tesla (550 G) y un tiempo de exposición de 6,5 h, se logran efectos positivos en la producción de la proteína recombinante GP-41 (HIV). Estas mismas condiciones pueden ser utilizadas para el aumento de los rendimientos de los procesos fermentativos de otras proteínas recombinantes producidas en E. coli