Introducción
Los tumores del estroma gastrointestinal (GIST) son raros representan del 1 al 3 % de todas las neoplasias primarias intestinales. Durante la década de 70 del pasado siglo se consideraban neoplasias derivadas del músculo liso y por lo tanto se clasificaban como leiomiomas, leiomioblastomas, sarcomas entre otros. Según Haliberto Armenteros B, 1 plantea que Mazur y Clarks son los primeros en utilizar el término de tumores estromales gastrointestinales en 1983.
Tienen su origen en las células intersticiales de Cajal que constituyen el marcapaso del aparato digestivo, el cual regula su motilidad. Los GIST constituyen los tumores mesenquimatosos más frecuentes del tubo digestivo, luego del adenocarcinoma y el linfoma. Con una incidencia a escala mundial de alrededor de 15 por millón de habitantes; lo que varía según región en Estados Unidos se describen entre 4 000 y 6 000 nuevos casos, mientras que entre 1998 y 2004 Suecia mostró una incidencia anual de 14,5 e Islanda reportó 11 por millón de habitantes, el Reino Unido 10 casos anuales y la incidencia en la población española clínicamente relevantes es de 1,1 casos por cada 100 000 personas. 1,2
En relación a su distribución según órgano afectado, un 60 % se ubican en el estómago, 30 % en el intestino delgado, 5 % en esófago y otras localizaciones de manera respectiva. Se presentan con mayor frecuencia entre la quinta y la séptima década de la vida, sin ninguna prevalencia en cuanto al género. En la mayoría de los casos la presentación clínica es inespecífica.
Para llevar a cabo el diagnóstico se requiere un alto índice de sospecha y recurrir a diferentes procedimientos, como son la endoscopia, ultrasonido y tomografía computarizada. El diagnóstico definitivo se hace por medio de inmunohistoquímica (IHQ), mediante la expresión del factor de crecimiento de la tirosina kinasa (CD 117) y proteína CD 34 (CD 34) que son positivos en 95 % de los casos. 2,3 Con el objetivo de exponer un caso de un tumor del estroma gastrointestinal de intestino delgado poco frecuente en la práctica médica se decidió realizar el artículo.
Caso clínico
Paciente de 77 años de edad, masculino, que fue atendido en el Hospital Universitario Amalia Simoni, por el servicio de urgencias, en el periodo 2016-2017; con antecedentes de hipertensión arterial para la cual cumple tratamiento, que presentó dolor abdominal, localizado en flanco derecho, de moderada intensidad, no irradiado, desde hace alrededor de ocho días. Al realizar el examen físico se constató una tumoración abdominal de aproximado 10 cm, no fija, dolorosa a la palpación y sin signos de reacción peritoneal. Se ingresó en la sala de Cirugía General para estudio y tratamiento, se realizó de manera inicial ecografía abdominal donde se visualiza en fosa ilíaca derecha imagen compleja a predominio ecogénico de 93x44 mm, y asa fija por detrás de la lesión.
En la tomografía axial contrastada se observó presencia de imagen heterogénea, hipodensa de 24 UH de 10x34 cm en la excavación pelviana derecha. Se discute en colectivo, cirujanos y gastroenterólogos, y con diagnóstico de tumor de colon, se decide laparotomía exploratoria, en el acto quirúrgico se encuentra en las últimas asas de yeyuno tumoración de 10 cm, con crecimiento exofítico, se realiza resección intestinal de alrededor de 12 cm y enterorrafia termino terminal, no adenopatías abdominales, ni metástasis hepática. Se realizó amplia toilette de la cavidad peritoneal y el cierre habitual. Se envió la muestra al departamento de Anatomía Patológica (Figura 1 y 2).

Figura 1 Aspecto macroscópico del tumor extirpado pediculado,ovalado y color pardo oscuro, con número de biopsia B17 2405

Figura 2 Tumor al corte de aspecto encapsulado, superficie heterogénea, con hemorragias y degeneración quística, con número de biopsia B17 2405
Se confirmó presencia del tumor epiteloide del estroma gastrointestinal de alto grado de malignidad, de 10 cm de diámetro mayor, con áreas de necrosis e índice mitótico de más de cinco mitosis (Figura 3 y 4).
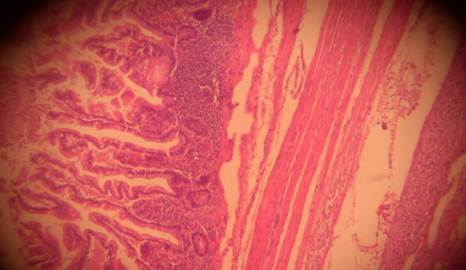
Figura 3 Tumor del estroma gastrointestinal Se observa células caliciformes y glándulas tubulares simples Debajo en la submucosa los componentes del tumor (H/E × 400)
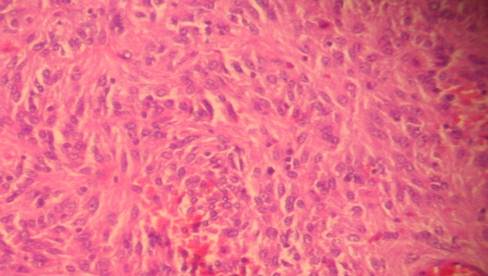
Figura 4 Tumor del estroma gastrointestinal, aspecto fusoredondo de sus células componentes (H/E × 400)
No tumor en los bordes de sección quirúrgico, se realizó estudios de inmunohistoquímica (IHQ) en el Centro de Referencia Nacional del Hospital Hermanos Almerjeiras lo cual arrojó: crecimiento de la tirosina kinasa (CD 117) y proteína CD 34 (CD 34) positivo XXX. Alfa actina negativa y S-100 negativos, proteína KIT (KIT) positiva en el 15 % de los núcleos tumorales. El paciente presentó una evolución satisfactoria y fue egresado a los nueve días, con seguimiento por consulta y pendiente a tratamiento oncológico.
Discusión
Como todos los tumores de intestino delgado, de difícil diagnóstico, en este caso, solo la laparotomía fue factible. Rara vez se desarrolla un tumor maligno a este nivel, aunque su incidencia ha aumentado en los últimos años. 3,4
Resulta importante resaltar lo que afirman Rivas L y Gómez V, (5 que el intestino delgado (ID) fue un territorio inaccesible para la endoscopia durante muchos años, hace referencia los autores que la enteroscopia por pulsión permite evaluar solo el yeyuno proximal, la radiografía tiene poca especificidad y baja capacidad en la detección de lesiones mucosas planas; la enteroscopia intraoperatoria, considerada como el gold standard en la evaluación de este órgano, es un procedimiento invasivo con elevada morbimortalidad.
La enteroscopia con cápsula endoscópica (ECE) y el ultrasonido endoscópico (UE) son técnicas útiles y sencillas que permite explorar el interior del intestino delgado (ID) de forma rápida y segura, al obtener imágenes en tiempo real a su paso por el tracto digestivo y la toma de biopsia poco invasiva de forma individual. 6
Sandoval Riveros C et al. 7 aluden a la enteroscopia con cápsula endoscópica (ECE) un rendimiento diagnóstico de 38 % al 83 %, con una sensibilidad del 95 % y una especificidad del 75 %, un valor predictivo positivo del 94 % al 97 % y uno negativo del 83 % al 100 %. La literatura revisada reporta resultados similares en relación al ultrasonido endoscópico como proceder diagnóstico y terapéutico al tener este proceder como desventaja la necesidad de un endoscopista bien entrenado. 1,4,5,6 A pesar de que existen varios procederes endoscópicos que permiten estudiar el intestino delgado el medio donde se diagnosticó el caso no cuenta con estas novedosas técnicas lo que hace más difícil el diagnóstico precoz de enfermedades a este nivel.
Manrique MN et al. (8 presentó un caso clínico de un paciente de 84 años que se le realizó el diagnóstico de tumor del estroma gastrointestinal (GIST) mediante el uso de la cápsula endoscópica (CE) de localización yeyunal. Depende de la histología, el cáncer del intestino delgado es tratable, y a veces curable. Luna Gozá MM et al. 4) plantean que los adenocarcinomas (mayoría de los casos), linfomas (poco comunes), sarcomas y tumores carcinoides (ocasionales) representan la mayoría de las neoplasias malignas, donde el estroma gastrointestinal es el menos encontrado, donde el yeyuno es la ubicación menos frecuente, solo pensando y al ver su aspecto macroscópico se pudiera sospechar el diagnóstico del tumor mencionado.
Pérez Tauriaux O et al. 9) refieren que el tamaño del tumor y el rango mitótico han sido los criterios más comunes usados para señalar el potencial maligno. Al respecto señalan que los tumores con menos de 2 cm de diámetro y con un conteo mitótico menor de cinco por 50 campos de gran aumento, son clasificados como de muy bajo riesgo; mientras que los de más de 5 cm de diámetro y el mismo conteo mitótico, como de alto riesgo. De hecho, los que se encuentran entre estas dos clases son los de riesgo intermedio. En ese sentido, los de más de 10 cm y con cualquier conteo mitótico, así como, los tumores de cualquier tamaño con un conteo mitótico mayor de 10 por 50 campos de gran aumento, también son de alto riesgo.
El sitio donde se encuentra el tumor es importante, pues los intestinales tienden a ser más agresivos, en relación a las localizaciones gástricas, lo cual coincide con el caso reportado. El tumor del caso que se presenta midió 10 cm, con un índice mitótico de más de cinco mitosis, considerado de alto potencial de comportamiento agresivo.
Los tumores del estroma gastrointestinal localizados en el intestino delgado constituyen la localización más infrecuente y difícil para el tratamiento de estas lesiones, Jiménez Cubedo E et al. 10) perciben tras la resección primaria de estos tumores, de un 40 a un 60 % de los pacientes desarrollarán una recidiva en un plazo de dos años, en forma de enfermedad metastásica o recurrencia local. El paciente hasta el momento no ha presentado manifestaciones descritas después de revisada la literatura, al tener en cuenta que el periodo libre de la enfermedad desde el acto quirúrgico hasta la realización del artículo no cumple con el periodo descrito.
Desde el punto de vista anatomopatológico, Landell Cruz J y Martínez Velázquez C, 11 corroboran que los Tumores del estroma gastrointestinal (GIST) exhiben tres patrones histológicos diferentes: fusiformes 70 %, mejor expectativa de vida; epitelial 20 % y mixtos 10 %. Según Verdecia Cañizares C et al. (12 plantearon que la forma de presentación es muy variable, al poder aparecer como pequeños nódulos asintomáticos encontrados de manera accidental junto con tumores agresivos y cuya sintomatología es inespecífica, como masa palpable o dolor abdominal lo que concuerda con el caso presentado, este último síntoma constituyó el motivo para recurrir a la asistencia médica.
Al revisar la literatura Verdecia Cañizares C et al. 12) describieron que la clave molecular del tumor del estroma gastrointestinal (GIST) se llama proteína KIT (KIT), que es una enzima capaz de iniciar una reacción química en cadena, necesaria para el funcionamiento normal de la célula. Landell Cruz J y Martínez Velázquez C, 11) plantean que la proteína KIT está pinchada a través de la membrana de la célula, con un extremo asomando al exterior y el otro alojado en el interior. La porción externa actúa como un sensor, y ante la presencia de determinados estímulos externos, la porción intracelular de KIT se activa. Esta activación da lugar a una serie de reacciones químicas en el interior de la célula que la modifican de manera radical en dos sentidos.
En primer lugar, comienza a multiplicarse a gran velocidad, en segundo lugar, estas células en multiplicación son inmortales; su vida no está limitada a un número finito de ciclos. En el medio estudiado se cuenta con recursos limitados para la realización de la IHQ por lo que se decidió enviar al Centro de Referencia Nacional de Anatomía Patológica lo que facilitó el diagnóstico preciso y a su vez el decidir tratamiento y así evitar la posibilidad de recidiva tumoral y con ello la invasión a otros órganos.
La valoración inicial de un GIST es similar a la evaluación de otros tumores gastrointestinales; (6 La TAC es esencial, mencionan Landell Cruz J y Martínez Velázquez C, 11 en el artículo Tumor del estroma gastrointestinal del estómago, la evaluación de la extensión tumoral y la presencia de metástasis, por su parte el seguimiento de los pacientes, se realiza por este medio diagnóstico, a los tumores de bajo riesgo se les realiza tomografía cada seis meses por cinco años, a los de gran riesgo o intermedio se le realiza cada tres o cuatro meses los tres primeros años, cada seis meses hasta el quinto año y anual los otros cinco años. El paciente reportado por ser un tumor de alto riesgo de malignidad se le realizó proceder contrastado a los tres meses de ser intervenido sin evidencias de recidiva o metástasis.
Al representar el tratamiento Ferrer Robaina H et al. 13) abordan que la cirugía es el tratamiento de elección, sin embargo, no se ha observado diferencias en la supervivencia a los cinco y diez años luego de una resección quirúrgica amplia o más limitada en los pacientes con tumores menores de cinco centímetros de diámetro y sin metástasis hepáticas en el momento del diagnóstico.
La laparotomía como procedimiento quirúrgico acercó al diagnóstico presuntivo del GIST del caso que se presentó, por sus características macroscópicas, donde en un inicio se sospechó posible neoplasia de colon.
El tratamiento por vía laparoscópica es una variante en el actuar frente a este tipo de tumor, pero según Martín Bourricaudy N y Martínez Alfonso MA, 3 se debe tener cuidado con la ruptura del mismo, lo que es equivalente en términos de pronóstico a una resección quirúrgica incompleta, los autores plantean además que la técnica es segura y con buen pronóstico oncológico. La identificación perioperatoria del sitio del tumoral es más importante que la talla para decidir una estrategia quirúrgica óptima, al incluir la extensión de la resección.
En pacientes en quienes la cirugía no puede ser curativa, según Ferrer Robaina H et al. 13 se autorizó el uso del mesilato de imatinib, que actúan por medio de la inhibición específica de la enzima tirosina quinasa, se administra como tratamiento paliativo, con escasas reacciones adversas. Mientras que Valdés-Peregrina EN et al. 14 refieren que el efecto terapéutico se basa en la exposición de las células tumorales positivas, este fármaco conduce al bloqueo de su actividad tirosina-quinasa considerada como crítica en la patogenia de estos tumores, detiene su proliferación e induce la apoptosis, dosificado con una duración de un año es capaz de prolongar la supervivencia libre de recaída en los tumores localizados y con diámetro de 3 cm o más con una resección macroscópica completa. Por lo tanto, la terapia adyuvante durante tres años es el tratamiento estándar de pacientes con un riesgo significativo de recaída. El paciente reportado está pendiente a cumplir tratamiento oncológico.














