INTRODUCCIÓN
El cáncer de mama es la segunda neoplasia más frecuente en el mundo y la más frecuente en mujeres, por lo que es considerado un importante problema de salud tanto en países desarrollados como en naciones del tercer mundo, con una incidencia anual de más de 1 000 000 de casos nuevos.1,2,3
De acuerdo con las estadísticas del proyecto GLOBOCAN, iniciativa de la Agencia Internacional de Investigación en Cáncer (IARC, por sus siglas en inglés), en 2020 el cáncer de mama fue la neoplasia maligna más común a nivel mundial (excluyendo el cáncer de piel no melanocítico) y fue, al mismo tiempo, el más frecuente en mujeres, con un estimado de 2 261 419 casos de cáncer de mama diagnosticados (24,5% del total de cánceres en mujeres) y provocó el 6,9% de las muertes por cáncer en el sexo femenino, por lo que es el cuarto cáncer en mujeres que más fallecimientos causa, solo precedido de los tumores malignos de pulmón, hígado y estómago. La incidencia a nivel mundial de cáncer de mama es de 47,8% casos por cada 100 000 mujeres.4
En Cuba, según el anuario estadístico del año 2021, en las féminas hubo una incidencia de cáncer localizada, en primer lugar, en la piel, y como segunda localización la mama, con 3 886 casos nuevos. En cuanto a la mortalidad, el cáncer de mama se ubicó en el segundo lugar en el sexo femenino, con una tasa de 30,4 por cada 100 000 mujeres, y fue desplazado solamente por los tumores de tráquea, bronquios y pulmón (tasa de 38,1 por cada 100 000 habitantes del sexo femenino).5
El cáncer de mama constituye un grupo de tumores que muestra un comportamiento biológico muy diverso y una gran variabilidad clínica. En el diagnóstico anatomopatológico de estas neoplasias se ha utilizado, tradicionalmente, la clasificación histológica basada en la morfología, en la que el carcinoma ductal es la variante más común;6 sin embargo, la clasificación histológica actual no refleja la heterogeneidad de los tumores en su comportamiento biológico ni permite identificar las pacientes que presentarán mejores respuestas y beneficios con las diferentes modalidades terapéuticas. Actualmente se asume que la diversidad clínica y pronóstica de los carcinomas mamarios que son semejantes y homogéneos en cuanto a su morfología y a sus factores pronósticos clásicos se establece a nivel molecular al expresar distintos genes que les confieren variabilidad en este sentido.3,6
Los avances en las técnicas biológicas moleculares han permitido la clasificación molecular simplificada del cáncer de mama con un panel de biomarcadores inmunohistoquímicos. En la actualidad se emplean decenas de marcadores en el estudio de las neoplasias de mama; sin embargo, los más conocidos y utilizados son: los receptores de estrógeno (RE), los receptores de progesterona (RP), el Her2 y el Ki-67, que definen el tratamiento y el pronóstico de la enfermedad.7
Los receptores hormonales de estrógeno (RE) y de progesterona (RP) son receptores acoplados a proteínas G y miembros de la superfamilia de receptores esteroideos. Estos receptores se activan al unirse con alta afinidad a las hormonas sexuales femeninas y, una vez activos, se comportan como factores de transcripción al unirse a los promotores de los genes blancos en sitios de pegado específicos.8 La determinación de estos receptores en el carcinoma de mama tiene valor predictivo y pronóstico, fundamentalmente los receptores de estrógeno como valor predictivo a la terapia antiestrogénica y los de progesterona como valor pronóstico.8,9
La mayoría (70-80%) de los carcinomas mamarios expresan RE y RP y, según la clasificación molecular, estos tumores se corresponden con el subtipo luminal.8,10 Estos tumores, a su vez, se subclasifican en:
Luminal A: son lesiones tumorales con un índice de proliferación celular (Ki67) bajo. Son positivos a la expresión de receptores hormonales (RE y RP), pero nunca sobreexpresan el oncogén Her2/neu. Suelen tener un buen pronóstico, con menos incidencia de recaídas y mayor índice de supervivencia. Presentan una alta tasa de respuesta a la terapia hormonal y un beneficio más limitado con la quimioterapia.10
Luminal B: son lesiones que además de expresar RE y RP (o ambos) pueden expresar el oncogén Her2. Suelen tener un índice de proliferación (Ki67) elevado y por lo general expresan menores niveles de RP que los tumores con subtipo luminal A. Representa el grupo de tumores luminales con peor pronóstico. Se benefician de la Hormonoterapia y en mayor por ciento de la Quimioterapia.8,9,10
En el Hospital “Celestino Hernández” se diagnostican cada año nuevos casos de carcinoma mamario, los que son sometidos a estudio inmunohistoquímico, que se realiza basado en los cuatro marcadores básicos: receptores hormonales (estrógeno y progesterona), Her2 y Ki67.
El presente estudio tuvo como objetivos determinar la incidencia de los subtipos luminales diagnosticados por inmunohistoquímica en el Hospital y conocer la relación de cada subtipo con otras variables clínico-patológicas clásicas de valor pronóstico en el carcinoma de la mama.
MÉTODOS
Diseño y población
Se realizó un estudio retrospectivo, de corte transversal en el Hospital Universitario Docente “Celestino Hernández” de la Ciudad de Santa Clara, Provincia de Villa Clara, del período comprendido de enero de 2017 a mayo de 2019. La población de estudio estuvo conformada por pacientes con diagnóstico histopatológico de carcinoma de mama infiltrante atendidas en la institución hospitalaria durante ese período de tiempo; las biopsias fueron sometidas a estudio inmunohistoquímico.
No se incluyeron en el estudio las pacientes con:
Diagnóstico histopatológico de carcinoma mamario “in situ” (no invasivo)
Estudio inmunohistoquímico incompleto por encontrarse en falta algún marcador en el momento del procesamiento o presentar la muestra de tejido algún artefacto que imposibilitara su adecuado estudio.
Variables del estudio
Subtipo molecular (inmunofenotipo): se refiere al perfil inmunohistoquímico de cada lesión tumoral determinado a través del estudio de los receptores hormonales (RE y RP), Her2 y Ki67. En el presente estudio fueron evaluados los subtipos moleculares del carcinoma mamario positivos a la expresión de receptores hormonales (subtipos luminales), los que se clasificaron de acuerdo a los criterios de Saint Gallen de 201510,11 de la siguiente forma:
Edad: variable cuantitativa discreta. Se define como la edad en años que presentaba cada paciente en el momento del diagnóstico.
Talla tumoral: variable cuantitativa continua. Se refiere al tamaño en centímetros de la lesión tumoral en el momento del diagnóstico. Fue dada en centímetros (cm). Aunque cada lesión fue medida en las tres dimensiones en el momento del estudio anatomopatológico, el diámetro mayor de cada lesión diagnosticada fue el que se tomó como referencia en esta investigación. En el análisis de la talla tumoral se utilizaron los rangos siguientes, los que fueron tomados de la clasificación TNM de los carcinomas mamarios:9
Tipo histológico: variable cualitativa nominal. Se refiere al tipo morfológico del tumor diagnosticado por microscopia óptica convencional. La histología de cada lesión tumoral diagnosticada se determinó de acuerdo a su morfología evaluada con la técnica de tinción de rutina (hematoxilina-eosina). Se utilizó la clasificación de la OMS (Organización Mundial de la Salud) vigente de 2019.12
Grado histológico: variable cualitativa ordinal. Se refiere al grado de diferenciación del tumor. Las lesiones diagnosticadas fueron graduadas histológicamente a través del score histológico de Nottingham, que corresponde al sistema de graduación de Scarff-Bloom-Richardson, modificado por Elston y Ellis. De acuerdo a este score se evaluó la formación de túbulos, el pleomorfismo nuclear y el conteo mitótico del tumor. Cada variable se identificó con un score 1, 2 o 3 y con la suma de los mismos se obtuvo el grado histológico total, según el que el grado 1 (score total=3 a 5 puntos) se corresponde con tumores bien diferenciados con un pronóstico favorable; el grado 2 (score total=6 a 7 puntos), con tumores moderadamente diferenciados con pronóstico intermedio y el grado 3 (score total=8 a 9 puntos), se corresponde con lesiones tumorales poco diferenciadas, con un comportamiento biológico más agresivo y un pronóstico desfavorable.9,10,13
Índice de proliferación celular (Ki67): variable cuantitativa discreta. Es una manera de medir que tan rápido crecen y se dividen las células cancerosas. Fue estudiada a través de técnicas de inmunohistoquímica mediante la determinación de Ki67 (proteína reguladora del ciclo celular), la que ha tenido un papel importante en la clasificación tumoral y, por lo tanto, es parte de los factores pronósticos y predictivos de los carcinomas mamarios. Valores altos para Ki-67 significan que muchas células se están dividiendo, por lo que el cáncer tiende a crecer y a propagarse más rápido.9
Recolección y manejo de datos
Los datos del estudio fueron obtenidos a partir de la revisión de las historias clínicas de los pacientes.
De acuerdo a la expresión de los marcadores se consideraron tumores RE y RP positivos a los que tienen tinción nuclear mínima del 1% de las células tumorales y Her2 positivos y cuando en el estudio inmunohistoquímico se observó una tinción intensa a nivel de toda la superficie de la membrana celular en más del 30% de las células tumorales (3+).
En la valoración del Ki67 se estableció el punto de corte de 20% (según el Consenso de expertos para el tratamiento del cáncer de mama, Saint Gallen, 2015) por debajo del que se consideró índice de proliferación bajo y por encima índice de proliferación alto.11,14
Se identificaron las lesiones tumorales positivas a la expresión de receptores hormonales (independientemente de la intensidad del marcaje) para determinar la incidencia de los subtipos luminales en los carcinomas mamarios diagnosticados en la institución hospitalaria durante el período señalado. Se determinó además la relación existente de cada subtipo luminal (A y B) con diferentes variables clínico-patológicas clásicas de conocido valor pronóstico.
Las variables de interés fueron recopiladas en una base de datos por métodos computarizados mediante la aplicación de Microsoft Excel para Windows versión 2016 (16.0), la que fue también empleada para la realización de los cálculos y los análisis estadísticos.
Análisis estadístico
Se examinó individualmente la distribución de cada una de las variables, se utilizaron tablas para mostrar la información recolectada y se mostraron los datos obtenidos en expresión nominal y porcentual.
Se calcularon la media y la desviación estándar en las variables cuantitativas, en el estudio del Ki67 se calculó además la mediana y el rango.
Se realizó la prueba Chi cuadrado en el estudio del grado histológico para determinar la asociación de esta variable con los subtipos luminales del carcinoma mamario. La prueba t de Student fue aplicada para comparar diferencias de medias. La significación estadística en ambas pruebas se estableció con un valor p˂0,05.
Aspectos éticos
El estudio se realizó solamente con historias clínicas de la institución hospitalaria, por lo que no existieron conflictos éticos al no intervenir pacientes directamente en la investigación. Se garantizó el anonimato de las identidades de los historiales utilizados. El acceso a las historias clínicas se realizó previa aprobación y con el permiso de la dirección de la institución.
RESULTADOS
Se estudiaron 281 pacientes con diagnóstico de carcinoma mamario infiltrante: 47 (16,7%) presentaron tumores con subtipo molecular luminal A, 164 (58,4%) fueron diagnosticadas con carcinomas de subtipo luminal B, 22 (7,8%) correspondieron al subtipo Her2/neu y 48 (17,1%) presentaron lesiones tumorales triple negativas. Estos resultados muestran que más del 75% de los tumores de mama diagnosticados correspondieron a los subtipos luminales, con la mayor incidencia para el inmunofenotipo luminal B.
En la Figura 1 se observa que el 70,1% de las pacientes con carcinomas luminal A y el 78,6% de las que presentaron lesiones tumorales luminal B tenían más de 50 años en el momento del diagnóstico, con la mayor incidencia en el grupo de edades entre 51 y 70 años en ambos subtipos luminales. La edad media de presentación fue también muy similar en ambos subtipos moleculares: 61,32 (±12,73) años en las pacientes con tumores luminal A y 60,73 (±7,78) años en las pacientes con lesiones tumorales luminal B. No hubo diferencia estadísticamente significativa entre las edades medias de los dos subtipos luminales (p=0,788).
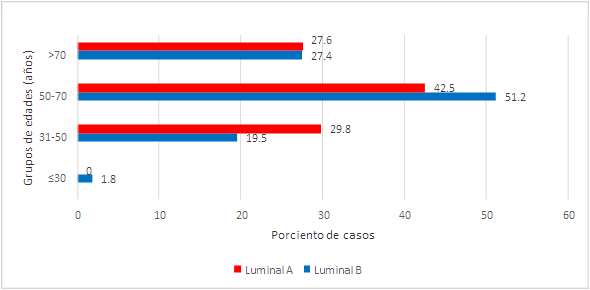 Fuente: historias clínicas
Fuente: historias clínicasFigura 1 Porciento de distribución de los subtipos luminales en carcinomas mamarios según grupo de edad
En relación a la talla tumoral 31 pacientes (65,96%) con lesiones tumorales luminal A presentaron tallas tumorales menores de 2 cm en el momento del diagnóstico y en 13 (27,66%) se informaron tumores mayores de dos y menores de 5 cm (˃ 2 y ≤ 5 cm). De las pacientes con tumores luminal B, 81 (49,39%) presentaron tallas tumorales mayores de dos y menores de 5 cm (Tabla 1). La talla tumoral media fue de 1,97 cm (±0,14) para el subtipo luminal A y 2,3 (±2,47) cm para el luminal B, lo que muestra una diferencia estadísticamente significativa (p=0,012) entre los dos subtipos moleculares, con una tendencia de los tumores luminal B a presentar tallas tumorales mayores en el momento del diagnóstico.
Tabla 1 Distribución de los subtipos luminales A y B en carcinomas mamarios según la talla tumoral (cm)

Fuente: historias clínicas
En relación al tipo histológico se informó el tipo histológico no especial (carcinoma ductal invasivo) en 29 pacientes (61,70%) con carcinomas mamarios con subtipo luminal A y en 135 (82,31%) con tumores luminal B, por lo que se observó un importante predominio de ese tipo histológico en ambos subtipos luminales. El tipo histológico lobulillar se notificó en segundo lugar por orden de frecuencia (Tabla 2).
Tabla 2 Distribución de los subtipos luminales A y B en carcinomas mamarios según el tipo histológico

Fuente: historias clínicas
Con respecto al grado histológico 35 pacientes (74,47%) con subtipo luminal A presentaron variantes histológicas moderadamente diferenciadas y en 10 (21,28%) se informaron grados histológicos moderadamente diferenciados. En cambio, en las lesiones tumorales con fenotipo luminal B, 109 pacientes (66,46%) tenían lesiones moderadamente diferenciadas y 34 (20,73%) lesiones poco diferenciadas (Tabla 3).
Aunque se observó un predominio del grado histológico 2 (moderadamente diferenciado) en ambos subtipos luminales, debe destacarse que una proporción importante de tumores con subtipo luminal B (20,73%) se asociaron a variantes histológicas poco diferenciadas y que las lesiones bien diferenciadas fueron informadas en mayor proporción en los tumores con subtipo luminal A (21,28%).
La asociación del grado histológico y el subtipo molecular fue estadísticamente significativa (p=0,018), lo que también traduce la mayor tendencia de los tumores luminal B a asociarse a variantes histológicas menos diferenciadas del carcinoma mamario.
Tabla 3 Distribución de los subtipos luminales A y B en carcinomas mamarios según el grado histológico
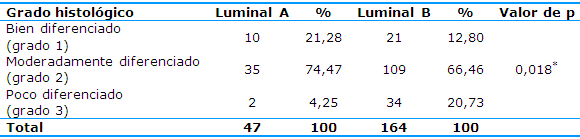
*Al considerar (por la prueba Chi-cuadrado de Pearson) las variables subtipo molecular y grado histológico se obtuvo una asociación estadísticamente significativa entre ambas variables (p=0,018)
Fuente: historias clínicas
En cuanto al índice de proliferación tumoral las lesiones con fenotipo luminal A tienen, por concepto, un índice de proliferación bajo (˂ 20%); sin embargo, los tumores luminal B pueden tener un índice de proliferación variable (alto o bajo). En la Tabla 4 se representa el índice de proliferación de las lesiones tumorales con subtipo luminal. Se puede apreciar que el 100% de los tumores con subtipo luminal A tenían un índice de proliferación bajo (˂ 20%); sin embargo, el 96,34% de los carcinomas con ese subtipo molecular tuvieron índices de proliferación alto (≥ 20%).
El índice de proliferación medio obtenido fue de 39% (±7,1%), con una mediana de 35% y un rango entre 10 y 90%.
DISCUSIÓN
Los resultados obtenidos en la presente investigación muestran que el subtipo luminal B se informó con una frecuencia mucho mayor. Estos hallazgos no son congruentes con la literatura científica consultada,7,9,10,13 en la que se refiere que el subtipo luminal A es el subtipo molecular que suele registrarse con mayor frecuencia (39-67%). En un estudio realizado en España6 el subtipo luminal A presentó una frecuencia del 62,5% (muy superior a la obtenida en el presente) y el subtipo luminal B fue se informó en el 18% de las pacientes estudiadas. En otras investigaciones también predominaron las lesiones tumorales con subtipo molecular luminal A, las que se identificaron en el 29,3%15 y en el 31%16 de los pacientes estudiados.
En un estudio realizado en Pakistán y publicado en 201817 se estudiaron 1 224 pacientes con carcinomas de subtipo luminal: 845 (69%) tuvieron lesiones con fenotipo luminal B y 379 (31%) fueron luminal A, por lo que se observó una incidencia muy superior de los tumores con subtipo luminal B.
Aunque el subtipo molecular luminal A suele ser el más frecuente en los diferentes estudios, este hallazgo no siempre es constante. Esas diferencias en cuanto a la incidencia de cada subtipo luminal en las distintas investigaciones realizadas a nivel mundial pueden explicarse por las variaciones en la expresión genética del carcinoma mamario en las diferentes regiones geográficas.
En cuanto a la edad, los resultados obtenidos por los autores concuerdan con los de un estudio6 en el que el 74,2% de las pacientes diagnosticadas con carcinomas mamarios luminal A y el 67,3% de las pacientes con lesiones luminal B también tenían más de 50 años en el momento del diagnóstico.
Los tumores con subtipos luminales también se presentaron con mayor frecuencia en pacientes con edades superiores a 50 años, con mayor incidencia en edades entre 51 y 70 años;17 sin embargo, las edades medias de las pacientes estudiadas fueron inferiores a las obtenidas en esta investigación, lo que mostró una tendencia marcada del subtipo luminal B a presentarse en pacientes más jóvenes. Desde el punto de vista estadístico, esa tendencia no fue significativa en la presente investigación, pero cabe destacar que la totalidad de las pacientes diagnosticadas con carcinomas mamarios en edades inferiores a 40 años presentaron tumores luminal B.
La talla tumoral es un factor pronóstico importante porque tiene una asociación directa con la sobrevida y el estado ganglionar en la paciente.9 Se ha postulado que los carcinomas con fenotipo luminal B tienen una mayor expresión de genes de proliferación y ciclo celular,9,10 por lo que tienden a crecer más rápido y a presentar mayor talla tumoral al diagnóstico que las lesiones luminal A. Esta afirmación fue corroborada por los resultados obtenidos en el presente estudio; sin embargo, en varias investigaciones realizadas se han obtenido hallazgos diferentes. Una investigación6 mostró que el 67,6% de las pacientes con tumores luminal A y el 59,1% de las lesiones luminal B tuvieron una talla inferior a 2 cm, por lo que se observó un predominio de las tallas tumorales relativamente pequeñas (˂ 2 cm) en ambos subtipos luminales. En otra investigación18 más del 50% de los carcinomas de ambos subtipos luminales presentaron tallas tumorales mayores de 2 cm al diagnóstico.
En relación al subtipo histológico el carcinoma de tipo no especial (carcinoma ductal infiltrante) fue el tipo histológico predominante en ambos subtipos luminales. El carcinoma de tipo lobulillar infiltrante se observó en segundo lugar en orden de frecuencia (23,4% de los casos en el subtipo luminal A y 12,2% de los casos en el subtipo luminal B). Resultados similares fueron obtenidos en otros estudios6,18 en los que el tipo histológico ductal fue el que se informó de forma predominante en todos los subtipos moleculares del carcinoma de la mama; y el tipo histológico lobulillar también se notificó en segundo lugar en orden de frecuencia, asociado principalmente a los subtipos moleculares luminales (luminal A y B).
Ese predominio de la histología no especial (carcinoma ductal) se explica por la elevada incidencia de ese tipo histológico (aproximadamente el 80%) dentro del total de carcinomas mamarios diagnosticados cada año.7,13,19,20
En cuanto al grado histológico los hallazgos obtenidos en el presente estudio fueron concordantes a los obtenidos en investigaciones realizadas.17,18 En una de estas también se encontró una asociación estadísticamente significativa del grado histológico con los subtipos moleculares del carcinoma mamario.17
En otro estudio realizado en Ecuador21 también se observó una mayor tendencia de los tumores luminal B a asociarse con las variantes histológicas poco diferenciadas del carcinoma de la mama.
El índice de proliferación determinado a través del marcador inmunohistoquímico Ki67 es un factor pronóstico y predictivo importante en el cáncer de mama, criterio de gran utilidad para subclasificar los subtipos luminales en luminal A y luminal B.14,19 En el subtipo luminal A el índice de proliferación siempre es bajo (˂20%), pero en el luminal B con baja expresión del receptor de progesterona (˂20%) o positivos al oncogén Her2 puede tener cualquier valor.
En esta investigación más del 90% de los carcinomas luminal B presentaron índices de proliferación alto (≥20%). Estas estadísticas son superiores a las obtenidas en un estudio realizado en Argentina22 en el que se estudiaron 147 pacientes con tumores luminal B, de las que 66 presentaron cifras de Ki67 superiores al 20%, lo que representó un 44,9%. La mediana de expresión del Ki67 en esa investigación fue de 25,9%, también inferior a la obtenida en la presente investigación.
El índice de proliferación elevado en una alta proporción de las pacientes con tumores luminal B es también un indicador importante de la tasa de crecimiento más rápida en este subtipo molecular del carcinoma mamario, lo que traduce un comportamiento biológico más agresivo de las lesiones diagnosticadas y un pronóstico más desfavorable.
Esta investigación tuvo la limitación de no contar con todas las variables clínicas de las pacientes al ser un estudio retrospectivo y no haber realizado seguimiento en las pacientes para observar supervivencia o respuesta al tratamiento; sin embargo, es un estudio muy útil en aras de lograr un mejor conocimiento acerca de los dos subtipos moleculares más frecuentes del carcinoma mamario y sus características clínico-patológicas. Esta investigación puede servir de referencia para otras investigaciones más amplias que puedan realizarse en el futuro acerca de este tema tan útil e importante.
CONCLUSIONES
La interpretación de los resultados de este estudio permite concluir que los subtipos moleculares de mayor incidencia en el carcinoma mamario son los luminales, con una incidencia mayor de los tumores luminal B. Los subtipos luminales A y B se presentaron con mayor frecuencia en mujeres con edad superior a 50 años y asociados, principalmente, al tipo histológico no especial. El subtipo luminal B presentó, con mayor frecuencia, una talla tumoral mayor de 2 cm en el momento del diagnóstico, mostró una mayor asociación con variantes histológicas poco diferenciadas del carcinoma mamario y tuvo, en un por ciento muy alto de pacientes, un índice de proliferación elevado, características que traducen un comportamiento biológico más agresivo y un pronóstico desfavorable. Se observó una asociación estadísticamente significativa entre los subtipos luminales del carcinoma mamario y la variable grado histológico.















