My SciELO
Services on Demand
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Cubana de Medicina
Print version ISSN 0034-7523
Rev cubana med vol.53 no.3 Ciudad de la Habana July.-Sept. 2014
TRABAJO ORIGINAL
Hemorragia subaracnoidea no aneurismática
Non-aneurysmal subarachnoid hemorrhage
Dr. Jesús Pérez Nellar, Dr. Claudio Scherle Matamoros, Dra. Marialis Gil Alfonso, Dr. Justo González González, Dr. Daniel Hierro García
Hospital Clinicoquirúrgico "Hermanos Ameiijeiras". La Habana, Cuba.
RESUMEN
Objetivo: determinar las características clínicas de hemorragia subaracnoidea aneurismática (HSA-A).
Métodos: estudio descriptivo basado en serie prospectiva de 204 pacientes con hemorragia subaracnoidea espontánea admitidos de forma consecutiva en la Unidad de Ictus del Hospital "Hermanos Ameijeiras" de La Habana, entre octubre de 2005 y diciembre de 2009.
Resultados: 165 pacientes tenían aneurismas cerebrales, 157 identificados por angiografía (155 en primer estudio y 2, en segundo) y 8 por necropsia. En 39 casos la causa fue no aneurismática. En 8 pacientes se reconocieron las causas: moya moya (2 casos), angioma venoso cerebral (2 casos), malformación arteriovenosa (MAV) espinal, MAV dural, disección arterial del sistema vertebro-basilar y apoplejía pituitaria. En 31 enfermos (15,2 %) la hemorragia fue criptogénica, se encontraron variantes anómalas de drenaje venoso en 4 de ellos. La HSA-NA se asoció a menor frecuencia de hipertensión (p= 0,029) y tabaquismo (p= 0,025). Se observó vasospasmo angiográfico en 55 casos (33,3 %) con aneurismas y en 1 con HSA-NA (2,6 %) (p< 0,001), vasospasmo sintomático en 25 casos con aneurismas (15,2 %) y en ninguno con HSA-NA (p= 0,063). Hubo resangrado en 31 casos (18,8 %) con HSA-A y solo en 1 con HSA-NA (2,6 %) (p= 0,024). El resultado final al egreso medido por la escala de Rankin modificada fue mejor en la HSA-NA (p= 0,002). Hubo 25 fallecidos (15,2 %) con aneurismas y ninguno con HSA-NA (p= 0,02).
Conclusiones: la HSA-NA tiene buen pronóstico. Las investigaciones neurovasculares no permiten identificar su causa en la mayoría de los casos.
Palabras clave: hemorragia subaracnoidea, ictus, aneurismas cerebrales.
ABSTRACT
Objective: determine the clinical characteristics of nonaneurysmal subarachnoid hemorrhage (ASH-A).
Methods: a descriptive study was conducted of a prospective series of 204 patients with spontaneous subarachnoid hemorrhage consecutively admitted to the Stroke Unit at Hermanos Ameijeiras Hospital in Havana from October 2005 to December 2009.
Results: 165 patients had cerebral aneurysms, of which 157 were identified by angiography (155 in the first study and 2 in the second), and 8 by necropsy. In 39 cases the cause was non-aneurysmatic. The following causes were identified in 8 patients: moyamoya disease (2 cases), cerebral venous angioma (2 cases), spinal arteriovenous malformation (AVM), dural AVM, artery dissection of the vertebrobasilar system and pituitary apoplexy. 31 patients (15.2 %) had cryptogenic hemorrhage, and four presented anomalous venous drainage. NA-SAH was associated with a lower frequency of hypertension (p= 0.029) and smoking (p= 0.025). Angiographic vasospasm was observed in 55 cases with aneurysms (33.3 %) and in one case with NA-SAH (2.6 %) (p< 0.001). Symptomatic vasospasm was observed in 25 cases with aneurysms (15.2 %) and in none with NA-SAH (p= 0.063). There was rebleeding in 31 cases with A-SAH (18.8 %) and in only one case with NA-SAH (2.6 %) (p= 0.024). The final outcome at discharge measured with the modified Rankin scale was better for NA-SAH (p= 0.002). There were 25 deaths with aneurysms (15.2 %) and none with NA-SAH (p= 0.02).
Conclusions: NA-SAH has a good prognosis. In most cases neurovascular research is unable to identify its cause.
Key words: subarachnoid haemorrhage, stroke, cerebral aneurysms.
INTRODUCCIÓN
El término hemorragia subaracnoidea no aneurismática (HSA-NA) se aplica a los casos con hemorragia subaracnoidea (HSA) cuando los estudios neurovasculares pertinentes no demuestran la presencia de aneurismas intracraneales. Si se encuentra la causa de la hemorragia, se clasifica como HSA de causa demostrada, pero si la causa del sangrado permanece incierta, se nombra HSA criptogénica.1-3
La mayoría de las investigaciones sobre la etiología y el pronóstico de la HSA se han centrado en los casos con aneurismas cerebrales, sin embargo, las causas no aneurismáticas no han recibido igual atención. Con este estudio se trata de determinar las características clínicas de este subgrupo de hemorragia subaracnoidea.
MÉTODOS
Se realizó un estudio prospectivo, longitudinal descriptivo de pacientes con diagnóstico de HSA no aneurismática, admitidos en la Unidad de Ictus Agudo del Hospital "Hermanos Ameijeiras", de La Habana, entre octubre del 2005 y diciembre del 2009, donde la atención de los pacientes es protocolizada y existe un registro continuo de los datos. Los protocolos de atención han sido publicados previamente.4,5
Criterios y definiciones
Se estableció el estado clínico de los pacientes al ingreso con la aplicación de la escala de la Federación Mundial de Cirujanos Neurológicos (FMCN).6,7
En todos los casos se realizó TAC de cráneo no contrastada y se clasificó el grado de sangrado según la escala de Fisher.7 A los pacientes con TAC de cráneo no contrastada normal, se les realizó punción lumbar para verificar la presencia de bilirrubina en el líquido cefalorraquídeo.
Se consideró patrón de sangrado perimesencéfalico, según los criterios de Rinkel,8 cuando en la TAC de menos de 72 h, la hemorragia estaba localizada por delante del meséncefalo o protuberancia, con extensión a la parte anterior de la cisterna ambiens o sin ella, en la parte basal de la cisura silviana lateral, sin relleno completo de la cisura interhemisférica anterior y sin componente intraventricular, excepto el producido por efecto de sedimentación. Cuando no se cumplieron estos criterios fueron clasificados como patrones no perimesencéfalicos.
Se realizó estudio angiográfico, angiografía por substracción digital (ASD) o angioTAC, en todos los enfermos cuyo estado clínico lo permitió, mientras que en los que fallecieron antes de poder realizarlo, se confirmó el diagnóstico en la necropsia. Cuando no se encontró la causa de la hemorragia se repitió el examen entre la segunda y la tercera semanas. Se eligió la prueba a realizar de acuerdo con el juicio clínico, teniendo en cuenta la causa más probable que limitara la identificación del aneurisma en el estudio inicial.
La ASD se realizó mediante cateterización selectiva de los vasos cerebrales, por el método de Seldinger, en un equipo Phillips Integris Allura, con obtención de vistas anteroposteriores, laterales y laterales oblicuas de los territorios arteriales carotídeo y vertebrobasilar.
Para la angioTAC se usó un tomógrafo helicoidal multicorte Phillips de 16 canales, con aplicación de contraste no iónico por vía venosa antecubital. Las imágenes axiales se reconstruyeron en la computadora de la estación de trabajo, con un grosor de 0,625 mm, se obtuvieron vistas tridimensionales, con supresión de las estructuras óseas circunvecinas, en fases arterial y venosa.
Los resultados de la ASD y la angioTAC fueron evaluados por radiólogos, neurólogos y neurocirujanos con experiencia en enfermedades cerebrovasculares. Se determinó la presencia, localización, cantidad, forma y tamaño de los aneurismas. En ausencia de estos se buscaron otras alteraciones arteriales y/o venosas que pudieran explicar el sangrado. Cuando se constató la fuente de la hemorragia se planteó una HSA-NA de causa demostrada, mientras que los casos con, al menos, 2 estudios neurovasculares negativos se clasificaron como HSA criptogénica. Se estudió el drenaje venoso y se catalogó en tipo A, B o C, según la clasificación de Watanabe. Se consideró tipo A cuando la vena basal de Rosenthal drenaba hacia la vena de Galeno; B, en presencia de un drenaje discontinuo: anteriormente hacia la vena uncal y, posteriormente, hacia la vena de Galeno y C, cuando la vena no drenaba en el sistema galénico, sino directamente en los senos durales. Ante la sospecha de una MAV espinal se obtuvo un examen de RMN de la región.
Todos los pacientes fueron monitorizados por ultrasonografía Doppler transcraneal (DTC) desde su llegada a la Unidad de Ictus, mediante un equipo DWL Embodop. Se realizaron registros diarios hasta que se produjo la resolución de los signos sonográficos y/o clínicos de vasospasmo o hasta el día 14 en los que no lo presentaron, los pacientes con angiogramas normales y patrón perimesencefálico fueron estudiados en días alternos. Se determinó la presencia de vasospasmo en la arteria cerebral media cuando las velocidades de flujo medias eran mayores de 120 cm/s. Se consideró vasospasmo ligero si estaban entre 120-159 cm/s, vasospasmo moderado entre 160-199 cm/s, vasospasmo intenso ³ ³ 200 cm/s. Se aceptaron diferencias ínterhemisféricas ³ 30 %.
Se diagnosticó vasospasmo angiográfico si había una disminución de más del 25 % del calibre arterial, de al menos una arteria intracraneal, de forma segmentaria o en rosario.
Se consideró vasospasmo sintomático la aparición de signos focales, en pacientes con vasospasmo comprobado por DTC o angiografía, entre los día 4 y 21 de la HSA, que no fuesen provocados por hidrocefalia, desequilibrio hidroelectrolítico, resangrado u otra causa probable.
Los pacientes fueron tratados según el protocolo de actuación establecido en la unidad de ictus.4,5 El presillado aneurismático o la terapia endovascular fueron realizados a los que cumplían con los criterios para ellos. Todos los enfermos recibieron tratamiento profiláctico del vasospasmo con nimodipino: 60 mg/4 h, por vía oral y sulfato de magnesio al 10 %: 80 mmol/d en infusión endovenosa. La prevención y reversión de la isquemia mediante la terapia de las 3 H (hipertensión, hipervolemia y hemodilución) se aplicó a casos seleccionados, según el estado clínico y el resultado de los estudios complementarios.
El estado del paciente en el momento del egreso fue evaluado según la escala de Rankin modificada (0-6 puntos), que incluye la mortalidad y se analizó de manera dicotomizada. Consideramos a los pacientes con valores entre 0 y 2 como afectados de forma leve, y a los que tenían valores superiores a 2, con afectación intensa.
Los pacientes fueron estratificados en 2 grupos de acuerdo con la etiología.
- Grupo 1: Pacientes con HSA aneurismática.
- Grupo 2: Pacientes con HSA no aneurismática.
Estos grupos fueron comparados en relación con las siguientes variables: edad, sexo, color de la piel, intensidad de los síntomas según la escala de la FMCN, intensidad del sangrado en la TAC según la escala de Fisher,6 patrón de sangrado en TAC no contrastada inicial, antecedentes patológicos personales, antecedentes familiares de HSA, adicción al cigarro, alcoholismo, presión arterial sistólica al ingreso, alteraciones electrocardiográficas, desequilibrio hidroelectrolítico, neumonía, hidrocefalia, vasospasmo sintomático, resangrado, estancia hospitalaria, mortalidad y estado clínico al egreso según la escala de Rankin modificada.
Técnicas para procesamiento y análisis de los resultados
Los datos se recogieron de forma prospectiva en la base de datos de la Unidad de Ictus del hospital y fueron procesados por medio del paquete estadístico Statistical package for Social Sciences (SPSS-PC), versión 11.5.
Se emplearon medidas de resumen de estadística descriptiva (frecuencia absoluta y relativa). Para las variables categóricas se realizaron pruebas no paramétricas: tablas de contingencia de 2 entradas, prueba de chi cuadrado para independencia de 2 variables, con significación asintótica por debajo de 0,05 y corrección por continuidad de Yates. La prueba binomial basada en aproximación Z se utilizó para contrastar frecuencias observadas con las esperadas. Para las variables cuantitativas se empleó la prueba t de Student para muestras independientes (todas las muestras eran > 30), con prueba de Levene para contraste de comparación de varianzas poblacionales.
Ética de la investigación
Los procederes diagnósticos y terapéuticos se realizaron con consentimiento informado del paciente o sus familiares. Les fue comunicado que formarían parte de una investigación y solo se procedió a su inclusión cuando dieron su consentimiento. La información personal se conservó confidencialmente.
RESULTADOS
Se estudiaron 204 pacientes con HSA espontánea, con edad media de 47,5 ± 12 años y predominio femenino, otras características generales de los casos estudiados aparecen en la tabla 1.
En la figura 1 se muestra la secuencia diagnóstica realizada. Se realizó angiografía a 196 casos (96,1 %), ASD en el 32,4 % y angioTAC en el 63,7 %. En 8 enfermos (3,9 %), ocurrió un resangrado temprano y no se pudo estudiar la anatomía vascular en vida, la necropsia demostró que la causa de la HSA era aneurismática.
Por estudios de neuroimagen se identificaron aneurismas cerebrales en 155 pacientes (76 %). Se hallaron otras causas no aneurismáticas de sangrado en 8 enfermos (3,9 %), mientras que en 33 (16,2 %), el estudio inicial fue negativo. En estos, el segundo estudio neurovascular demostró la presencia de aneurismas en 2 casos (6,1 %), 0,98 % del total. La localización de los aneurismas "ocultos" en el primer examen fue la arteria pericallosa y la porción supraclinoidea de la arteria carótida interna derecha. Por tanto, el total de pacientes con aneurismas intracraneales identificados por angiografía ascendió a 157 (76,9 %), la cifra final de pacientes con HSA aneurismática fue 165 (80,9 %) y la de HSA-NA, 39 (19,1 %).
En 31 pacientes (15,2 %) no se pudo demostrar la causa del sangrado y se clasificaron como HSA criptogénica, en 4 de ellos se identificó la presencia de variantes de drenaje venoso relacionadas con HSA.
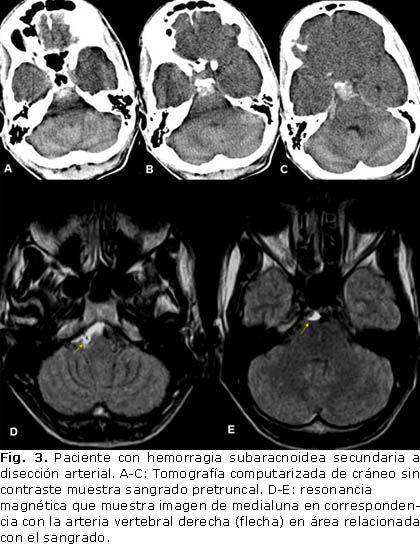
Las causas de HSA-NA identificadas fueron: 1 caso de apoplejía pituitaria (Fig. 2) y otro con disección arterial del sistema vertebro-basilar (Fig. 3); 2 pacientes tenían un patrón vascular tipo moya moya, un varón de 24 años con antecedentes de anemia drepanocítica (Fig. 4) y una mujer de 64 años, sin factor causal atribuible; en 4 enfermos existían malformaciones vasculares: 2 angiomas venosos (Fig. 5), una MAV espinal y una MAV dural. Los angiomas venosos estaban presentes en 2 mujeres, de 20 y 39 años, respectivamente, sin antecedentes de interés. La MAV espinal se localizó en la región cervical, paciente femenina de 26 años. La MAV dural se halló en un hombre de 54 años con antecedentes de trauma craneal.
Se encontraron anomalías del drenaje venoso en 4 enfermos con HSA criptogénica y patrón de sangrado perimesencefálico, uno de ellos presentaba una vena gruesa paralela a la vena basal de Rosenthal que drenaba al seno recto, en 2 se encontró un drenaje tipo C, según la clasificación de Watanabe, y en 1 caso se apreció una estenosis distal de la vena de Galeno en la conformación del seno recto así como en la porción inicial de este. El patrón de sangrado en la HSA aneurismática fue variable, mientras que en la HSA no aneurismática 9 casos presentaron TAC negativa; 14, patrón de sangrado perimesencefálico y 16, patrón no perimesencéfalico. Los patrones de sangrado en la HSA criptogénica fueron: TAC negativa en 8 casos, patrón perimesencefálico en 10 y patrón no perimesencéfalico, en 13. Mientras que en los de causa demostrada fueron: TAC negativa, en 1 caso; patrón perimesencefálico, en 4 y patrón no perimesencéfalico, en 3. La frecuencia de HSA criptogénica con patrón perimesencefálico del total de casos con HSA analizados fue de 4,9 %.
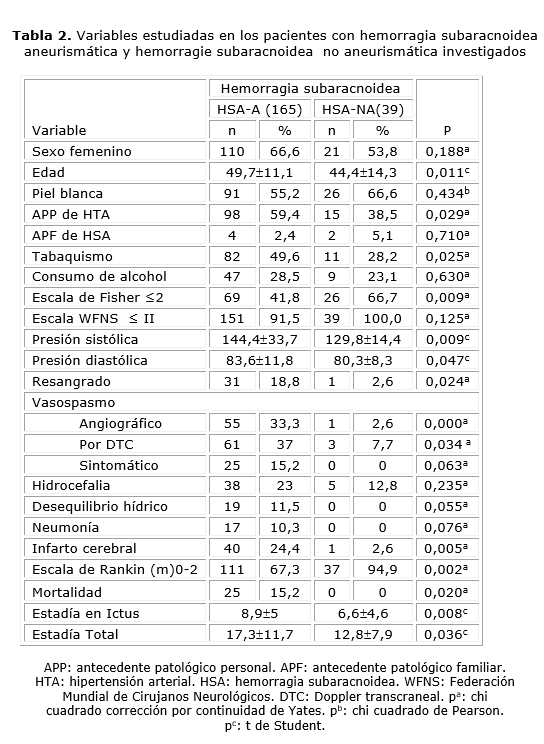
En la tabla 2 se muestran los resultados de la comparación de los pacientes con HSA-NA con los de causa aneurismática. Los del primer grupo resultaron más jóvenes (p= 0,011). La hipertensión fue más común en los casos con aneurismas (p= 0,029) y también la tensión arterial tomada en el momento del ingreso fue significativamente mayor en este grupo, tanto los valores sistólicos (p= 0,009) como los diastólicos (p= 0,047). El consumo de tabaco fue también más prevalente en los casos aneurismáticos (p= 0,025).
En la HSA-NA predominaron valores de la escala de Fisher ≤ 2 (p= 0,009). También predominaron los casos con grados favorables en la escala WFNS (tabla 2), aunque esta diferencia no fue significativa (p= 0,125).
Los pacientes con aneurismas mostraron más complicaciones durante la hospitalización, mientras en el grupo con HSA-NA fueron menos frecuentes, aunque 12,8 % presentó hidrocefalia y 2,6 % infarto cerebral, complicación de ASD (tabla 2). La media de estadía fue mayor en la HSA-A, como se observa en la tabla 2.
En ambos grupos predominaron los pacientes con un puntaje en la escala de Rankin, modificada, al egreso ≤ 2 % (p= 0,002). Hubo 25 fallecidos en el grupo de pacientes con HSA-A (tabla 2), sin reportarse en la HSA-NA (p= 0,020).
DISCUSIÓN
La HSA-NA representó la quinta parte de los casos HSA espontánea admitidos en la Unidad de Ictus del Hospital "Hermanos Ameijeiras" durante el período estudiado, esta frecuencia fue similar a la publicada por otros investigadores, que oscila en un rango entre 15 % y 20 %,1-3 aunque si se tiene en cuenta que se excluyeron los casos más graves, la proporción es relativamente alta, ya que la frecuencia de aneurismas es mayor en las formas más graves de HSA.
Varios factores pueden encubrir un aneurisma cerebral en la angiografía. Entre ellos se pueden citar que el saco aneurismático sea < 3 mm, la trombosis del contenido y el vasospasmo del cuello aneurismático o de su arteria madre con paso restringido del contraste a su interior. A ello se suman errores técnicos y limitaciones de la investigación escogida, por ejemplo la no disponibilidad de ASD tridimensional.8,9
La proporción de aneurismas inicialmente ocultos se comportó como en otras series y las causas de fracaso de la investigación neurovascular inicial encontradas en este trabajo han sido descritas por otros autores previamente.10
En 2 pacientes no se visualizaron aneurismas en el primer estudio angiográfico. En uno de ellos el fracaso de la investigación fue motivado por las limitaciones espaciales de la ASD, no se logró un ángulo adecuado que permitiera visualizar el aneurisma, que fue enmascarado por otras estructuras vasculares. El otro caso, que tenía un patrón de sangrado difuso no perimesencefálico, con mayor organización en la cisura interhemisférica, tenía una angioTAC negativa, y se decidió realizar como segundo estudio vascular una ASD, mediante la cual se encontró un aneurisma de menos de 3 mm en la arteria pericallosa. El pequeño tamaño del saco aneurismático y la localización distal fueron los factores que determinaron su no identificación en la prueba inicial.
El hallazgo de 2 aneurismas ocultos confirma la necesidad de realizar un segundo estudio angiográfico cuando la prueba inicial es negativa.
Varias enfermedades pueden ocasionar la HSA aunque los aneurismas constituyen la causa primordial,11,12 lo que observamos en 8 pacientes de esta investigación. En 4 de ellos las alteraciones eran susceptibles de encontrarse en la fase arterial de la angiografía (MAV y enfermedad de moya moya), mientras otras necesitaron estudiar de forma detallada la fase venosa (angiomas venosos) o la realización de RMN (disección arterial, aploplejía pituitaria y MAV espinal).
El consumo de drogas ilícitas no fue encontrado como factor etiológico en ninguno de los casos, por lo que parece no constituir una causa importante en nuestro medio.
Si bien la ASD continúa siendo la prueba de oro para el diagnóstico etiológico en la HSA, la RMN y la angioTHMC pueden ser pruebas complementarias importantes para identificar otras causas no aneurismáticas. La angioTHMC tiene la ventaja de permitir mejor evaluación de la circulación venosa. Esto fue de utilidad para identificar angiomas venosos y estudiar las variantes del drenaje venoso, comprobadas en 4 de los enfermos con HSA criptogénica con sangrado peri-mesencefálico, uno de estos casos fue publicado previamente.13
Watanabe y otros hallaron que los pacientes con HSA-NA con sangrado peri-mesencefálico presentaban con más frecuencia drenajes venosos primitivos,14 algunos autores como van der Schaaf y otros han corroborado estos hallazgos.15 La hipertensión venosa producida por estenosis de la vena de Galeno también se ha propuesto como causa de esta entidad.16 Aunque estas anomalías se han propuesto como fuentes de la HSA con sangrado peri-mesencefálico, tanto en las series de Watanabe, como las de van der Schaaf y la presente, no pueden explicar la mayoría de los casos. En la medida que avancen los medios diagnósticos o la manera de interpretar los actuales, el grupo de la HSA criptogénica podría disminuir, tal y como han demostrado van Rooij y otros, con el uso de la angiografía rotacional tridimensional (3DRA) para detectar aneurismas menores de 3 mm, usualmente no visibles en la ASD clásica.8,9
Ninguna variable clínica permite predecir de manera absoluta la presencia o no de aneurismas cerebrales, aunque determinados factores se asocian a mayor riesgo de aneurismas cerebrales. Audibert y otros17 confirmaron el rol preponderante del tabaco (riesgo multiplicado por 3), la HTA (riesgo multiplicado por 2,5) y el consumo de alcohol superior a 150 g/sem (riesgo multiplicado por 1,5) en la HSA en general. El presente estudio demuestra una relación inversa entre la hipertensión y la adicción al cigarro con la etiología no aneurismática, lo que coincide con reportes previos.16 Otros factores de riesgo invocados son la historia de aneurismas en familiares de primer grado, el sexo femenino, la piel negra y los antecedentes personales de enfermedad poliquística renal.17,18 En este estudio, los antecedentes de HSA no resultaron significativos, pero sí coincidió el predominio del sexo femenino con las cifras reportadas de 60-70 %.17 Aunque otros autores han encontrado supremacía del sexo femenino en la HSA-A y no en la HSA-NA,18 esto no se observó en esta serie. Tampoco se encontró enfermedad poliquística renal y predominaron los pacientes de piel blanca.
El resangrado y el vasospasmo son complicaciones relacionadas con los aneurismas cerebrales, lo cual confirma la marcada asociación de estas complicaciones con la HSA aneurismática encontrada en este estudio; sin embargo, aunque inusuales, fueron observadas también en algunos casos con HSA-NA.
Los índices de vasospasmo en pacientes con HSA-NA en series previas oscilan de 0-15 %.19 El vasospasmo angiográfico en estos casos suele ser leve y focal, con predominio de la circulación posterior, aunque se han reportado casos con vasospasmo intenso difuso.19 El vasospasmo sintomático es raro, aunque Mayor y otros reportaron un caso con vasospasmo sintomático.20 En la presente muestra no se evidenció vasospasmo sintomático en los casos con HSA-NA, el vasospasmo angiográfico constatado fue leve y el vasospasmo por DTC se encontró solo en pacientes con patrón no perimesencéfalico, lo que ha sido reportado en otras series como la de Hui y otros,21 no obstante, su evolución clínica fue satisfactoria.
Muchos casos de HSA-NA se asocian a sangrado de origen venoso, lo que pudiera explicar la menor frecuencia e intensidad, así como el mejor pronóstico de esta complicación.
El único caso con HSA-NA que resangró fue una paciente con patrón vascular tipo moya moya. Esta condición que suele producir eventos isquémicos en la infancia, en pacientes adultos se asocia a hemorragias. Se ha señalado que la causa de la hemorragia pueda deberse a la ruptura de pequeños aneurismas, en cuyo caso el resangrado es habitual; o a la ruptura de alguna de las múltiples colaterales que están sometidas a un gran estrés hemodinámico. A pesar que el resangrado de la paciente fue precoz, lo que podría relacionarse con la ruptura de un aneurisma, el estado y la evolución clínica posteriores no fueron los habituales de una HSA-A.
La evolución de los casos con HSA-NA fue más favorable, lo que se reflejó en el resultado final al egreso medido por la escala de Rankin modificada y la mortalidad, nula en estos casos, a diferencia de la HSA aneurismática con una mortalidad de 15,2 %. La menor asociación de vasospasmo, resangrado, hidrocefalia, así como complicaciones médicas (sepsis respiratoria, urinaria, desquilibrio hidroelectrolítico) y la menor estadía de los pacientes con HSA-NA demuestran el mejor pronóstico de estos en relación con la HSA-A, lo que coincide con los reportes analizados.11,19,22-26 Además, se halló que en la HSA criptogénica los pacientes que más se complicaron fueron los que no tenían patrón perimesencéfalico, lo que coincide con los reportes en la literatura.25 El presente trabajo se limitó a valorar la evolución durante la estancia intrahospitalaria, por lo que el pronóstico a largo plazo no se pudo establecer. Los estudios sobre la evolución a largo plazo de los casos con HSA-NA coinciden en su curso más favorable, particularmente los que presentan sangrado peri-mesencefálico.21-26
Esta investigación ofrece datos que refuerzan la necesidad de incluir en los protocolos de atención de la HSA estrategias diagnósticas que permitan la identificación de aneurismas ocultos y de otras causas menos comunes de HSA, incorporando los criterios clínicos, el patrón de sangrado en la TAC inicial, investigaciones como la RMN, venografía por angioTHMC y otras pruebas guiadas por un juicio clínico adecuado.
REFERENCIAS BIBLIOGRÁFICAS
1. Van Gijn J, Kerr RS, Rinkel GJE. Subarachnoid haemorrhage. Lancet. 2007;369:306-18.
2. Bruder N. Hémorragie sous-arachnoïdienne non anévrismale. Annales Françaises d'Anesthésie et de Réanimation. 2007;26:954-8.
3. Andaluz N, Zuccarello M. Yield of further diagnostic work-up of cryptogenic subarachnoid hemorrhage based on bleeding patterns on computed tomographic scans. Neurosurgery. 2008;62:1040-7.
4. Pérez-Nellar J, Scherle-Matamoros C, Roselló Silva H. Unidad de Ictus Agudo. Un nuevo concepto asistencial. Acta Médica. 2009 [citado 25 feb 2012];12. Disponible en: http://bvs.sld.cu/revistas/act/vol12_1_09/act02109.htm
5. Pérez-Nellar J, Roselló Silva H, Scherle Matamoros C, González J, Hierro Garcia D, De Jongh Cobo E. Grupo multidisciplinario de ictus. En: Rodriguez Silva H, Galego Pimentel D, Negrín Villavicencio JA, editores. Grupos multidisciplinarios del Hospital Hermanos Ameijeiras. La Habana: Editorial Ciencias Médicas; 2008.
6. Rosen DS, Macdonald RL. Grading of subarachnoid hemorrhage: modification of the World Federation of Neurosurgical Societies scale on the basis of data for a large series of patients. Neurosurgery. 2004;54:566-75.
7. Lindvall P, Runnerstam M, Birgander R, Koskinen LO. The Fisher grading correlated to outcoome in patients with subarachnoid haemorrhage. Br J Neurosurg. 2009;23(2):188-92.
8. Van Rooij WJ, Sprengers ME, de Gast AN, Peluso JP, Sluzewski M. 3D rotational angiography: the new gold standard in the detection of additional intracranial aneurysms. AJNR. 2008;29(5):976-9.
9. Van Rooij WJ, Peluso JP, Sluzewski M, Beute GN. Additional value of 3D rotational angiography in angiographically negative aneurysmal subarachnoid hemorrhage: how negative is negative? AJNR. 2008;29(5):962-6.
10. Inamasu J, Nakamura Y, Saito R, Horiguchi T, Kuroshima Y, Mayanagi K, et al. "Occult" ruptured cerebral aneurysms revealed by repeat angiography: result from a large retrospective study. Clin Neurol Neurosurg. 2003;106(1):33-7.
11. Bruder N. Hémorragie sous-arachnoïdienne non anéurismale. Annales Françaises d'Anesthésie et de Réanimation. 2007;26:954-8.
12. Cánovas D, Gil A, Jato M, Rubio I. Hemorragia subaracnoidea no aneurismática. Aportación de 60 casos. Neurología. 2006;21(10):704-9.
13. Pérez-Nellar J, Scherle-Matamoros C, Hierro-García D, Gil-Alfonso M. Hemorragia Perimesencefálica secundaria a drenaje venoso anómalo. Rev Cubana Neurol Neurocir. 2011:1(1):30-2.
14. Watanabe A, Hirano K, Kamada M, Imamura K, Ishii N, Sekihara Y, et al. Perimesencephalic nonaneurysmal subarachnoid haemorrhage and variations in the veins. Neuroradiology. 2002;44:319-25.
15. Van der Schaaf IC, Velthuis BK, Gouw A, Rinkel GJE. Venous Drainage in Perimesencephalic Hemorrhage. Stroke. 2004;35:1614-8.
16. Shad A, Rourke TJ, Haromi AH, Green AL. Straight sinus stenosis as a proposed cause of perimesencephalic non-aneurysmal haemorrhage. J Clin Neurosc. 2008;15:839-41.
17. Audibert G, Bousquet S, Charpentier C, Devaux Y, Mertes PM. Hémorragie sous-arachnoïdienne: épidémiologie, prédisposition, présentation clinique. Annales Françaises d'Anesthésie et de Réanimation. 2007;26:943-47.
18. Flaherty ML, Haverbusch M, Kissela B, Kleindorfer D, Schneider A, Sekar P, et al. Perimesencephalic Subarachnoid Hemorrhage: Incidence, Risk Factors, and Outcome. J Stroke Cerebrovasc Dis. 2005;14(6):267-71.
19. Greebe P, Rinkel GJE. Life Expectancy After Perimesencephalic Subarachnoid Hemorrhage. Stroke. 2007;38:1222-4.
20. Mayor S, Erro ME, Zazpe I, Gállego J. Infarto pontino por vasospasmo secundario a hemorragia subaracnoidea perimesencefálica. Neurología. 2008;23(4):256-8.
21. Hui FK, Tumialán LM, Tanaka T, Cawley CM, Zhan YJ. Clinical Differences Between Angiographically Negative, Diffuse Subarachnoid Hemorrhage and Perimesencephalic Subarachnoid Hemorrhage. Neurocrit Care. 2009;11:64-70.
22. Arauz A, López M, Cantu C. Hemorragia subaracnoidea no aneurismática. Estudio de seguimiento a largo plazo. Neurología. 2007;22(8):502-6.
23. Kang DH, Park J, Lee SH, Park SH, Kim YS, Hamm IS. Does non-perimesencephalic type non-aneurysmal subarachnoid hemorrhage have a benign prognosis? J Clin Neurosc. 2009;16:904-8.
24. Nayak S, Kunz AB, Kieslinger K, Ladurner G, Killer M. Classification of non-aneurysmal subarachnoid haemorrhage: CT correlation to the clinical outcome. Clin Radiol. 2010;65:623-8.
25. Gilmer M, Wiliams A, Ray D, Jones JS. Nonaneurysmal Subarachnoid Hemorrhage: Clinical Course and Outcome in Two Distinct Hemorrhage Patterns. Ann Emerg Med. 2009;54(3):S70-1.
26. Alfieri A, Unterhuber V, Pircher M, Schwarz A, Gazzeri R, Reinert M, et al. Psychosocial and neurocognitive performance after spontaneous nonaneurysmal subarachnoid hemorrhage related to the APOE-ε4 genotype: a prospective 5-year follow-up study. J Neurosurg. 2008;109:1019-26.
Recibido: 28 de febrero de 2014.
Aceptado: 2 de abril de 2014.
Dr. Jesús Pérez Nellar. Servicio de Neurología. Hospital Clinicoquirúrgico "Hermanos Ameijeiras". San Lázaro No. 701 entre Belascoaín y Marqués González, Centro Habana, La Habana, Cuba. CP 10300. jesus.perez@infomed.sld.cu