My SciELO
Services on Demand
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Cubana de Pediatría
On-line version ISSN 1561-3119
Rev Cubana Pediatr vol.71 no.2 Ciudad de la Habana Apr.-June 1999
Experiencia y resultados
Hospitales ginecoobstétricos "Eusebio Hernández" "América Arias", "Ramón González Coro", "10 de Octubre", "Justo Legón Padilla"; maternoinfantiles de Cienfuegos, de Camagüey; Hospital General "Carlos M. de Céspedes" de Granma; Materno Sur de Santiago de Cuba; Hospitales generales "Lenin" y "Agostino Netto"Estudio de la eficacia del Surfacen en el distress respiratorio del recién nacido
Dr. Olimpo Moreno Vázquez,1 Dr. Mario Lee López,2 Dr. Fernando Domínguez Dieppa,1 Dra. María Amparo Pascual López,3 Lic. Ariel Alonso Abad,4 Lic. Gladys Jiménez Rivero4 y Dra. Dahis Manzanares Tapia5RESUMEN
En 1994 se empleó el Surfacen, surfactante natural porcino, en 50 neonatos prematuros con síndrome de dificultad respiratoria, diagnosticados clínica y radiográficamente, con una deficiencia de oxigenación dada por una fracción inspirada de oxígeno (FiO2) de 0,8, una presión parcial de oxígeno PaO2/FiO2 de 12,1 kPa y un índice de a/AO2 de 0,13. El surfactante se aplicó por vía traqueal a la dosis de 100 mg de fosfolípidos y se repitió una segunda en 13 pacientes y en uno 3 dosis. La edad promedio de aplicación fue 3,5 horas, siempre después de estabilizado el paciente. A los 10 minutos la PaO2 aumentó de 9 a 20,6 kPa, la PaO2/FiO2 se elevó a 29,8 kPa y el índice a/AO2 a 0,34. No hubo respuesta favorable en el 4 % de los pacientes. El examen radiográfico de tórax a las 4 horas de administrado el Surfacen mostró una mejoría en 86,7 %. A las 72 horas de vida la FiO2 fue de 0,37 y la presión media de las vías aéreas de 10,3 con H2O. Las complicaciones más importantes fueron: ductus arterioso permeable 22, neumonía y hemorragia intraventricular grados III y IV 10 cada una, neumotórax 3 y displasia broncopulmonar 2. Al comparar las complicaciones con un grupo control histórico de 49 pacientes en quienes no se empleó surfactante se observa que en el grupo estudio hubo una disminución significativa del neumotórax, la neumonía y la hemorragia pulmonar y un aumento del ductus arterioso permeable. En el grupo tratado con Surfacen fallecieron 17 pacientes.Descriptores DeCS: SINDROME DE DIFICULTAD RESPIRATORIA/quimioterapia; SURFACTANTES PULMONARES/uso terapéutico; ANOXIA/etiología.
Avery y Mead 1 en 1959 señalaron que la llamada enfermedad de la membrana hialina (EMH) se producía debido a un déficit de surfactante. Después de varios intentos infructuosos,2,3 no fue hasta 1980 cuando Fujiwara, Maeta y Shida4 utilizaron con éxito un surfactante natural bovino enriquecido con lípidos (DPPC y PG). En los años siguientes se hicieron varios ensayos clínicos controlados con varios surfactantes naturales que han mostrado su eficacia y seguridad tanto en el tratamiento curativo como preventivo del síndrome de dificultad respiratoria (SDR) del prematuro.5-39
También se han utilizado surfactantes artificiales40-58 (ALEC, EXOSURF) en el SDR del prematuro con buenos resultados, aunque no tanto como los naturales.50,58,59
En los estudios iniciales se empleó generalmente una sola dosis de surfactante exógeno y se obtuvieron efectos significativos, muchas veces transitorios, de la ventilación y la oxigenación sin reducción importante de las complicaciones y la mortalidad. Se hizo necesario realizar ensayos multicéntricos con cientos de pacientes para obtener una disminución importante de las complicaciones y la mortalidad. También se han señalado mejores resultados con dosis múltiples de surfactante en el SDR del prematuro.60,61
En 1991 Lencey62 publicó un artículo titulado "The surfactant era. Starting of right" y en ese mismo año el Comité de Fetos y Recién Nacidos de la Academia Americana de Pediatría63 recomendó el empleo del surfactante en el SDR neonatal.
En 1990 el Centro Nacional de Sanidad Agropecuaria (CENSA) de Cuba obtuvo un surfactante natural obtenido del lavado pulmonar de cerdo, llamado Surfacen. Después de la caracterización bioquímica y de pruebas biofísicas, farmacológicas y toxicológicas en animales se empleó por primera vez en ese año en un estudio piloto de 29 neonatos con SDR grave, dirigido por uno de los autores de este trabajo, y se obtuvieron resultados satisfactorios.64
El propósito de este trabajo fue hacer un ensayo clínico con un número mayor de pacientes para determinar la eficacia del Surfacen en la oxigenación y la ventilación en el SDR del prematuro y comparar los resultados clínicos, complicaciones y mortalidad con un grupo de pacientes parecidos en quienes no se empleó este producto.
MÉTODOS
En 1994 se utilizó el Surfacen en 50 recién nacidos prematuros con SDR en 4 hospitales de Ciudad de La Habana, Cuba y 6 del interior del país.Se incluyeron en el estudio los pacientes que reunían los criterios siguientes:
- Recién nacido pretérmino (< 37 semanas de edad gestacional).
- Signos clínicos y radiográficos de EMH.
- Haberse realizado cateterismo arterial y/o utilizado un transductor cutáneo de oxígeno.
- Ventilación mecánica con fracción inspirada de oxígeno (FiO2) < 0,5 para una presión parcial de oxígeno (PaO2) de 60 a 80 torr.
- Deficiencia de oxigenación dada por:
- PaO2/FiO2 < 20 kPa
- a/AO2 < 0,32.
Se valoró en cada paciente el peso al nacer, la edad gestacional, el sexo y la puntuación de Apgar al minuto y a los 5 minutos.
PRODUCTO EN ESTUDIO
El Surfacen es un surfactante natural obtenido por lavado pulmonar de cerdos, cuyo componente principal es la dipalmitoil-fosfatidilcolina, que disminuye la tensión superficial a valores cercanos a cero. El producto final es un liofilizado blanco envasado en bulbos que contienen 50 mg de fosfolípidos. Los bulbos liofilizados se conservan en refrigeración a una temperatura de 4 a 8 oC. Para emplearlo se diluye el contenido de un bulbo con 2 mL de agua destilada tibia (ámpulas calentadas) de manera que 1 mL tenga 25 mg de fosfolípidos. Se coloca el bulbo en baño de María a 37 oC durante unos minutos y se agita hasta que no se observen grumos, para formar un líquido lechoso jabonoso, que se extrae con una aguja número 26. La dosis es de 100 mg (4 mL)/kg; si no hay respuesta positiva de la PaO2 en la primera hora, se considera como nula. Si después de ocurrir respuesta favorable y de haber transcurrido más de 8 horas de la instilación del producto se necesita elevar la FiO2 más del 10 %, se repite la dosis. Pueden ser necesarias hasta 4 dosis en las primeras 48 horas. Se deben descartar complicaciones no dependientes del déficit de surfactante.TRATAMIENTO
Antes de la administración del producto se realiza una gasometría y un examen radiográfico de tórax. Antes de administrar la 1ra. dosis se debe estabilizar al paciente en corrección de acidosis, hipotensión, hipoglicemia e hipotermia. Si es necesario se realiza aspiración traqueal previa. El producto se instila mediante una sonda endotraqueal: la punta de ésta deberá colocarse por encima de la carina (la sonda deberá ser medida previamente y marcada en relación con el tubo endotraqueal.La dosis de 100 mg/kg se divide en 3 partes y se administra cada una de ellas en 3 posiciones corporales distintas: decúbito lateral derecho, decúbito lateral izquierdo y por último decúbito supino, siempre en posición horizontal. Después de cada instilación se ventila al paciente durante unos minutos con una presión inspiratoria de 2 cm mayor que la que tenía previamente a la instilación y luego se vuelve a la presión anterior. No se debe aspirar la tráquea por lo menos hasta pasada 1 hora de haberse instilado el producto.
En el manejo del paciente los parámetros ventilatorios iniciales son:
- FiO2 ³ 0,5 según la PaO2.
- PIP (presión inspiratoria) de 15 a 25 cm de H2O que eleve el tórax 0,5 cm.
- PEP (presión al final de la espiración) de 4 a 5 cm de H2O).
- Frecuencia respiratoria (FR) de 60/min.
- Tiempo inspiratorio (T. Ins.) de 0,5 s.
Al producirse una elevación de la PaO2 con el producto, a los 10 minutos de administrado, se comienza inmediatamente a disminuir la FiO2 entre 10 y 20 % y luego cuantas veces sea necesario para mantener una PaO2 entre 60 y 80 torr. Posteriormente, cuando la PaCO2 esté por debajo de 40 torr se comienza a disminuir la PIP de 2 en 2 cm de H2O. Luego se disminuye la FR cuando la PIP sea de 15 cm de H2O o menos y la PCO2 este por debajo de 40 torr, y se aumenta un poco el tiempo inspiratorio.
Con una buena respuesta al Surfacen la FiO2 generalmente estará en 0,4 o menos en las primeras 12 h de haberse administrado éste. Se coloca entonces al paciente en ventilación mandatoria (VIM) con PEP, la cual se disminuye lentamente durante el desacople. En los prematuros muy inmaduros se prolonga un poco más la ventilación mandatoria con PEP o CPAP para disminuir la posiblilidad de respiración periódica o apnea.
Durante la evolución del paciente se tomará sistemáticamente temperatura, frecuencia respiratoria y cardíaca, tensión arterial y se efectuarán análisis de hemoglobina, glicemia, ionograma, osmolaridad sérica y urinaria y densidad urinaria. Se hará un hemocultivo al ingreso del paciente y posteriormente si hay sospecha de infección. La radiografía se repite a las 4, 12 y 24 h y después según la necesidad. El ultrasonido se realizará a los pacientes a los 1,3 y 7 días de edad y luego según sea necesario.
Durante los primeros días se administrarán los líquidos restringidos. El primer día se emplea 60 mL/kg y posteriormente se incrementarán a razón de 10 mL/kg, tomándose en cuenta el balance hídrico.
La alimentación se hará preferentemente con leche materna. Ésta se comienza a las 24 horas de edad, si no hay un signo clínico que lo impida.
Para evaluar la eficacia del Surfacen en relación con la oxigenación y la ventilación, se estudian las variables PaO2, PaO2/FiO2 y a/AO2, así como FiO2, PAM (presión media de las vías áereas) y radiografía de tórax antes de la aplicación del producto y después de ésta.
Según las variables PaO2, PaO2/FiO2 y a/AO2 la respuesta se consideró muy buena, buena y nula de la siguiente forma:
- Muy buena: La variable a los 10 min del tratamiento es el doble del valor inicial.
- Buena: La variable a los 10 min del tratamiento es mayor que el valor inicial, pero sin alcanzar el doble de él.
- Nula: La variable a los 10 min del tratamiento es igual o menor al valor inicial.
- Buena:
- FiO2: A las 8 horas 2 veces o más, menor que el valor inicial.
- PAM: Disminución a las 8 horas en ³ 2 cm de H2O.
- Rayos X: Disminución o ausencia de manifestaciones radiográficas.
- Nula:
- FiO2: En caso contrario.
- PAM: En caso contrario.
- Rayos X: En caso contrario.
En este estudio comparativo se analizaron: peso, edad gestacional, sexo, tiempo de rotura de membranas, modo de nacimiento, puntuación de Apgar al minuto y a los 5 minutos de vida, tiempo de ventilación mecánica, además de las complicaciones y mortalidad. Las complicaciones que se estudian son: neumotórax, neumomediastino, hemorragia pulmonar, apnea, ductus arterioso permeable (DAP), enterocolitis necrotizante (ECN), displasia broncopulmonar (DBP), infección nosocomial y hemorragia intraventricular (grados III y IV).
Se realizó necropsia a todos los fallecidos para determinar lesiones de atelectasia con membrana hialina, así como para conocer otras lesiones que contribuyen a la muerte, distintas a la enfermedad básica.
RESULTADOS
Se trataron 50 recién nacidos prematuros con Surfacen con las siguientes características:- Edad gestacional: 32,1 semanas, promedio, DS= 2,4.
- Peso al nacer: 1 690 g, promedio, DS= 5,3.
- Sexo masc./fem.: 1,8/1,0.
- Apgar al min. ³ 7: 32/50.
- Apgar al 5to. min. ³ 7: 42/50.
La primera instilación del producto se realizó a una edad promedio de 3,5 h, en 33/50 de los pacientes antes de las 6 h de nacidos y sólo en 8 fue después de las 12 h. Se aplicó una dosis en 36 (72 %) de los pacientes; en 13, 2 dosis y solamente en 1, 3 dosis.
Los valores de la PaO2, PaO2/FiO2 y a/AO2 antes del tratamiento y a los 10 y 60 min. después de éste se observan en la tabla 1.
| Variable | | | |
| PaO2 | | | |
| PaO2/FiO2 | | | |
| a/AO2 | | | |
La respuesta de la aplicación del Surfacen según la PaO2, PaO2/FiO2 y a/AO2 se aprecia en la tabla 2.
| | | | |
| Respuesta | | | |
| Muy buena | | | |
| Buena | | | |
| Nula | | | |
Al analizar la variable FiO2 a las 8 horas de instilado el producto ésta había disminuido a menos de la mitad de su valor inicial en el 23,4 % de los pacientes. La PAM disminuyó más de 2 cm de H2o en el mismo período en 48,9 % de los pacientes. La mejoría radiológica se observó en el 86,7 % de los neonatos tratados.
En las figuras 1 y 2 se observa que los índices de PaO2/FiO2 y a/AO2 aumentaron rápidamente en la primera hora de aplicado el Surfacen, a partir de lo cual hay un ligero descenso hasta las 8 horas y luego un gradual incremento hasta las 72 horas.
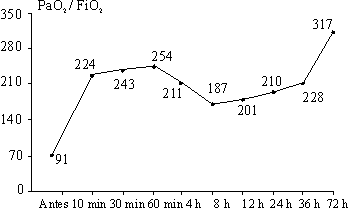
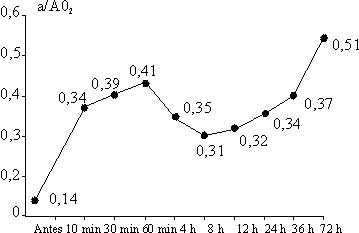
La FiO2 promedio al inicio fue de 0,8 y disminuyó rápidamente a las primeras 4 horas de iniciado el tratamiento, pero a partir de ese momento el descenso fue muy ligero para alcanzar un valor de 0,37 a las 72 horas.
La PAM promedio al inicio fue de 13,3 cm de H2O y descendió gradualmente en forma muy ligera, para alcanzar un valor de 10,3 a las 72 horas de edad.
Las complicaciones más importantes en este estudio fueron: neumonía con 10 casos, hemorragia pulmonar, 4; neumotórax, 3 y displasia broncopulmonar, 2. Entre las complicaciones no pulmonares estuvieron el ductus arterioso permeable, 22 casos y hemorragia intraventricular grado III ó IV con 10 casos.
No se halló ninguna reacción adversa farmacológica en los pacientes tratados.
Al comparar el grupo tratado con el grupo control histórico se encontró que ambos grupos son homogéneos en cuánto a número (50 vs. 49), edad gestacional (32,1 vs 32,4 semanas), peso (1 690,3 gvs. 1 689,8 g), sexo (masculino 64,2 % vs. 59,2 %) y femenino (36,0 % vs. 40,8 %), puntuación de Apgar a los 5 minutos de < 7 puntos (16,3 % vs. 28,6 %) y ³ 7 puntos (83,7 % vs. 71,4 %) y tiempo de intubación (103,65 h vs. 107,3 h). La incidencia de complicaciones de ambos grupos se presenta en la tabla 3.
| | | |
| Complicación | | |
| Neumotórax | | |
| Neumonía | | |
| Hemorragia pulmonar | | |
| DBP | | |
| DAP | | |
| HIV (III o IV) | | |
| Mortalidad | | |
DISCUSIÓN
El surfactante se ha empleado preferentemente en neonatos de menos de 34 semanas de edad gestacional y menos de 1 750 g, en los cuales la mortalidad es más elevada. En nuestra serie el 32 % tenía 34 semanas o más de edad gestacional y el 40 % más de 1 750 g; la mortalidad en estos grupos fue más baja. El SDR en todos los pacientes fue grave, pues al inicio la FiO2 promedio fue de 0,8 y la PAM de 13,3 cm de H2O, así como la existencia de grandes cortocircuitos importantes intrapulmonares que traen como consecuencia una hipoxemia severa.El promedio de aplicación de 3,5 h fue bueno, aunque hubo 8 pacientes en que esto se hizo tardíamente, entre las 12 y 24 h, lo que no es aconsejable porque el pulmón se afecta más por una FiO2 elevada y el barotrauma.
Se aplicó una dosis en 35/50(72 %) y sólo en 1 paciente 3 dosis. Aunque la respuesta con la primera dosis fue generalmente buena, se debieron aplicar con más frecuencia en un paciente varias dosis, lo que hubiera permitido disminuir más rápidamente la FiO2 y la PAM en las primeras 24 horas.
Hoekstra60 y Liechty61 reportan una reducción de la mortalidad con el empleo de dosis múltiples.
En nuestro estudio no hubo un control histórico concurrente, porque por los resultados del estudio piloto los neonatólogos que lo habían empleado con resultados satisfactorios se opusieron y además Merrit y Halmann65 señalan que "en la actualidad es difícil justificar".
Se puede considerar como control en nuestro trabajo la respuesta antes del estado clínico de cada paciente y después de éste. Hubo un incremento de 11 kPa a los 10 minutos de administrado el Surfacen, parecido al aumento con Curosurf de 12,1 kPa con una dosis de 200 mg/kg de fosfolípidos, que es el doble de lo que se empleó en este ensayo.66 Vidyasagar y Shimada66 señalan que hay una buena respuesta cuando la PaO2 aumenta más de 70 mm Hg (93 kPa).
Actualmente se da más importancia como índices de oxigenación y del valor del cortocircuito intrapulmonares, las relaciones PaO2/FiO2 y a/AO2. En este estudio estos índices aumentaron unas 3 veces más en relación con los valores del período presurfactante, igual de lo que sucedió con el primer estudio multicéntrico con el Curosurf.66
La respuesta no es igual en todos los pacientes, Fujiwara y colaboradores67 señalan que es buena cuando se produce un incremento de la a/AO2 mayor de 0,2; pobre si es de 0,1 a 0,2 y nula menor de 0,1. En nuestro estudio consideramos una respuesta muy buena cuando tuvo un incremento de este índice en 2 o más del valor inicial, buena entre 1 y 2 y nula menor de una vez. Solamente tuvimos 3 (6 %) pacientes en que no existió una respuesta favorable.
En el estudio piloto64 con Surfacen hubo el 16 % de pacientes que no respondieron. Hallman y colaboradores68 señalan que diversos factores pueden determinar que no exista una buena respuesta al surfactante (non-responders) por lo que Jobe69 reporta que puede haber hasta el 25 % en que no haya una respuesta favorable, porque no hay un déficit de surfactante.
Otro de los criterios de eficacia fue la mejoría radiográfica pulmonar a las 4 h de administración del Surfacen, lo que ocurrió en el 86,7 % de los neonatos, que coincide con los resultados de otros ensayos clínicos.4-58
Los índices de PaO2/FiO2 y a/AO2 disminuyeron discretamente entre las 8 y 36 horas de administrado el Surfacen, como se ha observado en otros estudios clínicos; también se disminuyó lentamente la FiO2 y la PAM. Esto se debe a la poca repetición de dosis como ya se señaló62,63 y a la falta de un manejo ventilatorio más dinámico.69
La complicación más frecuentemente hallada fue el DAP en el 43,2 %, que está cerca del límite inferior reportado en la literatura médica,70 que varía entre el 40 y 60 %. En nuestro estudio piloto la frecuencia fue del 54 % y hubo evidencias en algunos pacientes de que esta complicación aparecía poco después del empleo del producto, posiblemente por descenso rápido de la resistencia vascular pulmonar con aumento del flujo sanguíneo. Hay discrepancias en distintos ensayos clínicos en relación con el criterio de que el surfactante aumenta esta complicación.
La incidencia de HIV grados III y IV fue del 16 % y en el estudio piloto del 27 %, cifras que están dentro del rango de los estudios clínicos realizados. Horbar y colaboradores70 en un estudio controlado multicéntrico encontraron un incremento de la HIV grados III y IV en pacientes tratados con surfactante (Survanta), que quizás fue por el manejo de los pacientes, pues Gortner71 en un metanálisis (tabla 4) que realizó, no encontró aumento de esta complicación en los tratados al comparar con los placebos.
| | | |
| Complicación | | |
| Neumotórax | | |
| DAP | | |
| Supervivencia sin DBP | | |
| Mortalidad | | |
Hay criterio unánime que el surfactante reduce el neumotórax y otras formas de bloqueo aéreo, lo que ha hecho afirmar a McDunn y Shennan72 que este hecho por sí sólo justifica el empleo de este producto, aun en prematuros de mayor edad gestacional en los que la mortalidad por SDR es baja. En este ensayo clínico la incidencia de neumotórax fue del 6 % y en el estudio piloto no se encontró ningún caso, frecuencia muy por debajo de lo reportado en la literatura médica que es de alrededor del 12 %.
La incidencia de DBP fue muy baja, con 4 %. Esto parece deberse a que dicha complicación aparece generalmente en prematuros de menos de 30 semanas de edad gestacional y se diagnostica en sobrevivientes de más de 30 días de edad, condiciones éstas que no fueron frecuentes en nuestro ensayo.
La neumonía y la hemorragia pulmonar se encuentran en proporciones similares a otros estudios.52,53,66,71
Las cifras de mortalidad del ensayo clínico (34 %) y las del estudio piloto (29,6 %) son relativamente altas si se comparan con las que se reportan en los ensayos clínicos con numerosos pacientes. En los estudios publicados con pocos pacientes la mortalidad es variable y en los ensayos controlados aleatorizados y concurrentes se estima un mínimo de 60 pacientes por grupo para encontrar una disminución significativa de ella. Por otro lado, como señalan Hallman y colaboradores68 intervienen diversos factores en la mortalidad, como características pobla-cionales de la embarazada y el niño, en el manejo terapéutico de los pacientes con SDR grave. Ya se señaló60,61 lo ventajoso de emplear con mayor frecuencia dosis múltiples y el Comité de Fetos y Recién Nacidos de la Academia Americana de Pediatría63 indica que el manejo de las pacientes debe hacerse por un personal médico y de enfermería muy experimentado.
Fujiwara y colaboradores57 en noviembre de 1995 en un congreso internacional sobre surfactante expresaron su experiencia clínica en 15 años, y señalaron 3 etapas o períodos de respuesta clínica observada por ellos; a dichas etapas las denominaron aprendizaje, de adies-tramiento y de perfeccionamiento. Señalan en este artículo una mortalidad del 23 % en la fase de aprendizaje, del 13 % en adiestramiento y del 1 % en la de perfeccionamiento. De forma global indicaron una muy buena respuesta en el 92 % de los pacientes a los que se les aplicó surfactante exógeno, y concluyen el artículo en que se lograron mayores resultados en múltiples dosis que en dosis única, además de menores complicaciones y menor mortalidad.
Es importante también estudiar las necropsias, pues el surfactante actúa exclusivamente en el sistema pulmonar. El paciente puede morir por otras lesiones sin existir la atelectasia con membrana hialina, ej.: DAP, neumonía, HIV y DBP.
Al comparar las complicaciones de los pacientes tratados con Surfacen con el grupo control histórico encontramos que en el primero hay una disminución notable del neumotórax, la neumonía y la hemorragia pulmonar. En el grupo tratado fue más considerable el DAP; esta diferencia notable puede ser por el efecto del surfactante, aunque puede influir también un mejor diagnóstico de esta complicación. Ya se señaló que se mantiene la controversia de si el surfactante aumenta o no el DAP.
En el grupo tratado con surfactante se presentó mayor frecuencia de HIV graves, que puede ser un mejor diagnóstico o algún otro factor que no conocemos.
La mortalidad en el grupo control fue más elevada, aunque la diferencia no fue significativa. Ya se señaló que existen diversos factores que explican la diferencia que puede haber entre varios estudios.
SUMMARY
Surfacen, a natural porcine surfactant, was used in 1994 in 50 preterm neonates with clinical and radiologically diagnosed respiratory distress syndrome with an oxygenation deficiency due to an inspired fraction of oxygen (If02) of 0.8, a partial pressure of oxygen Pa02 of 2.1 kPa, and an index of a/A02 of 0.13. The surfactant was administered by the trachea at a dose of 100 mg of phospholipids. 13 patients received 2 doses and 1, 3. The average age of administration was 3.5 hours. It was always administered after the patient was stabilized. 10 minutes later, Pa02 increased from 9 to 20.6 kPa. Pa02/If02 rose to 29.8 kPa and the index a/A02 to 0.34. The chest X-ray showed an improvwement of 86.7 % 4 hours after the administration of Surfacen. At the 72 hours of life, If02 was 0.37 and the mean pressure of the airways was 10.3 with H20. The most significant complications were: permeable ductus arteriosus, 22; pneumonia and intraventricular hemorrhage degree III and IV, 10 each one: pneumothorax, 3; and bronchopulmonary displasia, 3. On comparing the complications with a historical control group of 49 patients who had not received surfactants, it was observed that in the case-base study there was a significant reduction of pneumothorax, pneumonia and pulmonary hemorrhage, and an increase of permeable ductus arteriosus. 17 patients died in the group treated with Surfacen.Subject headings: RESPIRATORY DISTRESS SYNDROME/DRUG THERAPY; PULMONARY SURFACTANTS/therapeutic use; ANOXIA/etiology.
REFERENCIAS BIBLIOGRÁFICAS
- Avery ME. Mead S. Surface properties in relation to atelectasia and hyaline membrane disease. Am J Dis Child 1959;97:517-23.
- Robillard E, Claire Y, Degenais-Perosse P. Microaerosol administration of synthetic betagamma-dipalmitoyl lecithin in the respiratory distress syndrome. A preliminary report. Can Med Assoc J 1964;90:57-9.
- Chu J, Clements L, Cotton EK. Neonatal pulmonary ischemia. Pediatrics 1967;40:709-16.
- Fujiwara T, Maeta H, Shida S. Artificial surfactant therapy in hyaline membrane disease. Lancet 1980;1:50-9.
- Smith JA, Metcalfe IL, Duffty. Hyaline membrane disease treated with bovine surfactant. Pediatrics 1983;71:1913-7.
- Hallman M, Merrit TA, Schneider H. Isolation of human surfactant from amniotic fluid and pilot study of its efficacy in respiratory syndrome. Pediatrics 1983;71:473-82.
- Nohara K, Murcmatsu R, Oda T. Six cases of RDS treated with surfactant CK. J. Jpn Med. Soc. Biol. 1983; Interface 14:173-8.
- Berggren P, Curstedt T, Grossman G. Beneficial effect of surfactant replacement in four cases of IRSD. Lakartidningen 1984;81:4180-2.
- Enhrning G, Shennan A, Possmayer F. Prevention of neonatal respiratory distress syndrome. A randomized clinical trial. Pediatrics 1985;76:145-53.
- Hallman M, Merrit TA, Jarvenpas X. Exogenous surfactant for treatment of severe respiratory distress syndrome. A randomized prospective clinical trial. J Pediatr 1985;106:963-9.
- Kwong MJ, Egan EA, Notter RH. Double blind clinical trial of calf lung surfactant extract for the prevention of hyaline membrane disease in extremely premature infants. Pediatrics 1985;76:585-92.
- Shapiro DL, Notter RH, Mirin F. Double blind randomized trial of a calf lung surfactant extract and administrated at birth to premature infants for prevention of respiratory syndrome. Pediatrics 1985;76:593-9.
- Edwards DK, Hilton SW, Meritt TA. Respiratory distress syndrome treated with human surfactant. Radiographic findings. Radiology 1985;157:329-34.
- Merrit TA, Hallman M, Bloom BT. Prophylatic treatment of premature infants with human surfactant. New Engl J Med 1986;315:785-90.
- Merrit TA, Hallman M, Olcomb K. Human surfactant treatment of severe respiratory syndrome: pulmonary effluent indicators of human inflammation. J Pediatr 1986;108:741-8.
- Gitlin JD, Sol RT, Parad RB. Randomized controlled trial of exogenous surfactant for the treatment of hyaline membrane disease. Pediatrics 1987;79:31-7.
- Raju TK, Vidyasagar D, Baht T. Double blind controlled trial of single dose treatment with bovine surfactant in severe hyaline membrane disease. Lancet 1987;1:651-6.
- Fujiwara T, Konishi M, Ogawa Y. Surfactant replacement for respiratory distress syndrome (RDS). A multicenter clinical trial. J Pediatr 1987;40:549-68.
- Noack J, Berggren P, Curstedt T. Severe neonatal respiratory distress syndrome trial with inhalated phospholipid fraction of natural surfactant. Acta Pediatr Scand 1987;76:697-705.
- Collaborative European multicenter study group. Surfactant replacement therapy for severe neonatal respiratory distress syndrome. An international randomized clinical trial. Pediatrics 1988;82:682-91.
- Kendig JW, Nother RH, Cox C; Surfactant replacement therapy at birth: final analysis of a clinical trial and comparisons with similar trials. Pediatrics 1988;82:756-62.
- Soll RF, Hockstra R, Fagman S. Multicenter trial of single dose surfactant TA (STA) for prevention of respiratory distress syndrome (RDS). Pediatr Res 1988;23:425A.
- Hobar JD, Linderkamp O, Schachinger H. European trial of simple dose surfactant TA (STA) for treatment of respiratory distress syndrome (RDS). Pediatr Res 1988;23:510.
- Konishi M, Fujiwara T, Naitu T. Surfactant replacement therapy in neonatal respiratory syndrome, a multicentre randomized clinical trial: comparison of high versus low dose of surfactant TA. Eur J Pediatr 1988;147:20-5.
- Survanta surfactant. Treatment IND Information Colombus OH1989. Ross Laboratories August 31.
- Segerer H, Vogel M, Oblanden M. Pulmonary lipids deposits after surfactant substitution for neonatal respiratory distress syndrome. Pediatr Res 1989;26:371.
- Horbar JD, Soll RF, Sutherland JM. A multicenter randomized placebo controlled trial of a surfactant therapy for respiratory distress syndrome. N Engl J Med 1989;320:559-65.
- Soll RF, Hockstra, Fangman J. Multicenter trial of single dose modified surfactant extract (Survanta) for prevention of respiratory distress syndrome. Pediatrics 1990;85:1092-1102.
- Dunn MS, Shennan AT, Possmayer F. Single versus multiple dose surfactant replacement therapy in neonates of 30 to 36 weeks gestation with respiratory distress syndrome. Pediatrics 1990; 86:564.
- Girtner L. A multicenter randomized controlled clinical trial of bovine surfactant for prevention of respiratory distress syndrome. Lung 1990;168:864-9.
- Lang MJ, Hall RT, Reddy NS. A controlled trial of human surfactant replacement therapy for severe respiratory distress syndrome in very low birth weight infants. J Pediatr 1990:16:295-300.
- Tubman TR, Halliday HL. Surfactant treatment of respiratory distress syndrome following prolongued rupture of membranes. Eur J Pediatr 1990;149:727-9.
- Horbar JD, Soll RF, Schacminger M. A European multicenter randomized controlled trial for surfactant therapy for idiopatic respiratory distress syndrome. Eur J Pediatr 1990;149:416-23.
- Annibale DJ, Hulsey TC, Wallen LP. Clinical diagnoses and management of respiratory distress syndrome in preterm neonates: effect of participation in a controlled trial. Pediatrics 1992;90:397-400.
- Speer CP, Robertson B, Curstedt. Randomized European multicenter trial of surfactant replacement therapy for severe neonatal respiratory distress syndrome: single versus multiple doses. Pediatrics 1992;89:13-20.
- Horbar LC, Merrit TA, Edwards DK. Improving the prediction of surfactant deficiency in very low birth weight infants with respiratory distress. Pediatrics 1992;89:643-7.
- Horbar JD, Wright EC, Onstad L. Decreasing mortality associated with the introduction of surfactant therapy: an observational study of neonates weighting 601 to 1300 grams at birth. Pediatrics 1993;92:191-6.
- Sevilacgua G, Halliday A, Parmigrani G. Randomized multicentre trial of treatment with porcine natural surfactant for moderately severe neonatal RDS. J Perinatal Med (en prensa).
- Morley CJ, Bangham AD, Miller N. Dry artificial trial surfactant. Its effects on very premature babies. Lancet 1981;1:64-8.
- Halliday HL, McClare G, Reid M. Controlled trial of artificial surfactant to prevent respiratory distress syndrome. Lancet 1984;1:476-8.
- Wilkinson A, Leukins PA. Two controlled artificial surfactant early effects and later outcome in babies with surfactant deficiency. Lancet 1985;2:287-91.
- Ten Centre Study Group: Ten centre trial of artificial surfactant (ALEC) in premature babies. BMJ 1987;294:991-6.
- Exosurf Pediatric Sterile Powder. Treatment IND. Protocol EXO-501. Site information Research. Triangle Park: Burroughs Wellcome 1989:32-43.
- Morley CJ, Greenough A, Miller N. Randomized trial of artificial surfactant (ALEC) given at birth to babies from 23 to 44 weeks gestation. Early Hum Dev 1988;17:41-54.
- Exosurf. Pediatric Sterile Powder. Treatment IND. Protocol EXO-501. Site information Research. Triangle Park: Burroughs-Wellcome, 1989:23-7.
- Bose C, Corbet A, Bose G. Improved outcome at 28 days for very low birth weight infant treated with a single dose of synthetic surfactant. J Pediatr 1990;117:947-53.
- US. Exosurf Pediatr Study Group. Effects of Exosurf in 419 neonates, with weight 700-1300 grams. American Pediatric Society and Pediatric Research. Abstract, 1990.
- Canadian Exosurf Pediatric Study Group. Effects of two rescue doses of Exosurf pediatric in 342 infants, who weight 750-1249 grams. American Pediatric Society and the Society for Pediatric Research, Abstract, 1990.
- US and Canadian Exosurf Pediatric Study Groups. Effects of two rescue doses of Exosurf Pediatric in 1222 infants weighting 1250 gm. American Pediatric Society and the Society for Pediatric Research. Abstract, 1990.
- US Exosurf Pediatric Study Group. Effects of a single dose of Exosurf Pediatric in 444 infants on 700-1100 gm. American Society and the Society for Pediatric Research 1990; Abstract.
- Phibbs RH, Ballard RA, Clements JA. Initial clinical trial of Exosurf, a protein-free synthetic surfactant for the prophylaxis and early treatment of hyaline membrane disease. Pediatrics 1991;88:1-9.
- Long W Corbet A, Cotton R. A controlled trial of synthetic surfactant in infants weighting 1250 or more with respiratory distress syndrome. N Engl J Med 1991;325:1696-1703.
- Corbet A, Buccelarelli R, Goldman S. Decreased mortality with a single dose of synthetic surfactant: a multicentre controlled trial. American Exosurf Pediatric Study Group. J Pediatr 1991;118:277-84.
- Long W Thompson T, Sundel H. Effects of two rescue doses of a synthetic surfactant on mortality in 700 to 1350 gram infants with respiratory distress syndrome. J Pediatr 1991;118:595-605.
- Levine D, Edwards DK, Merrit TA. Synthetic vs human surfactant in the treatment of respiratory distress syndrome: radiographic findings. AJR 1991;157:371-4.
- Stevenson D, Walther F, Long W. Controlled trial of a single dose of synthetic surfactant at birth in premature infants weighting 500 to 699 grams. J Pediatr 1992;120 (Suppl):53-512.
- Fujiwara T, Konishi M, Chida S. Summary of 15 years experience with exogenous surfactant therapy. Appl Cardiopulm Pathophysiol 1995;5 (Suppl 3):34-5.
- Spragg RG. Clinical results after natural and artificial exogenous surfactant therapy. Appl Cardiopulm Pathophisiol 1995;5(Suppl 3):116-8.
- Tapia JL, Oto MA, Ramírez RF. Terapia con surfactante exógeno en recién nacidos con enfermedad de membrana hialina. Rev Chil Pediatr 1994;65(3):137-42.
- Hoekstra RE, Jackson JC, Myers TF. Improved neonatal survival following multiple doses of bovine surfactant in very premature infants at risk for respiratory distress syndrome. Pediatrics 1991;88:10-8.
- Liechty EA, Donovan E, Purchit D. Reduction in neonatal mortality after multiple doses of bovine surfactant in low birth weight infants with respiratory distress syndrome. Pediatrics 1991;88:19-28.
- Lencey JF. The surfactant era. Starting of right. Pediatrics 1991;88:168.
- American Academy of Pediatrics. Comitteem the Fetus and Newborn. Surfactant replacement therapy and respiratory distress syndrome. Pediatrics 1991;87:946-7.
- Moreno, O. Estudio clínico piloto del Surfacen. Informe al Vice-Ministerio de Ciencia y Técnica. 1990. Minsap. Abstract, Cuba.
- Merrit TA, Hallman M. Surfactant replacement rationale for an international comparative trial. Research Perinatal Medicine 2 1990; Abstracts, Berlin.
- Vidyasagar D, Shimada S. Sustancia tensioactiva exógena en el síndrome de membrana hialina. Farmacol. Perinat North Am 1987;4:1041-69.
- Fujiwara T, Konishi M, Chida S, Maeta H. Factors affecting the response to a postnatal single dose of reconstituted bovine surfactant. En: Lachman B ed Surfactant replacement therapy in neonates and adult respiratory distress syndrome Berlín: Springer Verlag, 1988:91-107.
- Hallman M, Merrit TA, Karl S. Factors affecting surfactant responsiveneses. Ann Med 1991;23:693-8.
- Jobe AH. Do prenatal or postnatal steroids improve results? Neonatology. 1991 Abstracts:141-147.
- Horbar HD, Soll RF, Schachinger H. A European multicenter randomized controlled trial of single dose surfactant therapy for idiophatic respiratory distress syndrome. Eur J Pediatr 1990;149:416-23.
- Gorther L. Natural surfactant for neonatal respiratory distress syndrome in very premature infants. J Perinat Med 1992;20:409-19.
- Mc Dunn MS, Shennan AT, Possmater F. Single versus multiple doses surfactant replacement therapy in neonates to 30 to 36 weeks gestation with respiratory distress syndrome. Pediatrics 1990;86:564-70.
Dr. Olimpo Moreno Vázquez. Calle 30, No. 2703, entre 27 y 29, municipio Playa, Ciudad de La Habana, Cuba.
1 Doctor en Ciencias Médicas. Especialista de II Grado en Neonatología. Profesor Titular.
2 Especialista de I Grado en Neonatología. Asistente.
3 Especialista de II Grado en Bioestadísticas.
4 Licenciado en Matemáticas.
5 Doctor en Ciencias Bioquímicas.














