My SciELO
Services on Demand
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Cubana de Medicina Tropical
Print version ISSN 0375-0760
Rev Cubana Med Trop vol.66 no.3 Ciudad de la Habana Sept.-Dec. 2014
ARTÍCULO ORIGINAL
Eficacia in vitro de tres endectocidas frente a Triatoma infestans
In vitro efficacy of three endectocides against Triatoma infestans
Martín Miguel Dadé,I,II Martín Rafael Daniele,II María Pía Silvestrini,III Nora MestorinoII
I Cátedra de Farmacología Básica (General y Farmacodinamia), Facultad de Ciencias Médicas. Buenos Aires, Argentina.
II Laboratorio de Estudios Farmacológicos y Toxicológicos (LEFyT) Facultad de Ciencias Veterinarias. La Plata, Buenos Aires, Argentina.
III Bioestadística, Facultad de Ciencias Veterinarias. La Plata, Buenos Aires, Argentina.
RESUMEN
Introducción: distintos estudios han demostrado el papel preponderante que el peridomicilio cumple en la reinfestación de las viviendas por Triatoma infestans (vinchucas). Con el objetivo de eliminar focos residuales de T. infestans que habitan alrededor de los hogares se han desarrollado distintas estrategias. La administración de diferentes compuestos que tengan actividad contra T. infestans a los animales que habitan zonas cercanas a los domicilios y sirvan como fuente de alimentación a estos insectos, podría ser una buena manera de disminuir el riesgo de reinfestación domiciliaria.
Objetivo: evaluar la eficacia in vitro de tres agentes antiparasitarios, doramectina (DRM), ivermectina (IVM) y eprinomectina (EPR) frente a ninfas de quinto estadio de Triatoma infestans.
Métodos: se diseñaron alimentadores artificiales en donde se colocó sangre heparinizada y fortificada con distintas concentraciones de los tres endectocidas (100-0,4 ng/mL). Se utilizaron 600 ninfas de quinto estadio de T. infestans durante el experimento. Un grupo de vinchucas fue alimentada con sangre sin tratar (control). Luego de realizada la alimentación se observó el estado de los insectos cada 24 hs. durante el transcurso de una semana.
Resultados: los tres endectocidas demostraron actividad frente a ninfas de quinto estadio de T. infestans. Comparando la actividad de las tres moléculas, DRM fue la que exhibió una mayor potencia contra los insectos, inclusive mantuvo su actividad frente T. infestans a 0,4 ng/mL (menor concentración evaluada). En el caso de IVM y EPR comenzaron a perder eficacia a concentraciones por debajo de los 6,25 y 3,15 ng/mL respectivamente, siendo totalmente inactivas a 0,4 ng/mL.
Conclusiones: en base a estos resultados podemos aseverar que bajo nuestras condiciones experimentales, tanto IVM, EPR como DRM poseen una alta eficacia in vitro contra T. infestans, siendo la última la más efectiva de las tres evaluadas.
Palabras clave: enfermedad de Chagas, Triatoma infestans, mortalidad, endectocidas.
ABSTRACT
Introduction: various studies have demonstrated the role that areas around the houses play in domiciliary re-infestation by Triatomainfestans (kissing bugs). With the aim of removing residual foci of T. infestans that inhabit in neighboring areas of houses, different strategies have been developed. The administration of different anti-T. infestans compounds to animals living in areas around the houses might be a good way to reduce the risk of domiciliary re-infestation.
Objective: to evaluate the in vitro efficacy of three antiparasitic agents, doramectin (DRM), ivermectin (IVM) and eprinomectin (EPR) against fifth instar nymphs of Triatomainfestans.
Methods: artificial feeders were designed , which contained heparinized and fortified blood with various concentrations of the three endectocides (100-0.4 ng/mL). We used 600 fifth instar nymphs of T. infestans during the experiment. A group of insects were fed with untreated blood (control). After feeding they were under observation to check their condition every 24 hours for a week.
Results: the three molecules showed activity against T. infestans. In comparing the activity of the three molecules, DRM exhibited greater potency against insects, it even kept its activity against T. infestans at 0.4 ng/mL (lowest concentration tested). In the case of EPR and IVM, their efficacy began to lower at concentrations below 6.25 and 3.15 ng/mL respectively, being totally inactive at 0.4 ng/mL concentration.
Conclusions: Based on these results, we can assert that under our experimental conditions, IVM, EPR and DRM show in vitro high efficacy against T. infestans, being the latter more effective than the other two molecules.
Key words: Chagas disease, Triatomainfestans, mortality, endectocides.
INTRODUCCIÓN
La enfermedad de Chagas es una zoonosis endémica en Argentina y en el resto de América Latina. Afecta principalmente a individuos de bajos recursos, por lo que no resulta de gran interés comercial la inversión de capital en el desarrollo de una molécula eficaz para el tratamiento terapéutico a corto plazo o de una vacuna preventiva de la enfermedad.
La Organización Panamericana de la Salud (OPS) estima que actualmente en Argentina existen 1 600 000 infectados y que por año se registran aproximadamente 1 000 nuevos casos por infección congénita.1
Los fármacos más utilizados para el tratamiento de la enfermedad son Nifurtimox y Benznidazol, ambos con demostrada eficacia en las primeras etapas, tras el contacto entre Trypanosoma cruzi y el ser humano, fundamentalmente en niños.2 Lamentablemente a medida que la enfermedad progresa, la eficacia de ambos fármacos disminuye considerablemente y los resultados obtenidos se vuelven contradictorios.3
Ante este panorama, se hace imperioso desarrollar nuevas barreras de contención para prevenir la transmisión de la enfermedad a través de cualquiera de sus vías e innovar en estrategias dirigidas al control del principal vector de transmisión en Argentina: Triatoma infestans (vinchuca).4 Actualmente el control del vector se realiza mediante mecanismos que incluyen el mejoramiento de la vivienda, la educación sanitaria y el control directo de los insectos vectores.
Las campañas, para el control de vectores de la enfermedad, realizadas en Centro y Sud América se basan en la utilización de insecticidas piretroides de alto poder residual.5,6 El uso masivo y de manera imprudente de estos compuestos desencadenó el desarrollo de mecanismos de resistencia triatomínea a los anticolinesterásicos y piretroides.7 Además del fenómeno de resistencia, estudios recientes han demostrado la incidencia que el peridomicilio posee en la re-infestación con Triatoma infestans en los hogares rociados con productos químicos.8,9
Estos fenómenos, sumados al avance que en los últimos años se produjo sobre el control de artrópodos mediante el empleo de agentes cada vez más selectivos y potentes; y que permitió el desarrollo de moléculas altamente efectivas, se tornan como el principal argumento de una línea de investigación que establece que la administración de un fármaco con actividad triatomicida, en los distintos animales que habitan en el peridomicilio, podría contribuir al control de las vinchucas. Los endectocidas son un claro ejemplo de este tipo de moléculas.
La introducción de las primeras avermectinas revolucionó el mercado farmacéutico veterinario. Entre sus principales características podemos mencionar su elevada potencia farmacológica que permite dosificar en el orden de los µg/Kg de peso vivo (p.v.), prolongada persistencia y amplio espectro de actividad sobre parásitos internos y externos.10,11,12 Dentro de esta familia de moléculas, tanto ivermectina,13,14,15 como eprinomectina16 y doramectina17 han demostrado gran efectividad sobre endo y ectoparásitos; todas caracterizadas por poseer amplio margen de seguridad. Existen en el mercado diversas formulaciones en una amplia variedad de formas orales, parenterales y tópicas para ser administradas en diversas especies animales.
En cuanto al mecanismo de acción de las avermectinas debemos mencionar que actúan como agonistas de un tipo especial de canales de cloruro activados por glutamato,18 el efecto neto de esta actividad es un aumento en la permeabilidad de los iones Cl- y por consiguiente una hiperpolarización celular que desencadena una parálisis en la musculatura somática. La muerte del insecto se debe fundamentalmente a la parálisis que se observa a nivel de la musculatura faríngea.
Considerando que la utilización racional de estas moléculas endectocidas podría llegar a representar una nueva herramienta en el control de Triatoma infestans decidimos diseñar un ensayo in vitro para evaluar su posible acción triatomicida.
MÉTODOS
Material biológico
Triatoma infestans: se utilizaron 600 ninfas de quinto estadio provenientes de una cepa de T. infestans criada en el laboratorio con condiciones ambientales controladas: 25-30 °C, 50-70 % HR y foto-período 12:12 h. Al comienzo del ensayo las ninfas llevaban 4 semanas de ayuno. Las ninfas procedían del Centro de Referencia de Vectores, Córdoba, Argentina y se encontraban libres de Trypanosoma cruzi.
Los insectos fueron alimentados con sangre obtenida de bovinos, raza Holando Argentino, en perfectas condiciones de salud y que no hubiesen recibido tratamiento antiparasitario alguno durante los 6 meses previos al comienzo del estudio. Para alimentar a los ejemplares de vinchucas se utilizó una cámara de alimentación similar a la utilizada por Núñez et. al.19 De manera concisa, el alimentador artificial fue construido utilizando una cápsula de vidrio por donde se permitió circular, a través de una serpentina de vidrio, agua termostatizada; la base de la cápsula fue cerrada con una cubierta de látex. La sangre bovina, heparinizada y termostatizada (35-37 °C), fue colocada dentro de la cápsula en contacto con el látex. A las vinchucas contenidas en potes de plástico se les permitió alimentarse durante una hora, a través del látex, de la sangre bovina fortificada a diferentes concentraciones con cada una de las moléculas en estudio según se describe a continuación. Se comenzó siempre a alimentar con la menor concentración de endectocida; y entre cada alimentación se lavó correctamente el alimentador, se lo enjuagó con metanol y se secó en estufa a 60 °C, evitando así la contaminación cruzada. Para el control negativo se utilizó sangre heparinizada sin fortificar con endectocidas.
Principios activos
Se utilizaron estándares técnicos de ivermectina (90 %), eprinomectina (90,7 %) y doramectina (94,8 %).
Se preparó una solución stock estándar primaria, conteniendo 1000 µg/mL, con cada uno de los principios químicos a ensayar. Para lo cual se pesaron 10,00 ± 0,05 mg de cada endectocida (corrigiendo por su correspondiente potencia) en un matraz aforado de 10 mL, se lo disolvió y se llevó a volumen con metanol calidad cromatográfica (Baker MallinckrodtInc.,). A partir de estas soluciones primarias se prepararon diariamente las diversas soluciones de trabajo (secundarias) a ensayar. De estas soluciones secundarias se obtuvo una alícuota necesaria para lograr concentraciones en el rango de 0,4 a 100 ng/mL de cada una de las moléculas de interés, la que fue colocada en tubos cónicos de vidrio borosiliconado para ser evaporada a 50 oC bajo corriente de nitrógeno. El residuo seco fue disuelto en 50 mL de sangre heparinizada mediante agitación constante durante 30 minutos. La sangre con cada una de las distintas concentraciones a evaluar fue colocada en la cámara de alimentación para continuar con el estudio.
Diseño experimental
Las 600 ninfas fueron divididas en tres lotes de 200 individuos cada uno. El lote 1 se utilizó para realizar el ensayo con ivermectina, mientras que los insectos de los lotes 2 y 3 fueron utilizados para los ensayos con doramectina y eprinomectina respectivamente. El procedimiento seguido con cada una de los agentes endectocidas fue el siguiente:180 ninfas (20 individuos fueron reservados por cualquier eventualidad), fueron divididas en 9 grupos de 20 individuos cada uno. Cada grupo, a su vez, fue dividido en dos subgrupos. Los subgrupos fueron denominados 1A y 1B, 2A y 2B, 3A y 3B; y así sucesivamente hasta 9A y 9B. Los subgrupos A fueron alimentados con sangre fortificada con el endectocida en un rango de concentraciones de 0,4; 0,8; 1,6; 3,125; 6,25; 12,5; 25; 50 y 100 ng/mL. Los insectos pertenecientes al subgrupo B fueron alimentados con sangre sin fortificar (control negativo). Las vinchucas fueron alimentadas durante una hora. Los recipientes con los insectos fueron pesados antes y después de la alimentación, con el fin de calcular la cantidad de sangre ingerida por las vinchucas en cada uno de los ensayos.
Una vez concluida la alimentación de las vinchucas, se registró la mortalidad de las mismas cada 24 hs durante una semana. El criterio de muerte utilizado fue el establecido por la World Health Organization,20 estableciendo como “muerto” a todo insecto que puesto en un papel de filtro perdió la capacidad de movilizarse por sus propios medios en forma espontánea o bajo la influencia de algún estímulo.
Método estadístico
Se realizó un análisis de regresión Probit a partir de la variable de respuesta mortandad considerando como predictores al tiempo, a la concentración y al endectocida utilizados. A partir de los mismos se calculó la probabilidad de muerte de las ninfas. Se utilizó el test de Chi cuadrado para realizar las comparaciones entre los tratamientos y análisis de varianza para determinar la posible existencia de diferencias en el volumen de sangre consumida por las vinchucas.
Para el procesamiento de datos se utilizó el programa estadístico STATA 11SE (Stata Corporation, College Station, TX).
RESULTADOS
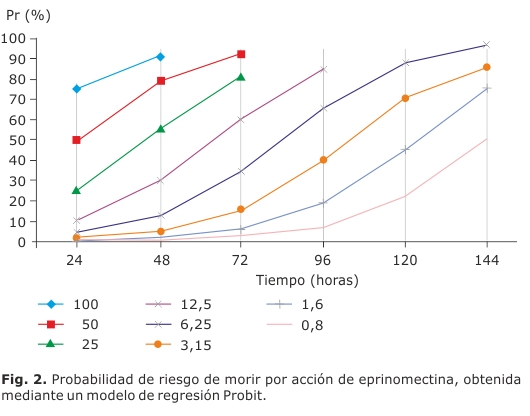
Bajo las condiciones específicas con las que se realizaron los ensayos, encontramos que las tres moléculas mostraron buena eficacia frente a T. infestans. El modelo empleado para la regresión Probit explica el 48 % de la variación de la mortandad de las ninfas (p<0,01). Los valores individuales de probabilidad de morir para cada molécula se presentan en las tablas y figuras 1, 2 y 3.
Los tres compuestos demostraron actividad frente a T. infestans, siendo sobresaliente el comportamiento de DRM (tabla 1-figura 1). A las 24 hs post-alimentación, DRM presentó un 60 % de mortandad a la máxima concentración ensayada y continúo ejerciendo efecto, incluso a concentraciones de 0,4 ng/mL, hasta 196 h post-tratamiento.
Se observó que a 1,6 ng/mL la DRM ocasionó la muerte de todos los insectos en el transcurso de una semana post-alimentación. Por debajo de esta concentración (1,6 ng/mL) la eficacia de DRM fue disminuyendo (tabla 1-figura 1). En el caso de EPM, al igual que lo observado para DRM, comenzó a ejercer actividad a partir de las 24 hs post-alimentación. Por debajo de 3,15 ng/mL ya no se alcanzó una mortandad del 100 % transcurrida una semana post-alimentación, inclusive a 0,4 ng/mL la eficacia de EPR como triatomicida fue nula (tabla 2-figura 2).
En cuanto a IVM, recién transcurridas las 48 hs post-alimentación se pudo observar su actividad como triatomicida (tabla 3-figura 3). Por debajo de 6,25 ng/mL de IVM la mortandad de vinchucas ya no fue del 100 %, y al igual con lo que ocurrió en el caso de EPR, la mortalidad fue nula a 0,4 ng/mL. En cuanto a la potencia para el 100 % de mortalidad, doramectina fue la más potente (1,6 ng/mL), mientras que eprinomectina (3,15 ng/mL) e ivermectina (6,25 ng/mL) necesitaron una mayor concentración para eliminar la totalidad de vinchucas.Los porcentajes de mortandad acumulados fueron 86 % para doramectina (DRM), 80 % para ivermectina (IVM) y 77 % para eprinomectina (EPR), sin embargo, no resultaron estadísticamente significativos (p>0,05) tras su comparación por Chi cuadrado. Como se mencionó con antelación para determinar la posible existencia de diferencias en el volumen de sangre consumida por las vinchucas, se realizó análisis de varianza, no encontrándose diferencias significativas entre los diferentes tratamientos (p>0,05).
DISCUSIÓN
A partir de estudios realizados en distintas localidades que habían sido rociadas con los insecticidas tradicionales,21,22 se logró confirmar el papel preponderante que ejerce el peridomicilio en el proceso de reinfestación con T. infestans.
Cabe destacar que la naturaleza heterogénea de las zonas cercanas a los domicilios, tanto desde sus estructuras (corrales, depósitos de leña, cocinas, etc.), como de la variedad de animales que pueden habitarlo (perros, gatos, cabras, gallinas, cerdos, etc.), hacen el territorio ideal para el desarrollo de focos residuales de T. infestans.
Diferentes estudios han demostrado que existe un aumento en la probabilidad de re infestación de un domicilio a partir de un peridomicilio infestado con T. infestans.23,24
Si bien en las campañas de rociado éste también es tratado, son varios los factores que influyen en la formación de focos residuales de vinchucas y limitan la eficacia del rociado, entre estos factores los de mayor relevancia son: la pronta degradación del insecticida por factores climáticos, la imposibilidad de rociar determinadas locaciones, el intercambio y acopio de distintos materiales y la existencia de animales que constituyen importantes fuentes de alimentación para T. infestans. Por lo tanto se hace imperioso eliminar esos focos residuales de T. infestans con metodologías alternativas.
El objetivo de este trabajo fue evaluar la eficacia de tres endectocidas contra ninfas de quinto estadio de T. infestans. Estas tres moléculas fueron elegidas por sus características frente a distintos parásitos (tanto endo como ectoparásitos), por ofrecer la posibilidad de ser utilizados en diferentes especies animales que habitan en el peridomicilio, y por su baja toxicidad en el hospedador (animal o humano).
Como antecedente en investigación de una de estas moléculas en un modelo in vitro frente a T. infestan podemos mencionar al trabajo realizado por Carvajal et al.,25 en el cual se prueba ivermectina aplicada tópicamente sobre ninfas de primer estadio. A los insectos se les aplicó un rango de dosis de 0.002-1 µg/insecto, determinando una dosis letal 50 (LD50) por encima de los 200 ng por insecto, aunque en la discusión del trabajo luego se afirma que no obtuvieron letalidad a las dosis evaluadas (0.002-1 µg/insecto), por lo tanto, no queda claro si la letalidad se obtuvo por encima de los 200 ng/insecto o por encima de los 1000 ng/insecto. Si bien estos resultados difieren con los obtenidos por nuestro grupo de investigación, cabe mencionar que las metodologías utilizadas fueron claramente diferentes. En el trabajo de Carvajal la vía de administración fue la tópica,ya que se buscaba demostrar la efectividad por contacto de distintos insecticidas, utilizando ninfas de primer estadio;mientras que en nuestro caso lo que se buscó evaluar fuela eficacia de los endectocidas a partir de la ingesta de los mismosen ninfas de quinto estadio de T. infestans. La gran diferencia en las concentraciones letales halladas en los dos trabajos podría estar determinada por las distintas vías de administración que se utilizaron, la vía tópica enfrenta una barrera compleja que es la cutícula del insecto, la necesidad de una dosis mayor puede estar determinada por el proceso de penetración a través de la cutícula y por eventos detoxificantes que se pueden ver involucrados durante el pasaje por dicha barrera.
Bajo nuestras condiciones experimentales las tres moléculas resultaron efectivas como triatomicidas. Doramectina resultó ser la más potente para el 100 % de mortalidad, seguida de eprinomectina e ivermectina. No se halló diferencia alguna entre el volumen de sangre ingerida por las vinchucas alimentadas con sangre tratada, y las que se alimentaron con sangre sin tratar (control), es decir que ninguna de las tres moléculas estudiadas posee la capacidad de reducir el volumen de sangre ingerida. Este dato es fundamental, pues nos permite descartar que la diferente eficacia triatomicida se deba a una diferencia en la ingesta de sangre por los insectos.
Como conclusión podemos afirmar que es un comienzo alentador el haber demostrado la actividad de estas tres moléculas evaluadas frente a T. infestans. A partir de estos resultados podemos continuar profundizando el conocimiento de la relación endectocidas -T. infestans- peridomicilio, lo que nos permitirá desarrollar distintas líneas de investigación. Una de ellas tendrá como objetivo demostrar si la actividad frente a T. infestans se conserva aún en modelos animales. Como antecedente del uso de endectocidas en modelos animales se puede mencionar el trabajo de Días et al.,26 quien utilizó el producto comercial Dectomax® (doramectina) administrado por la vía subcutánea en perros mestizos. A la concentración utilizada (20 mg a.i./Kg) encontraron que el producto tuvo una gran eficacia frente a las vinchucas hasta las 72 hs post administración del endectocida, para desaparecer por completo a las 312 hs. Aquí discernimos con los autores, ellos mencionan una dosis de 20 mg/kg, cuando los endectocidas en perros se dosifican a razón de 300 µg/kg a 600 µg/kg para el tratamiento por ejemplo de sarna sarcóptica o demodécica respectivamente,27 es decir la dosis mencionada por Días et al. es aproximadamente entre 33,33 y 67 veces superior a la dosis terapéutica. Días et al.26 también estudiaron el efecto de la doramectina sobre la parasitemia en los perros tratados, donde no hallaron efecto alguno del endectocida sobre Trypanosoma cruzi, es decir, la parasitemia no se vio disminuida tras el tratamiento de los perros con Dectomax®. Este tópico debe ser investigado en profundidad, ya que a pesar de que en el trabajo de Días la molécula no presentó eficacia frente a T. cruzi, no fue evaluado si el compuesto ejerce algún efecto sobre los T. cruzi presentes en T. infestans, y de esta manera transformarse en una promisoria herramienta, tanto en el control de T. infestans como en el control del T. cruzi que esté presente en los intermediarios.
Es de destacar finalmente, que este tipo de agentes endectocidas son de uso frecuente en animales de producción y de compañía, en los que se alcanzan niveles plasmáticos en el orden de las concentraciones evaluadas en el presente estudio, con una prolongada persistencia (entre 20 a 120 días) dependiendo de la formulación empleada.28,29,30 De manera que como conclusión final, podemos inferir que a partir de los resultados obtenidos, estas moléculas podrían transformarse en una prometedora alternativa para el control directo de los insectos vectores.
REFERENCIAS BIBLIOGRÁFICAS
1. Organización Panamericana de la salud. Estimación cuantitativa de la enfermedad de Chagas en las Américas. 2006;OPS/HDM/CD/425-06.
2. Freiji H, Altech J. Congenital Chaga's disease: diagnostic and clinical aspects. Clin Infect Dis. 1995;21(3):551-5.
3. Cancado JR. Criteria of Chagas disease cure. Mem. Inst. Oswaldo Cruz. 1999;94(1):331-6.
4. Jörg ME. Límite sur de la dispersión geográfica de Triatoma infestans y su infestación por Trypanosoma cruzi en Argentina. Bol Of Sanit Panam. 1957;42(1):59-66.
5. Oliveira Filho AM. Uso de nuevas herramientas para el control de triatominos en diferentes situaciones entomológicas en el continente americano. Rev.Soc. Bras. Med. Trop. 1997;30(1):41-6.
6. Oliveira Filho AM. Differences of susceptibility of five triatomine species to pyrethroid insecticides-implications for Chagas disease vector control. Mem. Inst. Oswaldo Cruz. 1999;94(1):425-8.
7. Picollo MI, Vassena CV, Santo Orihuela P, Barrios S. Hight resistance to pyrethroid insecticides aasociated with ineffective field treatments in Triatoma infestans (Hemiptera, Reduvidae) from the north of Argentina. J Med. Entomol. 2005;42(4):637-42
8. Diotaiutti L, Vaz de Melo Azeredo B, UberBusek SC, Fernandes AJ. Controle do Triatoma sordida no peridomicilio rural do municipio de Porteirinha, Minas Gerais, Brasil. Rev Panam Salud Pública. 1998;3:21-5.
9. Gürtler RE, Wisnivesky-ColliC, Solarz ND, Lauricella M, Bujas M. Dinámica de la transmisión de T. cruzi en una zona rural de la Argentina: II. Relación entre la infección doméstica en niños y perros y la densidad de Triatoma infestans infectados. Bol SanitPanam. 1988;104:130-43.
10. Burg RW, Miller BM, Baker EE, Birnbaum J, Currie SA, Hartman R, et al. Avermectins, new family of potent anthelminthic agents producing organisam and fermentation. Antimicrob. Agents Chemother.1979;15(3):361–7.
11. Forbes AB. A review of regional and temporal use of avermectins in cattle and horses worldwide. Vet. Parasitol. 1993;48:19–28.
12. Borges FA, Silva HC, Buzzulini C, Soares VE, Santos E, Oliveira GP, et al.Endectocide activity of a new long-action formulation containing 2.25 % ivermectin+1.25% abamectin in cattle. Vet Parasitol. 2008;155(3-4):299-307.
13. Turner MJ, Schaeffer JM. Mode of action of ivermectin. In: Campbell WC, editor. Ivermectin and Abamectin, New York: Springer Verlag. 1989;73-88.
14. Fink DW, Porra AG. Pharmacokinetics of ivermectin in animals and humans. In: Campbell WC, editor. Ivermectin and Abamectin, New York: Springer Verlag.1989;113-30.
15. Arieta-Román RJ, Rodríguez-Vivas RI, Rosado-Aguilar JA, Ramírez-Cruz GT, Basto-Estrella G. Moxidectina (10 %) e Ivermectina (3,15 %): evaluación de su eficacia y persistencia contra infestaciones naturales de Rhipicephalus (Boophilus) microplus en bovinos del trópico mexicano. Rev Mex Cienc Pecu. 2010;1(1):59-67.
16. Aguirre DH, Gaido AB, Cafrune MM, Castelli ME, Mangold AJ, Guglielmone AA. Eprinomectin pour-on for control of Boophilus microplus (Canestrini) ticks (Acari: Ixodidae) on cattle. Vet Parasitol. 2005;127(2):157-63.
17. Pereira JR. The efficiency of avermectins (abamectin, doramectin and ivermectin) in the control of Boophilus microplus, in artificially infested bovines kept in field conditions. Vet Parasitol. 2009;162(1-2):116-9.
18. Shan Q, Haddrill JL, Lynch JW. Ivermectin, an unconventional agonist of the glycine receptor chloride channel. Journal of Biological Chemistry. 2001;276(16):12556-64.
19. Núñez JA, Lazzari CR. Rearing of Triatomainfestans Klug (Het., Reduviidae) in the absence of a live host. Some factors affecting the artificial feeding. J Applied Entomol.1990;109:87-92.
20. World Health Organization. Protocolo de evaluación de efecto insecticida sobre triatominos. WHO/UNDP/WB/TDR. Acta Toxic Argent. 1994;2(1-2):29-31.
21. Oliveira Filho AM, Santos CE, Melo TMV, Figuereido MJ, Silva EL, Dias JCP, et al. Field trial of insecticides in an area of high levels of infestation and dispersion of Triatoma infestans. Mem Inst Oswaldo Cruz. 1986;81(Suppl):171.
22. Dias JCP. Reinfestação do município de Bambuí por triatomíneos transmissores da doença de Chagas. Mem Inst Oswaldo Cruz. 1967;66:197-208.
23. Cecere MC, Gürtler RE, Canale D, Chuit R, Cohen JE. El papel del peridomicilio en la eliminación de Triatoma infestans de comunidades rurales argentinas. BolOficSanitPanam. 1996;121:1-10.
24. Wisnivesky-Colli C. La importancia del peridomicilio en un programa de eliminación de Triatoma infestans. Rev Soc Bras Med Trop. 1993;26(supl3):55-63.
25. Carvajal G, Mougabure-Cueto G, Toloza AC. Toxicity of non-pyrethroid insecticides against Triatoma infestans (Hemiptera:Reduviidae).MemInst Oswaldo Cruz. 2012;107:675-9.
26. Días JCP, Shofield CJ, Machado EMM, Fernandes AJ. Ticks, ivermectin, and experimental Chagas disease. Mem Inst Oswaldo Cruz. 2005;100(8):829-832.
27. Martínez-Subiela S, Bernal LJ, Tvarijonaviciute A, Garcia-Martinez JD, Tecles F, Cerón JJ. Canine demodicosis: the relationship between response to treatment of generalised disease and markers for inflammation and oxidative status. Veterinary Dermatology. 2014;25(2):72-e24.
28. Dadé M, Daniele M, Buchamer A, Marchetti ML, Mestorino N. Perfiles residuales de ivermectina en pollos parrilleros. 8vas Jornadas Internacionales de Veterinaria Práctica, organizadas por el Colegio de Veterinarios de la Provincia de Buenos Aires. 2013.
29. Echeverria J, Mestorino ON, Errecalde JO. Comparative pharmacokinetics of ivermectin after its subcutaneous administration in healthy sheep and sheep infected with mange. Journal of Veterinary Pharmacology and Therapeutics. 2002;25:159-160.
30. Mestorino N, Turic E, Pesoa J, Echeverría J, Errecalde O. Pharmacokinetics in plasma of ivermectin after its oral (solution and tablets) administration to sheep. Journal of Veterinary Pharmacology and Therapeutics. 2003;26(4):307-309.
Recibido: 26 de diciembre de 2013.
Aprobado: 3 de junio de 2014.
Prof. Nora Mestorino. Laboratorio de Estudios Farmacológicos y Toxicológicos (LEFyT) Facultad de Ciencias Veterinarias, UNLP. 60 y 118 s/n, 1900, La Plata, Buenos Aires, Argentina. Correo electrónico: noram@fcv.unlp.edu.ar