Introducción
Los productos derivados de Bacillus thuringiensis se han empleado con éxito en el control de insectos durante más de medio siglo. La capacidad insecticida de esta bacteria reside fundamentalmente en un grupo diverso de proteínas denominadas deltaendotoxinas.1 De manera general, la eficacia y residualidad de estos productos pueden variar dependiendo del ingrediente activo, formulación, factores abióticos y bióticos, y de la frecuencia de recambios de agua en los criaderos.2,4,3,5,6,7,8
La formulación acuosa Bactivec® (LABIOFAM, Cuba) es un larvicida registrado en Cuba para el control de larvas de mosquitos. Estudios realizados demuestran que su utilización favorece la conducta de oviposición de las hembras de Aedes aegypti9 (Linnaeus) (Diptera: Culicidae), por lo que los criaderos tratados con B. thuringiensis se convierten en ovitrampas líticas.10
Las bondades que ofrece la utilización de este biolarvicida lo convierten en una alternativa factible para el control de Ae. aegypti.9,11 Sin embargo, la disminución de la residualidad de este y otros productos con base en B. thuringiensis4,6,12 promueve la búsqueda de otras alternativas. Estas podrían estar encaminadas a la selección de aislados de B. thuringiensis nativos adaptados a las condiciones ambientales de cada país.13,14,15 En Cuba, diferentes estudios informan la evaluación y selección de aislamientos con elevada actividad larvicida contra Ae. aegypti.16,17,18,19 Resultados previos muestran que el aislado A21 se destaca por su elevada actividad larvicida y ausencia de betaexotoxina.16,17,19 En este contexto, nos propusimos evaluar la toxicidad/patogenicidad aguda oral (modelo biológico Rattus norvegicus) y actividad larvicida residual del aislado A21.
Métodos
Material biológico
Cepa Rockefeller: cepa de laboratorio de Ae. aegypti susceptible a insecticidas, suministrada por el laboratorio del CDC (Centro para el Control y Prevención de Enfermedades) de San Juan, Puerto Rico.
Cepa: B. thuringiensis var. israelensis 266/2 9-VII-98 (ingrediente activo del biolarvicida comercial Bactivec®, LABIOFAM, Cuba).
Aislado: B. thuringiensis A2119 perteneciente a la colección de bacterias entomopatógenas, Departamento Control de Vectores, Instituto de Medicina Tropical Pedro Kourí (IPK), Cuba.
Animales de experimentación: R. norvegicus, cepa Wistar, adultos machos de 7 semanas, peso promedio de 300 g, suministrados por el CENPALAB (Centro para la Producción de Animales de Laboratorio, Cuba) con calidad higiénico-sanitaria.
Cultivo bacteriano
Tanto la cepa como el aislado de B. thuringiensis se cultivaron en el medio conformado por 20 g/L de levadura torula y 5 g/L de almidón de maíz; pH 7,0, suplementado con sales inorgánicas 12,5 mM MgSO4; y 25 mM NaCl, incubado en agitación a 150 rpm, 72 h a 28°C. Transcurrido este tiempo, se realizó la tinción simple con violeta cristal (al 2 %) en búsqueda de abundantes esporas y más de 80 % de cuerpos paraesporales liberados.
Evaluación de la toxicidad/patogenicidad aguda oral del aislado A21 en el modelo biológico Rattus norvegicus, cepa Wistar
Los animales (tres animales por grupo) se distribuyeron en dos grupos (control y tratado); al grupo control se le administró medio de cultivo estéril, y al tratado el aislado A21. Se utilizó una dosis de 5 x 108 UFC (unidades formadoras de colonias) del cultivo bacteriano por animal tratado, en dosis única por vía oral mediante una cánula curva metálica, en un volumen constante de 2 mL por animal. El estudio se prolongó durante 21 días tras la administración en los dos grupos de animales.20
Los animales fueron observados diariamente para el monitoreo de posibles cambios en la piel y pelaje, membranas mucosas y ojos, sistemas respiratorio, circulatorio, nervioso central y autónomo, actividad somato motora y patrón de comportamiento. Se prestó atención a la ocurrencia de algunos signos como temblores, convulsiones, diarrea, letargo, salivación, sueño y coma.
Los pesos individuales fueron determinados en los dos grupos, el día anterior del inicio del tratamiento, a las 3 h postratamiento, 3 días, semanalmente, y a los 21 días antes de ser eutanizados. El análisis estadístico de los resultados se llevó a cabo mediante el programa estadístico SPSS Statistics versión 17.0. Se realizaron pruebas de distribución normal mediante el test de Shapiro-Wilk, para una p > 0,05 se aplicó la correlación de Pearson.
Para estimar la eliminación de B. thuringiensis, las heces de los animales fueron recolectadas a las 3 h del inicio del tratamiento y a los días 3, 7, 14, y 21 del ensayo.20) Se realizaron diluciones seriadas de las muestras, posteriormente se sembraron en Agar Nutriente (BioCen, Cuba), (28°C, 24 h) para el posterior conteo de las UFC. Se realizó la lectura contando las colonias típicas de Bacillus crecidas en el medio de cultivo. La identificación se efectuó mediante el sistema API galería 50 CHB y se incluyó como control un cultivo puro del aislado A21. Para la confirmación de la especie B. thuringiensis se realizó la tinción simple con violeta cristal en búsqueda de cristales paraesporales. Se informaron como positivas las colonias cuyas características morfológicas y bioquímicas coincidieron con las del aislado A21.19
A los 21 días del ensayo se eutanizaron los animales del grupo tratado y control, y se les realizó necropsias completas. La eutanasia se efectuó mediante una sobredosis (30 mg/kg) del anestésico tiopental sódico por vía intraperitoneal.21 Antes de realizar la necropsia, se confirmó la muerte del animal.
Se realizó un análisis visual para la búsqueda de cambios macroscópicos en los órganos. Se tomaron muestras de riñones, hígado, bazo, pulmones, sangre y nódulos linfáticos.20 Una porción (0,5 g) de cada muestra se homogenizó en 1 mL de PBS mediante vórtex por 20 s. Se diluyó 100 µL de cada producto y se extendió en placa Petri con Agar Nutriente y se incubó durante 18 h a 30°C para el posterior conteo22 e identificación de colonias.
Determinación de la actividad larvicida residual del aislado A21
Bioensayos cuantitativos
Se realizó el cálculo del peso seco23 de la suspensión bacteriana obtenida con el aislado A21 y la cepa 266/2 9-VII-98 (control positivo del estudio de residualidad). La concentración se expresó en mg/L.
Para el cálculo de las concentraciones letales (CL 10, 50 y 90) se realizaron bioensayos según las guías de la OMS para larvicidas bacterianos de uso en salud pública24 a 26 ± 2 °C de temperatura y 55 % de humedad. Las larvas (III-IV estadio) de Ae. aegypti (25 larvas/100 mL de agua) utilizadas en los ensayos se obtuvieron de la cría mantenida en las instalaciones del insectario del Departamento de Control de Vectores del IPK, Cuba.25
Se evaluaron 8 concentraciones (dosis) con un factor de diferencia entre estas de 0,7; se garantizó que en al menos con 5 se obtuviera mortalidad entre 10 y 90 %. Los resultados fueron analizados en SPSS Statistics versión 17.0 mediante el análisis Probit.26 Por cada dosis se realizaron cuatro réplicas y los experimentos se repitieron cuatro veces en semanas diferentes.
La corrección de la mortalidad se realizó según la fórmula de Abbot, cuando la mortalidad en los controles se comportó entre el 5 y 10 %.
Actividad residual
Los bioensayos de laboratorio (26 ± 2 °C y 55 % de humedad relativa) se realizaron siguiendo la metodología de la OMS,24 simulando condiciones del terreno en cuanto al tipo de recipiente (plástico) y recambios de agua.
En cada recipiente se añadieron 8 L de agua declorinada y 50 larvas (III-IV estadio). Se aplicó como dosis el resultado del múltiplo 9 por el valor de la CL90 obtenida en los bioensayos cuantitativos para el aislado y el control.24
La dosis se aplicó solo una vez al inicio del bioensayo. Se utilizaron recipientes controles negativos (medio de cultivo estéril). Se contaron las larvas sobrevivientes cada 2 h hasta 72 h para realizar el cálculo de la mortalidad larvaria.
Los individuos vivos a las 72 h se extrajeron de los recipientes y se eliminaron. Semanalmente, se efectuó el recambio de agua en los recipientes que así lo requerían según se describe a continuación:
Recambio total: se eliminó toda el agua y se restituyó por 8 L de agua declorinada.
Recambio medio: se eliminaron 4 L y se restituyeron por 4 L de agua declorinada.
No recambio: no se eliminó el agua, solo se restituyó en cada recipiente la que disminuyó como resultado del proceso de evaporación.
Las larvas se adicionaron, nuevamente, 24 h después de cada recambio de agua.24 El valor de mortalidad larval se expresó en porciento. Se realizaron cuatro réplicas de los bioensayos de laboratorio. El experimento se detuvo cuando la mortalidad alcanzó valores ≤ 50 % durante dos semanas consecutivas.
Los datos de mortalidad larvaria fueron recogidos y procesados en el paquete estadístico SPSS Statistics versión 17.0. Los tiempos letales (TL) 50 y 95 (expresados en horas) se determinaron mediante Probit.26 Se calculó el porciento de mortalidad larvaria, la media y su desviación estándar. Los resultados se analizaron estadísticamente mediante un ANOVA de una vía, cuando existieron diferencias significativas (p ≤ 0,05) se aplicó análisis post hoc mediante la prueba de Tukey.
Consideraciones éticas
El protocolo de investigación fue aprobado por el Comité de Ética Institucional del IPK (código 21-16). El diseño utilizado redujo al mínimo el número de animales a emplear en este tipo de investigación. Los animales se mantuvieron con una dieta certificada por el CENPALAB. Se cumplieron las medidas de bioseguridad establecidas para el trabajo con animales de laboratorios.27
Resultados
Toxicidad/patogenicidad aguda oral del aislado A21
En ninguno de los grupos de animales se notificaron muertes ni signos clínicos de toxicidad durante los 21 días en que transcurrió el experimento. El comportamiento y el aspecto físico de los animales durante las supervisiones fueron normales para la especie y se constató comportamiento espontáneo en respuesta a la manipulación del usuario, pelo en buen estado, no presencia de secreciones y respiración estable. No se obtuvieron diferencias significativas en el peso de los animales tratados con el aislado A21 (p = 0,902) (media de 327,211) (DE ± 6,05) ni en el grupo control (p = 0,539) (media de 336,4778) (DE ± 5,731). No se detectaron diferencias significativas entre los grupos (p = 0,283).
Se obtuvo crecimiento de colonias sugestivas del género Bacillus en las heces de un solo animal después de 3 h de administrado el aislado A21 y en el resto de los animales tratados en el día 3 (Tabla 1).
La ausencia de cuerpos paraesporales y un perfil bioquímico diferente al obtenido para el aislado A21 de las colonias sugestivas del género Bacillus, obtenidas en el grupo control y en dos colonias obtenidas en el grupo tratado con A21 (a los 3 días), permitió confirmar que no se correspondían con B. thuringiensis. El resto de las colonias obtenidas en el grupo tratado con A21 presentaron cuerpos paraesporales y perfil bioquímico igual a A21, por lo que fueron clasificadas como B. thuringiensis (Tabla 1).
Tabla 1 - Resultados del conteo de colonias sugestivas de Bacillus en heces de Rattus norvergicus
| Control | 1 | 0 | 1 x 10 | 0 | 0 | 0 |
| 2 | 0 | 1 x 10 | 1 x 10 | 0 | 0 | |
| 3 | 0 | 1 x 10 | 0 | 0 | 0 | |
| Tratado | 1 | 0 | 2 x 102 | 0 | 0 | 0 |
| 2 | 0 | 1 x 10 | 0 | 0 | 0 | |
| 3 | 1 x 10 | 2 x 10 | 0 | 0 | 0 | |
En el análisis de infectividad, a los 21 días del ensayo, a partir de las muestras de tomadas de los animales sacrificados (tratado y control) no se obtuvo crecimiento bacteriano.
Efecto residual del aislado A21
Obtenidas las CL90 del aislado A21 y la cepa 266/2 9-VII-98 (Tabla 2), se calculó la dosis para el tratamiento de los recipientes en el bioensayo de actividad residual. Las dosis finales fueron de 0,01701 mg/L y 0,19512 mg/L, respectivamente.
Tabla 2 - Valores de concentraciones letales obtenidos con el aislado A21 y la cepa 266/2 9-VII-98
|
CL10 LI-LS |
0,00029 0,00023-0,00035 |
0,00416 0,00343-0,00482 |
|
LI-LS |
0,00075 0,00066-0,00085 |
0,00952 0,00876-0,01027 |
|
CL90 LI-LS |
0,00189 0,00153-0,00250 |
0,02168 0,01930-0,02438 |
Leyenda: CL: concentraciones letales; LI: límite inferior, LS: límite superior.
Los TL50 y TL95 entre la semana 1 y la 6 no se determinaron, debido a que a las 2 h de exposición de las larvas al aislado A21 se obtuvo un 100 % de mortalidad para recambio total, parcial y no recambio de agua.
En la tabla 3 se muestran los TL50 y TL95, desde la semana 7 hasta la semana 14 del experimento. Los valores de TL50 menores y mayores obtenidos fueron de 0:13 y 9:25 h, en las semanas 9 y 14, respectivamente, para no recambio. En la semana 7 se obtuvo el valor más pequeño de TL95, resultando de 1:15 h para el tratamiento de recambio total, y en la semana 13 se apreció el mayor valor obtenido de TL95, de 213:00 h para el grupo sin recambio de agua (Tabla 3). A partir del recambio 15 no se obtuvieron valores significativos de mortalidad hasta después de las 24 h, por lo que no se realizó el cálculo de los TL.
Tabla 3 - Valores de TL50, TL90 y TL95 con sus respectivos límites de confianza, determinados para el aislado A21, utilizando diferentes grupos de recambio de agua
| Semana | Recambio de agua | Tiempos letales (h) | |
|---|---|---|---|
| TL50 (LI-LS) | TL95 (LI-LS) | ||
| 7 | Total | 0:23 (0:002-1:04) | 1:15 (0:21-2:00) |
| Parcial | 0:32 (0:01-1:21) | 2:04 (0:59-2:41) | |
| No recambio | 0:34 (0:01-1:20) | 1:74 (1:08-2:50) | |
| 8 | Total | 0:45 (0:06-1:31) | 2:29 (1:31-4:00) |
| Parcial | 0:48 (0:060-1:35) | 2:44 (1:44-4:16) | |
| No recambio | 0:49 (0:06-1:38) | 2:50 (1:47-4:19) | |
| 9 | Total | 0:29 (0:13-0:36) | 3:58 (3:03-5:17) |
| Parcial | 0:59 (0:36-1:27) | 9:30 (8:13-11:09) | |
| No recambio | 0:13 (0:07-0:23) | 2:10 (1:38-3:11) | |
| 10 | Total | 1:32 (1:06-2:01) | 8:58 (7:50-10:25) |
| Parcial | 1:16 (1:32-1:43) | 7:53 (6:51-9:12) | |
| No recambio | 1:09 (0:52-1:29) | 4:48 (4:06-5:48) | |
| 11 | Total | 1:16 (1:31-1:44) | 8:01 (6:48-9:37) |
| Parcial | 2:23 (1:47-2:20) | 12:37 (10:55-14:05) | |
| No recambio | 0:58 (0:42-1:18) | 4:20 (3:36-5:27) | |
| 12 | Total | 0:22 (0:04-1:01) | 25:19 (15:25-42:14) |
| Parcial | 1:13 (0:20-2:01) | 82:50 (53:38-52:30) | |
| No recambio | 0:15 (0:02-0:44) | 17:01 (9:51-28:51) | |
| 13 | Total | 1:43 (1:11-2:39) | 43:58 (30:51-66:12) |
| Parcial | 5:26 (3:35-7:44) | 160:49 (109:50-67:13) | |
| No recambio | 7:37 (4:65-9:55) | 213:00 (142:10-68:36) | |
| 14 | Total | 4:10 (3:23-5:07) | 35:27 (29:37-44:01) |
| Parcial | 7:15 (6:19-9:00) | 68:14 (57:17-84:19) | |
| No recambio | 9:25 (7:31-10:49) | 84:37 (70:11-04:39) | |
Leyenda: LI: límite inferior; LS: límite superior.
Los TL50 y TL95 de mortalidad larvaria obtenida con la cepa 266/2 9-VII-98, en la semana uno (sin recambio) fueron de TL50 (LI-LS) 4:16 h (3:48-5:35); TL95-(LI-LS) 15:23 h (11:36-22:14) para los tres grupos (recambio total, parcial y no recambio de agua). En la segunda semana los tiempos letales 50 y 95 (LI-LS) fueron de 4:05 h (3:41-5:24) y 17:10 h (15:09-20:30) para el grupo de recambio total. Con el grupo de recambio medio se obtuvieron TL50 (LI-LS) de 4:22 h (3:20-4:48) y TL95 (LI-LS) de 16:15 h (14:23-19:21). Con el grupo de no recambio de agua los TL (LI-LS) fueron de 3:45 h (3:15-4:09) (TL50) y 14:56 h (12:25-18:05) (TL95). A partir del tercer recambio no se obtuvieron valores de mortalidad significativos hasta después de las 24 h, por lo que no se realizó el cálculo de los tiempos letales.
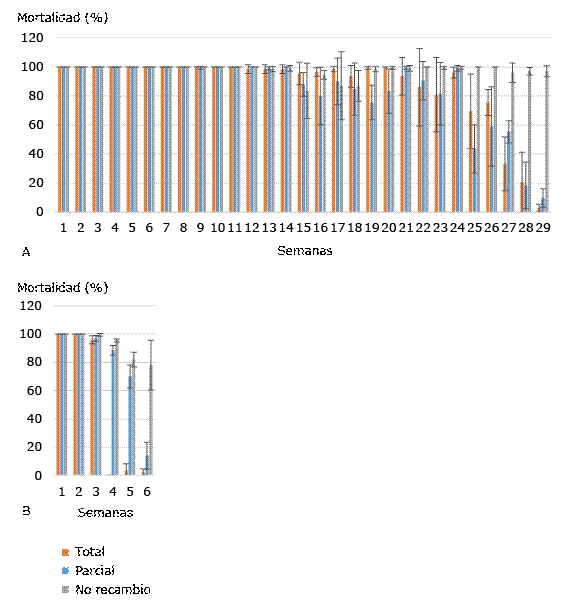
En la figura A se observan los porcentajes de mortalidad larvaria de Ae. aegypti de los recipientes tratados con el aislado A21 con recambio total, parcial y no recambio de agua a las 72 h de exposición en cada semana. La mortalidad larvaria a las 72 h se mantuvo entre 98 y 100 % para los tres niveles de recambio de agua hasta la semana 14, a partir de la cual se observó una disminución en la mortalidad sin diferencias significativas en cuanto a los tratamientos de recambio de agua. Sin embargo, a partir de las semanas 25 hasta 29 la mortalidad larvaria disminuyó de manera significativa (p < 0,05).
Con la cepa 266/2 9-VII-98 se alcanzó el 100 % de la mortalidad durante las primeras dos semanas en los tres grupos. En las semanas cuarta y quinta comenzó a disminuir la mortalidad larvaria con diferencias significativas (p ≤ 0,002) en relación con el recambio de agua. Para la sexta semana no se encontraron diferencias significativas en la mortalidad larvaria del grupo de recambio total y recambio medio de agua (p = 0,424), pero sí entre esos dos grupos y el de no recambio (p = 0,000). En la séptima semana se obtuvieron diferencias significativas (p ˂ 0,05) en la mortalidad larvaria de los tres grupos (Fig. B).
En las tres primeras semanas del experimento no se obtuvo diferencia significativa (p > 0,5) en la mortalidad larvaria obtenida tanto con A21 como con la cepa 266/2 9-VII-98. Sin embargo, a partir de la cuarta semana se presentaron diferencias (p ≤ 0,025).
Discusión
Las estrategias de control de vectores deben adaptarse a las condiciones locales, principalmente en los países de ingresos bajos y medios, que son los más afectados por el dengue y el cambio climático.28 La obtención de aislados de B. thuringiensis no tóxicos con elevada actividad larvicida contra Ae. aegypti en presencia de diferentes factores asociados a los criaderos, es el primer paso para el desarrollo de biolarvicidas más eficaces.
Teniendo en cuenta la elevada actividad contra larvas de Ae. aegypti del aislado A21 informada en otros estudios,16,19) evaluamos la toxicidad/patogenicidad de este aislado. Esto es un aspecto a tener en cuenta debido a que los principales sitios de cría de Ae. aegypti lo constituyen recipientes utilizados para el almacenamiento de aguas de consumo humano.29,30
En el ensayo de toxicidad/patogenicidad no se encontraron diferencias entre el grupo de animales tratado y el de control. Resultados similares fueron informados por Bishop y otros (1999)31 y Berlitz y otros (2012)32 después del tratamiento oral de ratones con aislados de B. thuringiensis. En estudios realizados con R. norvegicus se obtuvieron resultados semejantes.20
La poca diseminación y rápida eliminación de A21 en R. norvegicus fue demostrada en este estudio. Los resultados obtenidos coinciden con evaluaciones realizadas con el biolarvicida Bactivec®.20 Se plantea la hipótesis de que la poca distribución sistémica de B. thuringiensis se debe a que este microorganismo queda confinado en el tracto gatrointestinal sin colonizarlo y es eliminado posteriormente a través de las heces.20,32 Por otra parte, los principales factores de virulencia (Cry) de B. thuringiensis requieren de pH alcalinos para ejercer su mecanismo de acción1,33 y el pH del tracto gastrointestinal de los mamíferos no ofrece estas condiciones, lo que provoca la degradación y expulsión de estas proteínas.32 En resumen, los resultados obtenidos en el ensayo de toxicidad/patogenicidad y la ausencia de betaexotoxinas informada en estudios previos17 dan indicios de la inocuidad del aislado A21.
El constante recambio de agua en los depósitos utilizados por Ae. aegypti como sitios de cría conduce a la eliminación del principio activo de los biolarvicidas, por lo que quedan expuestos a la reinfestación.34 Los programas de control de vectores a menudo no cuentan con los recursos o el personal necesario para la revisión de viviendas y el tratamiento de los almacenamientos de agua, por lo que se hace necesario contar con biolarvicidas con efecto residual para el control de mosquitos.34
Los datos de TL50 y TL95 evidencian que el aislado A21 provoca una rápida mortalidad de las larvas de Ae. aegypti al compararse con la cepa 266/2 9-VII-98, aun después de numerosos recambios de agua. Estos tiempos letales también resultaron menores que los obtenidos por Sukesi y otros en 2019 al utilizar una suspensión de B. thuringiensis contra larvas de Ae. aegypti.35
En este estudio se obtuvo poca actividad residual con la cepa 266/2 9-VII-98 y esta se afectó por los recambios de agua en los recipientes. Sin embargo, con el aislado A21 se consiguió una elevada mortalidad, prolongada en el tiempo. Esto puede estar dado por características propias e intrínsecas del aislado. Se plantea que las características fenotípicas y genotípicas (expresión de componentes estructurales y proteínas de adhesión a las superficies) específicas de cada bacteria intervienen en los mecanismos de adhesión a las superficies.36 Las esporas de B. thuringiensis tienen una elevada hidrofobicidad que les confiere un elevado potencial adhesivo.37 Por tanto, se sugiere la posibilidad de que las esporas del aislado A21 se adhieran más a las superficies de los recipientes utilizados que las de la cepa 266/2 9-VII-98. Esto podría facilitar la interacción entre las larvas-esporas y cristales. En larvas muertas infectadas con B. thuringiensis, ocurren los procesos de proliferación, esporulación y como resultado se liberan esporas y cristales al medio que pueden ser consumidos por otras larvas.38 La conducta alimentaria de las larvas es fundamental, ya que la persistencia del producto también puede estar relacionada con el reciclado de toxinas como consecuencia de la ingestión de larvas muertas.39
Teniendo en cuenta las diferencias notificadas previamente en cuanto a la capacidad de adhesión de los aislados de B. thuringiensis a determinadas superficies,37 se recomienda evaluar la residualidad de A21 en otros recipientes.
Conclusiones
Los resultados del presente estudio evidencian la baja toxicidad y la elevada actividad larvicida residual contra Ae. aegypti del aislado A21 y lo convierten en un candidato promisorio para el desarrollo de biolarvicidas netamente cubanos. Estos productos, podrían contribuir a mejorar las estrategias de control existentes en Cuba. Investigaciones futuras deben estar encaminadas a realizar estudios de genómica y metabolómica con el aislado A21 para completar su caracterización.