Introducción
El dengue es una enfermedad viral aguda que se transmite mediante la picadura de la hembra de los mosquitos vectores Aedes aegypti y Aedes albopictus. El DENV (DENV, del inglés dengue virus) pertenece al género Flavivirus de la familia Flaviviridae. DENV posee un genoma de ARN de cadena única. Se conocen cuatro serotipos: DENV-1, DENV-2, DENV-3 y DENV-4.1
Los viriones poseen una simetría icosaédrica y contienen una bicapa lipídica o envoltura derivada de membranas procedentes del retículo endoplasmático, con tres proteínas estructurales, la glicoproteína de envoltura, la proteína de membrana y la proteína de cápside.2 La infección en humanos puede causar un amplio espectro de manifestaciones clínicas que van desde una enfermedad no aparente o asintomática (cerca del 50 % de los casos), a una fiebre autolimitada (fiebre del dengue o FD) o las formas graves de la enfermedad, que son la fiebre hemorrágica del dengue / síndrome de shock por dengue (FHD/SSD).3
El dengue es la enfermedad viral transmitida por mosquitos de más rápida propagación en el mundo. Su incidencia ha aumentado 30 veces con la creciente expansión geográfica hacia más de 100 países, y el incremento de casos reportados en más de 15 veces, en relación con las últimas dos décadas. Se estiman 100 millones de infecciones anuales con aproximadamente 500 000 casos graves, que conducen a casi 25 000 muertes por año.4
Esta enfermedad es endémica en África, el Mediterráneo Oriental, el Sudeste Asiático, el Pacífico Occidental y en las Américas.5 Más de 2/5 partes de la población mundial se encuentran en riesgo de contraer la infección.6
En América los brotes durante las últimas décadas se han manifestado de forma cíclica cada tres a cinco años.7 En Cuba, como consecuencia de las epidemias ocurridas desde el año 1977 hasta el presente, ha existido circulación de los cuatro serotipos en la población (característica de zonas endémicas), cuya implicación está relacionada con el mayor riesgo de aparición de las formas graves de la enfermedad.8,9 A pesar de su alta incidencia y extensión geográfica no existe actualmente ningún fármaco antiviral específico disponible ni vacuna aprobada para su uso contra la infección por DENV.6,10) Varias drogas tales como balapiravir,11 cloroquina,12 celgosivir,13 lovastatin,14 y prednisolona15 introducidas en ensayos clínicos no han resultado eficaces para su empleo contra el DENV. De ahí el interés creciente que existe en la comunidad científica por encontrar un tratamiento exitoso.
La humanidad ha empleado las plantas desde hace milenios debido a sus diversas propiedades biológicas, y son reservorios de sustancias que pueden emplearse como fármacos o servir como guías para la obtención de compuestos, cuyas estructuras químicas representan la base para la obtención de compuestos novedosos.10 Igualmente los productos naturales marinos, aunque no han sido evaluados en la misma proporción que los de origen terrestre, representan una fuente valiosa para el descubrimiento de compuestos biológicamente activos. Particularmente las algas se han empleado en el tratamiento de un gran número de enfermedades dada la presencia de compuestos que actúan como antioxidantes, antivirales, antialérgicos, antiinflammatorios, anticancerígenos, anticoagulantes, etc.16,17
Existen numerosos métodos in vitro e in vivo para evaluar la actividad antidengue de extractos naturales o moléculas derivadas de estos.18,19,20
Teniendo en cuenta lo descrito, es evidente la necesidad de la búsqueda y desarrollo de nuevos compuestos terapéuticos contra el DENV, para lo cual es preciso contar con sistemas evaluativos que permitan este objetivo.
En el presente trabajo se presenta la metodología empleada por el Grupo de Antivirales Naturales de la Facultad de Biología (Universidad de La Habana), en conjunto con el Laboratorio de Arbovirus del Instituto de Medicina Tropical Pedro Kourí para la evaluación de productos naturales contra el DENV utilizando modelos basados en cultivos celulares.
Métodos
Se utilizaron como fuentes primarias de información artículos publicados por el Grupo de Antivirales Naturales de la Facultad de Biología en revistas científicas nacionales e internacionales, registradas en las bases de datos SciELO o PubMed, así como revisiones y artículos de investigación relacionados con la temática.
El punto de partida para la evaluación de un producto como antiviral radica en el establecimiento de las condiciones en que se realizarán los ensayos, así como de los pasos en la metodología de trabajo. A continuación se muestra un esquema organizativo de los pasos fundamentales durante la pesquisa primaria (Fig. 1).
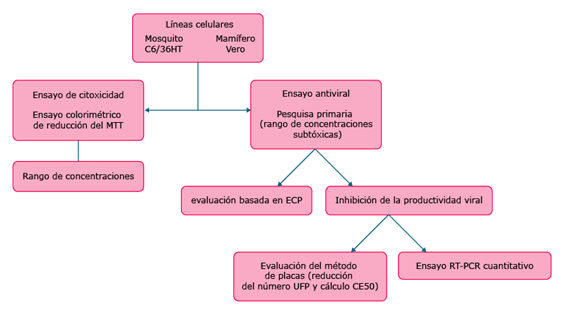
Fig. 1 Diagrama de flujo de pesquisa primaria antiviral contra dengue. La evaluación antiviral se procede en dos líneas de diferentes orígenes: de mosquito y de mamífero.21
Una breve descripción de cada uno de los pasos fundamentales se analiza a continuación:
Análisis de los métodos
Selección del sistema virus-célula adecuado
Los métodos basados en cultivos celulares son usados ampliamente y permiten comprobar si los productos evaluados inhiben la replicación viral o protegen a las células de los efectos citopáticos que estos virus provocan. El ensayo es relativamente simple y eficaz en cultivos de células permisivas y sensibles a la replicación del DENV, el cual se replica en el citoplasma de las células de vertebrados y de mosquitos.18 Puede afirmarse que el descubrimiento de antivirales ha venido en paralelo al desarrollo de ensayos basados en células infectadas.
No obstante, es importante considerar que la sensibilidad de los cultivos celulares a los virus y la respuesta de estos a un antiviral pueden variar considerablemente entre sistemas, de ahí la necesidad de incluir en las evaluaciones diferentes tipos celulares y variantes de virus.21,22 En particular, este hecho se ha demostrado en ensayos antivirales con DENV. Como ejemplo podría citarse el comportamiento antiviral diferente contra el DENV-2 de los carragenanos, según se trate de ensayos en células de mamíferos o de mosquitos (Vero y C6/36 HT), así como de diferentes mecanismos de inhibición. Además, hay que tener en cuenta que la actividad antiviral de un producto dado puede variar de un serotipo viral a otro.22
Un estudio con dos polisacáridos sulfatados obtenidos a partir de algas: Gymnogongrus griffithsiae y Cryptonemia crenulata mostraron la actividad antiviral dependiente del serotipo viral y de la célula hospedera. Una considerable inhibición de la replicación del DENV-2 en células Vero, un menor efecto se observó contra DENV-3 y DENV-4 y no hubo inhibición contra DENV-1.20
La inclusión en los ensayos de cepas virales estándares conjuntamente con aislamientos clínicos, así como variantes virales con diferente susceptibilidad a los fármacos de referencia, posibilita la validación de la investigación.22
Evaluación de la citotoxicidad del producto
La primera etapa en el estudio de cualquier producto como antiviral potencial consiste en un ensayo cuantitativo que permite evaluar sus efectos nocivos sobre las células o citotoxicidad, expresada como el valor de concentración que provoca daño celular evidente al 50 % de los cultivos tratados (concentración citotóxica media, CC50). El valor predictivo de los estudios de citotoxicidad se basa en la idea de que cuando se afectan funciones celulares básicas, que son comunes a todas las células, la determinación del daño celular es una medida aproximada de la toxicidad general del compuesto.
El conocimiento de este valor posibilita posteriormente emplear intervalos de concentración inferiores o subtóxicos en los ensayos de actividad antiviral.17,23 Se han descrito numerosos procedimientos para estimar el valor de CC50, pero los métodos colorimétricos son los más empleados. Entre estos se destaca el ensayo del MTT basado en la reducción del compuesto bromuro de 3-(4,5-dimetiltiazol-2-il)-2-difeniltetrazolio (MTT) por enzimas mitocondriales que se encuentran activas en las células viables con formación de un precipitado púrpura de formazán y el consecuente aumento de absorbancia. Este método se ha utilizado ampliamente para ensayos de citotoxicidad.23,24,25
Ensayo primario para el pesquisaje de actividad antiviral
La determinación de la actividad antiviral de un producto o compuesto mediante la metodología basada en células consiste en la evaluación de su capacidad de reducir o anular la multiplicación viral en los sistemas empleados. Por tanto, dicha determinación se basa en medir la replicación viral en presencia y ausencia del producto y compararlas entre sí. En estos ensayos la preincubación de los cultivos celulares con el producto a evaluar antes de la inoculación con el virus, garantiza que ningún mecanismo posible de acción antiviral quede excluido durante la pesquisa, lo que incluye la acción directa inactivante sobre la partícula viral extracelular.26
Este ensayo primario puede basarse en diferentes métodos o criterios: observación del efecto citopático (ECP), titulación del virus por el método de placas o unidades formadoras de placas (UFP), determinación de la viabilidad celular o alguna macromolécula viral (proteína o el ácido nucleico viral).27
Evaluación basada en la observación del efecto citopático
La mayoría de los virus son capaces de provocar alteraciones morfológicas como expresión de los cambios fisiológicos en las células conocidos en su conjunto como ECP. En muchas ocasiones estos cambios pueden apreciarse muy fácilmente al microscopio óptico invertido. De ahí que un método para la evaluación de un antiviral consiste por tanto en la determinación de la capacidad del producto de reducir o anular el ECP inducido por el virus. La concentración que provoca reducción del ECP en el 50 % de las unidades de prueba (pocillos de la placa) se conoce como concentración efectiva media (CE50) y es la manera de expresar cuantitativamente la actividad antiviral. Este método debe emplearse en los sistemas virus-célula donde el ECP, observado al microscopio, es bien evidente. Este es el método más barato y rápido que brinda criterio acerca de la actividad antiviral del producto en ensayo.23,26
Para llevar a cabo esta evaluación las células se cultivan en placas de 96 pocillos empleando el medio de cultivo apropiado para la línea celular. Los ensayos pueden ser diseñados para evaluar diferentes concentraciones de un producto natural o extracto proveniente de la fuente natural o pueden evaluarse diversos extractos en una concentración única subtóxica seleccionada (Fig. 2).

Fig. 2 Placa modelo empleada en nuestros laboratorios para ensayo de compuestos antivirales (dosis-respuesta). Los compuestos se añaden de concentraciones bajas a altas en los pocillos indicados (6 pocillos/concentración) y tres experimentos independientes. La lectura se realiza cuando todos los pocillos del control de virus presentan ECP.
Evaluación por el método de placas
Algunos virus son capaces de formar placas de lisis cuando se multiplican en determinados sistemas de cultivo, recubiertos por un medio semisólido como la agarrosa, metilcelulosa o la carboximetilcelulosa. En este método la difusión de las partículas virales formadas de novo es muy limitada debido a la consistencia semisólida, por lo que la infección está restringida a las células vecinas a la célula susceptible a la infección inicial.
Esto conduce a la formación de una zona de lisis celular masiva (placa de lisis) visible a simple vista. Teniendo en cuenta las diluciones apropiadas, cada placa de lisis se considera originada por una única partícula viral. La actividad antiviral de un producto puede ser entonces medida como su capacidad para reducir el número de placas de lisis formadas, con respecto al control.22,28
Por lo general, el DENV provoca placas en diversas líneas celulares, por lo que este método se emplea para evaluar la actividad antiviral de productos naturales contra este virus. Este método también permite determinar el valor de concentración efectiva media (CE50).
Inhibición de la formación de partículas virales infectivas
Un ensayo muy utilizado es el de la inhibición de la productividad viral también conocido como del rendimiento viral.
En nuestro laboratorio, este ensayo es el más empleado con el DENV y parte del mismo criterio de la pesquisa primaria de preincubación de los cultivos celulares y con el mismo protocolo de placa. Tan solo que comprende dos etapas:
Una vez realizado el tratamiento con el producto en cuestión, los cultivos celulares se infectan e incuban a la temperatura indicada, según la línea celular empleada.
Transcurrido el periodo de incubación se colectan los sobrenadantes y se procede a titular cada una de las variantes de tratamiento y respectivos controles mediante el método seleccionado. Bien por titulación de CCID50 (dosis infecciosa media en cultivo celular) en el que se tiene en cuenta el ECP o mediante cuantificación por UFP.29,30 También puede utilizarse técnicas inmunocitoquímicas como más adelante se expresa.
En nuestro sistema de pesquisa preliminar mediante este criterio, es decir, basado en células, se emplea en el ensayo una línea de mosquito C6/36HT y otra de mamífero como Vero. Una vez recogidos los sobrenadantes se titula o cuantifica en la línea BHK21 para el conteo de placas y así detectar la reducción de la productividad o rendimiento viral. En la figura 3 se muestra como ejemplo los porcientos de inhibición de la productividad vírica como consecuencia de la acción de los extractos de Ageratina havanensis evaluados en C6/36HT para la cepa DENV-2 A15.31
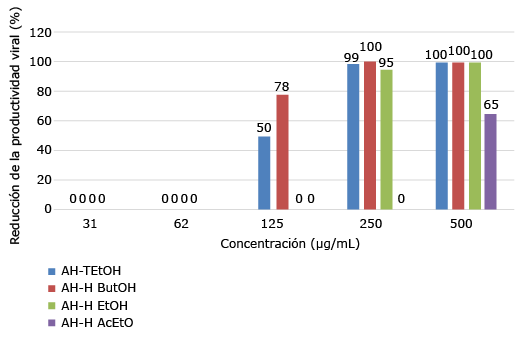
Fig. 3 Porcientos de inhibición de la productividad vírica como consecuencia de la acción de los extractos de Ageratina havanensis evaluados en C6/36HT para la cepa DENV-2 A15. Tomado de del Barrio et al., 2021.
El método colorimétrico del MTT mencionado u otro similar también puede ser empleado en la evaluación de la actividad antiviral. En este caso, este ensayo se fundamenta en que la replicación viral, conjuntamente con los cambios morfológicos que provoca, trae aparejada una marcada disminución de la viabilidad celular y alteración de las funciones mitocondriales. Un producto antiviral debe ser capaz de impedir el daño fisiológico de las células, impedir la disminución de la viabilidad celular y mejorar la función mitocondrial al inhibir la replicación viral en un intervalo de concentraciones subtóxicas. Esta inhibición viral se puede cuantificar mediante el ensayo del MTT a través de la siguiente fórmula:
donde AV+E es la media de las absorbancias de los cultivos inoculados y tratados con la concentración en cuestión
ACC es la media de las absorbancias de los controles celulares
ACV es la media de las absorbancias de los controles de virus.31,32
La concentración del producto asociada con un 50 % de inhibición define la CE50 en este ensayo.
Inhibición de la síntesis de macromoléculas virales
Los ensayos destinados a evaluar la acción del producto sobre la biosíntesis de macromoléculas virales demandan un conocimiento más profundo de los virus empleados, pues pueden requerir la utilización de cebadores o sondas de secuencias conocidas para detectar regiones específicas del genoma viral o anticuerpos que reconozcan determinada proteína viral. Ejemplos de ellos son:
La cuantificación de la síntesis de ADN o ARN viral: El efecto de compuestos en la producción de ácido nucleico viral puede evaluarse mediante varias técnicas, que incluyen hibridación, northern blotting, southern blotting reacción en cadena de la polimerasa (PCR) en tiempo real19 (actualmente la más empleada y de uso en nuestros laboratorios).
Análisis de proteínas virales: El efecto de compuestos en la producción de proteínas virales pueden evaluarse mediante western blotting, ensayos inmunoenzimaticos, marcaje radiactivo y citometría de flujo, entre otras.19,27
Ensayo RT PCR cuantitativo: Este ensayo se fundamenta en que la inhibición de la replicación viral trae aparejada una disminución del ARN viral, y así la determinación y cuantificación de este brinda un criterio acerca de la actividad antiviral.19,28
Para ello se extrae el ARN de los cultivos infectados y tratados y se compara con el obtenido de los cultivos infectados sin tratar. Igualmente en el ensayo de pesquisa primaria, este análisis se realiza en cultivos previamente tratados de modo similar al empleo de los métodos en que se evalúa mediante el criterio de ECP y UFP.
Los ensayos RT PCR cuantitativos para dengue generalmente son realizados in house en los laboratorios, aunque en muchos se realiza empleando estuches comerciales. Están dirigidos principalmente hacia la región estructural del virión, a través de la amplificación de los genes de la envoltura del virus y de la glicoproteína NS1.32,33
Determinación del reconocimiento de la proteína E u otra proteína a considerar, por ELISA de doble anticuerpo: En el ELISA la expresión o no de la proteína E del DENV está condicionada por el posible efecto antiviral del extracto añadido y se registra cuando hay una disminución de los valores de densidad óptica (DO). Se infiere entonces, que esta disminución de DO se debe a la acción inhibitoria del compuesto sobre la replicación viral, que impide la expresión de la proteína E en las células infectadas. Para ello, el laboratorio debe contar con los reactivos y anticuerpos específicos y necesarios, por lo que no siempre es factible.31
Determinación del índice selectivo
Con cualquiera de los métodos señalados se puede obtener un criterio primario acerca de la actividad antiviral del extracto o compuesto en estudio. Los valores de CC50 y CE50 permiten determinar el índice selectivo del antiviral.
El índice selectivo se define como el cociente entre la CC50 y la CE50 y representa una medida de la distancia entre la concentración antiviral y aquella que provoca efectos nocivos sobre las células, de ahí que mientras mayor es su valor, mejor es el antiviral desde el punto de vista de su acción selectiva y específica sobre la inhibición de la replicación viral.34,35 Por ello es necesario, previamente a la evaluación antiviral, conocer la citotoxicidad de dicho producto. No existe un valor de corte para esta magnitud a partir del cual se defina un buen antiviral; sin embargo, algunos autores consideran que para un producto natural, un índice selectivo mayor que 2 es suficiente.36,37
Chattopadhyay y otros en 2009 consideraron que un índice selectivo mayor que 3 indica potencial actividad antiviral del producto evaluado.38
El valor de índice selectivo es muy útil, además, para monitorear la purificación de principios activos presentes en los productos naturales y debe aumentar a medida que se avanza en el proceso con respecto a los extractos crudos. No se descarta que pudiera existir sinergia entre los compuestos presentes en los extractos crudos y ello posibilitaría mayores valores de selectividad.23,38
Ensayos secundarios y de mecanismos de acción
Una vez demostrada la acción inhibitoria en el ensayo primario debe realizarse estudios posteriores; esto es, estudios secundarios y de mecanismos de acción para caracterizar dicha actividad y conocer en qué momento del ciclo replicativo el producto tiene su acción, así como las posibles dianas moleculares de la inhibición, puesto que el ensayo de pesquisa primaria no permite conocer en detalle la actividad antiviral. El éxito de estos ensayos depende en gran medida de un buen conocimiento del virus en cuestión y su replicación.
No es objetivo del presente trabajo profundizar en el diseño de estos experimentos, aunque se mencionan algunos para conocimiento general:
Estudio del momento de acción: ensayo de tiempo de adición
Inhibición de la adsorción/penetración/desnudamiento: ensayo de tiempo de eliminación
Acción virucida.
Este último suele incluirse en nuestra pesquisa primaria, dado que numerosos compuestos de naturaleza química variada presentes en los extractos vegetales manifiestan esta acción. La acción inactivante directa de un producto sobre los viriones conduce a una disminución brusca en el título infectivo residual de la suspensión con respecto a los controles no tratados. Este es el fundamento del ensayo virucida extracelular. En la tabla se muestra que diferentes extractos obtenidos de Ageratina havanensis no actúan como virucidas extracelulares. Sin embargo estos son capaces de inhibir la replicación viral como se evidenció en la figura 3.31
Tabla Actividad virucida extracelular de los extractos AH-T EtOH y AH-HButOH frente a la cepa DENV-2 A15. Tomado de del Barrio et al., 2021
| Concentración (µg/mL-1) | Control del virus | Tratamiento con AH-T EtOH | Red (log) | Control del virus | Tratamiento con AH-HButOH | Red (log) |
|---|---|---|---|---|---|---|
| 500 | 2,82 x 104 | 1,8 x 104 | 0 | 2,4 x 104 | 2 x 104 | 0 |
| 1000 | 2,82 x 104 | 1,8 x 104 | 0 | 2,4 x 104 | 2,06 x 104 | 0 |
Red (log): reducción del logaritmo del título infectivo viral.
Discusión
La carencia de tratamientos específicos preventivos como son las vacunas debido a la complicación y el curso clínico de la enfermedad, que puede ser causada por cualquiera de los cuatro serotipos, y el hecho de que la infección con uno no protege frente a otro de los serotipos, sino más bien podría causar una amplificación dependiente de anticuerpos, unido a la carencia de tratamientos terapéuticos contra el DENV evidencia la gran necesidad de encontrar o desarrollar productos o moléculas terapéuticas.30,37
Diversos estudios han mostrado los efectos beneficiosos de productos naturales, particularmente los extractos de plantas y sus metabolitos secundarios, así como de algas marinas. La mayoría de estos compuestos poseen aplicaciones terapéuticas para enfermedades crónicas, procesos degenerativos, carcinogénesis y actividad antiviral.10,16,17,27
La demostración de efectos antivirales es clave para la pesquisa de compuestos o productos candidatos.38
Estos compuestos o moléculas precisan su estudio para confirmar o demostrar la actividad y en especial las propiedades antidengue representan actualmente una de las prioridades en el control.
Se utilizan diferentes técnicas en las que se emplean virus infectivos para estudiar las actividades antidengue in vitro e in vivo de extractos de plantas o moléculas derivados de estos; pero estos productos pueden ser tóxicos para las células, por lo que es muy necesario contar con una metodología que distinga entre ambas actividades, dado que la muerte celular podría estar relacionada con la citotoxicidad.20,22,32
La propuesta de nuestro protocolo de evaluación de productos o compuestos antidengue se basa en el desarrollo de una pesquisa primaria capaz de definir la eficacia y citotoxicidad en los modelos celulares de distintos orígenes y clasificación; esto es, humanos y no humanos, especialmente de mosquitos, así como líneas continuas y diploides. Dado que el DENV es citopático y es muy importante diferenciar la actividad antiviral de la actividad citotóxica, el producto debe ser capaz de inhibir la replicación viral sin provocar toxicidad en las células infectadas. Justo estos productos son los antivirales potenciales que justifican la continuación de la investigación.39
Si bien se precisa de altos niveles de control de la bioseguridad, en estos sistemas basados en cultivos celulares se tiene la ventaja de contar con la evaluación del ciclo de replicación viral completo.
La determinación de la concentración efectiva media y la CC50 brinda los criterios necesarios para la certeza de propiedad antiviral específica.34 Además, mediante la inhibición de la productividad vírica con el criterio mencionado de reducción del 50 % o más de UFP y la disminución del ARN viral, detectado mediante RT-PCR, se constata en estos estudios primarios la presencia o no de actividad inhibitoria de la infección o replicación del DENV.31
Mediante esta metodología de pesquisa primaria que permite comprobar la posible inhibición de cualquiera de los pasos del ciclo replicativo, junto al hecho que se suele partir de mezclas de componentes presentes en tales productos naturales existe una mayor oportunidad de hallazgo de bloqueo o inhibición de la infección.26 A ello se añade el hecho de que al considerar fuentes naturales, constituidas por una variedad de compuestos o metabolitos secundarios se abarca mayor espectro de blancos virales. Una vez detectada esta actividad debe procederse a estudiarla o caracterizarla, así como identificar el o los posibles principios activos presentes.
Cada vez surgen nuevas epidemias y pandemias causadas por agentes infecciosos donde los virus revisten gran importancia, por lo que resulta imprescindible contar con la infraestructura necesaria, tecnologías y metodologías para lograr más rápidamente los tratamientos y controles necesarios.
La metodología aquí descrita ha permitido poner en marcha un programa de búsqueda de fármacos antidengue teniendo en cuenta los criterios de la evaluación de la eficacia, toxicidad, intervalo y posterior estudio de mecanismos de acción de los diferentes compuestos o productos en estudio.
Este sistema de ensayos ha posibilitado identificar y demostrar actividad y potencialidad de plantas utilizadas en la medicina popular y dar prioridad al estudio de las que muestran resultados más interesantes.














