My SciELO
Services on Demand
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Cubana de Hematología, Inmunología y Hemoterapia
On-line version ISSN 1561-2996
Rev Cubana Hematol Inmunol Hemoter vol.15 no.1 Ciudad de la Habana Jan.-Apr. 1999
Cartas al Director
Efecto de un extracto de Morinda Roioc LIN (mediver) sobre la proliferación de los linfocitos humanos
Al director:La prueba de transformación linfoblástica (PTL) in vitro se puede medir a tráves de la captación de timidina radiomarcada (THdr), nucleótido necesario en el ensamblaje de la síntesis de ácido desoxirribonucleico,1 mediante lo cual se detecta la proliferación de los linfocitos de diferentes especies de animales, que pueden ser activados por antígenos,2 mitógenos3 y productos naturales a partir de extractos de plantas. En la actualidad existen numerosos medicamentos elaborados sobre la base del aislamiento de principios activos farmacológicos de plantas medicinales.4 La medicina tradicional le atribuye diversas propiedades a la Morinda roioc Lin (Mediver), perteneciente a la familia de las Ribiáceas, arbusto silvestre medicinal de ramas trepadoras, con las flores y los frutos amontonados en una especie de piña o cabezuela, es aromático-amargo, se considera que tiene probables efectos afrodisiácos y diuréticos. Se localiza en algunas zonas de Cuba como son: Isla de la Juventud, Camagüey, Ciénaga de Zapata, Boca de Jaruco y otros lugares de la costa norte de la provincia de La Habana, y se conoce por diversos nombres vulgares tales como: piñipiñi, piña de ratón, raíz de indio, curamagüey, y raíz de añil.5
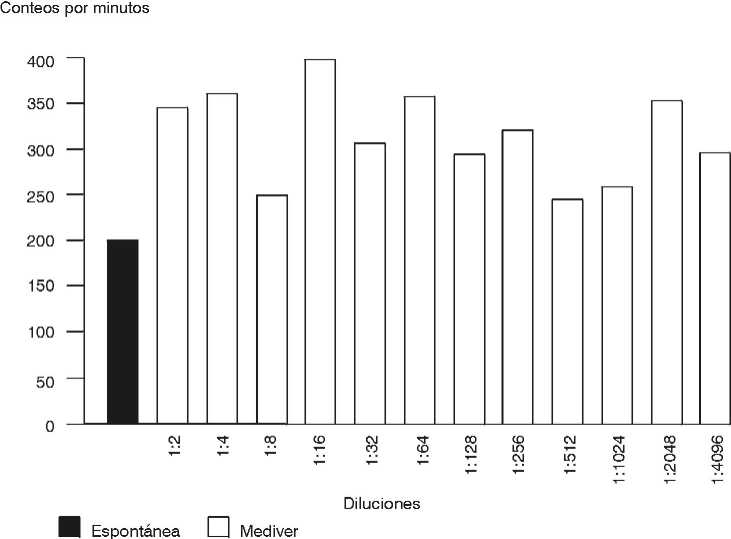
Con el objetivo de determinar el efecto del Mediver sobre la proliferación de los linfocitos humanos se realizó la PTL por una técnica normalizada en nuestro laboratorio.3 Los linfocitos se obtuvieron a partir de sangre periférica heparinizada (13 Ul/mL) de 7 donantes del Banco de Sangre del Instituto de Hematología e Inmunología (IHI) mediante un gradiente de densidad de Ficoll Hypaque según la técnica de Böyum modificada,6 los linfocitos se ajustaron a 2 x 106 células/mL en RPMI 1640 al 10 % de suero fetal bovino.
El producto presentado en cápsulas se disolvió en 4 mL de RPMI 1640, se incubó a 4 °C durante 1 hora, se centrifugó a 3 000 rev/min durante 10 minutos a 4 °C y se filtró con membranas Millipore de 0,2 µ para garantizar su esterilidad. La PTL se realizó en placas de poliestireno de 96 pozos de fondo en U (NUNC-Dinamarca). Se partió del extracto a una concentración de 0,5 µg/mL y se hicieron diluciones dobles desde 0,25 µg/mL (dilución 1:2) hasta 0,0001 µg/mL (dilución 1:4096). Cada pozo contenía 50 µL de los linfocitos y la incubación de la placa se efectuó en atmósfera húmeda de CO2 al 5 % durante 72 horas. Seis horas antes de finalizado el cultivo, se le adicionó a cada pozo 1 µCi de timidina tritiada (Amersham, actividad específica 25 Ci/mmoL). Las placas de cultivo se procesaron en un cosechador semiautomático (Titertek cell Harvester, Flow Laboratories). Las emisiones radiactivas de la THdr incorporadas al ADN de nueva síntesis en las células transformadas se midieron en un contador de centelleos para partículas ß (Rackbeta 1215 LKB-Wallac). No se obtuvieron diferencias significativas entre los conteos por minuto de los linfocitos cultivados a diferentes diluciones del Mediver en relación con la linfoproliferación espontánea, por lo que se comprobó que el extracto no induce la proliferación de los linfocitos humanos en las condiciones experimentales anteriormente descritas (fig.).
Referencias Bibliográficas
- Valle LO del, Macías C, Rojas A. Reacción medicamentosa mediante la transformación linfoblástica. Rev Cubana Hematol Inmunol Hemoter 1995;11(1):68-70.
- Valle LO del, Aranda RE, Rivero R, Almagro D, Roque MC, Alfonso ME. Determinación de anticuerpos antiplaquetarios mediante estimulación linfocitaria. Rev Cubana Hematol Inmunol Hemoter 1986;2(2):159-64.
- Valle LO del, Macías C, Rivero R, Inclán G, Cruz C. Transformación blástica inducida por el antígeno extraído de la fitolaca americana. Valores de referencia. Rev Cubana Hematol Inmunol Hemoter 1993;9(1):61-4.
- Wagner H. Search for plant derived natural products with immunoestimulatory activity. Recent Advances Pure Appl Chem 1990;62:1217-22.
- Roig y Mesa JT. Diccionario botánico de nombres vulgares cubanos. 3 ed. La Habana: Editora del Consejo Nacional de Universidades. 1965;t 2:792.
- Böyum A. Isolation of mononuclear cells and granulocytes from human blood. Scand J Clin Lab Invest 1968;21:77-89.
Lic. Ileana Esquivel Suárez
Lic. Lázaro O. del Valle Pérez
Dra. Consuelo Macías Abraham
Dra. Jacqueline Rodríguez Amado
Lic. Yulién Alpízar Olivares
Lic. Ileana Esquivel Suárez. Instituto de Hematología e Inmunología. Apartado 8070, CP 10800, Ciudad de La Habana, Cuba.
Teléf. (537)578268. Fax(537)338979.e-mail:ihidir@hemato.sld.cu














