Introducción
La fibrosis pulmonar idiopática (FPI) es la neumonía intersticial más común, sin causa aparente. Esta enfermedad se asocia a un mal pronóstico. Sus exacerbaciones agudas presentan una mortalidad a los 90 días del evento de hasta el 70 % .1 La búsqueda de alternativas terapéuticas que reduzcan su mortalidad o mejoren la calidad de vida de los pacientes es de alta prioridad en la actualidad, siendo la terapia celular con células madre adultas autólogas, entre las que destacan las células madres mesenquimales (CMM) uno de los actores destacados a la luz del avance científico contemporáneo.2,3,4
Existen alentadores hallazgos de estudios preclínicos, en las cuales las CMM pueden mejorar significativamente la fibrosis pulmonar (FP) inducida por bleomicina, lo que sugiere que las CMM pueden servir como un tratamiento potencial para la FP, incluida la FPI y la FP inducida por virus.5,6
Estudios preclínicos sugieren que las CMM tienen propiedades inmunomoduladoras, antiinflamatorias y potencialmente antifibróticas, por lo que podrían ser eficaces en el tratamiento de la FPI. Los primeros ensayos clínicos han demostrado que las CMM pueden administrarse de forma segura a pacientes con FPI.7
A pesar de los indicios del potencial beneficio que podrían tener las terapias con células madres para el tratamiento de la FPI, existen aún preguntas por responder como la seguridad sobre una base longitudinal, óptima duración del tratamiento, vía de administración y dosis,8 sobre todo porque muchos estudios han basado sus resultados en modelos preclínicos y clínicos de formas incipientes de FPI; sin embargo en la práctica médica cotidiana se atiende pacientes con FPI avanzada, cuyas alternativas terapéuticas son escasas, por ello es importante destacar casos tratados con células madre adultas autólogas en este grupo de pacientes.
El objetivo del presente caso fue evaluar el tratamiento con células madre adultas autólogas de médula ósea (MO) de paciente de 68 años con diagnóstico radiológico de fibrosis pulmonar y disnea en reposo.
Presentación de caso
Paciente de 68 años con diagnóstico hace 4 años de fibrosis pulmonar, sin antecedentes de exposición a contaminantes ambientales, enfermedades reumatológicas, tuberculosis u otra enfermedad relacionada con afectación pulmonar; que presentó disnea en reposo, con saturación de 74 %, medida por pulsioximetría. Como único tratamiento, recibió 25 µg de salmeterol más 250 µg de fluticasona de forma irregular.
Hallazgos clínicos
La paciente presentó una ligera palidez y marcada acropaquia; el examen cardiovascular no detectó alteraciones funcionales.
Línea de tiempo
Desde su diagnóstico hace cuatro años, la disnea progresó hasta manifestarse en reposo.
Evaluación diagnóstica
Dos semanas antes de la consulta, se realizó tomografía espiral multicorte, en la que se concluye enfermedad pulmonar intersticial difusa, a considerar fibrosis pulmonar; tractos fibróticos secuelares, asociadas a bronquiectasias de tracción bilateral, adenopatías mediastínicas de hasta 9 mm y aortosclerosis leve.
Al día siguiente de la consulta: tiempo de protrombina, 10,5 s; examen de orina completo, sin alteraciones; hemograma: hemoglobina, 10,7 g/dL, 7.220 leucocitos/µL, 42 % segmentados, 47 % linfocitos; grupo sanguíneo, O positivo; glucosa, 84 mg/dL; creatinina, 0,8 mg/dL; urea, 33 mg/dL; antígeno de superficie de la hepatitis B, negativo; prueba rápida de VIH, negativa; IgM e IgG para SARS COV2, negativo; electrocardiograma, sin alteraciones.
Dos meses después de la consulta y del tratamiento con células autólogas de la médula ósea: Colesterol total, 189 mg/dL; triglicéridos, 94 mg/dL; transaminasa oxaloacética, 52 mg/dL; Proteína total, 10,2 mg/dL; albúmina, 3,1 mg/dL; hemoglobina, 15,4 mg/dL; creatinina, 0,82 mg/dL; urea, 39 mg/dL; tiempo de protrombina, 10,4 s.
Tres meses después del procedimiento: electroforesis de proteínas, que concluyó hiperproteinemia marcada, disproteinemia marcada, hallazgos sugestivos de proceso inflamatorio crónico.
Cuatro meses después del procedimiento: hemoglobina, 14,9 g/dL; inmunofijación de proteínas séricas, sin detección de bandas monoclonales.
Intervención terapéutica
Tras evaluación pertinente, a la semana siguiente de la consulta se programó a la paciente en quirófano. Se le aplicó en cada cresta ilíaca posterosuperior 20 mL de anestésico local, compuesto por xilocaína al 1 % combinada con 0,01 ml de epinefrina al 1/1000 y 1 mL de bicarbonato al 8,4 %. Luego de 5 min de espera, se extrajeron 45 mL de médula ósea de cada cresta, mediante 3 punciones, en diferentes áreas de cada una de ellas, utilizando una aguja espinal número 18 con bisel tipo quincke, en cada punción, y jeringas de 20 mL, conteniendo 0,5 mL de heparina sódica de 5000 UI/mL diluída en 1 mL de cloruro sódico al 0,9 %, obteniendo un total aproximado de 90 mL de médula ósea.
Luego se centrifugó la MO en tubos cónicos de 50 mL, a 2000 rpm, durante 5 min, utilizando una centrífuga de ángulo fijo. Posteriormente, dentro de una cabina de flujo laminar clase II tipo A2, se eliminó la mitad superior (aproximadamente 25 mL) del plasma obtenido. Luego se aspiró el plasma restante, con una pipeta descartable estéril de 3 mL junto con la capa leucocitaria y la mitad superior del paquete globular, obteniendo un volumen final de 50 mL (Fig).
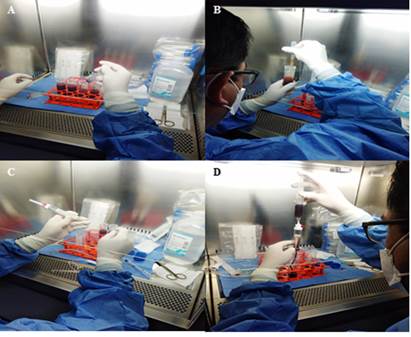
Fig Procesamiento de médula ósea. A.- La médula ósea se vertió en tubos cónicos estériles de 50 mL, con una aguja N° 21 x 1 ½, para retener pequeños coágulos, y se centrifugó a 2000 rpm por 5 min. B.- Se eliminó la mitad superior del plasma obtenido, con una pipeta estéril descartable; se aspiró luego el plasma restante junto con la capa leucocitaria y la mitad superior de la capa de eritrocitos y se depositó en un tubo de 50 mL estéril. C.- Se eliminó el extremo proximal del transfusor para la filtración y se reemplazó con una aguja N°18 x 1 ½, se cortó el extremo distal, dejando unos 5 cm.D.- La médula ósea se filtró por el transfusor, vertiéndola en otro tubo cónico de 50 mL. La médula filtrada se aspirón con jeringuilla de 20 mL y se diluyó en cloruro de sodio al 0,9 % en un volumen final de 100 a 200 mL para aplicarla por vía venosa periférica.
En seguida se calculó el número de células nucleadas totales (CNT)/µL, utilizando una cámara de Neubauer y solución de Türk, mediante una dilución 1/20 de una muestra de médula, se obtuvo 23,750 CNT/ µL, con un total de 1 187 500 000 CNT en los 50 mL de MO finales. Luego se utilizó azul de tripán, mediante una mezcla de 10 µL de médula con 10 µL de dicho reactivo, se estimó una viabilidad del 98 % de las CNT. El volumen final de MO se filtró, mediante un filtro de transfusión, y se diluyó en 100 mL de cloruro de sodio al 0,9 %, y se aplicó al paciente por vía intravenosa, en una vena periférica, por medio de otro equipo de transfusión, en un período de tiempo aproximado de 10 min. No se observaron efectos secundarios importantes después del procedimiento, excepto dolor moderado en los sitios de aspiración, que se controló con la administración de 50 mg de tramadol por vía intravenosa.
Seguimiento y resultados
A los 4 meses del procedimiento, la saturación en reposo fluctuó de 85 a 90 %.
A los 7 meses, de 90 a 93 %. En dicho mes la paciente toleraba caminar 10 pasos sin disnea, actividad que no realizaba antes del tratamiento.
A los 8 meses del procedimiento se aplicó una segunda dosis de células autólogas de MO, obteniéndose 75 mL de cada cresta iliaca posterosuperior (Fig), la cual fue procesada con el mismo protocolo inicial, con un volumen final de 67,5 mL, una concentración de CNT de 21 650/µL y 1, 461, 375 000 CNT en dicho volumen, así mismo una viabilidad de 99.0 %. El producto final se aplicó diluido en 200 mL de cloruro de sodio al 0.9 %, por vía endovenosa periférica en 20 min aproximadamente.
A las tres semanas de este último procedimiento, la paciente presentó saturaciones por oximetría de pulso de 94 a 97 %. Además hubo una reducción marcada de la acropaquia.
Al momento de este reporte, han transcurrido 5 meses del segundo procedimiento y 13 meses del primero permaneciendo estable con saturaciones de 95 a 97 % en reposo.
Discusión
El tratamiento de la fibrosis pulmonar idiopática es complejo, dado que se desconoce su causa, es improbable establecer un tratamiento específico, por lo que su manejo en las últimas décadas ha sido fundamentalmente sintomático; aunque existe alguna evidencia incipiente de su naturaleza autoinmune, sospechada por la presencia de autoanticuerpos, no cumple criterios para considerarla como neumonía intersticial con características autoinmunes.9 Sin embargo, podría explicar el efecto beneficioso de las células madre adultas autólogas de la médula ósea , incluidas las células madre mesenquimales, gracias a su efecto inmunomodulador.3
Por otro lado, es probable que el efecto principal se deba a la inhibición del depósito de colágeno pulmonar, de la expresión del factor de crecimiento transformante β1 (TGF-β1) y de interleucina-6, esta última conocida por su efecto inflamatorio.10,11
Así mismo estudios in vitro han evidenciado la capacidad de las CMM para inhibir la proliferación de fibroblastos y promover la regeneración epitelial.12 Si bien es notoria la capacidad de las CMM de promover la regeneración, también es conocido que el ambiente pernicioso intrapulmonar de los pacientes afectados con FPI induce en ellas la expresión de genes proinflamatorios y ralentiza la proliferación celular de las mismas, así como de los fibroblastos pulmonares aumentando la senescencia celular, lo que explica el incremento de material extracelular en estos pacientes, debido a que adquieren un patrón proinflamatorio secretor.13). Esto explicaría la necesidad de repetir las terapias con células autólogas, debido a que las CMM infundidas en el paciente y que probablemente se alojan en el pulmón podrían verse afectadas por la influencia de las células locales y adquirir finalmente un fenotipo patológico con el transcurrir de los meses.13
Podemos concluir que el tratamiento con células madre adultas autólogas de la médula ósea podría mejorar los signos y síntomas de los pacientes con fibrosis pulmonar idiopática.














