Introducción
El trasplante renal, específicamente el trasplante renal con donante vivo (TRDV)1,2 es el mejor tratamiento para los pacientes en insuficiencia renal terminal, pues tiene mejor tasa de supervivencia, mejor calidad de vida y menos dependencia de los servicios sanitarios de salud que la diálisis.2,3 Este se promueve en todas partes del mundo y Cuba no es la excepción, debido a la insuficiente disponibilidad de riñones de donantes cadavéricos3 y a sus mejores resultados.3,4
Las pruebas de compatibilidad pretrasplante se realizan tanto a candidato a trasplante renal como a su posible donante, la detección del estado serológico frente al Citomegalovirus (CMV) y el virus de Epstein Barr (EBV) (IgG anti-CMV e IgG anti-EBV, respectivamente). La presencia de estos anticuerpos informa que ya ocurrió la infección primaria o primoinfección con estos virus.5,6
Este estudio tuvo valor pronóstico acerca del riesgo de complicaciones postrasplante del posible receptor debido a estos virus: siendo de riesgo bajo, cuando ambos, donante y receptor, son IgG negativos (R-/D-); riesgo intermedio, cuando el receptor es IgG positivo y el donante es IgG negativo o IgG positivo (R+/D+ o -) y riesgo alto, cuando el receptor es IgG negativo y el donante es IgG positivo (R-/D+).5
La importancia de precisar si ya ocurrió la primoinfección con el CMV y el EBV radica en que no solo son responsables de la mayoría de las complicaciones postrasplante de tipo infeccioso que pueden llevar de forma directa o indirecta al rechazo agudo y crónico con pérdida del injerto en el trasplante de órganos sólido5,6,7 y de progenitores hematopoyéticos8 sino que aquellos pacientes con riesgo alto son los que peor llevarán estas complicaciones.5,6 Esto se debe a que son pacientes sin memoria inmunológica expositiva previa, por lo que no tienen una respuesta inmunológica adecuada frente a la replicación viral, ni pueden crearla por la terapia inmunosupresora a la que son sometidos.9 Proveer de esta información al médico de asistencia antes del trasplante permite que se tomen las medidas profilácticas correspondientes de acuerdo con el riesgo del paciente.6
En nuestro país existen estudios previos de seroprevalencia del CMV y el EBV en pacientes en espera de trasplante renal con donante cadavérico (TRDC)5 y de progenitores hematopoyéticos8 y aunque en la investigación del año 2017 se mencionó la seroprevalencia de estos virus en pacientes candidatos a TRDV4 no se abordaron los factores de riesgo asociados a estas infecciones.
El objetivo de esta investigación fue determinar el riesgo de complicaciones postrasplante por CMV y EBV en pacientes cubanos candidatos a TRDV.
Método
Se realizó un estudio observacional, descriptivo, de corte transversal.
A las muestras de 301 candidatos a TRDV y 309 de sus posibles donantes, recibidas de julio del 2013 a julio del 2019 en el Departamento de Histocompatibilidad del Instituto de Hematología e Inmunología, se les determinó anticuerpos IgG anti-CMV e IgG anti-EBV por Ensayo de inmunoabsorción ligado a enzima (ELISA) de tipo heterogéneo, indirecto, no competitivo. Se utilizaron los estuches comerciales: Cytomegalovirus IgG ELISA y Epstein-Barr virus VCA IgG de la compañía IBL International, en un analizador automatizado tipo ChemWell® (Awareness Technology, Inc., EE.UU.). La detección de anticuerpos IgG anti-HLA se realizó primero por ELISA (estuches comerciales: LIFECODES QuikScreen y LIFECODES B-Screen, para la determinación de anticuerpos anti-HLA clase I y II, respectivamente) y luego por tecnología XMAP de Luminex utilizando el estuche comercial LIFECODES LifeScreen Deluxe (Immucor Transplant Diagnostics, Inc., EE.UU.). En todas las técnicas se siguieron las instrucciones del fabricante.
La información sobre las variables de estudio se obtuvo de las planillas de Estudio inicial que se llenan y envían por el médico de asistencia con la solicitud de los estudios de compatibilidad donante-receptor, siguiendo las normas Éticas de la Asociación Médica Mundial.
Se utilizó la comparación de proporciones para los análisis de seroprevalencia y el Chi-cuadrado para detectar dependencia de los anticuerpos anti-EBV y anti-CMV con la edad, sexo, color de la piel, grupo sanguíneo, sensibilización con anticuerpos anti-HLA, hepatitis B (VHB) y C (VHC), tipo de diálisis, trasplantes y transfusiones previas. Se consideró la p < 0,005 como significativa. Se catalogó el riesgo de complicaciones postrasplante según la presencia de IgG anti-CMV y IgG anti-EBV en el candidato a trasplante renal (R) y su posible donante (D): riesgo bajo: (R-/D-), riesgo intermedio: (R+/D+ o -) y riesgo alto: (R-/D+).
Resultados
El 47,8 % de los pacientes candidatos a TRDV tenían entre 20 y 40 años. Existió predominio del color de piel blanca (67,1 %) y del sexo masculino (60,4 %).
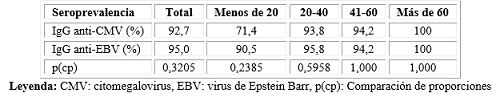
La seroprevalencia del EBV fue mayor que la del CMV, aunque no significativa.
La seroprevalencia del CMV fue menor que la del EBV en los menores de 40 años y se igualaron en los mayores de 41 años, siendo del 100 % en los pacientes con más de 60 años. No existió diferencia significativa entre la seroprevalencia de ambos virus en los grupos etarios (Tabla 1).
Los hombres tuvieron una seroprevalencia del CMV ligeramente mayor que las mujeres (93,4 % vs. 91,6 %), mientras que las mujeres tuvieron una ligera seroprevalencia mayor con respecto al EBV (96,6 % vs. 94 %), pero no significativa (p=0,7163 y p=0,4384).
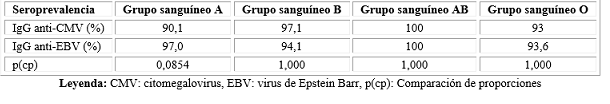
El grupo sanguíneo con mayor seroprevalencia viral fue el AB (100 % para ambos virus).
El grupo sanguíneo B presentó el segundo lugar de seroprevalencia para el CMV, seguido por al O y el A.
Para el EBV la seroprevalencia fue de mayor a menor: grupos sanguíneo A, B y O. La seroprevalencia del EBV fue mayor en el grupo sanguíneo A, mientras que el CMV predominó en el grupo sanguíneo B, pero sin ser significativas (Tabla 2).
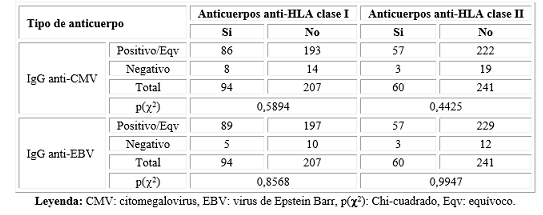
No existió asociación entre la IgG anti-EBV, la IgG anti-CMV y la presencia de anticuerpos anti-HLA de clase I y II (Tabla 3).
No existió asociación entre la presencia de anticuerpos IgG anti-CMV e IgG anti-EBV y el color la piel (p=0,2022 y p=0,1345), el sexo (p=0,5553y p=0,2957), el grupo sanguíneo (p=0,4419 y p=0,5659), el antecedente de transfusiones sanguíneas (p=0,8578 y p=0,5384), los trasplantes previos (p=0,4217 y p=0,1965), el tipo de diálisis (p=0,3756 y p=0,1240), la presencia de hepatitis B (p=0,1712 y p=0,6447) y de hepatitis C (p=0,8407 y p=0,8480).
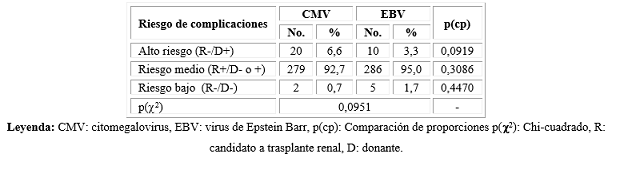
El 92,7 % y el 95 % de los pacientes presentaron riesgo intermedio de presentar complicaciones postrasplante por CMV y EBV. El riesgo fue alto solo en el 7,3 % del total de parejas receptor-donante (6,6 % para CMV y 3,3 % para EBV). La compatibilidad serológica receptor-donante fue similar en ambos virus (Tabla 4).
Discusión
En estudios anteriores realizados por este mismo laboratorio en pacientes del TRDC (año 2016)5 y TRDV (año 2017)4 se reportaron predominio del sexo masculino y grupos etarios similares a la presente investigación.
Los hombres son más afectados que las mujeres por la Enfermedad Renal Crónica (ERC) y por lo tanto se encuentran en mayor riesgo de tener insuficiencia renal terminal tributaria de trasplante.10,11
Un fenómeno reportado a nivel mundial es el traslado de las enfermedades crónicas no transmisibles, como la ERC, a grupos cada vez más jóvenes de pacientes.12 Esto se debe a que los factores de riesgo vascular renal están vinculados a estilos de vida como el hábito fumar, la obesidad y la inactividad física,13 que ganan terreno en este grupo etario.14 Aunado a que los factores de riesgo vascular que dañan el riñón también provocan hipertensión arterial (HTA) y diabetes mellitus, las dos primeras causas de ERC.15
Algunos autores han reportado que los descendientes de afroamericanos, hispanos e indios tienen mayor riesgo de hipertensión arterial y de ERC que los caucásicos.11,16 En nuestro país existe una mezcla racial, en donde los individuos poseen antecesores de diferentes razas, por lo que el color de la piel no es una garantía de diferencias genéticas propias.17 Las personas cubanas de piel blanca pueden tener genes de riesgo de ERC e HTA asociados a otros grupos étnicos.
La seroprevalencia de CMV varía según la región y el país, oscilando entre el 30 al 97%,9,18 mientras que la del EBV se estima sea mayor del 90 % a nivel mundial.19 En Cuba se han reportado seroprevalencias elevadas de ambos virus.4,5,8 En el estudio del año 2016, el CMV tuvo mayor seroprevalencia, aunque no significativa con respecto al EBV.5 En el del 2017, la seroprevalencia del EBV fue mayor que la del CMV.4 Algunos países reportan aumento de la seroprevalencia del EBV,20,21 pero se desconoce si es un fenómeno que también sucede en nuestro medio, pues no se han realizado estudios epidemiológicos grandes de seroprevalencia poblacional en Cuba a lo largo de los años.
La asociación entre estos virus y la edad cambia de una investigación a otra. Hay investigadores que si la han hallado,22 mientras otros no,23 pero todos concuerdan en que la seroprevalencia de la infección con CMV y EBV aumentan con la edad.18,20,22 23 24
La mayoría de los autores describen una seroprevalencia del CMV mayor en mujeres que en hombres y24 otros lo contrario.25 Algunos autores no detectaron diferencias entre sexos con respecto a la seroprevalencia del EBV,26 mientras que Beader y otros hallaron que las mujeres tenían mayor seroprevalencia que los hombres, con una asociación significativa entre sexo y EBV.22
Una de las posibles explicaciones a la mayor seroprevalencia de estos virus en mujeres es que ellas se encuentran en mayor contacto con los niños, que representan una forma de transmisión horizontal para madres, mujeres embarazadas y para aquellas en ocupaciones asociadas con su exposición.25 Otra posible teoría se basa en la transmisión sexual de ambos virus, pues durante la infancia no se reportan diferencias significativas de la seroprevalencia entre niños y niñas. Con estos virus puede ocurrir algo análogo a lo que ocurre con el Virus de Inmunodeficiencia Humano (VIH), en el que la transmisión de hombres a mujeres es más eficiente que de mujeres a hombres, debido a que las mujeres presentan mayor superficie de mucosa expuesta durante el coito.27
Mahmood y otros, describen una seroprevalencia del 100 % de la IgG anti-CMV en el grupo sanguíneo AB, del 95% en los pacientes O positivos y no encontraron asociación entre la seropositividad al CMV y el grupo sanguíneo23 lo que es similar a lo detectado en estudio y por Varga y otros.24
Mahmood y otros reportó una seroprevalencia en el grupo A ligeramente mayor que en el B.23
Al Taie y otros describen al grupo sanguíneo AB como el de mayor seroprevalencia con infección del EBV, seguido del A, O y el B.28
Varga M y otros tampoco hallaron diferencias significativas entre las seroprevalencia del CMV y el EBV en los distintos grupos sanguíneos.24
Muchos reportes se han suscitado en las últimas dos décadas acerca de los antígenos de los grupos sanguíneos como receptores de virus, bacterias y parásitos.28 Se conoce que los antígenos específicos del grupo sanguíneo A se encuentran en patógenos y son neutralizados por los anticuerpos naturales de los grupos sanguíneos O y B. Los individuos del grupo sanguíneo AB son más susceptibles a las enfermedades infecciosas, eso se debe a que no tienen anticuerpos naturales (entre ellos anti-A) en su suero.28 Esto podría ser una posible explicación a la alta seroprevalencia de ambos virus encontrada, por varios autores, en este grupo sanguíneo.
En los estudios del 2016 y 20174,5 se detectó asociación entre anticuerpos anti-HLA y la IgG anti-CMV, no así con la IgG anti-EBV.
Los anticuerpos anti-HLA se encuentran relacionados con el rechazo a trasplante7 y la supervivencia a largo plazo de los pacientes con trasplante renal.29 La producción de estos anticuerpos se debe principalmente a eventos sensibilizantes como: transfusiones sanguíneas, embarazos y trasplantes previos, pero la evidencia sustenta que su aparición puede estar también asociada a infecciones o vacunación.30
Los llamados efectos indirectos del CMV: su asociación con el rechazo inmunológico, arterioesclerosis e infección secundaria con bacterias y hongos durante el trasplante de órganos sólidos y de células progenitoras hematopoyéticas se conoce con certeza18 y se sospecha que su proliferación es un factor de riesgo para la aparición de anticuerpos anti-HLA.29,31
Parajuli y otros concluyeron que pacientes con anticuerpos anti-HLA contra panel (PRA)>80 % o pacientes con altos niveles de anticuerpos anti-HLA, pudieran estar protegidos ante el riesgo de enfermedad por CMV postrasplante, debido a que se les pone especial cuidado en las terapias inmunosupresoras y protocolos antivirales, o porque pueden tener una respuesta inmunológica más potente,7 pero otro estudio demostró que el aumento o disminución de los anticuerpos anti-HLA específicos de donante (DSA) no provocó aumento del título de los anticuerpos anti-CMV.30 Esto se debe a que durante el alo-reconocimiento de las moléculas HLA no hay activación de patrones moleculares asociados a patógenos (PAMP).30
Ettenger y otros no encontraron asociación entre la serología pretrasplante (del CMV y EBV) y la formación de anticuerpos anti-HLA de nueva síntesis o síntesis “de novo” en un seguimiento postrasplante durante el primer año,32 pero D'Orsogna y otros hacen referencia a otro estudio en el que aumentó el título y la fuerza de los anticuerpos anti-HLA tras una infección viral. El aumento del título fue dentro del mismo grupo de reacción cruzada (CREG), lo que implica un aumento de las especificidades existentes y no la formación de anticuerpos de síntesis “de novo”.30,31 La relación entre infección y aumento de los anticuerpos anti-HLA se piensa sea secundaria a la presencia de una respuesta robusta de linfocitos B de memoria debido a la liberación de citocinas proinflamatorias.31
La transmisión del EBV y CMV puede ser por transfusiones sanguíneas y el trasplante de órganos.26,33 En el estudio del 2016, detectó asociación entre la IgG anti-CMV y el sexo, las transfusiones sanguíneas y la hepatitis C (VHC),5 pero no en este, lo que puede deberse al mayor tamaño muestral y predominio de pacientes del TRDC del primero. En ese estudio tampoco se detectó asociación entre la presencia de la IgG anti-CMV e IgG anti-EBV con los trasplantes previos o la positividad a hepatitis B (VHB).5
Está bien documentado que los pacientes en hemodiálisis tienen respuestas inmunes dañadas, lo que se traducen en altas tasas de prevalencia de infecciones virales, incluida la del CMV33 y la EBV.26
Vilibic-Cavlek T y otros reportan la hemodiálisis como un predictor significativo de la seropositividad al CMV y que su alta prevalencia, en los pacientes sometidos a hemodiálisis, puede deberse a las transfusiones sanguíneas frecuentes o a la exposición al CMV durante el proceso hemodialítico.33 El EBV tiende a causar más problemas en pacientes inmunodeprimidos por enfermedades, como los pacientes en hemodiálisis y trasplantados.26
El efecto inmunomodulador del virus de la hepatitis C provoca aumento de la coinfección con el CMV34 y la coinfección del CMV como factor de riesgo para la recurrencia del VHB se ha descrito en pacientes trasplantados con órganos sólidos,35 pero no en el trasplante de progenitores hematopoyéticos.36
La coinfección de EBV y VHC provoca mayor replicación de este último, que cuando la VHC no concomita con el EBV. Esto se debe a que la proteína EBNA1 (EBV-encoded nuclear antigen 1) del EBV aumenta la replicación viral del VHC.37 La asociación de la hepatitis B y EBV no se encuentra muy estudiada, aunque se plantea que este último provoca hepatitis aguda severa con tendencia a la cronicidad de la Hepatitis B.38
Varios factores de riesgo han sido reportados asociados a la infección con CMV en pacientes renales trasplantados, entre ellos: factores ambientales, geográficos, económicos, condiciones del hospedero como: la edad, comorbilidades, enfermedades subyacentes, leucopenia, linfopenia, tiempo de isquemia fría, factores genéticos y el estatus inmunológico. Sin embargo, el factor de riesgo determinante es la incompatibilidad serológica entre donante y receptor, siendo el primero positivo y el segundo negativo.9,39,40
En cuanto a los factores de riesgo para la infección con EBV se citan la edad, ser del sexo femenino, pertenecer a un grupo étnico no caucásico y vivir en hogares con privaciones socioeconómicas.20 Mientras que la incompatibilidad de genes HLA, la enfermedad de injerto contra hospedero, el uso de globulina anti-timocítica y la reactivación del CMV han sido descritos como factores responsables de la infección postrasplante con EBV.41
Algunos autores no reportan a la incompatibilidad serológica entre receptor y donante como un factor de riesgo significativo para la aparición de EBV postrasplante,41 mientras que otros autores si la describen como factor de riesgo de importancia para la aparición de desórdenes linfoproliferativos postrasplante, que van desde la mononucleosis infecciosa hasta procesos monoclonales malignos.39
La mayoría de los pacientes presentaron riesgo intermedio por incompatibilidad serológica donante-receptor y solo un porcentaje pequeño fue de riesgo alto de complicaciones postrasplante con estos virus. Esto se debe a la elevada seroprevalencia de ambos virus en esta de población.