Introducción
La leucemia promielocítica (LPM) representa el 10-15 % de los casos de leucemia mieloide aguda, y se considera una enfermedad bien definida por sus peculiares características clínicas, morfológicas, citogenéticas y moleculares.1,2,3
El descubrimiento de los mecanismos oncogénicos implicados en la génesis de la enfermedad que se origina en el 95-98 % de los casos, por la fusión de los genes PML (leucemia promielocítica, siglas en inglés) y RARα (receptor alfa del ácido retinoico, siglas en inglés) a partir de la translocación recíproca y balanceada de los cromosomas 15 y 17, hacen de este subtipo de leucemia uno de los modelos más relevantes de investigación traslacional con impacto tanto en las técnicas de diagnóstico biológico como en el desarrollo de terapias dirigidas a dianas moleculares.4,5,6,7
La reacción en cadena de la polimerasa por transcriptasa reversa (RT-PCR) constituye el método de elección para realizar el diagnóstico definitivo de LPM tras detectar la fusión PML/RARα y permite determinar el tipo de transcrito molecular, de vital importancia en el monitoreo de la respuesta al tratamiento, así como en el seguimiento a largo plazo de cada paciente. Actualmente, en la supervisión de la enfermedad mínima residual (EMR) se utiliza la PCR en tiempo real (RQ-PCR) cuya principal ventaja frente a la RT-PCR es la cuantificación de los transcritos que permite una detección precoz de la recaída molecular.8,9,10
La introducción en Cuba a finales del siglo pasado de la determinación del gen PML/RARα por RT-PCR en el Instituto de Hematología e Inmunología (IHI) constituyó un avance fundamental en el manejo de la LPM, con implicaciones relevantes tanto en el tratamiento de la enfermedad como en su seguimiento a partir del estudio de los transcritos de fusión. Esta estrategia integral de manejo contribuye a alcanzar altos porcentajes de curación de los pacientes, así como a un incremento en la calidad de la atención y al desarrollo de la ciencia en el país.11
Estudios moleculares han demostrado que existen 3 puntos de ruptura dentro del gen PML. En dependencia de la ubicación del punto de ruptura en el gen PML, se pueden formar tres tipos de transcritos del PML/RARα: el bcr (punto de ruptura, siglas en inglés) 1 (situado en el intrón 6) cuya frecuencia es de aproximadamente 60 %, el bcr 3 (situado en el intrón 3) cuya frecuencia aproximada es de 33 % y el bcr 2 (situado en posiciones variables del exón 6) que constituye el resto de los casos. El punto de ruptura en el RARα es siempre el mismo (en el intrón 2).1,12,13
A pesar de que varios autores coinciden en la caracterización general de los transcritos y de su relación con algunas variables al diagnóstico de la enfermedad, se desconoce si el comportamiento de estas isoformas y su expresión clínica-hematológica es similar en los pacientes con LPM en el IHI. Por tanto, el objetivo del estudio fue caracterizar los transcritos de fusión del gen PML/RARα en pacientes con LPM.
Métodos
Se realizó una investigación observacional, ambispectiva, descriptiva, longitudinal, en pacientes con diagnóstico de LPM en el Instituto de Hematología e Inmunología (IHI), entre enero de 2001 y diciembre de 2020. El universo estuvo constituido por 105 pacientes con diagnóstico clínico morfológico de LPM y estudio molecular positivo del biomarcador PML/RARα por RT-PCR. Se excluyeron los pacientes de los que no fue posible completar la información necesaria para formar parte de la investigación.
Procedimientos
La tipificación de la LPM al inicio de la enfermedad se realizó mediante la clasificación morfológica del grupo FAB. A los pacientes se les aplicó el protocolo de diagnóstico y tratamiento para LPM del IHI, que incluye interrogatorio, examen físico y estudios complementarios de laboratorio y la estrategia terapéutica, que varió de acuerdo a dos protocolos de tratamiento, uno basado en ATRA y otro basado en TOA.
El estudio del reordenamiento del gen PML/RARα y la identificación de sus transcritos de fusión, se realizó a partir del procesamiento técnico realizado en el laboratorio de Biología Molecular del IHI, a partir de la RT-PCR.8,9,11,12
Recolección de los datos
Los datos se obtuvieron de las historias clínicas de cada paciente, del libro registro del laboratorio de Citogenética y Biología Molecular del IHI y del registro de cáncer del centro.
La información se organizó y almacenó en una base de datos compatible con el empleo del programa estadístico SPSS versión 25.0 para Windows.
Se seleccionaron como variables: edad, edad estratificada, sexo, color de la piel, coagulación intravascular diseminada (CID), síndrome de diferenciación celular (SDC), muerte precoz, tiempo de seguimiento, recaída hematológica, protocolo de tratamiento, riesgo de recaída, transcrito de fusión del gen PML-RARα, variante morfológica, recuento de plaquetas, recuento de leucocitos estratificado, recuento de leucocitos, hemoglobina estratificada, hemoglobina y estado actual.
Procesamiento y análisis de la información
El análisis estadístico comenzó por la caracterización de la población de estudio, lo que implicó la descripción de todas las variables y la obtención de las frecuencias absolutas y relativas (porcentajes) de las distintas categorías.
Para el análisis estadístico de las variables cualitativas se empleó la prueba de (2 de Pearson. Si la frecuencia esperada fue menor de 5 se utilizó la prueba exacta de Fisher. Para las variables cuantitativas se empleó la prueba paramétrica t de Student después de haber verificado que cumplieran la hipótesis de normalidad, o en caso contrario la prueba no paramétrica U de Mann Whitney.
La probabilidad de supervivencia fue estimada por el método de Kaplan-Meier y las diferencias en la distribución de las curvas de sobrevida se evaluaron mediante la prueba de log-rank. Se consideró como supervivencia global (SVG) el tiempo transcurrido desde la fecha del diagnóstico hasta la muerte del paciente o fecha de última consulta. Para validar los resultados en términos de significación se consideró significativo todo valor de p < 0,05 para el estadígrafo asociado a la prueba.
Aspectos éticos
Para realizar esta investigación se contó con la aprobación del Consejo Científico del IHI. Se tomaron en cuenta los principios referentes al código de ética de acuerdo con la declaración de Helsinki.14 Se garantizó la seguridad y confidencialidad de la información y se aclaró que los datos derivados de la investigación podrían ser utilizados con fines científicos e incluirse en publicaciones.
Resultados
Del total de pacientes estudiados, 75,2 % fue positivo al transcrito de fusión bcr1/2, con una frecuencia absoluta de 79 pacientes (75,2 %). La minoría estuvo representada por el transcrito bcr3 (24,8 %).
La edad estuvo comprendida entre 2 y 84 años con una mediana de 25 años.
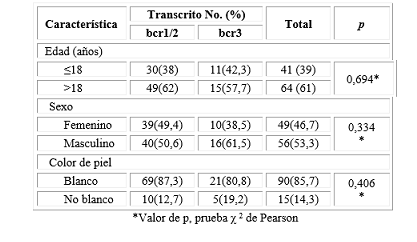
La edad media de los pacientes con transcrito bcr1/2 y bcr3 fue de 28,89± 18,19 años y 27,48±15,83 años, respectivamente; con un predominio de los pacientes mayores de 18 años, sin diferencias significativas (Tabla 1). Se encontró el transcrito bcr3 en la edad extrema de 2 años con un rango de 62 años. Predominó el sexo masculino en ambos grupos y el color de piel blanca, sin comportamiento significativo.
Tabla 1 Características generales de pacientes con leucemia promielocítica en relación a los transcritos de fusión del gen PML/RARα
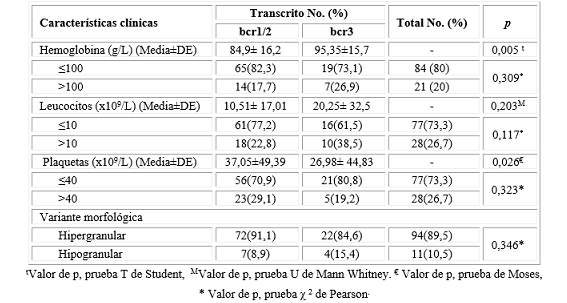
Al analizar las características clínicas de los pacientes, no se encontró asociación estadística entre el tipo de transcrito de fusión y la presencia de CID, SDC, muerte precoz o estado actual. Sin embargo, se evidenció una mayor frecuencia de CID en los pacientes con transcrito bcr3, para un 65,4 % (Tabla 2).
Tabla 2 Relación de las características clínicas de pacientes con leucemia promielocítica y los transcritos de fusión del gen PML/RARα

Los pacientes con LPM positivos al transcrito bcr1/2 tuvieron menores cifras de hemoglobina y leucocitos, mayores cifras de plaquatas y predominio de la variante morfológica hipergranular al compararlo con el transcrito bcr3. Por otra parte, aquellos positivos al transcrito bcr3, se caracterizaron por una mayor frecuencia de la variante microgranular y la presencia de leucocitosis. La relación en cuanto a las cifras medias de hemoglobina y plaquetas y los transcritos fueron estadísticamente significativas (Tabla 3).
Tabla 3 Relación de las características hematológicas y los transcritos de fusión del gen PML/RARα en pacientes con leucemia promielocítica
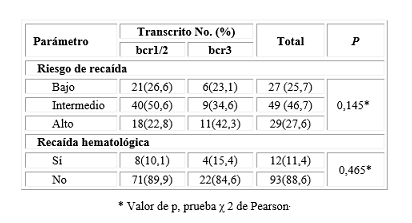
La mayor cantidad de pacientes se concentró en los grupos pronósticos de riesgo bajo e intermedio de recaída en el transcrito bcr1/2 y el grupo de alto riesgo predominó en los pacientes positivos al transcrito bcr3 para un 42,3 % así como la presencia de recaída en este último grupo. No se evidenció relación estadísticamente significativa al analizar las variables anteriores. (Tabla 4)
Tabla 4 Distribución de pacientes con leucemia promielocítica según riesgo, incidencia de recaída y transcritos de fusión del gen PML/RARα
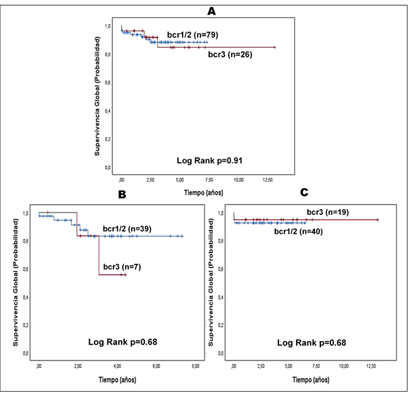
La probabilidad de SVG de la serie fue superior al 80 % en ambos grupos de pacientes, al tener en cuenta el tipo de transcrito de fusión (Fig. A ). Además, al estratificar la muestra de acuerdo al protocolo de tratamiento indicado, se evidenció que no existen diferencias estadísticamente significativas en la supervivencia entre ambos grupos (Fig. B y C ).; esto se comprobó al aplicar la prueba de log rank.
Discusión
En la leucemia promielocítica se reconocen fundamentalmente tres tipos de transcritos originados como consecuencia de puntos de ruptura reconocidos en el gen PML. Estos transcritos codifican a isoformas de la proteína PML/RARα que le confieren actividad oncogénica a la célula progenitora que adquiere carácter leucémico.12
La distribución de los diferentes transcritos se reportó indistintamente en diferentes estudios de varias latitudes en Europa,15,16,17,18 y EE.UU.19,20 de cuyos reportes derivaron estudios correlacionales y de pronóstico que aún en la actualidad se reproducen. Los resultados de estos estudios, reflejaron sobre todo en los inicios, el comportamiento de centros únicos con poblaciones de origen europeo y no contemplaban las diferencias en cuanto a distribución geográfica y poblaciones con poco acceso a servicios de salud.
Posteriormente, se reportaron estudios en pacientes latinos que demostraron diferencias importantes en cuanto a las frecuencias de los transcritos entre estas poblaciones. El alto porcentaje encontrado en la distribución de la isoforma larga (bcr1) en la presente serie, difiere sobre todo de los reportes europeos y asiáticos21,22,23) y se corrobora su semejanza en distintas series con poblaciones de origen latino (México, América Central y Perú) en las que se reporta alta incidencia de este transcrito, lo cual pudiera indicar que existen influencias genéticas o medioambientales que determinan el punto de corte en el gen PML y los subtipos moleculares de LPM. Sin embargo, aún se desconoce cuál es el factor que determina el sitio de ruptura.24,25
Múltiples reportes referentes a las características generales y epidemiológicas de la LPM se encuentran disponibles en publicaciones internacionales.26,27,28,29,30 En la presente serie, no se demostró asociación con ninguna de estas características, aunque se evidenció un claro predominio masculino y una mediana de edad al diagnóstico inferior a otros reportes. Otros investigadores como reportaron resultados similares al análisis de esta investigación.19,31,32
La relación de los transcritos de fusión con la CID y otras características clínicas se ha intentado demostrar por varios autores, bajo la suposición de que la secuencia aminoacídica que diferencia a uno de otro pudiera cambiar las interacciones oligoméricas que se establecen con otras proteínas celulares y por tanto predisponer a manifestaciones resultantes dependientes de este hecho.25,26)
Diferentes investigadores demostraron una alta distribución de la CID en pacientes con transcrito bcr3;19 sin embargo, al aplicar herramientas estadísticas no se evidenciaron valores que se consideraran significativos. Estos resultados coinciden con los hallazgos de la presente serie y con otros autores.25,33) Sin embargo, ninguno de los reportes consultados encontró diferencias estadísticamente significativas al comparar los grupos de transcritos, y la presencia de SDC y muerte precoz, lo cual indica, que similar a los resultados obtenidos por la investigación en cuestión, estos no tienen relación con las características clínicas al diagnóstico de la enfermedad, lo que motiva al estudio de otras variables biológicas, que pudieran explicar las diferencias existentes entre subgrupos específicos de pacientes, que los hagan susceptibles a la presencia de estas complicaciones. Las mutaciones genómicas adicionales, el fenotipo inmunológico de membrana y el nivel cuantificado de los transcritos serían factores a considerar y a integrar en su conjunto, sobre todo con análisis multivariado para intentar demostrar el significado de estas variables y su relación con la presentación clínica y el pronóstico de la enfermedad.32
Varios autores reportan que no existen diferencias significativas con respecto a la clasificación morfológica, recuento de leucocitos y de plaquetas así como niveles de hemoglobina.34) En la presente serie, los pacientes con bcr3 presentaron mayor cifra media de hemoglobina y menores cifras de plaquetas que el grupo bcr1/2 con significación estadística. En el resto de los parámetros hematológicos, a pesar de observar en ellos distribuciones de frecuencias interesantes, no se demostró que tuvieran impacto al evaluarlas por los métodos estadísticos correspondientes.
El tratamiento de la LPM constituye una representación de terapia dirigida a dianas moleculares y refleja el poder de la investigación traslacional. La introducción del ATRA, así como del TOA fue crucial para alcanzar las tasas actuales de curación.2,3,4 La mayoría de los reportes consultados no consideran el estudio de la posible implicación de los transcritos de fusión en la incidencia de recaída teniendo en cuenta además el protocolo de tratamiento, aunque los que han evaluado esta posibilidad no demostraron resultados significativos.
En la presente serie, a pesar de tener una mayor distribución de los pacientes con transcrito bcr3 en el subgrupo que recibió el protocolo TOA y el bcr1 en el que recibió ATRA, al analizar la incidencia de recaída en uno u otro grupo no se encontró significación estadística que indicara relación entre uno u otro transcrito y la presencia de este evento. Sin embargo, es válido señalar, que la mayor parte de los estudios que consideran la incorporación de los transcritos como variable independiente, tienen varias limitaciones, como el análisis univariado o bivariado de las variables, la incorporación de poblaciones demasiado homogéneas que no reflejan la heterogeneidad clínico-biológica de la enfermedad y la no comparación en dichos reportes de ambos protocolos de tratamiento.
Al evaluar la influencia de los transcritos de fusión en la SVG, individualmente y estratificada según el protocolo de tratamiento administrado, no se encontró relación significativa desde el punto de vista estadístico en cuanto a su impacto en la supervivencia.
Gallagher y otros, analizaron una serie de 221 pacientes que recibieron ATRA, en la que se tuvieron en cuenta los transcritos de fusión y la supervivencia en los pacientes, sin demostrar diferencias estadísticas entre los diferentes grupos.19
Por otra parte, Soignet, Fukutani, Rasekh y González, tampoco reportaron significación estadística al realizar análisis de regresión o multivariado en diferentes series que evaluaron la relación del protocolo terapéutico, los transcritos y la supervivencia y tuvieron en cuenta diferentes agentes diferenciadores,18,20,22) Esto coincide con los resultados alcanzados en la presente investigación.
Muchos estudios no incorporan TOA en sus protocolos de tratamiento debido al alto costo del mismo en los países involucrados. Los estudios iniciales que utilizaban ATRA como terapéutica estándar se basaron en la actividad específica de este para inducir la diferenciación celular a partir de la unión a ligandos específicos del dominio RARα de la proteína quimérica. Sin embargo, el mayor conocimiento de la biología molecular de la enfermedad indicó que la porción PML de dicha proteína mostraba un importante efecto mediador de la respuesta celular al ATRA. Las variaciones en este componente, resultantes de los transcritos de fusión del oncogen, han demostrado tener modestas diferencias en sus actividades moleculares, sin embargo, ensayos biológicos que analicen de forma directa e independiente la porción PML de la molécula no han sido publicadas en abundancia, por lo que se pueden subestimar las diferencias biológicas relacionadas con el tipo de PML/RARα.3,4,5.6,7,19,28
En conclusión, las características de los transcritos de fusión del gen PML/RARα son similares a los reportes internacionales, sobre todo de poblaciones de origen latino. No existe relación entre los transcritos y la edad, sexo, color de piel y las características clínicas. La presencia del transcrito de fusión bcr3 se asoció a mayores cifras de hemoglobina y menor valor de plaquetas. La incidencia de recaída no se relacionó con los transcritos de fusión y no se comprobó que existiera influencia de éstos, sobre la supervivencia global en pacientes con LPM.