Introducción
El mieloma múltiple (MM) es una enfermedad neoplásica caracterizada por la proliferación de células plasmáticas aberrantes mayor o igual al 10 %, la detección de una inmunoglobulina monoclonal en suero u orina y la presencia de anemia, lesiones óseas, hipercalcemia o insuficiencia renal (CRAB, siglas en inglés). 1)
Se define como mortalidad precoz (MP) en el MM, al porcentaje de muertes que ocurren dentro de los primeros seis meses antes del diagnóstico y se estima entre el 10 y el 14 %. La MP se atribuye a efectos combinados de la enfermedad activa y los factores de comorbilidad.
Los factores pronósticos en el MM se agrupan en cuatro categorías, los dependientes de la biología del tumor, del estadío, de la respuesta al tratamiento y los relacionados con las características individuales de los pacientes. Los factores pronósticos en el MM se suelen medir en términos de supervivencia libre de progresión (SLP), supervivencia global (SG), calidad de vida relacionada con salud y MP.2
A nivel mundial, el Grupo de Trabajo Internacional de Mieloma Múltiple (IMWG, por sus siglas en inglés) publicó en el 2005, la primera clasificación pronóstica del MM que incluyó dos marcadores biológicos, entre ellos la β-2 microglobulina y la albúmina por sistema de estadificación internacional (ISS, por sus siglas en inglés).3
En el año 2015, se realizó una revisión de la clasificación (R-ISS, por sus siglas en inglés) y se decidió incluir la dosificación de la enzima lactato deshidrogenasa (LDH).4 Los estudios citogenéticos no convencionales por hibridación fluorescente in situ (FISH, por sus siglas en inglés) y los estudios de reordenamientos.5
Los biomarcadores que más se utilizan para la estratificación de riesgo son la LDH, la beta-2 microglobulina, la albúmina, las anormalidades cromosómicas por citogenética no convencional (FISH) y las lesiones osteolíticas, estas últimas confirmadas por radiología convencional, resonancia magnética nuclear y la tomografía de emisión de positrones / tomografía computarizada (PET-CT). 6) Los exámenes, biomarcadores y criterios que actualmente son utilizados para el diagnóstico y pronóstico del MM se muestran en la Fig. 1.

Fig. 1 Exámenes, biomarcadores y criterios para el diagnóstico y pronóstico en el mieloma múltiple (MM). FISH: Hibridación fluorescente in situ. EFP: Electroforesis de proteínas. IF: Inmunofijación. B2MG: β 2 microglobulina. TAC: Tomografía axial computarizada. PET-CT: Tomografía de emisión de positrones-Tomografía computarizada. FDG: Fluordexoxiglucosa. RMN: Resonancia magnética nuclear.
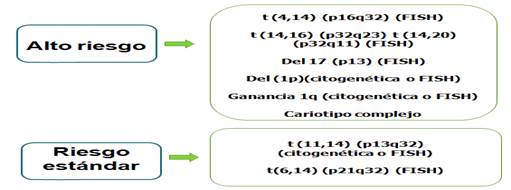
El estudio de las alteraciones genéticas ha provisto las bases para la identificación de genes involucrados en la iniciación y progresión del MM y ha permitido establecer grupos de riesgo citogenético2 (Fig. 2).
 Fuente: Rajkumar SV. Multiple myeloma: 2020 update on diagnosis, risk‐stratification and management. Am J Hematol. 2020;95(5):548-672
https://doi.org/10.1002/ajh.25791
Fuente: Rajkumar SV. Multiple myeloma: 2020 update on diagnosis, risk‐stratification and management. Am J Hematol. 2020;95(5):548-672
https://doi.org/10.1002/ajh.25791
Fig. 2 Grupos de riesgo citogenético en el mieloma múltiple (MM). FISH: Hibridación inmuno-fluorescente in situ.
En la actualidad los estudios de caracterización inmunológica y de secuenciación masiva han permitido profundizar en el conocimiento sobre la patogénesis del MM y su relación con el diagnóstico, pronóstico y la supervivencia. Existe una asociación entre los componentes del síndrome metabólico (obesidad central, diabetes mellitus tipo II, dislipidemia e hipertensión arterial) y el desarrollo del cáncer, entre ellos el MM.7
Las células tumorales se caracterizan por una desregulación del metabolismo energético, conocido como el efecto Warburg, el cual consiste en la conversión de la glucosa a ácido láctico en presencia de oxígeno. 8) Estas alteraciones le confieren a las células tumorales una mayor proliferación y supervivencia. Otro de los tejidos involucrados en la patogénesis del MM es el tejido adiposo que produce hormonas llamadas adipoquinas (leptina, resistina, visfatina, IL6, factor de necrosis tumoral alfa y el factor de crecimiento similar a la insulina 1, entre otras).
Se ha demostrado que estas adipoquinas favorecen la evolución de una gammapatía monoclonal de significado incierto (GMSI) hacia un MM, además contribuyen al desarrollo de la enfermedad ósea e influye negativamente en el pronóstico y en la supervivencia en el MM. 9,10)
La presencia de comorbilidades en los pacientes con MM de nuevo diagnóstico está muy asociada a una alta mortalidad. Para muchos de los pacientes estas comorbilidades son una causa directa de muerte, pero también constituyen factores de riesgo de MP relacionada con la enfermedad por comprometer la capacidad de brindarles un tratamiento efectivo.11
El objetivo del artículo es describir los principales predictores relacionados con mortalidad precoz y su función en la patogénesis de la enfermedad.
Métodos
Se realizó una búsqueda de información en las bases de datos PubMed, Wiley, Google Scholar y DirectScience.
Los criterios de búsqueda incluyeron artículos publicados sobre patogénesis y alteraciones metabólicas en el MM, principalmente en los últimos cinco años. Se incluyeron artículos científicos clásicos y recientes sobre predictores inmunológicos, citogenéticos y metabólicos del MM.
Las palabras claves empleadas fueron: mieloma múltiple, mortalidad precoz, nuevo diagnóstico y biomarcadores. El número de artículos seleccionados fue 80 de los que se utilizaron 52.
Análisis y síntesis de la información
La citogenética en la patogénesis del mieloma múltiple
El mieloma múltiple representa la evolución final de las neoplasias derivadas de las células B y es el resultado de eventos genéticos y epigenéticos. Los primeros se producen en el centro germinal del nódulo linfático durante los procesos de hipermutación genómica y cambio de isotipo de las células del MM. Posteriormente el microambiente de la médula ósea induce inestabilidad genómica (translocaciones en IgH, hiperdiploidía, deleciones), que favorece la transformación desde una discrasia premaligna (gammapatía monoclonal de origen indeterminado / mieloma asintomático) hacia un MM sintomático.12
Un aspecto característico de esta enfermedad es la variabilidad en la evolución clínica de los pacientes, con casos que presentan larga sobrevida con poco requerimiento terapéutico y otros que muestran rápida progresión con un incremento en la MP.
Los estudios citogenéticos en el MM constituyen herramientas de gran utilidad en la comprensión de dicha heterogeneidad así como en la identificación de marcadores que permitan definir en forma más precisa el curso clínico de la enfermedad y su respuesta al tratamiento, siendo primordiales al momento del diagnóstico.13
Se han podido identificar alteraciones citogenéticas en el número o en la estructura de los cromosomas entre el 20 y 60 % de los casos. Las alteraciones citogenéticas primarias se relacionan directamente con la patogénesis de la enfermedad y las secundarias con el pronóstico.14
Las citoquinas en el desarrollo del mieloma múltiple
Los plasmocitos malignos presentan un bajo índice mitótico y se diferencian completamente, pero para su supervivencia, su proliferación y su diferenciación dependen de citoquinas, entre ellas los factores de crecimiento y las interleuquinas.15
Las interleuquinas se consideran biomarcadores predictivos de la respuesta al tratamiento y factores pronóstico en términos de supervivencia libre de eventos. 16,17) Dentro de ellas la Interleuquina 6 (IL6) es crucial en la inducción de la expresión de proteínas de la familia BCL-2.18
Se ha aprobado que los niveles elevados de los factores de crecimiento dan lugar al uso de las drogas antiangiogénicas en la curación del MM y son buenos candidatos como factores pronósticos de la enfermedad. 19)
Se ha demostrado que disminuciones de los niveles de los factores de crecimiento vascular endotelial (VEGF) y de fibroblatos-2 (FGF-2) en pacientes con MM, han sido asociados a una inhibición de la progresión en el MM.20
Otro de los factores estudiados son el factor de crecimiento de hepatocitos (HGF) y derivados de la plaquetas (PDGF-b), los cuáles se consideran que sus niveles elevados son un factor de mal pronóstico en el MM, con un impacto en la mortalidad precoz y en la respuesta al tratamiento.21,22
Influencia del metabolismo en el desarrollo del mieloma múltiple
Como la mayoría de las células tumorales experimentan una glicólisis aerobia aumentada en presencia de oxígeno, también conocido como el efecto Warburg, 8) El paso final de esta consiste en la conversión de fosfoenolpiruvato en piruvato y ATP, donde el fosfoenolpiruvato en piruvato es catalizado por la piruvato quinasa en el citosol de la célula. El oncogen c-MYC también induce una expresión elevada de PKM2,la misma juega un rol importante en la progresión tumoral y en la supresión apoptótica.23
El tejido adiposo produce adipoquinas involucradas en el control de la inflamación y la homeostasis energética; regulan la angiogénesis, la oxidación y señalización celular favoreciendo la supervivencia de las células mielomatosas y la evolución de una GMSI hacia un MM,24,25 además contribuye al desarrollo de la enfermedad ósea e influye negativamente en el pronóstico y en la supervivencia en el MM.9
La hiperlipidemia es otro de los componentes del SM y ha sido reportado su asociación en pacientes con GMSI y MM, específicamente el suptipo IgA.
Las paraproteínas producidas por las células plasmáticas malignas se unen a las lipoproteínas séricas, a los receptores tisulares y a la lipasa de lipoproteína, con la consecuente reducción del aclaramiento de estas e inducción de la hiperlipidemia. 26)
Se ha reportado que las células del MM dependen del colesterol exógeno para la supervivencia y que el colesterol unido a la LDL tienen un efecto antiapoptótico relevante.27
Factores pronósticos de mortalidad precoz
En el año 1975 se desarrolló un primer sistema de estadiamiento con la utilización de simples parámetros clínicos, donde se demostró su correlación con la masa mielomatosa. 28)
El sistema de estadiamiento internacional desarrollado en el 2005 por el Grupo Internacional de Trabajo de MM (IMWG, por sus siglas en inglés) es un algoritmo para la estratificación de riesgo basado en los niveles de β2 microglobulina (β2MG) y albúmina. Los altos niveles de β2MG reflejan una alta masa tumoral mielomatosa, además de una disminución de la función renal.29
En estudio realizado por Cuervo-García y otros, se identificó factores pronósticos relevantes en pacientes con MM y su influencia en la mortalidad. Entre ellos: factores asociados al huésped, factores asociados al microambiente tumoral, factores asociados a variables clínicas (función renal, enfermedad focal o difusa de la médula, los niveles de albúmina, de β2MG y LDH) y los factores relacionados con las características del tumor (inmunofenotipo y las alteraciones citogenéticas).30
Factores asociados al huésped
Se encuentran: edad, sexo y color de la piel.
El aumento de la edad confiere a los pacientes un alto riesgo de adquirir enfermedades malignas y a un aumento en la incidencia de comorbilidades, además de una menor tolerancia de respuesta al tratamiento. 31,32) El MM es la neoplasia hematológica más común entre personas de raza negra. En estudio realizado por Waxman y otros, en el período comprendido entre 1973 y 2005, se estudiaron 5 798 pacientes de raza negra y 28 939 pacientes de raza blanca, en la prevalencia del MM los pacientes de raza negra fueron el doble de los de raza blanca, con incidencia superior en 50 % en el sexo masculino.33
Factores asociados al microambiente tumoral
El microambiente de la médula ósea incluye una mezcla de factores de crecimiento, el factor de crecimiento similar a la insulina 1 (IGF-1) y la IL-6, que se han identificado como los factores de crecimiento más potentes para MM. La unión del ligando al receptor del IGF-1 desencadena la autofosforilación de la subunidad β del IGF-1 e induce el reclutamiento de los sustratos del receptor de insulina y de la proteína transformadora, lo que promueve la activación de las cascadas de P3IK-AKT, mediador potencial de la expansión tumoral en MM.34,35
La IL 6 es un factor de supervivencia de las células del mieloma, cuya capacidad antiapoptótica está asociada con la expresión de las proteínas de la familia BCL-2: BCLXL y MCL-L, que poseen una función antiapoptótica. 36) Se ha observado una correlación relevante entre el nivel sérico de IL 6 y un incremento de LDH, de la β2MG y a un recuento elevado de células plasmáticas aberrantes en médula ósea.37
Factores asociados a variables clínicas
Los factores asociados a variables clínicas relacionados con MP incluyen la función renal, la enfermedad focal o difusa de la médula, y los niveles de albúmina, β2MG y LDH.
La insuficiencia renal (IR) es una complicación común del mieloma múltiple. Se asocia con mayor carga tumoral, una enfermedad más agresiva, disminución de la calidad de vida, desarrollo de complicaciones y aumento de la mortalidad que confieren un mal pronóstico.38 Se estima que la incidencia de IR en los pacientes con MM oscila entre 20 y el 50 %.
Las causas más frecuentes de IR en el MM son la excreción de cadenas ligeras (90 %), la hipercalcemia, la deshidratación, la hiperuricemia y las secundarias al uso de las drogas nefrotóxicas. 39) El daño renal asociado a una discrasia de células plasmáticas puede manifestarse como un fracaso renal agudo (FRA) y se considera un factor de mal pronóstico en relación con la SG en pacientes con MM de nuevo diagnóstico. El tipo más frecuente de FRA en los pacientes con MM es el riñón de mieloma o nefropatía por cilindros.
En estudio de Peña y otros identificaron que la IR en pacientes con MM está asociada con parámetros adversos como LDH elevada, hipercalcemia, anemia y un estadio avanzado por el sistema de estadificación internacional. 40).
Otro de los predictores de SLP y SG reducida es la presencia de células plasmáticas aberrantes con distribución focal o difusa en la médula ósea, con destrucción ósea y la presencia de lesiones osteolíticas. Las lesiones focales de gran tamaño se asocian a una mortalidad precoz. 41) Se ha observado que los bajos niveles de albúmina (menores de 3 g/dL), los valores elevados de β2MG sérica y de LDH se han asociado a un ISS grado III y a una a una mortalidad temprana en pacientes con MM de nuevo diagnóstico.4
En el mieloma múltiple sintomático se presentan signos de daño orgánico establecido (CRAB), donde se han identificado varios biomarcadores asociados aproximadamente a 80 % de riesgo de MP y de una progresión hacia un daño orgánico terminal. Entre ellos la presencia de más del 60 % de células plasmáticas clonales en la médula ósea, el índice κλ mayor o igual a 1,75 (dosificación de cadenas ligeras libres séricas) y la evidencia de más de una lesión focal en la resonancia magnética nuclear.42
Factores relacionados con las características del tumor
La identificación de los niveles de expresión de antígenos aberrantes se han asociado a un alto recuento de células plasmáticas (mayor a 10 % CD38+/CD138+) y a un aumento en la mortalidad precoz en el MM de nuevo diagnóstico, entre ellos CD56+, CD27-, CD45-, CD19 -(43) y la presencia de CD19 , CD28 y la ausencia de CD117.
Según estudios de Paiva y otros, los pacientes con MM presentan un mal pronóstico si expresan CD20+ y CD 28+ en las células plasmáticas aberrantes.44
Desde el punto de vista citogenético la Del17p13 es considerada como el factor adverso más importante en el MM y como una alteración citogenética de alto riesgo por el sistema de estadificación revisado. El gen TP53 funciona como un promotor de la apoptosis y su pérdida se relaciona con una enfermedad agresiva con presentación de una enfermedad extramedular, hipercalcemia, con un compromiso del sistema nervioso central y con una disminución de la supervivencia en estos pacientes.45,46,47,48,49
Otras de las alteraciones citogenéticas descritas en el MM que no están incluidas en los grupos de riesgo citogenéticos (Fig. 2), es el MM doble hit. Entre ellas se encuentra la inactivación bialélica de TP53 (deleción en un alelo y mutación en el otro) y un estadío III por ISS con amplificación de la subunidad 1B regulatoria de la proteína cinasa CDC28 con más de cuatro copias (gen CKS1B). Este grupo constituye el 6 % de las anomalías citogenéticas en el MM y cursa con una enfermedad muy agresiva con una disminución en la supervivencia global (SG) y libre de progresión (SLP).50
En el mieloma múltiple recién diagnosticado la enfermedad de riesgo estándar se caracteriza por una mediana de supervivencia global de 50,5 meses. En el caso de la enfermedad de alto riesgo por la presencia de al menos una de las aberraciones genéticas del(17p), t(4;14)(p16;q32) o t(14;16)(q32;q23), presenta una mediana de supervivencia global de 24,5 meses.5
Zhuang y otros, identifican que los pacientes con mieloma múltiple que presentaban amplificación 1q21 y deleción 17p tenían un riesgo ultra alto, incluyendo características clínicas del sistema de estadificación internacional grado III, insuficiencia renal, hipercalcemia, lactato deshidrogenasa elevada y leucemia de células plasmáticas secundaria.51
Consideraciones finales
El aumento en la mortalidad precoz en el mieloma múltiple de nuevo diagnóstico se ha asociado a la alteración de diversos factores tales como la disminución de la función renal, la presencia de enfermedad focal o difusa de la médula, los niveles séricos bajos de albúmina y de altos de β2MG y LDH.
La presencia de las alteraciones citogenéticas, entre ellas la del(17p13), t(4;14)(p16;q32) , t(14;16)(q32;q23) y el MM doble hit son marcadores que le confieren al paciente peor pronóstico. Se comportan de igual manera el aumento de los niveles de IL 6 y de los factores de crecimiento, entre ellos el factor de crecimiento vascular endotelial (VEGF), el factor de crecimiento de fibroblatos-2 (FGF-2),el factor de crecimiento de hepatocitos (HGF) y el factor de crecimiento derivado de la plaquetas (PDGF-b), así como la expresión de antígenos CD38+/CD138+ y de antígenos aberrantes como el CD56+, CD27-, CD45-, CD19-, la presencia CD19, CD28 y la ausencia de CD117. 52)
La presencia de comorbilidades está asociada a una alta MP por constituir causa directa de muerte y comprometer la capacidad de recibir un tratamiento óptimo. Adicionalmente, la presencia de células plasmáticas aberrantes con distribución focal o difusa en la médula ósea, con destrucción ósea y la presencia de lesiones osteolíticas contribuyen a una MP.














