My SciELO
Services on Demand
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Cubana de Investigaciones Biomédicas
On-line version ISSN 1561-3011
Rev Cubana Invest Bioméd vol.16 no.2 Ciudad de la Habana July-Dec. 1997
Inhibidores fisiológicos de la coagulación
Dr. Andrés O. Pérez Ruíz, Dr. José A. Castillo Herrera, Dr. Pablo Santos Rodríguez, Dra. Deysi Martínez Alvarado y Dr. Pedro J. Argudín MartínezLa significación fisiológica de los mecanismos de control de la coagulación es obvia. Esta función requiere de un sistema balanceado de actividades procoagulantes y anticoagulantes, pudiendo ser las últimas tan importantes como los factores que influyen en la formación del coágulo.
Una vez activado el mecanismo de la coagulación, las reacciones se desarrollan a una velocidad vertiginosa. De manera que cuando se activa un factor el número de moléculas activadas en los sucesivos pasos aumenta aún mucho más, generándose suficiente cantidad de trombina, la enzima coagulante por excelencia.
¿Cómo poner freno a este mecanismo?
Existen mecanismos de control que se refieren a:
- 1. Flujo sanguíneo.
- 2. Remoción de la circulación de los factores activados.
- 3. Inhibidores plasmáticos que pueden ser:
- Inhibidores proteolíticos naturales de vía intrínseca y extrínseca.
- Mecanismos de retroalimentación de la trombina.
Cuando se inicia la formación de un coágulo, la formación continuada de éste sólo tiene lugar si la sangre no circula, porque la sangre en movimiento se lleva la trombina y otros procoagulantes liberados durante el proceso de coagulación, alejándolos tan rápidamente que su concentración no puede aumentar con rapidez suficiente y promover una mayor coagulación. Así pues la extensión del coágulo casi siempre se interrumpe cuando entra en contacto con la sangre que está fluyendo a una velocidad mayor de cierto límite.
REMOCIÓN DE LA CIRCULACIÓN DE LOS FACTORES ACTIVADOS
El hígado es capaz de remover del plasma los componentes responsables de un estado de hipercoagulabilidad, tales como los factores activados de la coagulación a través de un sistema de macrófagos, en particular las células de Kupffer y también los macrófagos del bazo y la médula ósea suprimen la mayor parte de factores procoagulantes circulantes en un plazo de pocos minutos.
INHIBIDORES PROTEOLÍTICOS NATURALES DE VÍA INTRÍNSECA
INHIBIDORES DE SERINOPROTEASASAntitrombina III (AT III)
Antes de comenzar su caracterización es importante aclarar que se han descrito hasta 6 actividades antitrombínicas en la sangre, pero la AT III resulta ser el mayor inhibidor fisiológico de la trombina y del FXa.
La AT III es una glicoproteína de una sola cadena que forma un complejo equimolar estequiométrico muy fuerte, con la trombina, irreversible sin actividad proteásica.
Es de síntesis hepática y su vida media es de alrededor de 50 horas. Pertenece al grupo de las serpinas (inhibe a serinproteasas). Su mecanismo de acción se detalla en la figura 1.
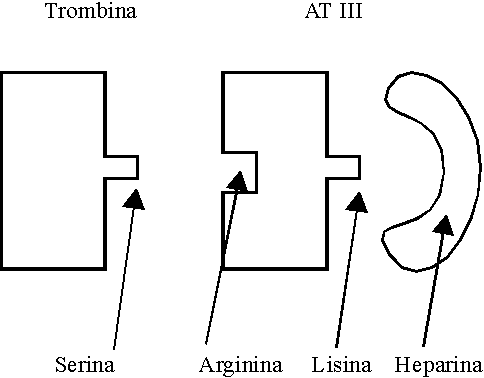
La heparina es un glicosaminoglicano polisulfonado con densidad de carga negativa, por lo que se une a radicales lisina de la AT III, lo que provoca un cambio conformacional en la molécula de AT III que hace más sensible a la arginina para unirse a la serina de la proteasa, aumentando así unas 2 000 veces la velocidad de interacción de la AT III con la trombina y varias veces con el FXa. Una vez que la AT III y la trombina se han unido, se produce entonces un cambio conformacional: la heparina se libera y puede ser reutilizada ulteriormente.
El uso de heparina de bajo peso molecular tiene importante repercusión clínica, puesto que tiene mayor actividad anti-Xa, e impide de esta manera la formación de trombina, por ello se emplea en la prevención de los procesos trombóticos venosos con exitosos resultados.
Otros glicosaminoglicanos, como los sulfatos de heparina y dermatán, se hallan en bajas concentraciones en la pared endotelial y son capaces de fijar AT III y neutralizar proteasas de serina, resultando de esta manera eficaces en la capacidad de tromborresistencia del endotelio vascular.
La AT III tiene capacidad también de inhibir a los factores XIIa, XIa, IXa, calicreínas y plasmina e incluso neutraliza la capacidad que tiene la trombina de favorecer la proliferación de las células musculares lisas de la capa media del vaso, acción que es potenciada por la heparina.
La AT III es responsable del 50 % de la actividad antitrombínica del plasma y su importancia fisiológica está dada por la tendencia al tromboembolismo venoso recurrente que presentan los pacientes con déficit congénito o adquirido de este inhibidor. Su valor normal en plasma es de 0,8 a 1,2 U/mL. Niveles por debajo del 60 % predisponen a la trombosis.
Cofactor II de la heparina
Inhibe selectivamente a la trombina. Es activado por el sulfato de dermatán o por la heparina. Su vida media es de alrededor de 50 h. Si lo comparamos en cuanto a su rapidez de acción con el complejo AT III-heparina, éste actúa en forma más lenta y necesita aproximadamente 5 min para alcanzar su óptimo equilibrio. Dado que de los glicosaminoglicanos de la íntima arterial el sulfato de dermatán constituye el 70 %, es posible que por esta razón el cofactor II de la heparina tenga una mayor actividad antitrombínica localmente que en la circulación.
a2 Macroglobulina
Sintetizada en el hígado, por fibroblastos y en el endotelio vascular, es una glicoproteína plasmática responsable de cerca del 25 % de la actividad antitrombínica, a través de su acción inhibitoria directa sobre la trombina.
Puede unirse también e inhibir simultáneamente en grado variable, a un gran número de proteasas fisiológicas importantes, como la plasmina, calicreína y otras. Se halla elevada durante el embarazo y en niños, de aquí su probable acción protectora contra la trombosis durante los primeros años de vida en los pacientes con déficit hereditario de AT III.
C1 Inhibidor
Es una glicoproteína que inhibe los factores XIIa y XIa y a las calicreínas formando un complejo 1:1, además de actuar sobre el sistema del complemento.
a1 Antitripsina
Es una glicoproteína de síntesis hepática de una sola cadena así como una proteasa de tipo serina de amplia especificidad: inhibe a la trombina, al F XIa y a la plasmina. Su principal sustrato es la elastasa leucocitaria. Su déficit, heredado en forma autosómica recesiva, no produce tendencia trombótica.
a2 Antiplasmina
Glicoproteína de una cadena, es el principal inhibidor de la plasmina; sólo cuando su capacidad ha sido agotada, la a2 macroglobulina ejerce un efecto inhibidor subsecuente. Algo similar ocurre con la antitripsina.
Pertenece a la familia de las serpinas, inhibidores de serinoproteasas.
Un déficit de ella o un defecto en su capacidad de inhibición de la plasmina condiciona una tendencia hemorrágica. Además de neutralizar a la plasmina, la a2 antiplasmina inhibe la unión del plasminógeno a la fibrina y también actúa sobre el FXIIa, FXIa, trombina y calicreína.
INHIBIDORES DE LOS COFACTORES ACTIVADOS
Proteína C (PC)
Es sintetizada en los hepatocitos, pertenece al grupo de las proteínas que dependen de la vitamina K para su carboxilación. Posee 2 cadenas: una pesada, donde se encuentra el sitio activo, y una liviana, carboxilada en 9 residuos de ácido glutámico mediante una carboxilasa dependiente de la vitamina K.
Circula como zimógeno y normalmente se puede activar por interacción con la trombina; esta activación es mucho más efectiva en presencia de la trombomodulina. Otra variante de activación que se ha descrito es la del complejo trombomodulina con cadenas ligeras de factor Va en presencia de trombinas; una vía alterna de activación es mediante el factor Xa con fosfolípidos en presencia de iones y de trombomodulina.
Una vez activada la proteína C se acopla a otra proteína de este sistema, la proteína S, que normalmente es transportada por un componente del complemento, la proteína C4b; ahora el complejo proteína C-proteína S puede inactivar a los cofactores V y VIII por proteólisis limitada de las cadenas pesadas de ambas moléculas.
Otra actividad que tiene la molécula de proteína C activada, en donde al parecer no intervienen la proteína S, calcio, heparina, ni fosfolípidos, es la profibrinolítica por neutralización directa de los inhibidores de los activadores del plasminógeno, favoreciendo así la acción del activador tisular de plasminógeno t -PA.
Se han descrito 3 inhibidores de la proteína C, uno dependiente de heparina denominado inhibidor de la proteína C y otros 2 independientes de ésta: la a2 macroglobulina y la a1 antitripsina; aunque al parecer el primero es el de mayor importancia, aunque a pesar de su nombre no es específico para la proteína C ya que también inhibe a la trombina, a los factores XIa y Xa y a los activadores del plasminógeno (figura 2).

DE VÍA EXTRÍNSECA
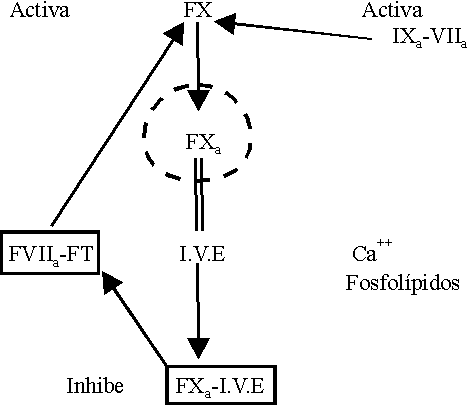
Los inhibidores de la vía extrínseca (IVE) son lipoproteínas que circulan en el plasma producidas por el endotelio y son secretadas a la pared del vaso; son reguladas por las LDL. El tratamiento con inhibidores de la hidroximetilglutaril coenzima reductasa provoca disminución de las LDL y de los IVE. Estos últimos se encuentran aumentados en la embarazada, en septicemias, cáncer y ancianos y disminuidos en la coagulación intravascular diseminada.
La actividad inhibitoria ocurre en 2 pasos:
2. El complejo IVE FXa se une al complejo FT-FVIIIa en una reacción dependiente de calcio (figura 3).
MECANISMOS DE RETROALIMENTACIÓN DE LA TROMBINA
La trombina en pequeñas cantidades es indispensable en la activación del FV y del FVIII y éstos participan en la formación de más trombina. Sin embargo una vez formada suficiente cantidad de trombina, esta poderosa enzima coagulante ejerce las siguientes retroalimentaciones negativas:
- Actúa sobre la protrombina, liberándole el fragmento 1, e impidiendo de esta manera que el FXa active completamente a la protrombina.
- Activa al sistema de inhibidores fisiológicos de la coagulación, el de las proteínas C y S, los cuales inactivan proteolíticamente a los factores Va y VIIIa.
REFERENCIAS BIBLIOGRÁFICAS
- Scazziota A, Altman R. Mecanismo de la hemostasia normal. Rev Iberoam Tromb Hemost 1994;7:95-109.
- Pérez Resquejo JL, Pérez García M. Inhibidor de la vía extrínseca. Rev Iberoam Thromb Haemost 1991;66:189-93.
- Scazziota A, Altman R. Mecanismo de la hemostasia normal. Rev Iberoam Tromb y Hemost 1994;7:95- 109.
- Tollefsen D. Laboratory diagnosis of antithrombin and heparin cofactor II deficiency. Semin Thromb Haemost 1990;16:162-8.
- Pérez Campo E. Bioquímica de la proteína C de la coagulación. Rev Iberoam Tromb Hemost 1994;7:131 -135.
- Hoogendoorn H, Toh CH, Neshein ME, Giles AR. A-2 Macroglobulina binds and inhibits activated protein C. Blood 1991;78:2283-90.
- Lozano F, Gómez Alonso A. Enfermedad tromboembólica venosa. Síndrome postflebítico. En: Viver ER ed. Patología vascular Barcelona: Edika Médica, 1993:351-85.
- Lozano F. Las heparinas de bajo peso molecular en el tratamiento de las trombosis. Rev Iberoam Tromb Hemost 1995;8:28-32.
- Rouvier J. Función de la vitamina K. Su deficiencia. En: López Borrasca A, eds. Enciclopedia iberoamericana de hematología. 1 ed. Vol III. Salamanca: Ediciones Universidad de Salamanca, 1992; vol 3:489-98.
- Sánchez C, Bartoli C, Vides M, Guglielmone H. Antigenic and functional levels of antithrombin III in full term newborns. Rev Iberoam Tromb Hemost 1994;7:73-5.
- Navarro J, César J, García Avelló A. Fisiopatología de la trombosis arterial y bases farmacológicas del tratamiento trombolítico. Rev Iberoam Tromb Hemost 1994;7:165-8.
- Rouvier J, Scazziota A. Factores y marcadores de riesgo de trombosis. Rev Iberoam Tromb Hemost 1994;7:192-209.
Dr. Andrés O. Pérez Ruíz. Instituto Superior de Ciencias Médicas de La Habana. Calle 146 No.3102 esquina 31, reparto Cubanacán, municipio Playa, Ciudad de La Habana, Cuba. CP 11600.












