Introducción
Los defectos de partes blandas en el miembro inferior con material ortopédico subyacente son un evento frecuente en la práctica hospitalaria de los servicios de Traumatología y Cirugía Plástica. A los tratamientos de artroplastias y osteosíntesis puede sucederse la dehiscencia del tejido suprayacente, en estos casos entre 1-12 % se complican con infección de partes blandas, hueso o el implante.1
El tratamiento de esta enfermedad supone un reto para el cirujano reconstructivo, porque implica tomar decisiones sobre la implicación del material extraño en el proceso de cobertura del defecto. El mayor problema de esta cirugía es que fracase al no erradicar una posible infección asociada a estos dispositivos. Se han publicado tasas de fracaso del colgajo de hasta el 23 % en pacientes con infecciones previas a la reconstrucción.2
El diagnóstico y tratamiento de la infección asociada al implante ortopédico es diferente entre hospitales y países.1,3 En la extremidad inferior, el tratamiento tradicional es el desbridamiento, la antibioticoterapia sistémica y la retirada del material ortopédico previos a la reconstrucción del defecto de partes blandas.4,5 Si la retirada del implante genera una fractura inestable, puede tratarse provisionalmente con un fijador externo. Más recientemente se está apostando por mantener el material y cubrirlo con colgajos, una vez realizado el desbridamiento.1
Existe un consenso en cuanto a la importancia crítica del desbridamiento y la necesidad de aportar tejido bien vascularizado,5,6 para conseguir una cobertura estable de partes blandas y la consolidación de la fractura o la integración de la artroplastia.3) Los colgajos musculares y fasciocutáneos tienen una serie de características que los hacen ventajosos para estos procedimientos. Son maleables y con tejido suficiente como para obliterar el espacio muerto;7,8) los colgajos musculares están muy vascularizados, lo que permite un mayor aporte de componentes inmunitarios, antibiótico y oxígeno a la zona de lesión.9,10 En el miembro inferior la disponibilidad regional de este tipo de colgajos es limitada y en las partes más distales, en muchos casos, es ineludible recurrir a la transferencia microquirúrgica.7,11
El manejo del implante también difiere respecto de su indicación. Los dispositivos de osteosíntesis para una fractura o artrodesis pueden mantenerse más tiempo a pesar de la infección, porque pueden extraerse una vez conseguida la consolidación del hueso.5 En cambio en las prótesis lo importante es su preservación, ya que confieren una ventaja funcional frente a la alternativa de la artrodesis.12
Por otra parte, no hay unanimidad en cuanto a la definición de infección en este tipo de heridas. Se aceptan como criterios de infección los signos clínicos (dolor, eritema, exudado purulento), un cultivo microbiológico positivo, y la exposición o la palpación del implante a través de la lesión. Las publicaciones más estrictas la diagnostican solo en presencia de los tres criterios,2) otras exigen solo signos clínicos y cultivos positivos5,13 y otras consideran suficiente la detección de solo uno de ellos.14) En cualquier caso, muchos autores coinciden en que todo material endoprotésico debe considerarse colonizado y tratarse como tal.12,15
El objetivo de este estudio fue evaluar el éxito reconstructivo con colgajos de defectos de partes blandas en miembros que han precisado de una osteosíntesis, en función de la presencia de infección y el estado de los dispositivos de implante en el momento de la reconstrucción.
Métodos
Se realizó un análisis retrospectivo de 15 pacientes intervenidos por el servicio de Cirugía plástica entre enero de 2008 y enero de 2015. Todos los pacientes presentaban un defecto de partes blandas en el miembro inferior, secundario a una cirugía de osteosíntesis o artroplastia. Los pacientes procedían de los diferentes servicios de Traumatología de la región. Incluimos a todos los pacientes tratados con dispositivos ortopédicos para artroplastia u osteosíntesis en miembro inferior, con un defecto de partes blandas secundario. Aquéllos en los que este material fue retirado antes del ingreso en cirugía plástica se excluyeron.
En el caso de las fracturas, su consolidación se evaluaba según la imagen radiográfica. Si existía clínica de osteomielitis, solicitamos análisis hematológicos, que se complementaban con pruebas de imagen (radiografía y gammagrafía). El diagnóstico definitivo en ambos casos corría a cargo del servicio de Traumatología.
Todos los pacientes recibieron antibioticoterapia perioperatoria. Inicialmente de amplio espectro, y específica en caso de disponer de un cultivo positivo y antibiograma.
La decisión terapéutica la tomaba el cirujano plástico, al que se le asignaba el paciente a su ingreso en el hospital. En todos los pacientes se realizó, al menos, un procedimiento de desbridamiento del defecto. En algunos pacientes utilizamos terapia de presión negativa previa a la cirugía de cobertura.
La reconstrucción de los defectos de partes blandas la realizamos con colgajos musculares, musculocutáneos o fasciocutáneos, pediculados (gastrocnemio, hemisóleo, peroneo lateral, de perforantes de tibial anterior o posterior, fasciocutáneo regional) o libres (gracilis y anterolateral de muslo (ALT)). La opción reconstructiva era decisión del cirujano.
Durante el posoperatorio evaluamos la aparición de complicaciones. En su ausencia o en el caso de complicaciones menores como la dehiscencia, al paciente se le daba de alta para tratamiento ambulatorio. Las complicaciones mayores como la necrosis se trataron con desbridamiento durante la estancia intrahospitalaria del paciente, algunos con un segundo o tercer procedimiento quirúrgico adicional para completar la reconstrucción. Todos los pacientes se siguieron periódicamente en consultas tras el alta hospitalaria, por parte de los servicios de Cirugía plástica y Traumatología.
Obtuvimos datos demográficos de la totalidad de los pacientes incluidos. Revisamos la historia médica del paciente desde el diagnóstico desencadenante y el tratamiento ortopédico, hasta su desenlace tras el tratamiento reconstructivo. Consideramos como factores de riesgo para el fracaso de los colgajos la hipertensión arterial, la diabetes mellitus y el tabaquismo. Clasificamos como éxito la obtención del cierre completo del defecto al final del periodo de seguimiento.
Registramos el diagnóstico traumatológico inicial y el tratamiento ortopédico recibido. Recogimos los siguientes datos referentes a la lesión: localización, signos clínicos de infección (dolor, eritema, exudado), cultivo microbiológico positivo y exposición o palpación del material ortopédico a través de la herida. Solo aquellos casos que cumplían estos tres últimos criterios eran considerados infección. Registramos la estancia hospitalaria y los tiempos quirúrgicos, las terapias médicas y quirúrgicas recibidas durante este tiempo y los resultados y complicaciones que ocurrieron tras la reconstrucción del defecto con colgajos musculares o fasciocutáneos, con o sin extracción del material ortopédico durante esta cirugía.
El análisis estadístico lo realizamos con el programa SPSS 15.0, con los tests de chi cuadrado y Wilcoxon para la comparación de variables cualitativas, y U de Mann Whitney para la comparación de variables cualitativas y cuantitativas. Consideramos un nivel de significación p < 0,05.
Resultados
Fueron analizados 15 pacientes durante este estudio, 14 varones (93,3 %) y una mujer. La media de edad fue de 47,2 años (22,83-84,37). La comorbilidad y factores de riesgo de los pacientes se muestran en la tabla 1.
Las indicaciones para el tratamiento ortopédico aparecen resumidas en la tabla 1. Fueron 13 casos (86,7 %) por fractura, 1 caso por infección de prótesis total de rodilla y 1 por pseudoartrosis de tibia. Los dispositivos ortopédicos empleados en el tratamiento se reflejan en la tabla 1. El lugar más frecuente de localización del defecto de partes blandas fue la región pretibial (40 %).
Tabla 1 Comorbilidad, diagnóstico e indicaciones para el tratamiento ortopédico
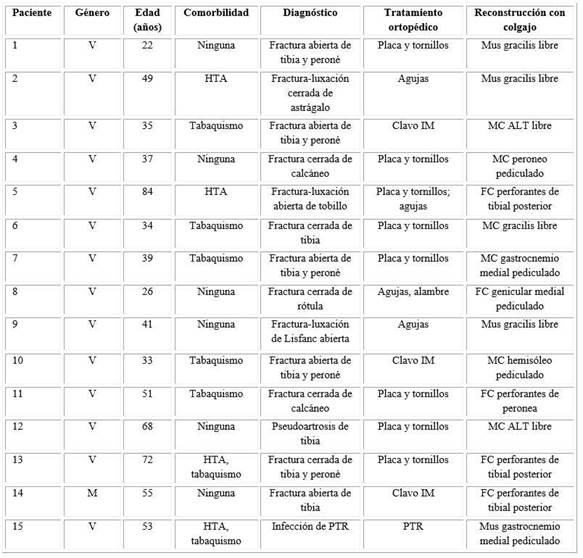
V: varón; M: mujer; HTA: Hipertensión arterial; PTR: Prótesis total de rodilla; IM: Intramedular; ALT: Anterolateral thigh (de muslo anterolateral); Mus: Muscular; MC: Músculo-cutáneo; FC: fasciocutáneo.
A su ingreso en cirugía plástica, 4 pacientes (26,7 %) presentaban infección de la lesión. La totalidad de los pacientes recibieron antibioticoterapia sistémica perioperatoria (tabla 2). En ninguno de estos pacientes se detectaron signos de osteomielitis intramedular localizada o difusa.
Tabla 2 Infección, manejo de los implantes durante la reconstrucción, complicaciones posoperatorias y resultado final
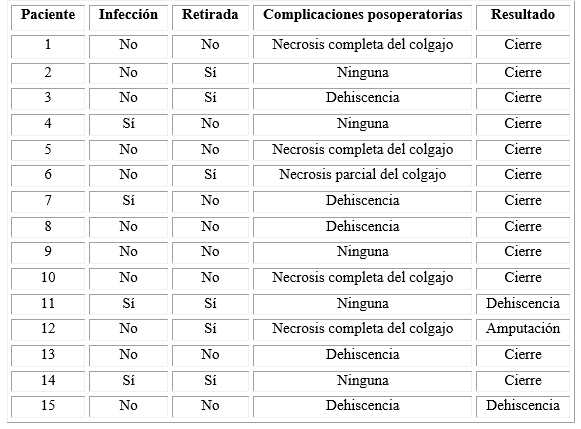
De los 13 pacientes con diagnóstico de fractura, se consideró que 3 (23,1) presentaban signos de consolidación de la fractura en el momento de la cirugía reconstructiva. De estos, 2 fueron sometidos a un procedimiento con extracción del material de osteosíntesis, en el paciente restante se dejó.
La media de tiempo que transcurrió desde la aparición del defecto hasta la reconstrucción fue de 71,4 días (8-281). De media, transcurrieron 135 días desde la colocación del dispositivo hasta la reconstrucción (11-807).
La terapia de vacío se aplicó a 8 pacientes (53,3 %), durante su estancia en nuestro hospital o en el hospital de origen, durante 17,83 días de media (7-32).
En los 15 casos el defecto se reconstruyó con colgajos musculares o fasciocutáneos, libres (40) o pediculados (60 %) (tabla 2). Durante esta cirugía en el 40 de los casos (6 de 15) se extrajo el material ortopédico. De estos 6 pacientes, 2 (33,3 %), presentaban signos de consolidación y 2 (33,3 %) cumplían los tres criterios de infección. Solo 1 (16,7 %) paciente de este grupo presentaba simultáneamente signos de consolidación y criterios de infección. De los 4 pacientes con infección a su ingreso, a 2 (50 %) se les retiraron los dispositivos ortopédicos. De los 3 pacientes con diagnóstico de consolidación, en 2 casos (66,7 %) se les retiró el material extraño (tabla 2).
Tras la cirugía reconstructiva se registraron complicaciones en 10 (66,7 %) de los 15 pacientes intervenidos. Registramos 4 casos de necrosis completa del colgajo, 1 caso de necrosis parcial, y dehiscencia de la herida quirúrgica en 5 casos, con un tiempo medio de presentación de 8,87 días (0-28) (tabla 2). La supervivencia global de los colgajos fue de 73,3 %. En todos los casos de necrosis se realizó desbridamiento y cierre por segunda intención o cobertura con un nuevo colgajo muscular según el tamaño y la situación clínica del paciente.
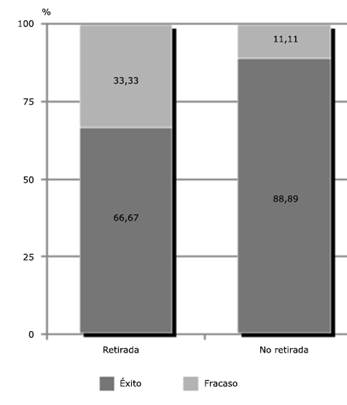
Conseguimos el cierre completo del defecto en el 80 % de los casos (12 pacientes), sin recidivas en un tiempo medio de 56,77 días. El porcentaje de éxito entre los pacientes en los que se preservó el material fue de 66,67 %, y de 88,9 % en aquellos en los que se retiró. En 2 pacientes persistía una dehiscencia al final del periodo de seguimiento, y hubo que realizar la amputación del miembro en 1 caso (6,7 %) que desarrolló osteomielitis por S. aureus meticilín-resistente (SARM). (Fig. 1)
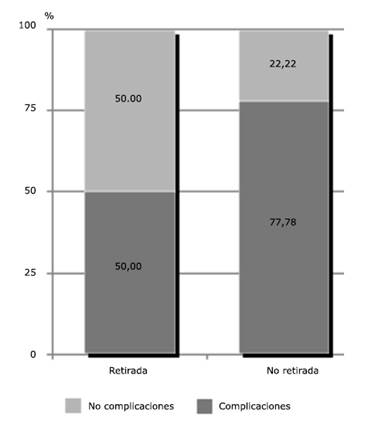
El 50 % de los pacientes a los que se les extrajo el material ortopédico (3 de 6) presentaron complicaciones. De estos, ninguno de los que estaban infectados desarrolló una complicación, y 4 de 6 (66,67 %) resultaron en una cobertura satisfactoria. En el grupo de pacientes a los que no se les extrajo el material ortopédico, el 77,8 % (7 de 9) presentaron complicaciones. De estos pacientes 2 tenían infección, de los cuales 1 (50 %) desarrolló una complicación. 8 de 9 (88,89 %) resultaron en una cobertura satisfactoria (Fig. 2).
Los pacientes requirieron 1,6 procedimientos quirúrgicos de media. Con un máximo de 3 cirugías en 2 de ellos. La estancia media hospitalaria, desde su ingreso en el servicio de Cirugía plástica hasta el alta, fue de 52,8 días (4-193). El seguimiento que realizamos a los pacientes fue de 8,96 meses de media.
En el análisis estadístico no encontramos asociaciones significativas entre los datos clínicos de los pacientes, y el resultado final y las complicaciones. Comparando los resultados entre los grupos de pacientes a los que se les retiró el material ortopédico y a los que no, no encontramos diferencias significativas en cuanto al resultado final, complicaciones, número de cirugías adicionales, tiempo hasta el cierre definitivo del defecto o estancia hospitalaria.
El tiempo transcurrido desde la aparición del defecto hasta la reconstrucción con el colgajo no se asociaba con el resultado final ni con el tiempo hasta el cierre defecto. Encontramos mayores frecuencias de complicaciones en pacientes en los que la reconstrucción se realizó más precozmente, frente a aquellos en la que se demoró. En ningún caso descubrimos una diferencia estadísticamente significativa (100 % de complicaciones antes de las 2 semanas, vs. 58,3 % después de las 2 semanas. p = 0,171).
Encontramos diferencias significativas entre las frecuencias de éxito de los pacientes con cultivo positivo y exposición del material de osteosíntesis y las de pacientes con cultivo negativo y no exposición (57,14 % vs. 100 % p= 0,038).
En el 25 % de los pacientes con infección preoperatoria no se consiguió una cobertura definitiva, frente al 18,18 % de los pacientes no infectados. No encontramos asociación entre resultado final e infección preoperatoria (p = 0,77).
Encontramos complicaciones en el 81,8 % de pacientes sin infección de la herida, frente al 25 % de aquéllos infectados (p = 0,039). No obstante, la frecuencia de complicaciones fue menor en pacientes infectados a los que se les retiraron los dispositivos ortopédicos (0 %), frente a los que no se los retiraron, o se los retiraron sin estar infectados (76,92 %) (p = 0,032). Estas mismas frecuencias de complicaciones se repetían con el mismo nivel de significación al comparar los pacientes a los que se les retiró el material y presentaban únicamente signos clínicos y exposición del material como signos de infección con el resto.
Por otra parte, aquellos pacientes con cultivo bacteriano positivo y exposición del material, a los que se les retiró el material ortopédico, presentaron una frecuencia de complicaciones de 25 %, frente al 81,8 % de complicaciones en el resto de la muestra (p = 0,039). Asimismo, en este subgrupo de pacientes encontramos que estas complicaciones aparecían más precozmente que en el resto de la muestra (rango promedio de 3,75 días vs. 9,55 días p = 0,024).
Observamos que el rango promedio de tiempo transcurrido hasta el cierre completo del defecto era menor en los pacientes infectados a los que se les extrajo el material ortopédico (media de 69 días) frente al resto de pacientes (media de 138 días), sin alcanzar el nivel de significación. No encontramos diferencias estadísticamente significativas entre el resto de variables y el tiempo hasta el cierre completo del defecto.
No encontramos asociaciones significativas con el número de procedimientos quirúrgicos entre los grupos de pacientes según la retirada de material ortopédico, la presencia de infección o el tiempo transcurrido hasta la reconstrucción. Tampoco objetivamos la influencia del tiempo transcurrido desde la colocación del dispositivo o el uso de terapia de vacío en el resto de variables del estudio.
Discusión
El problema con el que se encuentra el cirujano reconstructivo ante este tipo de defectos es si retirar o no el material ortopédico, y en caso de que esté indicada su preservación, ofrecer una cobertura tisular estable y precoz.
Existe una tendencia a cubrir el material endoprotésico con un colgajo muscular o fasciocutáneo, y proporcionar un cierre definitivo que evite su retirada. En la literatura aparecen publicadas series de casos sin retirada de los dispositivos ortopédicos con frecuencias de éxito de entre el 44,1 % y 83,3 %,1,6,16 hasta del 91 % en una serie de pacientes con artroplastia de rodilla.12 En nuestro caso conseguimos preservar el material en el 66,67 % de los casos, sin encontrar asociaciones significativas entre su retirada o preservación y los resultados.
La regla general en estos casos es realizar el procedimiento reconstructivo de forma temprana. Godina y Byrd postulaban que el tiempo ideal para la intervención en fracturas abiertas era antes de cumplir la primera semana.16,17Liu y otros concluyen que la frecuencia de complicaciones quirúrgicas era mayor en defectos de más de 7 días de evolución, y a partir de las 24 horas de la exposición del material ortopédico.13 Otros autores describen que si el defecto se localiza en la extremidad distal, se obtienen mejores resultados si la cobertura del dispositivo se ejecuta en las primeras 3 semanas.5,16
No obstante, en la bibliografía se describe la opción de realizar la reconstrucción de forma diferida.4 En estos casos se han obtenido buenos resultados con un procedimiento en dos etapas en el que tras el desbridamiento inicial, se inicia un periodo de terapia de vacío, para posteriormente realizar la reconstrucción definitiva.1,18,19 Nuestro análisis no encontró influencia de la terapia de vacío en los resultados , complicaciones o tiempos quirúrgicos. Algunas publicaciones asocian la terapia de vacío a una menor frecuencia de reintervención del colgajo, pero a mayor fracaso en la reconstrucción e infección del material ortopédico.13
La importancia de llevar a cabo una cirugía precoz es porque a mayor tiempo de exposición mayor es el riesgo de colonización e infección bacteriana.1,13 Se estima que dos semanas de infección son tiempo suficiente para la generación de glucocálix sobre el material ortopédico.3,5 Se piensa que la infección del defecto previa a la reconstrucción se asocia al fracaso del colgajo y a un mayor número de complicaciones.2,4
En este estudio el promedio de tiempo desde la aparición del defecto hasta la reconstrucción fue de 71,4 días. Esta demora la atribuimos a que en muchos casos dependemos del tiempo que tarde el traumatólogo en decidir la derivación del paciente a nuestro servicio. No es infrecuente que inicialmente no se aprecie la gravedad de una herida después de una osteosíntesis o artroplastia.20 Objetivamos mayores frecuencias de éxito reconstructivo en intervenciones realizadas antes de las 2 semanas de evolución, no estadísticamente significativas. En cualquier caso nuestros resultados coinciden con los de Gault en cuanto a que no encontramos asociación entre la duración de la exposición del material y el resultado final.6
El porcentaje de casos con cobertura satisfactoria fue mayor en los pacientes no infectados (81,8 %) que en los infectados (75 %), sin alcanzar el nivel de significación. De los 15 pacientes del estudio 4 presentaban infección previa a la cirugía, tras la reconstrucción se obtuvo el cierre completo en 3 de ellos (75 %). En este aspecto coincidimos con los resultados de otras publicaciones, que confirman una reducción de la infección tras este tipo de reconstrucción.4
En la serie de casos presentada por Vaienti y otros, el 100 % de complicaciones ocurrieron en pacientes con infección, estos autores afirmaban que la infección preoperatoria estaba asociada significativamente con las complicaciones.4 En otro estudio de 103 pacientes, todos aquéllos en los que fracasó el colgajo presentaban infección del defecto.13 Nosotros no encontramos asociación entre la presencia de infección y el resultado final. En contra de lo descrito en la literatura, observamos un mayor número de complicaciones en aquellos pacientes sin infección de la lesión (81,8 %), frente a los que la presentaban (25 %).
Este resultado aparentemente contradictorio puede atribuirse a otros factores causantes de las complicaciones, y no únicamente a la infección. En ninguno de los casos diagnosticados de infección se realizó un colgajo libre. Otro de los motivos puede ser el diagnóstico estricto que hacemos de la infección en este estudio.
En este sentido existen publicaciones con resultados significativos con criterios más laxos al establecer este diagnóstico. Éstas describen una mayor frecuencia de cultivos lesionales positivos en pacientes en los que fue necesaria la retirada del material ortopédico para conseguir una cobertura estable,18 y un mayor éxito reconstructivo con cultivos negativos.6
Así, se ha observado que los resultados se correlacionan con los cultivos preoperatorios.6 En nuestra serie de pacientes aquellos pacientes con un cultivo preoperatorio positivo y exposición del material, que se sometieron a un procedimiento de extracción de los dispositivos ortopédicos, presentaron menos complicaciones y mayor frecuencia de éxito reconstructivo que el resto de individuos.
Por otra parte, dentro del grupo de pacientes a los que se les retiró el material ortopédico, encontramos la misma frecuencia de complicaciones y nivel de significación en aquellos infectados y en pacientes con cultivo positivo y exposición del material. Esto puede derivarse de que no sea necesario que para predecir los resultados de este tipo de reconstrucción deban cumplirse los tres criterios que establecíamos para la infección, y sea suficiente con que el material esté expuesto y obtengamos un cultivo positivo.
En esta serie de pacientes realizamos la amputación del miembro inferior en un paciente tras el desarrollo de una osteomielitis por SARM. La frecuencia de amputación (6,67 %) es similar a la reflejada en la bibliografía, que establece una tasa de amputaciones secundarias a lesiones graves de extremidad inferior de entre 5,7 y 13,9 %.
La literatura coincide en que si en el momento de la reconstrucción la fractura se encuentra consolidada, o existe inestabilidad del material ortopédico es primordial retirar el implante. 2,4,5,15 En nuestro caso en uno de los pacientes el cirujano decidió no retirar el material de osteosíntesis durante la reconstrucción a pesar de la consolidación.
En este estudio, consideramos que con la cobertura del material ortopédico subyacente al defecto con colgajos musculares o fasciocutáneos conseguimos un resultado satisfactorio hasta en el 66,67 % de los casos. La exposición o palpación del material ortopédico junto con un cultivo positivo del defecto se asocia a mayor índice de fracaso reconstructivo. La retirada de los dispositivos ortopédicos en pacientes con estas características disminuye el número de complicaciones quirúrgicas. Consideramos que puede ser suficiente para el diagnóstico de infección, como un factor predictivo del fracaso del colgajo dos de los siguientes tres criterios: exposición o palpación de material y un cultivo positivo.
Nuestros resultados no concuerdan con los de la literatura en cuanto a que los tiempos de reconstrucción del defecto influyen en los resultados y complicaciones de la cirugía, no obstante, estamos de acuerdo con la propuesta de algunos autores que consideran las dos semanas como el límite a partir del cual el fracaso de la cirugía reconstructiva es mayor en este tipo de lesiones. Serán necesarios nuevos estudios para evaluar la efectividad de estas prácticas.