My SciELO
Services on Demand
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de Protección Vegetal
On-line version ISSN 2224-4697
Rev. Protección Veg. vol.32 no.1 La Habana Jan.-Apr. 2017
ARTÍCULO ORIGINAL
Toxicidad de acaricidas sobre Tetranychus urticae (Koch) en laboratorio
Toxicity of acaricides on Tetranychus urticae (Koch) in the laboratory
A. Montoya1*, G. Galano-Flores1, H. Rodríguez2, A.A. Franco3, O.Z. Zanardi3, P.T. Yamamoto3
1 Centro de Estudios de Tecnologías Agropecuarias (CETA), Facultad Agroforestal (FAF). Universidad de Guantánamo (UG). El Salvador, Guantánamo, CP 95 100.
2 Departamento Biología-Sanidad Vegetal, Facultad de Agronomía. Universidad Agraria de La Habana (UNAH). San José de las Lajas, Mayabeque. CP 32 700, Cuba.
3 Departamento de Entomología y Acarología, Escuela Superior de Agricultura "Luiz de Queiroz", Universidad de São Paulo (ESALQ/USP), Piracicaba, São Paulo. CEP 13418-900, Brazil.
RESUMEN
Con el objetivo de evaluar la toxicidad por contacto residual y el efecto ovicida de acaricidas sobre Tetranychus urticae (Koch), se realizaron ensayos en condiciones de laboratorio (25 ± 2°C, humedad relativa de 60 ± 10% y fotoperiodo 14L: 10O h). Los acaricidas y las dosis (g i.a. L-1) evaluados fueron: spirodiclofén (0,048), propargita (0,720), spiromesifén (0,750) y milbemectina (0,075). Como control se usó agua desionizada. Los tratamientos se pulverizaron sobre hojas de frijol utilizando 2 ml de caldo en una torre de Potter. Después de la aplicación de los tratamientos, los folíolos se mantuvieron en una sala climatizada por dos horas para secar los residuos. Transitado ese periodo, se colocaron discos de algodón hidrófilo sobre el envés de los folíolos para la confección de la unidad experimental; posteriormente, se transfirieron 10 hembras de T. urticae. Todos los tratamientos se replicaron cinco veces. Se contabilizaron la cantidad de hembras vivas y el número de huevos a las 24, 48 y 72 horas después de la aplicación de los tratamientos. En el caso del efecto ovicida, se evaluó hasta las 120 horas. Se obtuvo que todos los acaricidas evaluados son tóxicos y muy efectivos sobre las hembras y los huevos de T. urticae. Con propargita se obtienen valores de mortalidad significativos desde las primeras 24 horas y, junto a milbemectina, la menor media de huevos por hembra; propargita muestra la mayor mortalidad corregida y todas las moléculas evaluadas muestran una efectividad en el control superior al 96%. Todos los acaricidas evaluados tienen un marcado efecto ovicida, donde se destacan significativamente propargita y spiromesifén, los que inhibieron al 100% la reproducción.
Palabras clave: ácaro de dos manchas, milbemectina, propargita, spirodiclofén, spiromesifén.
ABSTRACT
Toxicity by residual contact and the ovicidal effect of miticides on Tetranychus urticae (Koch) were evaluated under laboratory conditions (25 ± 2°C, relative humidity of 60 ± 10%, and photoperiod of 14L : 10D h). The miticides and dose (g i.a. L-1) evaluated were spirodiclofen (0.048), propargita (0.720), spiromesifen (0.750), and milbemectin (0.075). A control of deionized water was used. The treatments were sprayed on bean leaves using a Potter's tower with 2 ml of solution for testing the residual toxicity by contact on females After treatment applications, the leaflets were left in an air-conditioned room for two hours to dry the residues. Then, cotton wool discs were placed on the underside of the leaflets to make the experimental unit. Subsequently, 10 T. urticae females were transferred. All treatments were replicated five times. The number of live females and eggs were recorded at 24, 48, and 72 hours after treatment application. The ovicidal effect was evaluated for 120 hours. All evaluated miticides were toxic and highly effective on T. urticae females and eggs. Significant mortality values were obtained with propargita from the first 24 hours, and, as well as with milbemectin, the lowest average number of eggs per female was also achieved. Propargita showed the highest corrected mortality, and all evaluated molecules showed a control effectiveness over 96 %. All the miticides evaluated had a strong ovicidal effect, where propargita and spiromesifen stood out inhibiting 100% of the reproduction.
Key words: two spotted spider mite, milbemectina, propargita, spirodiclofen, spiromesifen.
INTRODUCCIÓN
El ácaro de dos manchas Tetranychus urticae (Koch) (Acari: Tetranychidae) se considera uno de los ácaros plaga de mayor importancia a escala mundial. El daño provocado por este ácaro consiste en la remoción del contenido celular, la célula queda prácticamente vacía, con escaso contenido de material intracelular y da un aspecto de hoja con puntuaciones cloróticas y bronceadas. T. urticae se alimenta, principalmente, del contenido de las células del mesófilo, donde reduce significativamente la resistencia estomática, la tasa fotosintética y respiratoria, así como el crecimiento, la floración y el potencial productivo de los cultivos (1,2,3).
El cultivo del frijol (Phaseolus vulgaris L.), excelente fuente de proteína y calorías, se afecta significativamente por el ácaro de dos manchas y su control resulta difícil y costoso. Debido al impacto económico producido por el ataque de T. urticae en diferentes sistemas de producción agrícola, la estrategia de control se basa, casi exclusivamente, en el uso de agroquímicos; sin embargo, su efectividad es variable (3,4,5,6).
Uno de los principales problemas que se enfrenta con el control químico de este ácaro es su rápida habilidad para la selección de poblaciones resistentes, después de unas pocas generaciones. Es un hecho conocido que, poblaciones de T. urticae resistentes a acaricidas, fueron ampliamente documentadas a nivel mundial, incluso acaricidas recientemente autorizados para su control (7,8,9). Por lo que es indispensable conocer datos de toxicidad con diferentes acaricidas autorizados para el control de diversas especies de ácaros que permitan efectuar una correcta toma de decisiones.
El Ministerio de Agricultura, Pecuaria y Abastecimento (MAPA) de la República Federativa de Brasil recomienda acaricidas como cetoenoles, sulfitos y otros, destinados al control de T. urticae en diversos cultivos, entre ellos algodón (Gossypium herbaceum L.), crisantemo (Chysanthemum spp.), berenjena (Solanun melongena L.) y melón (Cucumis melo L.). Estos productos resultan muy efectivos para esos sistemas de cultivo, sin embargo, no se indicaron para el cultivo del frijol.
A partir de lo antes expuesto, se realizó el siguiente estudio con el objetivo de evaluar la toxicidad por contacto residual y el efecto en la reproducción de T. urticae de acaricidas, para su posible uso en el control de ese ácaro en el cultivo del frijol.
MATERIALES Y MÉTODOS
Ácaros
Los especímenes de T. urticae se obtuvieron a partir de una cría mantenida en el Laboratorio de Acarología de la Escuela Superior de Agricultura "Luiz de Queiróz" en el municipio Piracicaba, São Paulo, Brasil. La multiplicación del ácaro se realizó en plantas de frijol carioca (P. vulgaris) cultivadas en aisladores biológicos con paredes de mallas y techo de plexiglas. Para los bioensayos se utilizaron hembras de tercera generación.
Arenas
Las arenas se hicieron con discos de algodón hidrófilo de 5 cm de diámetro colocados sobre la parte abaxial de los folíolos de frijol común, en el interior de bandejas plásticas (29 × 21 × 6 cm de largo, ancho y altura, respectivamente) contenidos sobre espuma humedecida con agua destilada.
Bioensayos
Los bioensayos se realizaron en condiciones de laboratorio (25 ± 2ºC, H.R. 60 ± 10% y fotoperiodo: 14L: 10O horas); se utilizó un diseño completamente aleatorizado con cinco tratamientos y cinco repeticiones. Los tratamientos consistieron en la aplicación de 2 ml de spirodiclofén (0,048), propargita (0,720), spiromesifén (0,750), milbemectina (0,075) y agua desionizada como control.
Efectos en la mortalidad y la reproducción de las hembras
La toxicidad residual de los acaricidas empleados en el estudio (Tabla 1), sobre hembras de T. urticae, se evaluó a nivel de laboratorio. Para ello, se pulverizaron hojas de frijol, inicialmente con 2 ml de caldo de los diferentes tratamientos, en torre de Potter (Burkard Scientific, Uxbridge, UK), ajustada a una presión de 0,703 kg.cm-2, obteniendo una deposición de 1,8 ± 0,1 mg.cm-2 de hoja.
Después de la aplicación, las hojas se mantuvieron en sala climatizada para el secado de los residuos. Transcurrido este periodo, se transfirieron 10 hembras, con 2 días de edad aproximadamente, para cada arena confeccionada (unidad experimental). Cada tratamiento se repitió cinco veces (n=50).
Las evaluaciones se realizaron a las 24, 48 y 72 horas; se contabilizaron las hembras vivas y muertas y los huevos depositados en cada unidad experimental. Sobre la base de los datos de mortalidad (efecto letal) y el número de huevos (fecundidad) y larvas (fertilidad), se estimó la efectividad total (E) para cada acaricida, utilizando la fórmula E (%) = 100 - (100 - Mc) × Er propuesta por Pascual-Ruiz et al. (10), donde: Mc = mortalidad corregida por la fórmula de van de Veire et al. (11) y Er = efecto en la reproducción calculada como: Er = (F tratamiento/Fcontrol) donde: F = razón del número medio total de huevos depositados por las hembras durante el periodo de evaluación en los diferentes tratamientos.
Acción ovicida
Para la evaluación de la actividad ovicida de los acaricidas, se transfirieron 10 hembras del T. urticae provenientes de la cría a cada unidad experimental. 24 horas después de la infestación, se removieron las hembras y se contaron los huevos depositados.
Seguidamente, los huevos se sometieron a la pulverización de 2 ml de caldo de cada tratamiento en torre de Potter, conforme la descripción anterior. Los acaricidas, el modo de acción y las dosis utilizadas en el bioensayo se describen en la Tabla 1; como tratamiento control se utilizó agua desionizada.
Después de la aplicación de los tratamientos, las arenas se colocaron en bandejas plásticas y se acondicionaron en sala climatizada. Cada tratamiento se repitió cinco veces (n=50). Las evaluaciones se realizaron cada 24 horas durante cinco días, se contaban las larvas eclosionadas en cada unidad experimental utilizando un estereomicroscopio con aumento de hasta 40x. La toxicidad sobre huevos en los diferentes tratamientos se calculó por la fórmula de Henderson y Tilton (12).
Análisis de los datos
Para el análisis de los datos de proporción de la mortalidad, número de huevos y larvas se emplearon modelos lineales generalizados (15) con distribución del tipo cuasibinomial y cuasiPoisson, respectivamente. Se verificó la calidad del ajuste con el empleo del gráfico medionormal de probabilidades con simulación envolvente (16,17). Cuando hubo diferencias significativas entre los tratamientos, se empleó la prueba de Tukey (p<0,05), asistido con la función glht del paquete multicomp con ajuste de los valores de p. Todos estos análisis se realizaron con el programa estadístico "R", versión 2.15.1 (18).
RESULTADOS Y DISCUSIÓN
Desde las primeras 24 horas, los ácaros tratados con propargita registraron la mayor mortalidad. Este producto mostró una alta toxicidad y el mayor porcentaje de efectividad; de manera similar se observó a las 48 y 72 horas, lo que evidencia la significativa toxicidad del ingrediente activo (sulfito de alquila) sobre este ácaro (19) (Tabla 2).
En este sentido, se destaca el hecho de que a las 72 horas se refleja un mayor efecto de las restantes moléculas evaluadas, todas con porcentajes de mortalidad superiores al 80%, con excepción de milbemectina, que obtuvo valores de 68,9%, inferior al 80% de mortalidad y reveló la menor media de huevos por hembra; aspecto significativo a tener en cuenta para reducir de manera notable las poblaciones, en un proceso de desarrollo de estrategias de control para el ácaro de dos manchas, como fue indicado por Gotoh (20), debido a su efectividad en la supresión de diferentes ácaros tetránicos.
La actividad de spirodiclofén sobre hembras adultas de T. urticae fue lenta, lo que coincide con lo informado por Marcic et al. (21) y Ribeiro et al. (22), quienes destacaron que la mortalidad de spirodiclofén (Envidor 240 SC®) es menor en las primeras 24 y 48 horas con respecto a otras moléculas evaluadas para este ácaro.
En el estudio los tratamientos disminuyeron las posibilidades de oviposición de las hembras expuestas (superiores al 90%), lo que descarta, en gran medida, la continuidad de la población. Los cetoenoles evaluados (spirodiclofén y spiromesifén) en T. urticae permitieron medias mayores de oviposición que propargita y milbemectina.
Los productos milbemectina, propargita, spiromesifén y spirodiclofén, por ese orden, fueron efectivos sobre la reproducción (Tabla 3) y todos mostraron valores superiores al 96% de efectividad total. En estudios realizados por Esteves et al. (23) se obtuvieron valores inferiores a los informados en este ensayo, con relación al efecto en la reproducción y al efecto total con el empleo de spiromesifén.
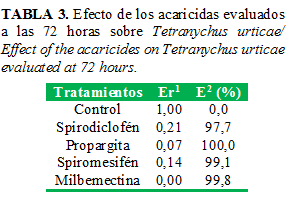
En cuanto a la toxicidad de los acaricidas evaluados sobre huevos, se evidenció la significativa efectividad 120 horas después, donde se observó un ínfimo número de larvas a partir de los huevos tratados y mostraron que no son capaces de eclosionar cuando se exponen a estas moléculas, marcando así un potente efecto ovicida (Tabla 4).
A partir de 48 horas después del tratamiento directo con spiromesifén sobre hojas de frijol, Nauen et al. (24) encontraron que se redujo, en gran medida, la fecundidad de las hembras de T. urticae, y el número de huevos por hembra en el 50%. Un patrón similar de actividad subletal de spirodiclofén informó Van-Pottelberge (25).
Las moléculas empleadas redujeron significativamente la supervivencia y la reproducción de T. urticae, lo que confirma los efectos subletales de esos productos sobre el desarrollo de las fases inmaduras, cuantificado en un impacto sobre el ciclo de vida y el crecimiento de la población: elementos de singular importancia para evaluar los efectos de un acaricida. Los resultados de este estudio podrían ser vistos como un aporte para mejorar la gestión de las poblaciones de T. urticae en el cultivo del frijol.
Propargita mostró los mayores valores de mortalidad sobre T. urticae; sin embargo, esta molécula que no se informó para el cultivo del frijol por el MAPA de la República Federativa de Brasil, podría emplearse en esta leguminosa de gran importancia económica para el mundo. No obstante, debe considerarse la disciplina tecnológica, las buenas prácticas agrícolas y el uso controlado de este producto, con el fin de evitar resistencia cruzada en T. urticae (7).
En el estudio todos los acaricidas evaluados son tóxicos y muy eficaces sobre las hembras adultas y los huevos tratados de T. urticae. Propargita obtiene valores de mortalidad significativos desde las primeras 24 horas y, junto a milbemectina, la menor media de huevos por hembra; por su parte, propargita muestra la mayor mortalidad y todas las moléculas evaluadas evidenciaron un control eficaz.
La información obtenida de este estudio se puede utilizar para mejorar las recomendaciones hechas a los productores acerca del control de T. urticae en diferentes cultivos. Se propone la aplicación en las primeras etapas del ciclo del cultivo de un acaricida, como propargita, que es altamente tóxico para una población de T. urticae con un corto efecto residual y otras aplicaciones de otros acaricidas evaluados, con buen efecto en la disminución de la reproducción y en la eclosión de huevos (19).
Además, el control del ácaro de dos manchas se ve obstaculizado por la rápida evolución de la resistencia a muchas clases químicas de acaricidas (26), lo que crea una necesidad permanente de desarrollar compuestos con nuevos modos de acción (27). Con el fin de evitar o retrasar el desarrollo de la resistencia, se recomienda respetar los principios generales de la gestión de la resistencia a plagas, incluida las actividades encaminadas a detectar los primeros signos de resistencia (28).
Sin embargo, no se debe olvidar que, en la práctica, la pericia en el manejo de los factores que inciden en la selectividad, junto con el seguimiento de la evolución de las plagas y sus enemigos naturales, favorecen la compatibilidad entre productos fitosanitarios y organismos beneficiosos (29,30,31,32). Estos resultados tienen un incuestionable valor desde el punto de vista práctico, debido a que la determinación de los productos fitosanitarios de uso frecuente en el control de T. urticae puede ser sopesada con mayor veracidad.
AGRADECIMIENTOS
A Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES), por la concesión de la bolsa de estudios. Al Departamento de Entomología e Acarología de la Escuela Superior de Agricultura "Luiz de Queiroz" de la Universidad de Sao Paulo. A los investigadores, Dra. Ana Cavalcante y el Dr. Gilberto de Moraes por los especímenes de Tetranychus urticae cedidos para la investigación.
1. Moraes GJ, Flechtmann CHW. Manual de acarologia - acarologia básica e ácaros de plantas cultivadas no Brasil. Holos Editora, Ribeirão Preto, 2008. 88-90 p.
2. Lomba R, Sato M, Zatti M. Milbemectin resistance in Tetranychus urticae (Acari: Tetranychidae): selection, stability and cross-resistance to abamectin. Exp Appl Acarol. 2010;50(3):231-241.
3. Goff GJL, Hance T, Detrain C, Deneubourg JL, Mailleux AC. Impact of living with kin/non-kin on the life history traits of Tetranychus urticae (Acari: Tetranychidae). Exp Appl Acarol. 2014;63(1):37-47.
4. Botelho F, Mendes R, Oliveira J, Emiliorelli J, De Aguiar T, Pereira D. Desempenho fisiológico de sementes de feijão colhidas em diferentes periodos do desenvolvimento. Ciênc. Agrotec. Lavras. 2010;34(4):900-907.
5. El-Tohamy WA, El-Abagy HM, Badr MA. Drought tolerance and water status of bean plants (Phaseolus vulgaris L.) as affected by citric acid application. Journal of Applied Botany and Food Quality. 2013;86:212-216.
6. Modarres S. Resistance to Tetranychus urticae Koch (Acari: Tetranychidae) in Phaseolus vulgaris L. Middle-East Journal of Scientific Research. 2012;11(6):690-701.
7. Ay R, Ebru-Fatma K, Demirel S. Toxicity, inheritance of fenpyroximate resistance, and detoxification-enzyme levels in a laboratory-selected fenpyroximate-resistant strain of Tetranychus urticae Koch (Acari: Tetranychidae). Crop Protection. 2011;30(6):605-610.
8. Osborne LS, Ehler LE, Nechols JR. Biological control of the two-spotted spider mite in greenhouses. University of Florida. Agr Exp Sta Tech Bull. 1985. 853, 40p.
9. Villegas-Elizalde SE, Rodríguez-Maciel J, Anaya-Rosales S, Sánchez-Arroyo H, Hernández-Morales J, Bujanos-Muñiz R. Resistencia a acaricidas en Tetranychus urticae (Koch) asociada al cultivo de fresa en Zamora, Michoacán, México. Agrociencia. 2010;44(1):75-77.
10. Pascual-Ruiz S, Gómez-Martinez MA, Ansaloni T, Segarra-Moragues JG, Sabater-Muñoz B, Jacas JA, Hurtado-Ruiz MA. Genetic structure of a phytophagous mite species affected by crop practices: the case of Tetranychus urticae in clementine mandarins. Exp App Acarol. 2014;62,477-498.
11. van de Veire MG, Sterk M, van der Staaij PMJ, Ramakers L Tirry. Sequential testing scheme for the assessment of the side-effects of plant protection products on the predatory bug Orius laevigatus. BioControl. 2002;47:101-113.
12. Henderson CF, Tilton EW. Tests with acaricides against the brown wheat mite. Journal of Economic Entomology. 1955;48(1):157-161.
13. IRAC - Insecticide Resistance Action Committee (IRAC) - Mode of action classification, 2013. Disponible en: http://www.irac-online.org. Accessed 6 de mayo, 2014.
14. MAPA-Agrofit. Sistema de Agrotóxicos Fitossanitários - Ministério da Agricultura, Pecuária e Abastecimento, Brazil, 2014. Disponible en: http://agrofit.agricultura.gov.br/agrofit _cons/principal_agrofit_cons. Accessed 20 marzo.
15. Nelder JA, Wedderburn RWM. Generalized linear models. Journal of the Royal Statistical Society. 1972;135(3):370-384.
16. Demétrio CGB, Hinde JP. Half-normal plots and overdispersion. GLM Newsletter. 1997;27:19-26.
17. Hinde J, Demétrio CGB. Overdispersion: models and estimation. Computational Statistics & Data Analysis.1998;27(2-3):151-170.
18. R Development Core Team. R: A language and environment for statistical computing. Vienna, Austria. 2012. 1706 p.
19. Ashley J, Ames H, Edwin E, Carlyle L, Brewster C, Huckaba R. Toxicity of three acaricides to Tetranychus urticae (Tetranychidae: Acari) and Orius insidiosus (Anthocoridae: Hemiptera). Journal of Economic Entomology. 2006;99(1):54-59.
20. Gotoh T, Fujiwara S, Kitashima Y. Susceptibility to acaricides in nine strains of the tomato red spider mite Tetranychus evansi (Acari: Tetranychidae). International Journal of Acarology. 2011;37(2):93-102.
21. Marčić D, Ogurlić I, Perić P. Effects of spirodiclofen on the reproductive potential of two-spotted spider mite (Acari: Tetranychidae) ovipositing females. Archives of Biological Science. 2009;61(4):777-785.
22. Ribeiro LP, Zanardi OZ, Vendramim JD, Yamamoto PT. Comparative toxicity of an acetogenin-based extract and commercial pesticides against citrus red mite. Exp Appl Acarol, DOI 10.1007/s10493-014-9810-2, 2014.
23. Esteves AB, Vargas J, Braz J, Cysneiros C. Toxicity of spiromesifen and natural acaricides to Tetranychus urticae Koch and compatibility with Phytoseiulus macropilis (Banks): Ciências Agrárias. 2013;34(6):2675-2686.
24. Nauen R, Schnorbach HJ, Elbert A. The biological profile of spiromesifen (Oberon) a new tetronic acid insecticide/acaricide. Pflanzenschuz-Nachrichten Bayer. 2005;58:417-440.
25. Van-Pottelberge S, Khajehali J, Van-Leeuwen T, Tirry L. Effects of spirodiclofen on reproduction in a susceptible and resistant strain of Tetranychus urticae (Acari: Tetranychidae). ExpApplAcarol. 2009;47(4):301-309.
26. Whalon ME, Mota-Sanchez D, Hollingworth RM. Analysis of global pesticide resistance in arthropods. In: Whalon ME, Mota-Sanchez D, Hollingworth RM. (eds). Global pesticide resistance in arthropods. CABI Publishing, CAB International, Wallingford, 2008: 5-31.
27. Bretschneider T, Fisher R, Nauen R. Inhibitors of lipid synthesis (acetyl-CoA- carboxylase inhibitors). In: Kramer W, Schirmer U. (eds). Modern Crop Protection Compounds. 2007:909-925.
28. Marčić D, Ogurlić I, Mutavdzic S, Perić P. The effects of spiromesifen on life history traits and population growth of two-spotted spider mite (Acari: Tetranychidae). Experimental and Applied Acarology. 2010;50(3):255-267.
29. Montoya A, Rodríguez H, Posos P. Selectividad de Amblyseius largoensis (Muma) a productos fitosanitarios en la producción protegida de pimiento (Capsicum annuum L.) Rev. Protección Veg. 2013;28(1):65-69.
30. Szczepaniec A, Creary SF, Laskowski KL, Nyrop JP, Raupp MJ. Neonicotinoid insecticide imidacloprid causes outbreaks of spider mites on elm trees in urban landscapes. PLoS ONE. 2011;6:1.
31. Schlesener DCH, Duarte AF, Guerrero MFC, Cunha US, Nava DE. Efeitos do nim sobre Tetranychus urticae Koch (Acari: Tetranychidae) e os predadores Phytoseiulus macropilis (Banks) e Neoseiulus californicus (Mcgregor) (Acari: Phytoseiidae). Rev Bras Frutic. 2013;35:59–66.
32. Bernardi D, Botton M, Cunha US, Bernardi O, Malausa T, Garcia MS, Nava DE. Effects of azadirachtin on Tetranychus urticae (Acari: Tetranychidae) and its compatibility with predatory mites (Acari: Phytoseiidae) on strawberry. Pest Manage Sci. 2013;69:75–80.
Recibido: 20/3/2016
Aceptado: 26/10/2016
* Autor para correspondencia: A. Montoya. E-mail: montoya@cug.co.cu














