Introducción
La bacteria Haemophilus influenzae del serotipo b (Hib) es un problema sanitario mundial grave para el ser humano y afecta principalmente a niños menores de 5 años.(1 Entre las enfermedades que provoca se encuentran la meningitis, neumonía, epiglotitis y otras enfermedades del tracto respiratorio.2 La incidencia mundial de las enfermedades provocadas por Hib durante 2000-2012 fue de 0,27 por cada 100. 000 habitantes según la HealthyPeople 2020.1
El principio activo de las vacunas comerciales contra Hib lo constituye el polisacárido polirribosilribitol fosfato (PRP). En un inicio se utilizó el polisacárido capsular purificado para inducir inmunidad protectora, sin embargo, la respuesta en los niños fue muy escasa. La solución a este problema se logró uniendo de forma covalente el polisacárido a proteínas portadoras como son: el toxoide tetánico (PRP-TT),3) el toxoide diftérico,4 el CRM197 (variante no tóxica de la toxina diftérica) y el complejo proteico de la membrana externa de la bacteria Neisseria meningitidis del serogrupo B (PRP-OMP).5) Con todas estas preparaciones de antígeno, se obtuvo un nivel protector de anticuerpos y una elevada respuesta inmunológica a partir de los dos meses de edad.6) Estas vacunas se denominan vacunas glicoconjugadas y han sido reportadas como vacunas de gran eficacia y seguridad para todos los pacientes sin importar la edad que presenten.7
En el caso de la vacuna Quimi-Hib® el polisacárido se obtiene por síntesis química y se conjuga al toxoide tetánico (TT). Las incidencias de las infecciones producidas por Hib en Cuba disminuyeron significativamente de 1,5 por 100.000 habitantes en 1998 a 0,9 en 2001 después de su introducción en el esquema nacional de vacunación. En 2003, se registró y comercializó Quimi-Hib® la primera vacuna con un antígeno sintético en el mundo.8
El Ingrediente Farmacéutico Activo (IFA) contra Hib se produce a escala industrial en el Centro de Ingeniería Genética y Biotecnología (CIGB). El desempeño de la reacción de conjugación ha sido consistente en el cumplimiento de las especificaciones del PRP y el conjugado, según establece la OMS para la producción de vacunas contra Hib.9 La calidad del PRP se evalúa lote a lote mediante las siguientes técnicas y se comparan con los correspondientes límites de aceptación: contenido de ribosa (> 32% con respecto al peso seco), el contenido de fósforo (6,8 a 9,0% con respecto al peso seco), el contenido de endotoxinas bacterianas (<10 EU/µg de PRP) y el grado de polimerización y activación (>5 unidades poliméricas). La identidad y la presencia de impurezas se evalúa por Resonancia Magnética Nuclear (RMN1H13C). El límite de aceptación establecido para los contaminantes en la última etapa de síntesis es el siguiente: ácido maleimido propiónico (< 0,8 ppm/20 µg de producto), antígeno espaciador amino (<10% de la señal en 3,3 ppm), N-hidroxisuccinimida (< 0,8 ppm/20 µg de producto), ácido maleámico (< 0,3 de la señal 6,83 ppm) y fosfato cíclico (< 10% de la señal en 5,01 ppm).9
La purificación del PRP activado con el éster N-hidroxisuccinimidilo del ácido β-maleimido propiónico se realiza por filtración con una membrana de 1.000 Da y otra de 10.000 Da lo que sugiere que su peso molecular se encuentra en este intervalo. En la evaluación por RMN1H se observa la presencia en 2,7 ppm de una señal intensa que se corresponde con la presencia de dimetilsulfóxido (DMSO), disolvente utilizado en la reacción de activación del PRP.9 Este disolvente presenta propiedades oxidantes en un rango de pH de 3,0 a 8,010 el cual comprende las condiciones en la que se realiza la reacción de conjugación a pH 7,4.6
El presente estudio tiene como objetivos caracterizar el PRP por cromatografía de exclusión molecular de alta eficacia con detección ultravioleta para obtener el perfil de elución, el peso molecular y la pureza mediante el empleo de esta técnica. Además, purificar el PRP y evaluar el efecto de las impurezas presentes en el PRP en el desempeño de la reacción de conjugación.
Materiales y Métodos
Muestras, reactivos y estándares
Los lotes de PRP y el toxoide tetánico fueron suministrados por el Instituto Finlay de Vacunas.
El IFA control fue proporcionado por la planta de producción del IFA de la vacuna Quimi-Hib® del CIGB.
Las proteínas patrones empleadas para realizar la curva de calibración fueron: ovoalbúmina (43.000 Da), anhidrasa carbónica (29.000 Da), ribonucleasa A (13.700 Da), aprotinina (6.512 Da) suministradas por Sigma Aldrich (EE UU).
Los reactivos empleados para la reacción de conjugación en la escala de laboratorio fueron de calidad “para síntesis” y los utilizados en los ensayos analíticos fueron de calidad “para análisis”. El ditiotreitol (DTT) utilizado fue suministrado por Merck KGaA (Darmstadt, Alemania); el éster N-hidroxisuccinimido del 3,3-ácido ditiopropiónico y el N-etilmaleinimido, por Sigma-Aldrich (St. Louis, MO, EEUU) y el dimetilsulfóxido (DMSO), por Scharlau (Scharlab S.L., España). El EDTA utilizado fue suminstrado por la Merck (Alemania).
El proveedor del dihidrógeno fosfato de sodio (NaH2PO4) fue Merck (Alemania) y del cloruro de sodio (NaCl), la AppliChem (Alemania).
La caracterización del PRP mediante cromatografía de exclusión molecular se realizó en un equipo Äkta pure 25 M (EE UU) y se empleó una columna SuperdexTM 75 10/300 GL Increase (GE HealthCare, EEUU) con un rango de fraccionamiento de 3.000-70.000 Da. Las muestras de PRP purificado, de los conjugados PRP-TT y del IFA control se evaluaron en un cromatógrafo líquido de alta resolución acoplado a un detector UV de Prominence (SHIMADZU, Japón) y se utilizó una columna YarraTM SEC 2000 (Phenomenex, EE UU) con un rango de separación de 1.000- 300.000 Da.
Análisis del PRP mediante cromatografía de exclusión molecular
La longitud de onda de máxima absorción del PRP se determinó en un espectrofotómetro Ultrospec 2000 (Pharmacia Biotech, Suecia) empleando una muestra a 0,25 mg/mL tomada del lote PRP2.
El perfil de elución del PRP se determinó en la columna SuperdexTM 75 10/300 GL Increase (GE HealthCare, EEUU). La fase móvil empleada fue una solución tampón de NaH2PO4 (100 mM) y NaCl (150 mM), a pH=7,0. Se analizaron tres lotes de PRP y se aplicó un volumen de 10 µL a una concentración de 5,0 mg/mL. El flujo empleado fue 0,8 mL/min a una presión máxima de 1,8 MPa durante 31 min a temperatura ambiente. Las muestras se midieron a la longitud de onda de máxima absorción. La pureza del PRP se determinó como el porciento de área bajo la curva en el tiempo de retención.
La curva de calibración para determinar el peso molecular se realizó pesando 1 mg de cada proteína patrón disuelto en 1 mL de agua reactivo tipo II, obteniéndose una concentración final de 1,0 mg/mL de cada una. De cada proteína patrón se tomaron 50 µL para un volumen final de 200 µL de muestra. El peso molecular relativo del PRP se determinó a través del mejor ajuste de la curva de correlación entre el tiempo de retención y el peso molecular de las proteínas patrones.
La evaluación de las impurezas en el PRP (DMSO u otras) se realizó en los tres lotes de PRP en la columna SuperdexTM 75 10/300 GL Increase manteniendo para el análisis las condiciones empleadas para determinar el perfil de elución. La muestra aplicada fue de 100 µL de DMSO puro (98%) a una concentración de 4,5 % (0,049 g/mL) e igual volumen de PRP disuelto a una concentración de 1,0 mg/mL.
Purificación del PRP
Los lotes de PRP seleccionados para este estudio fueron el PRP2 y PRP3 a una concentración de 30,0 mg/mL en un volumen de 1 mL. Para la purificación las muestras se filtraron en un Amicon Ultra-15 (Alemania) de 2.000 Da de tamiz molecular, a 2.330 x g, con un tiempo de filtración de 2,5 h. Al final de cada lavado, se ajustó el volumen a 1 mL y se determinó la concentración de PRP mediante el ensayo de orcinol11 y la pureza por cromatografía de exclusión molecular en una columna YarraTM SEC 2000 (Phenomenex, EE UU). El volumen de muestra aplicado fue de 50 µL a una concentración de 1 mg/mL. El flujo empleado fue 0,8 mL/min a una presión máxima de 1,8 MPa durante 17 min a temperatura ambiente. Las muestras se midieron a la longitud de onda de máxima absorción del PRP. La fase móvil empleada fue una solución tampón a pH=7,0 (100 mM NaH2PO4, 150 mM NaCl). La pureza del PRP se determinó como el porciento de área bajo la curva en el tiempo de retención.
Conjugación del PRP al toxoide tetánico
La conjugación se realizó en dos etapas:
Etapa 1: Una solución de toxoide tetánico se filtró con tampón fosfato salino, pH 8,2; con EDTA 86 g/L, 250 mL) con una membrana de tamiz molecular de 30.000 Da. A la solución filtrada (100 mg; 0,67 µmol) se le añadió el éster n-hidroxisuccinimido del 3,3-ácido ditiopropiónico (8,1 mg; 20 µmol) en dimetilsulfóxido (500 µL) y en atmósfera de N2(g). La mezcla se agitó durante 2 h a 20°C. Después se adicionó DTT (77,12 mg; 500 µmol) bajo atmósfera de N2(g) y se mantuvo la agitación durante 1 h a 20°C. La solución resultante se filtró con tampón fosfato salino, pH 7,4 con EDTA a 1,86 g/L, 250 mL) con una membrana de tamiz molecular de 30.000 Da evaluándose la presencia de grupos tioles en el permeado, por la técnica de Ellman.12) Este fue el criterio para detener la filtración. La concentración de proteína se determinó por el método de Lowry.13,14
Etapa 2: A la solución de toxoide tetánico previamente modificada por adición de grupos tiol (5 mg, 1 mL) se le añadió el PRP disuelto previamente en tampón fosfato salino, pH 7,4; 30 mg/mL a una relación 1:2,5 PRP-TT en atmósfera de N2(g). La solución se mantuvo en agitación durante 12 h a 20oC. Se adicionó el reactivo N-etilmaleimido (0.082 mg; 0,654 µmol) para inactivar los grupos tioles que quedaron libres en la reacción de conjugación. El conjugado se filtró con un tampón fosfato salino, pH 6,8 con una membrana de tamiz molecular de 30.000 Da evaluándose la cantidad de PRP presente en el permeado por la técnica de fenol-sulfúrico15 como criterio para detener la filtración. Al conjugado se le determinó la concentración de proteína y de carbohidratos totales y libre mediante las técnicas analíticas Lowry13,14 y orcinol,11 respectivamente.
La conjugación al toxoide tetánico se hizo por duplicado con el PRP3 y el PRP3.1 (PRP3 purificado) y los correspondientes conjugados y compuestos de partida fueron analizados mediante cromatografía de exclusión molecular en una columna YarraTM SEC 2000 (Phenomenex, EE UU), en las mismas condiciones experimentales antes mencionadas para la determinación de pureza del PRP, después de ser purificado. El rendimiento de la reacción se determinó como la relación entre la masa de PRP enlazada y la masa de PRP de partida. Los resultados obtenidos se compararon mediante un análisis simple de varianzas (ANOVA) para un de nivel de significación de 0,05 y estos a su vez con el porciento de incorporación del PRP3 de partida reportado por el Laboratorio de Control de la Calidad (CIGB, Cuba) que fue de 34,2 %.
Resultados y discusión
Análisis del PRP mediante cromatografía de exclusión molecular
El barrido espectrofotométrico del PRP2 desde 200 a 400 nm mostró un máximo de absorción alrededor de 215 nm de longitud de onda según se observa en la Figura 1.
El valor de longitud de onda obtenido es característico de los grupos cetónicos α, β-insaturados en el anillo maleimido presente en el PRP. La conjugación entre el grupo carbonilo y el sistema vinílico, disminuye la diferencia de energía entre los orbitales π y π* produciéndose el desplazamiento batocrómico de la banda hacia la zona de 210 a 235nm (εmax = 8.000 a 20.000). Esta banda tiene un apreciable carácter de transferencia de carga, es decir, en el estado excitado aumenta la densidad electrónica sobre el carbonilo a expensas de la nube π del vinilo.16
La Tabla 1 muestra la distribución más probable de pesos moleculares según el tiempo de retención y el % de pureza de los tres lotes de PRP expresada, esta última, como el área bajo la curva.
Tabla 1 Distribución más probable de pesos moleculares según el tiempo de retención y % de pureza de las muestras PRP1, PRP2 y PRP3 evaluadas en la columna SuperdexTM 75 10/300 GL Increase a 215 nm.
| Población 1 | Población 2 | Población 3 | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Muestras | TR1 (min) | Pureza (%) | MM1 (Da) | TR2 (min) | Pureza (%) | MM2 (Da) | TR3 (min) | Pureza (%) | MM3 (Da) |
| PRP1 | 21,75 | 86,96 | 7.409 | 24,52 | 1,75 | 3.588 | 26,23 | 11,30 | 2.293 |
| PRP2 | 21,67 | 69,16 | 7.576 | 24,46 | 0,72 | 3.645 | 26,07 | 30,13 | 2.402 |
| PRP3 | 21,88 | 76,14 | 7.157 | ND | ND | ND | 26,41 | 23,86 | 2.187 |
| Media STD | 21,77 | 77,42 | 7.381 | 24,49 | 1,24 | 3.616 | 26,23 | 21,76 | 2.294 |
| 0,12 | 8,97 | 201,93 | 0,04 | 0,73 | 40,30 | 0,17 | 9,59 | 107,50 | |
STD: Desviación estándar. MM: masa molecular. TR: tiempo de retención. ND: No detectadas.
El peso molecular relativo se determinó sustituyendo los tiempos de retención (tr) en la ecuación de la curva de calibración log MM=6,344-0,113 tr, construida a partir de la curva de los patrones de proteína. El coeficiente de determinación R² = 0,996, próximo a la unidad, evidenció el buen ajuste del modelo. La estimación del peso molecular del PRP se realizó utilizando la curva de calibración construida con las siguientes proteínas patrones: ovoalbúmina (tr=14,81 min, 43.000 Da), anhidrasa carbónica (tr=16,69 min, 29.000 Da), ribonucleasa (tr=19,15 min, 13.700 Da) y aprotinina (tr=21,99 min, 6.512 Da).
A partir de los valores de masa obtenidos para la población más abundante (población 1) se estimó la masa molecular aparente promedio del PRP obteniéndose el valor 7.381 Da ± 210,93, el cual se encuentra dentro del rango de tamaño declarado para el PRP obtenido por síntesis química, entre 1.000 - 10.000 Da.
Las restantes poblaciones eluyen en el límite de exclusión de la columna por lo que resulta poco precisa la estimación de la distribución de sus pesos moleculares y, por tanto, su correcta identificación.
Como antecedente se conoce que en el PRP producido por el Instituto Finlay de Vacunas existe dimetilsulfóxido dado por la señal que aparece a 2,7 ppm en el espectro de RMN1H y que su presencia en el medio de reacción pudiese provocar la oxidación de los grupos tiol previamente formados en la proteína.10 El DMSO es miscible en agua y presenta propiedades oxidantes en un amplio rango de pH de 3,0 a 8,0.17 Esta reacción competiría con la interacción tiol-maleimido entre el toxoide tetánico modificado y el polisacárido, disminuyendo los rendimientos del producto de interés. Las poblaciones 2 y 3 que se observan en el cromatograma podrían corresponderse con la presencia del DMSO en la muestra, con un tamaño molecular de 78,13 Da, especie muy pequeña que penetra en los poros de la fase estacionaria y eluye en un tiempo de retención no acorde a su tamaño. De las restantes impurezas que pudieran estar presentes en los lotes evaluados se observan señales muy pocos intensas en los espectros RMN1H y 13C, por lo que no fueron objetos de análisis en este estudio.
La presencia del DSMO en los tres lotes de PRP se evaluó en la SuperdexTM75 10/300 GL Increase (Fig. 2).
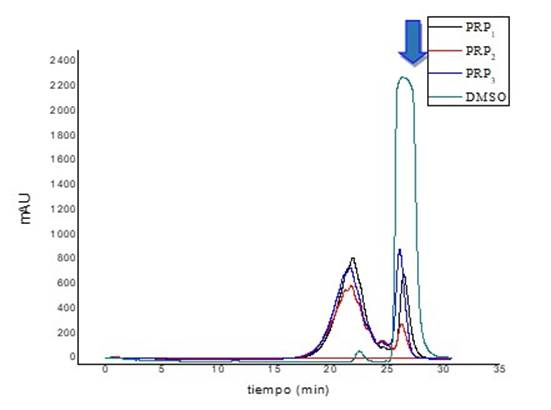
Fig. 2 Identificación de la señal característica del DMSO en muestras de los lotes PRP1, PRP2 y PRP3 mediante la cromatografía de exclusión molecular con la columna SuperdexTM 75 10/300 GL Increase a 215 nm.
En el cromatograma (Fig. 1) se observa que en la muestra de DMSO puro (98%) aparece una señal a los 26,32 min, que solapa a la segunda población que más predomina en las muestras de PRP, con un tiempo de retención promedio de 26,23 min. Esta superposición de ambas señales con similares tr sugiere que esta señal se corresponde con la impureza de DMSO presente en el PRP.
Purificación del PRP
La purificación del PRP se realizó con el objetivo de eliminar el contenido de DMSO presente en el PRP. Los lotes de PRP que se emplearon en el estudio fueron el PRP2 y PRP3. Las muestras tomadas de cada lavado se sometieron a una separación isocrática en una columna YarraTM SEC 2000 por presentar un rango de separación más amplio y permitir el análisis de muestras con tallas moleculares superiores a la del PRP como es el conjugado al TT (150.000 Da). La Figura 3 muestra los perfiles de elución de las muestras resultantes del análisis del PRP2 y PRP3 en cada filtración realizada.
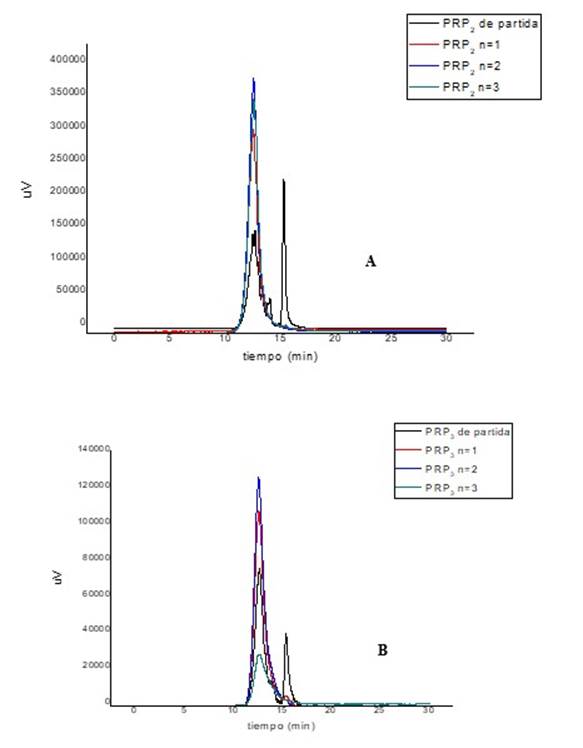
Fig. 3 Perfil de elución del PRP (A: PRP2 y B: PRP3) purificado en la columna YarraTM SEC 2000 a 215 nm, n: filtraciones realizadas con agua en un Amicon Ultra-15 de 2.000 Da.
La Figura 3 muestra que con la columna YarraTM SEC 2000 el tiempo de la corrida es menor y, por tanto, los tr disminuyen para cada población. No obstante, se mantiene el valor de pureza determinado para el PRP en la columna SuperdexTM75 10/300 GL Increase a 215 nm (Tablas 1 y 2).
Los cromatogramas evidencian como la señal del DMSO experimenta una considerable disminución desde el primer lavado con agua, condición que mantiene la muestra en el resto de los lavados realizados. La Tabla 2 muestra los resultados del % pureza del PRP purificado y la concentración de carbohidratos determinadas mediante el ensayo de orcinol.11
Tabla 2 Concentración de las muestras PRP2 y PRP3 iniciales y purificadas con 3 lavados determinadas mediante el ensayo de orcinol11 y % de pureza de la señal PRP según análisis en la columna YarraTM SEC 2000.
| Muestras | n | Volumen (mL) | TR (min) | Concentración PRP (mg/mL) | Pureza (%) |
|---|---|---|---|---|---|
| PRP2 | 0 | 1 | 12,51 | 30 | 63,34 |
| PRP2.1 | 1 | 12,51 | 19,2 | 100,00 | |
| PRP2.2 | 2 | 12,53 | 15,4 | 100,00 | |
| PRP2.3 | 3 | 12,50 | 10,1 | 99,68 | |
| PRP3 | 0 | 1 | 12,69 | 30 | 76,20 |
| PRP3.1 | 1 | 12,68 | 20,59 | 99,10 | |
| PRP3.2 | 2 | 12,56 | 14,69 | 99,87 | |
| PRP3.3 | 3 | 12,50 | 9,55 | 100,00 |
TR: tiempo de retención.
Como ambos aspectos, pureza y concentración, son fundamentales para obtener un producto con elevados rendimientos se decidió que un lavado es suficiente para obtener un PRP con una pureza por encima del 99% y una concentración próxima a los 30,0 mg/mL, como establece la reacción de conjugación a escala industrial. Teniendo en cuenta estos elementos el PRP se purificó por filtración con un lavado y se realizó la reacción de conjugación al toxoide tetánico.
Conjugación del PRP al toxoide tetánico
La reacción de conjugación se realizó con el PRP3 y el PRP3.1 y la Figura 4 muestra el perfil de elución obtenido en la columna YarraTM SEC 2000 a 215 nm para muestras tomadas de los conjugados PRP3-TT, PRP3.1-TT y del IFA 19002 (control) y de los reaccionantes PRP3 y anatoxina tetánica modificada.

Fig. 4 Perfil de elución de los conjugados PRP3-TT y PRP3.1-TT y del IFA 19002 (control y los precursores PRP3 y la anatoxina tetánica modificada. en la columna YarraTM SEC 2000 a 215 nm.
En el cromatograma se observan perfiles de elución muy semejantes entre los conjugados PRP3-TT y PRP3.1-TT y de estos a su vez con el IFA 19002 control, indicativo de que se logró reproducir a escala de laboratorio el proceso industrial. En este caso predomina una sola población correspondiente al conjugado que se filtró por una membrana de corte de 30.000 Da donde se elimina el PRP libre y otras impurezas. El tiempo de retención promedio fue de 6,10 min ± 0,003, el cual disminuye en comparación al obtenido para el PRP de partida, producto de la unión covalente al TT con un valor de peso molecular reportado de 150.000 Da.
El rendimiento promedio de la reacción de conjugación con el PRP3 fue de 33,7% ± 3,57 y con el PRP3 purificado (PRP3.1) fue de 30,0% ± 1,77. La comparación de estos resultados mediante el ANOVA mostró que no existen diferencias significativas entre ellos ni con el valor reportado por el Laboratorio de Control de la Calidad (34,2%) para el conjugado obtenido a escala productiva, con un nivel de confianza de 95% (p≥0,05).
Los resultados evidencian que la presencia del DMSO en el PRP no afecta el desempeño de la reacción de conjugación al toxoide tetánico en el proceso obtención del IFA de la vacuna Quimi-Hib®. Es decir, que la concentración a la que se encuentra el DMSO en la muestra no es suficiente para promover la formación de enlaces disulfuros en la proteína.
Conclusiones
La caracterización del PRP obtenido por síntesis química a escala industrial mediante cromatografía de exclusión molecular de alta eficacia con detección ultravioleta, permitió determinar que el PRP presenta un máximo de absorción a 215 nm, con un porciento de pureza de 77,42 ± 8,97 y una masa molar promedio de 7,381 Da ± 210,93 la cual es coherente con el tamaño esperado entre 1.000 - 10.000 Da. El análisis del perfil de elución evidenció que la principal impureza presente en la composición del PRP es el DMSO. La purificación del PRP hasta un 99,1% y posterior conjugación al TT demostró que el DMSO presente no afecta el desempeño de la reacción de conjugación.















