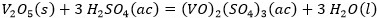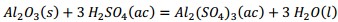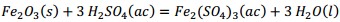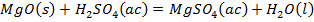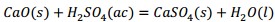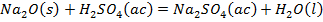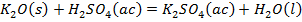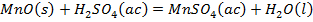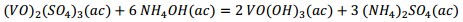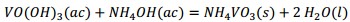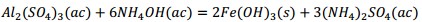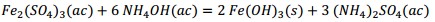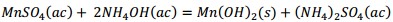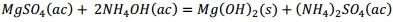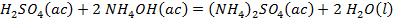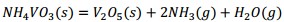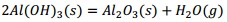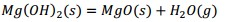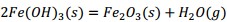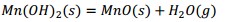INTRODUCCIÓN
El vanadio no suele formar minerales independientes, sino que está oculto en la estructura de otros minerales. Se reporta su presencia en 65 minerales, las menas con 1 % se consideran económicamente explotables (Rösler 1991). Está presente en varios minerales, como la vanadinita Pb5(VO4)3Cl, carnotita K2(UO)2(VO4)2.3H2O, y la patronita VS4, entre otros (Manaa 2018; Housecroft y Sharpe 2005). También se reporta en residuos sólidos como: cenizas volantes, catalizadores gastados proveniente de procesos tales como hidrodesulfuración, craqueo catalítico fluidizado, hidrotratamiento y producción de ácido sulfúrico; además, se encuentra en escorias silicáticas del acero, bauxitas, piedras de carbón, escorias ferrofosforosas, entre otras (Hernández 2017; U. S. Geological Survey 2018).
El vanadio, tanto en forma de óxido como de metal, es muy importante, con muchas aplicaciones industriales en la fabricación de aleaciones especiales, en la industria aeroespacial, en cerámica y vidrio y en catalizadores en la industria química (Manaa 2018).
Alrededor del 5 % de la producción anual de vanadio es para catálisis, usado fundamentalmente en la manufactura de importantes productos químicos, entre ellos ácido sulfúrico y anhídrido ftálico (Curia 2010). Los catalizadores de vanadio pueden contener hasta un 10 % de pentóxido de vanadio (Marinov y Paunova 2003; Gaballah et al. 1995), contenido superior a los valores presentes en muchos de los minerales portadores de este elemento.
Para la producción de ácido sulfúrico, por el método de contacto, se emplean catalizadores con un contenido de pentóxido de vanadio superior al 4 %, los cuales, una vez agotados totalmente, no pueden ser vertidos al medio ambiente por ser considerados desechos peligrosos según el Convenio de Basilea sobre el control de los movimientos transfronterizos de los desechos peligrosos y su eliminación (Moglia 1989) y la Ley N° 81 del Medio Ambiente (1997).
Estas leyes obligan a almacenar estos residuos por tiempo indefinido. Alonso y otros investigadores (2008) plantean que los sitios de disposición final de residuos sólidos deben cumplir con el criterio de ser lugares sin riesgo para la flora y la fauna, por lo que esta opción está resultando costosa hoy en día, estimándose en unos doscientos dólares/tonelada.
Resulta entonces importante evaluar métodos que permitan recuperar el vanadio presente en los catalizadores, de modo que estos no constituyan un riesgo al medio ambiente y que el producto recuperado pueda ser usado para otros fines. Entre los métodos más usados para la recuperación de este elemento se encuentran los métodos pirometalúrgicos, los cuales utilizan calor y los hidrometalúrgicos, en los que se emplean soluciones líquidas para la extracción y recuperación de los elementos metálicos, donde la lixiviación desempeña un papel fundamental.
De aquí que la recuperación de los elementos metálicos, fundamentalmente el vanadio contenido en los catalizadores agotados de la producción de ácido sulfúrico, constituye el objetivo principal de este trabajo.
MATERIALES Y MÉTODOS
Materias primas y equipamiento
La muestra de catalizador agotado proviene de la planta productora de níquel Pedro Soto Alba de Moa, donde se utiliza para la producción de ácido sulfúrico por el método de contacto, cuya composición química se muestra en la Tabla 1 (Perdomo et al. 2016; Perdomo et al. 2018).
Tabla 1 Composición química (% en masa) del catalizador agotado
| Componente | Contenido (%-m) |
|---|---|
| SiO2 | 43,58 |
| Al2O3 | 1,72 |
| Fe2O3 | 1,37 |
| MgO | 0,18 |
| CaO | 0,81 |
| Na2O | 1,75 |
| K2O | 6,83 |
| H2O | 28,73 |
| S | 9,28 |
| V2O5 | 5,6 |
| MnO | 0,15 |
Como medio disolvente lixiviante se utilizó ácido sulfúrico al 98 % (calidad técnica), a partir del cual se preparó la disolución de ácido sulfúrico al 15 % v/v y tanto para la neutralización de la disolución como para la precipitación de los óxidos hidratados se usó solución amoniacal al 25 %.
Se utilizó una balanza marca Kern, con límite de pesada de 320 g y precisión de 0,001 g, estufa Boxun para el secado, mufla marca Nabertherm, recubierta de ladrillo refractario capaz de alcanzar 1 400 °C, para la calcinación de la muestra; y zaranda vibratoria marca GFL 3016 regulada 90 oscilaciones/min aproximadamente), para mantener la agitación de la muestra de catalizador durante la lixiviación.
Tratamiento de las muestras
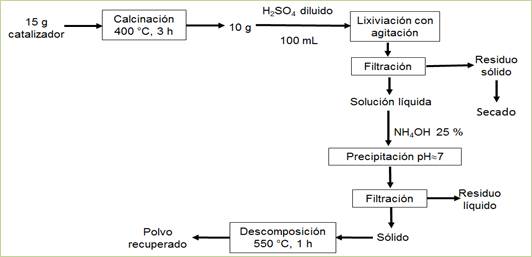
Las muestras de catalizador agotado fueron trituradas hasta un diámetro de partícula por debajo de 0,1 mm, posteriormente fueron calcinadas a 400 °C durante tres horas en la mufla para eliminar el azufre en forma de SO2 y el agua contenidos en el residual. Con las masas de cada muestra, antes y después de la calcinación, se precisó el porcentaje de pérdida de estos compuestos. La secuencia completa de trabajo seguida en el tratamiento del catalizador agotado se muestra en la Figura 1.
Los elementos químicos Mn, Cu, Co, Ca, Fe, Ni y Cr en el catalizador, el sólido recuperado y el residuo generado de la lixiviación fueron determinados mediante espectroscopia de absorción atómica en un equipo marca Pye Unicam. El vanadio se precisó mediante espectroscopia ultravioleta visible, empleando un espectrofotómetro Ultravioleta Visible marca Génesis 6, con la aplicación Visionlite versión 2.1.
El catalizador agotado y el producto recuperado fueron analizados en la Fábrica de Cemento Carlos Marx de Cienfuegos, mediante fluorescencia de rayos X (FRX) en un equipo Axios XRF spectrometer con ánodo de Rh Kα=0,614796 Å y cristal analizador LiF 220, d=1,424 Å, el cual permitió realizar análisis cualitativo y semicuantitativo.
ANÁLISIS Y DISCUSIÓN DE RESULTADOS
Potencialidades del catalizador
De la Tabla 1 se puede apreciar que el SiO2 es el componente predominante en la composición del catalizador agotado, representando el 43,58 % del contenido total; el agua ocupa el segundo lugar con 28,73 %, mientras que el pentóxido de vanadio representa el 5,6 % y el azufre el 9,28 % (Perdomo et al. 2016). Por tanto, al calcinar la muestra a 400 °C, durante tres horas, se debe perder agua y azufre en forma de SO2, lo que permite deducir que, producto del calentamiento, se eliminaría el 38 % aproximadamente de la masa de catalizador agotado.
Como resultado de este tratamiento la concentración de los elementos presentes en el catalizador debe incrementarse de manera proporcional a los elementos eliminados. En la Tabla 2 se muestra la composición estimada para el catalizador tratado térmicamente a 400 °C.
Tabla 2 Composición teórica del catalizador calcinado
| Componente | Contenido (%-m) |
|---|---|
| SiO2 | 70,30 |
| Al2O3 | 2,78 |
| Fe2O3 | 2,21 |
| MgO | 0,29 |
| CaO | 1,31 |
| Na2O | 2,82 |
| K2O | 11,02 |
| V2O5 | 9,03 |
| MnO | 0,24 |
| Total | 100 |
Como se observa en la Tabla 2 el contenido de pentóxido de vanadio representa el 9,03 % de la muestra de catalizador agotado luego de la calcinación. Si el catalizador tratado térmicamente se somete a un proceso de lixiviación, con disolución de ácido sulfúrico, potencialmente deben ocurrir las reacciones químicas (1), (2), (3), (4), (5), (6), (7), (8):
Producto de estas reacciones, los compuestos lixiviables con ácido sulfúrico presentes en el catalizador deben pasar a la disolución, la cual se trata con solución de amoníaco al 25 % para precipitar los óxidos hidratados presentes en la solución lixiviada, debiendo ocurrir las reacciones químicas (9), (10), (11), (12), (13), (14):
El ácido sulfúrico en exceso se consume mediante la ecuación (15).
El precipitado es filtrado y finalmente calcinado a 500 °C, donde el metavanadato de amonio se descompone obteniéndose el pentóxido de vanadio, según la ecuación (16) y los óxidos metálicos hidratados se descomponen formando los óxidos correspondientes Al2O3, MgO, Fe2O3 y MnO, mediante las ecuaciones (17), (18), (19) y (20), debiéndose obtener una mezcla de óxidos metálicos en el sólido recuperado.
Sobre la base de la composición química del catalizador calcinado a 400 °C (Tabla 2) y las reacciones químicas que deben ocurrir durante el procesamiento, mostradas anteriormente, se realizó un balance de masa (Tabla 3) a partir del cual se determina teóricamente la cantidad y composición química de cada uno de los productos generados durante el procesamiento del catalizador. Los resultados se muestran en la Tabla 4.
Tabla 3 Balance de masa (g) del proceso
| Compuesto | Entrada | Generación | Consumo | Salida |
|---|---|---|---|---|
| SiO2 | 7,030 | 0,000 | 0,000 | 7,030 |
| Al2O3 | 0,277 | 0,000 | 0,277 | 0,000 |
| Fe2O3 | 0,221 | 0,221 | 0,221 | 0,221 |
| MgO | 0,029 | 0,029 | 0,029 | 0,029 |
| CaO | 0,131 | 0,000 | 0,131 | 0,000 |
| Na2O | 0,282 | 0,000 | 0,282 | 0,000 |
| K2O | 1,102 | 0,000 | 1,102 | 0,000 |
| V2O5 | 0,903 | 0,903 | 0,903 | 0,903 |
| MnO | 0,024 | 0,024 | 0,024 | 0,024 |
| H2SO4 | 16,500 | 0,000 | 16,500 | 0,000 |
| H2O | 85,000 | 5,905 | 0,000 | 90,905 |
| Al2(SO4)3 | 0,000 | 0,930 | 0,930 | 0,000 |
| K2SO4 | 0,000 | 2,039 | 0,000 | 2,039 |
| Fe2(SO4)3 | 0,000 | 0,553 | 0,553 | 0,000 |
| MgSO4 | 0,000 | 0,087 | 0,087 | 0,000 |
| CaSO4 | 0,000 | 0,317 | 0,000 | 0,317 |
| Na2SO4 | 0,000 | 0,647 | 0,000 | 0,647 |
| (VO)2(SO4)3 | 0,000 | 2,095 | 2,095 | 0,000 |
| MnSO4 | 0,000 | 0,051 | 0,051 | 0,000 |
| Mg(OH)2 | 0,000 | 0,042 | 0,042 | 0,000 |
| Fe(OH)3 | 0,000 | 0,296 | 0,296 | 0,000 |
| VO(OH)3 | 0,000 | 1,171 | 1,171 | 0,000 |
| NH4VO3 | 0,000 | 1,161 | 1,161 | 0,000 |
| Mn(OH)2 | 0,000 | 0,030 | 0,030 | 0,000 |
| NH4OH | 10,831 | 0,000 | 10,831 | 0,000 |
| (NH4)2SO4 | 0,000 | 19,768 | 0,000 | 19,768 |
| NH3 | 0,000 | 0,169 | 0,000 | 0,169 |
| Al(OH)3 | 0,000 | 0,424 | 0,424 | 0,000 |
| Al2O3 | 0,000 | 0,277 | 0,000 | 0,277 |
| Total | 122,331 | 37,142 | 37,142 | 122,331 |
Tabla 4 Resultados teóricos del procesamiento del catalizador
| Producto recuperado | Masa (g) | %-m | Líquido residual | Masa (g) | %-m |
|---|---|---|---|---|---|
| V2O5 | 0,903 | 62,08 | H2O | 90,722 | 80,160 |
| Al2O3 | 0,277 | 19,07 | K2SO4 | 2,039 | 1,802 |
| Fe2O3 | 0,221 | 15,19 | Na2SO4 | 0,647 | 0,571 |
| MnO | 0,024 | 1,66 | NH4)2SO4 | 19,768 | 17,467 |
| MgO | 0,029 | 2,00 | Total | 113,176 | 100 |
| Total | 1,455 | 100 | Residuo sólido | Masa (g) | %-m |
| Gases | Masa (g) | %-m | SiO2 | 7,030 | 95,681 |
| NH3 | 0,169 | 47,96 | CaSO4 | 0,317 | 4,319 |
| H2O | 0,183 | 52,04 | Total | 7,347 | 100 |
| Total | 0,352 | 100 |
En la Tabla 4 se observa que el proceso, potencialmente, permite obtener:
1,455 g de producto sólido recuperado constituido por 62 % de V2O5 (Tabla 4), el cual pudiera ser utilizado en la industria, sobre todo si se tiene en cuenta que el 79 % del producto recuperado debe estar formado por los óxidos de vanadio, hierro y manganeso, metales de amplio uso industrial.
7,35 g de residual sólido no contaminante formado por más del 95 % por dióxido de silicio y alrededor del 4 % de sulfato de calcio factible de usar en la industria cementera.
113,2 g de solución líquida residual no contaminante, la cual constituye el 92,5 % de los productos generados, formado por 80 % de agua, 17,4 % de sulfato de amonio y 2,3 % por los sulfatos de potasio y sodio; de posible uso como fertilizante después de su total caracterización.
Se desprenden 0,35 g de gases durante la calcinación del metavandato de amonio obtenido, formado fundamentalmente por NH3 y agua (48 % y 52 %, respectivamente).
Procesamiento de los residuales catalíticos
En la Tabla 5 aparecen los resultados de varias muestras de catalizador, calcinadas a 400 ºC durante tres horas, de acuerdo con la secuencia mostrada en la Figura 1.
Tabla 5 Resultados de la pérdida de masa del catalizador durante la calcinación a 400 °C
Como resultado del proceso de calcinación, el catalizador pierde como promedio 17,81 % de su masa (s=1,04), valor inferior al calculado teóricamente a partir de los datos de composición química; no obstante, se logra un enriquecimiento de este previo a su procesamiento.
A las muestras previamente calcinadas se les realizó el proceso de lixiviación del catalizador con ácido sulfúrico al 15 % v/v, a temperatura ambiente y agitación constante durante una hora. Se observó un incremento gradual de la coloración de la solución lixiviante (Figura 2), lo cual debe estar relacionado con el traspaso de los elementos metálicos desde el residual sólido a la solución en forma iónica. Para ello deben ocurrir las reacciones desde la (1) hasta la (8), exceptuando la reacción (4), donde el CaSO4 debe precipitar como sólido (kps=6,8.10-8) y separarse, durante la filtración, de la solución junto a la sílice, formando el sólido residual. La Figura 2 muestra la coloración adquirida por la solución.
Precipitación y calcinación
Al adicionar solución amoniacal al 25 % al líquido lixiviado la primera va tomando coloración gris-verdosa y se observa la formación del precipitado (Figura 2, ecuaciones (2), (3) y (4)). Este debe estar constituido mayoritariamente por metavanadato de amonio (NH4VO3), de acuerdo con la ecuación (10), y contener los óxidos metálicos hidratados de aluminio, hierro, manganeso y magnesio (Al(OH)3, Fe(OH)3, Mn(OH)2 y Mg(OH)2); atendiendo, respectivamente, a las ecuaciones (11), (12), (13) y (14).
El precipitado se retira de la solución mediante filtración, separándose del papel de filtro y colocándose en un crisol para su calcinación a 500 °C, debiendo ocurrir la descomposición del metavanadato de amonio según la ecuación (15). Como resultado se obtiene un sólido muy fino de color naranja, parecido al color típico del pentóxido de vanadio, no obstante a que debe estar mezclado con los óxidos de aluminio, hierro, magnesio y manganeso, los que influyen en la coloración final del producto obtenido (Figura 3). Los resultados concluyentes del proceso se muestran en la Tabla 6.
Tabla 6 Masa original, recuperada y del residual generado (en g)
| No. | Masa muestra original | Masa recuperada | Residual sólido | |||
|---|---|---|---|---|---|---|
| 1 | 10,001 | 1,505 | --- | |||
| 2 | 10,015 | 1,346 | --- | |||
| 4 | 10,001 | 1,743 | 3,638 | |||
| 5 | 10,006 | 1,952 | 4,725 | |||
| 6 | 10,060 | 1,952 | 4,61 | |||
| 7 | 10,025 | 1,857 | 4,566 | |||
| 8 | 10,006 | 1,86 | 4,605 | |||
| 9 | 10,006 | 1,805 | 6,233 | |||
| 10 | 10,012 | 1,786 | 6,381 | |||
| 11 | 10,008 | 1,785 | 6,26 | |||
| 12 | 10,000 | 1,724 | 6,257 | x1,756 | 5,253 | |
| s | 0,183 | 1,028 | ||||
En la Tabla 6 se revela que se obtuvo un promedio de 1,76 g de producto recuperado, valor que supera en un 20 % al valor teórico establecido en el balance de masa, lo cual puede estar relacionado con el posible arrastre de otros compuestos químicos al producto obtenido. El producto recuperado representa alrededor del 17 % del residual calcinado (14,9 % del catalizador original).
También se obtienen 5,25 g de residuo sólido, para el 71,5 % con respecto al valor determinado en el balance de masa, lo cual se corresponde con lo observado para el sólido recuperado. El residuo sólido debe estar integrado básicamente por dióxido de silicio y sulfato de calcio. Este residual representa aproximadamente el 52,5 % del catalizador calcinado (44,6 % del residual original).
En general, se obtienen unos 7 g de productos sólidos, que representa aproximadamente el 70 % del residual tratado, lo cual puede deberse a que parte del residual o del producto recuperado permaneciera en el papel de filtro usado en las operaciones de filtración; aunque también es posible que quedaran elementos metálicos sin precipitar en el residual líquido, por lo que es necesario estudiar más a detalle las condiciones de lixiviación y precipitación.
Caracterización química
La Tabla 7 expone los resultados de las determinaciones de varios elementos químicos en el catalizador agotado, en el producto recuperado y en el residuo sólido generado.
Tabla 7 Concentración de metales determinada mediante espectroscopia de absorción atómica (%-m)
| Compuesto | Catalizador agotado | Muestra recuperada | Residual |
|---|---|---|---|
| CaO | 0,04 | 0,01 | 0,01 |
| Cr2O3 | 0,05 | 0,22 | 0,01 |
| MnO | 0,14 | 0,42 | (( 0,01 |
| Fe2O3 | 1,23 | 4,82 | 0,20 |
| CoO | ( 0,01 | 0,01 | (( 0,01 |
| NiO | 0,02 | 0,04 | (( 0,01 |
| CuO | 0,01 | 0,01 | (( 0,01 |
Se observa que el catalizador agotado contiene Cr, Ni, Cu y Co, además de los elementos reportados en la Tabla 1, lo cual está en correspondencia con el incremento de la cantidad sólido recuperado con relación al balance de masa. El contenido de Ca, Co, Ni y Cu presenta valores muy bajos (0,04 % o menos) en cada muestra analizada. En el caso del Cr2O3 el producto recuperado presenta mayor concentración que el catalizador original, verificándose que el Cr ha sido extraído; y el residual refleja muy bajo contenido de Cr. Comportamiento similar se observa con el Mn, donde el contenido de MnO en el producto recuperado es 0,42 %, valor inferior al determinado teóricamente en el balance de masa (1,33 %) y en el residuo el contenido de MnO es inferior a 0,01 %.
Entre los elementos analizados, el Fe es el que en mayor concentración aparece, donde el Fe2O3 constituye el 1,23 % del catalizador original y en el producto recuperado alcanza el 4,8 %, también inferior al calculado teóricamente en el balance de masa (10,6 %), lo que representa en el residuo el 0,2 %. Igual comportamiento se observó para el Co, Ni y Cu.
De manera general, se puede observar una mayor concentración de los elementos metálicos analizados en el producto recuperado mediante la lixiviación y una menor concentración de ellos en el residuo sólido obtenido (Tabla 7), lo que evidencia la eficiencia del proceso hidrometalúrgico como alternativa de recuperar los elementos químicos presentes en el residual y la conversión del residuo industrial en un producto no contaminante, el cual debe ser estudiado más a detalle para darle un posible uso industrial, sobre todo si se tiene en cuenta su alto contenido de SiO2.
La determinación de vanadio en el producto recuperado mediante espectroscopia ultravioleta visible dio como resultado que la concentración de pentóxido de vanadio promedio en la muestra recuperada es de 24,8 %, valor que resulta inferior al obtenido teóricamente en el balance de masa (62,08 %), pero que indica que es factible recuperar el vanadio y otros elementos metálicos contaminantes presentes en los catalizadores agotados de la fabricación de ácido sulfúrico.
El análisis por FRX se le realizó a una muestra de catalizador agotado y a una del producto recuperado, incorporándose al estudio un patrón de cemento portland P-350, el cual se usó como referencia para el análisis.
La designación de las relaciones de área entre los picos para los diferentes elementos presentes en el catalizador agotado y en el producto recuperado permitió establecer la composición química aproximada del producto recuperado.
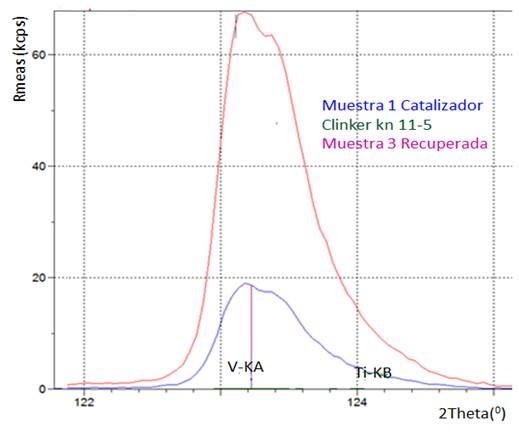
El resultado de las relaciones de área entre los picos para el vanadio contenido en el catalizador agotado y en el producto recuperado fue como promedio 5,1 por lo que el contenido de vanadio en el producto recuperado es de 28,6 % de V2O5. En la Figura 4 se muestra una sección del espectro de FRX donde aparece el vanadio.
Este mismo procedimiento para el aluminio dio una relación de 3,3; obteniéndose un contenido de aluminio, expresado en forma de Al2O3, de 9,15 %. En el caso del hierro se obtuvo una diferencia de áreas entre picos de 2,3, resultando el contenido de óxido de hierro III de 3,21 %. El contenido de SiO2 se consiguió a partir de los datos de un patrón de referencia del cemento portland P-350, lográndose un contenido de sílice de 1,41 %; valor muy inferior al del catalizador agotado (43,58 %).
Los resultados del análisis semicuantitativo por FRX se muestran en la Tabla 8. Además, en el espectro de FRX se observó que el producto recuperado contenía otros elementos metálicos: Pb, Zr, Sr, Cr y Ti.
Tabla 8 Composición química estimada del producto recuperado por FRX
| Compuesto | V2O5 | Al2O3 | Al2O3 | Fe2O3 | SiO2 |
| Contenido (%) | 28,6 | 9,15 | 9,15 | 3,21 | 1,41 |
Si se compara el resultado, en cuanto a contenido de V2O5, obtenido por FRX (28,6 %) con el establecido mediante espectroscopia ultravioleta visible (24,8 %) se puede afirmar que el resultado por ambos métodos se encuentra en los mismos rangos, lo que confirma la presencia de vanadio en el producto recuperado. Por otro lado, la determinación semicuantitativa y cualitativa del resto de los elementos metálicos reportados avala la eficacia del procesamiento hidrometalúrgico para la recuperación del vanadio junto a otros elementos metálicos presentes en los catalizadores agotados de la fabricación de ácido sulfúrico.
CONCLUSIONES
La calcinación de la muestra de catalizador agotado a 400 °C hasta peso constante y en condiciones normales de temperatura y presión constituye un paso estratégico a seguir, ya que elimina parte del agua zeolítica y del azufre presentes en el residual e incrementa proporcionalmente la concentración de todos los elementos en un 17,8 %.
La lixiviación con ácido sulfúrico al 15 % v/v, seguida de una precipitación con hidróxido de amonio al 25 % m/m y calcinación de los hidróxidos metálicos presentes, permite obtener 1,756 g de producto recuperado en forma de polvo, lo que representa el 14,9 % del residual; se genera así 5,25 g de residual sólido no contaminante que constituye el 44,6 % del residual original.
Los porcentajes de elementos químicos en el polvo recuperado obtenidos por las tres técnicas de determinación empleadas permiten afirmar que la estrategia de procesamiento hidrometalúrgico evaluada logra recuperar el vanadio y otros elementos metálicos presentes en el catalizador agotado, a la vez que se erige como una vía factible para el procesamiento del residual contaminante.