My SciELO
Services on Demand
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Cuban Journal of Agricultural Science
On-line version ISSN 2079-3480
Cuban J. Agric. Sci. vol.51 no.4 Mayabeque Oct.-Dec. 2017
Ciencia de los Pastos
Productividad de Zea mays L. en estrés de sequía, inoculado con Bradyrhizobium sp. y Trichoderma harzianum
1Instituto de Investigaciones de Pastos y Forrajes, Estación Experimental Sancti Spíritus, Apdo. 2255, ZP. 1, C. P. 62200, Sancti Spíritus, Cuba
2Universidad “José Martí Pérez”, Avenida de los Mártires No. 360. Sancti Spíritus, Cuba
3Centro Meteorológico Provincial de Sancti Spíritus, Calle Comandante Fajardo S/N, Olivos 2. Provincia y Municipio Sancti Spíritus, Cuba.
Se desarrolló un experimento de campo en condiciones de estrés de sequía agrícola para evaluar variables agroproductivas de Zea mays L., al cual se le aplicaron inóculos de Bradyrhizobium sp. y Trichoderma harzianum. La preparación de los inóculos y la inoculación de las plantas se realizaron según normas reconocidas. Se empleó un diseño experimental de bloques al azar con siete tratamientos: 1) Bradyrhizobium sp. (Ho13), al germinar la semilla; 2) Trichoderma, al germinar la semilla (Trichoderma); 3) Bradyrhizobium sp. + Trichoderma, al germinar la semilla (Ho13 + Trichoderma); 4) Bradyrhizobium sp, al germinar la semilla + Trichoderma a los15 d de la siembra (Ho13 + Trich.15 d); 5) Trichoderma, al germinar la semilla + Bradyrhizobium sp. a los15 d de la siembra (Trich.+Ho13.15d); 6) control absoluto y 7) testigo fertilizado con 150 kg N/ha y tres réplicas. Se realizó análisis de ANOVA. Las diferencias entre medias se determinaron por LSD de Fisher. Los valores con conteo de dígitos se transformaron por √x. y los datos porcentuales por 2arcosen√P. Se evaluó el peso seco de la parte aérea, el índice de eficiencia de la inoculación sobre la base del PSPA, la longitud del tallo, el peso seco de la mazorca, el rendimiento de grano, el índice de eficiencia de la inoculación sobre la base del rendimiento del grano y el peso de 1000 granos (P1000G). Se determinó el estado de la sequía agrícola. En el peso seco de la mazorca, los tratamientos inoculados al germinar la semilla con Trichoderma (120.30 g) y Ho13+Trichoderma (118.25 g), así como con Trichoderma al germinar la semilla+Ho13 a los 15 d de siembra (119.90 g) (Trich.+Ho1315d) fueron superiores al resto de los tratamientos. El rendimiento del grano en el tratamiento inoculado con Ho13 (1.49 t/ha) y en el tratamiento inoculado con Trich.+Ho13.15d. (1.58 t/ha) superaron al resto, excepto al testigo fertilizado. Se concluye que, en general, se incrementó la productividad del cultivo al ser inoculado con la aplicación simple de Bradyrhizobium sp. (Ho13) como combinada con Trichoderma harzianum. Las variables con mejor respuesta a los tratamientos inoculados fueron: peso seco de la mazorca, longitud del talo y rendimiento del grano. También se observó que el tratamiento fertilizado fue inferior a los tratamientos inoculados en peso seco de la masorca y peso de 1000 G. Los tratamientos con resultados superiores en las variables estudiadas fueron Ho13 y Trichoderma + Ho13.15 d., recomendados para aplicar en la práctica agrícola.
Palabras-clave: Bradyrhizobium; Trichoderma; sequía agrícola; maíz
En ocasiones, la productividad de los cultivos se afecta por diversos factores ambientales estresantes. Se conoce que el estrés hídrico, provocado por la sequía, limita el crecimiento y la productividad de los cultivos, especialmente en áreas áridas y semiáridas (Yang et al. 2008).
Ante cualquier estrés abiótico existe decrecimiento significativo en la fotosíntesis y, consecuentemente, reducción en la cantidad de metabolitos y energía. Es muy importante para las plantas usar esta reducida cantidad de recursos para maximizar su crecimiento y potencial reproductivo (Timmusk et al. 2014). Las rizobacterias pueden contribuir a que las plantas toleren mejor los efectos de la sequía. Entre las rizobacterias, los rizobios ocupan un lugar importante en la inducción de tolerancia a estrés en las plantas (Stiens et al. 2006).
El hongo filamentoso Trichoderma spp., es un antagonista eficaz contra fitopatógenos (Howell 1998). Otros estudios han indicado la inducción de mecanismos de defensa en las plantas por este hongo, así como su actividad promotora del crecimiento vegetal (Saber et al. 2009 y Shaban y El-Bramawy 2011). Existen antecedentes del efecto positivo de T. harzianum en trigo, al combinarse con rizobios (Bécquer et al. 2015) y en triticale en condiciones de sequía agrícola (Bécquer et al. 2016b).
El objetivo de este trabajo fue evaluar variables agroproductivas de Zea mays L., al que se le aplicaron inóculos de Bradyrhizobium sp. y Trichoderma harzianum en diferentes combinaciones y de forma simple, y así seleccionar las mejores opciones para su aplicación práctica.
Materiales y Métodos
Localización del experimento. El experimento se realizó de febrero a mayo de 2016, en una parcela experimental perteneciente a la Estación Experimental de Pastos y Forrajes de Sancti Spíritus, situada a 21º53´ 00´´ de latitud norte y a 79 º21´ 25´´ de longitud oeste, a 40 msnm.
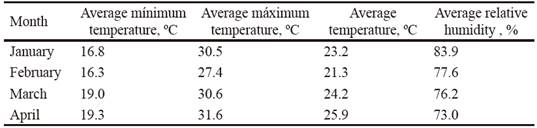
Clima y suelo. Los datos de temperatura, precipitaciones y humedad relativa se tomaron de la Estación Meteorológica Sancti Spíritus (CMP 2016). Las precipitaciones en la zona de estudio tuvieron comportamiento irregular (figura 1). Durante enero y abril fueron superiores a los valores históricos, mientras que febrero, marzo y mayo tuvieron valores muy inferiores. El período experimental se caracterizó por el predominio de altas temperaturas, sobre todo en abril. Existió alta humedad relativa en enero, pero relativamente baja en los meses restantes, especialmente en febrero, marzo y abril, lo que coincidió con la siembra y desarrollo del cultivo (tabla 1).
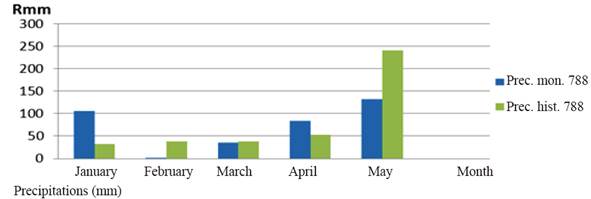
Figure 1 Distribution of precipitation by months and historical rainfall from January / 2016 to May / 2016
El suelo del área experimental correspondió al tipo pardo mullido carbonatado, de arcilla parda a pardo ligeramente oscuro, con reacción ligera al HCl. Presenta algunas gravas en el horizonte A1, drenaje superficial e interno bueno, medianamente erosionable (Hernández et al. 2015). El contenido de macronutrientes fue bajo en fósforo y potasio (2.63 mg/100 g de P2 O5 y 6.0 mg/100 g de K2 O), así como en materia orgánica (1.51 %). El pH fue ligeramente ácido (5.9).
Material vegetal. Se evaluó maíz (Zea mays L.), variedad TGH, procedente de la Empresa Provincial de Semillas de Sancti Spíritus. En la provincia, este cereal tiene antecedentes de altos rendimientos al inocularse con rizobios (Bécquer et al. 2011) y constituye, conjuntamente con las gramíneas pratenses, una de las alternativas posibles para la alimentación animal en Cuba.
Preparación del suelo, siembra, riego y control de plagas y enfermedades. Se realizaron labores convencionales de cultivo: roturación, grada, cruce, recruce, grada y surcado. La siembra del experimento se realizó en la segunda tercera decena de enero y se cosechó en la tercera decena de abril. La dosis de siembra fue de 12 kg/ha, a chorrillo espaciado. El marco de siembra fue de 70 cm entre surcos. Cada parcela midió 2.10 m x 4 m, con tres surcos por parcelas. Las muestras se tomaron en el surco del medio (5 muestras/parcela/réplica) y se consideraron los surcos restantes como efecto de borde.
En el experimento, el riego se aplicó cuatro veces, dos veces durante febrero; una en marzo y otra en abril, a razón de 100 m3/ha en cada riego, de forma tal que solo favoreciera la supervivencia de los microorganismos rizosféricos introducidos. Esta frecuencia de riego solo constituye 30 % del número promedio de riego, así como 22.8 % del volumen total (1775.4 m3/ha) utilizado por Montero et al. (2012) en maíz. A los 95 d de siembra, se realizó la cosecha de forma manual.
Se realizaron cuatro aplicaciones de Bacillus thuringiensis biovar. 26, a partir de los 15 d de siembra, cada 7 d, a razón de 6 L/ha. El biopreparado se aplicó con un aspersor, cuyo surtidor fue dirigido a todas las partes de la planta, con énfasis en la parte foliar, en una dilución con agua de 1:15 hasta llegar a 16 L de volumen total con un título inicial de 109 esporas/mL (Registro Central de Plaguicidas 2008).
Microorganismos. Se aplicó la cepa Ho13, perteneciente al género Bradyrhizobium sp. (Bécquer et al. 2016a) microsimbionte de Centrosema virginianum, leguminosa procedente de un ecosistema ganadero árido de Holguín, Cuba. Se utilizó también el producto TRICHOSAVE 34 (LABIOFAM S.A.), compuesto por un sustrato de cáscara y cabecilla de arroz, inoculado con micelios esporulados de Trichoderma harzianum A-34.
Preparación de los inóculos de Bradyrhizobium. Las cepas crecieron en medio sólido levadura-manitol (Vincent 1970) y se resuspendieron en medio liquido hasta lograr concentración celular de 106-108 UFC/ mL. Para la inoculación de las plantas, se procedió a diluir el inóculo en proporción 1:10 en solución salina 0.9 %.
Preparación de los inóculos de Trichoderma. El producto antes mencionado, por recomendación técnica del fabricante, se añadió a agua corriente, a razón de 35 g/L. Se filtró con gasa antes de inocular las plantas (1-2x109 conidios/g) y posteriormente. Las suspensiones conidiales se inocularon a las plantas de acuerdo con el tratamiento utilizado, de forma simple, o en combinación con los inóculos bacterianos. El título final de la suspensión (106-108 conidios/mL) se utilizó de acuerdo con lo planteado por Wolffhechel y Funck-Jensen (1992).
Inoculación de las plantas con Bradyrhizobium. La inoculación se realizó al germinar la semilla (6 d), para lo cual se utilizó una bureta graduada, cuyo contenido se vertió sobre las plantas recién germinadas, de forma que al regular el surtidor cada planta recibió aproximadamente 8-10 mL del inóculo líquido. La reinoculación de los tratamientos se efectuó a los 15 d de siembra.
Inoculación de las plantas con Trichoderma. La inoculación se realizó al germinar la semilla (6 d), con una dosis equivalente a 250 L/ha de dicha solución. Se utilizó el mismo procedimiento que para el inóculo de Bradyrhizobium. La reinoculación de los tratamientos se efectuó a los 15 d de siembra.
Inoculación fraccionada. Se realizó de acuerdo con el tratamiento, a los 15 d de aplicado el inóculo inicial del microorganismo.
Determinación del estado de sequía agrícola. Se realizó mediante el índice de aridez o índice de sequía agrícola (IE), según Solano y Vázquez (1999). Este se utilizó para comprobar si el experimento se efectuaba en condiciones de estrés hídrico:
donde:
E o ETR |
- Evapotranspiración real estimada, dependiente del estado de humedad del suelo. |
Eo o ETP |
- Evapotranspiración potencial estimada, dependiente de las condiciones atmosféricas. |
Cuando ETR=ETP, el aprovisionamiento de agua del suelo es adecuado. Cuando ETR<ETP hay insuficiencia de agua.
Se observó que las mayores pérdidas de humedad del suelo ocurrieron en febrero y abril (tabla 2), momento en que se realizó la cosecha. El estado de la sequía agrícola, en enero, marzo y abril con un IE de regular a insuficiente. En febrero alcanzó la categoría de insuficiente a crítico (tabla 2). Se considera, por lo tanto, que el cultivo estuvo sometido a un alto estrés hídrico (CMP 2016).
Table 2 Humidity content in the soil and estimated values of PET and AET (2016)
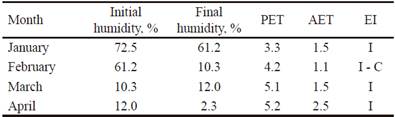
I: Insufficient I-C: Insufficient to Critical R: Regular
Tratamientos, diseño experimental y análisis estadístico. La tabla 3 presenta los tratamientos utilizados en el experimento.
Se empleó un diseño experimental de bloques al azar, con siete tratamientos y tres réplicas. Se realizó análisis de ANOVA. Las diferencias entre medias se determinaron por LSD de Fisher (Fisher 1935). Los valores con conteo de dígitos se transformaron por √x y los datos porcentuales por 2arcosen√P (Ruesga et al. 2005). Se utilizó el programa estadístico StatGraphics Centurion (Stat Point Technologies 2010).
Variables evaluadas. Se tomaron al momento de la cosecha por réplica y tratamiento. Se determinó peso seco de la parte aérea (follaje sin mazorcas, PSPA, g/m2); longitud del tallo (LT, m); número de hojas/ planta (NH); rendimiento de grano (RG, kg/ha, extrapolado); longitud de la mazorca (LM, cm); peso seco de la mazorca (PSM, g); peso de 1000 granos (P1000G., g) e índice de eficiencia de la inoculación (IEI, %) según Santillana et al. (2012):
Resultados y Discusión
Longitud del tallo (m). La tabla 4 muestra que el tratamiento Ho13+Trichoderma (2.03 m) presentó valores superiores (P < 0.05) en comparación con el control absoluto (1.84 m) y testigo fertilizado (1.83 m), mientras que compartió superíndices comunes con el resto de los tratamientos. Según Mia y Shamsuddin (2010), la síntesis de auxinas por los rizobios ha sido ampliamente demostrada, por lo que no se descarta que en la cepa Ho13 existiera fuerte actividad de estas enzimas. Es posible que la cepa de Bradyrhizobium, que se aplicó en diferentes variantes, influyera positivamente en esta variable por la emisión de dichas sustancias estimuladoras del crecimiento vegetal, aunque Pecina-Quintero et al. (2005) consideraron que la respuesta de la planta a la inoculación depende de factores diversos, entre los que se encuentra el genotipo de la planta. No se obvia el desempeño de Trichoderma, ya que autores diversos (Tsavkelova et al. 2006) demostraron que moléculas similares a citoquinina (sustancia que estimula la división celular en las plantas), posiblemente, quinetina, pueden ser producidas por T. viride. Según Stewart y Hill (2014), T. harzianum induce la promoción del crecimiento en muchas especies comerciales de plantas.
Table 4 Results obtained in stem length (SL), number of leaves NL/plant), dry weight of the aerial part (DWAP) and inoculation efficiency index based on the DWAP (IEIDWAP)
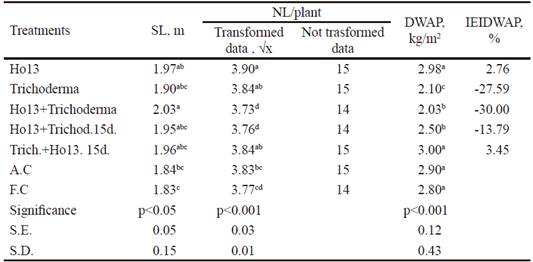
abcdDifferent letters per columndiffera at P<0.001 (Duncan 1955)
Número de hojas/planta. El tratamiento inoculado con la cepa Ho13 (3.90) mostró superíndices comunes en Trichoderma y Trich.+Ho13.15d. (3.84, respectivamente) en el número de hojas/planta, pero resultó superior (P < 0.001) al resto de los tratamientos (tabla 4). Cho et al. (2008) y Yang et al. (2008) consideraron que la respuesta de las plantas al estrés hídrico incluye incremento en el ácido abscísico (ABA), que causa el cierre de los estomas para minimizar la pérdida de agua. Debido a que el cultivo se sometió a ese tipo de estrés, se deduce que Bradyrhizobium, al estar en el grupo de rizobacterias con propiedades de inducción de tolerancia sistémica al estrés ambiental, produjo citoquininas que contrarrestaron el efecto negativo del ácido absícico en las hojas. Se conoce que la colonización que realiza Trichoderma también mejora, frecuentemente, el crecimiento de las raíces e influye en la productividad del cultivo, así como en la resistencia al estrés abiótico y a la toma y uso de los nutrientes del suelo (Saba et al. 2012).
Peso seco parte aérea (kg/m2). Para esta variable (tabla 4), los tratamientos inoculados fueron inferiores o compartieron superíndices comunes con el control absoluto (2.90 kg/m2) y testigo fertilizado (2.80 kg/m2). El control absoluto y el testigo fertilizado compartieron superíndices comunes con dos de los tratamientos inoculados y fueron superiores al resto, lo que sugiere que no hubo efecto probado de los tratamientos inoculados en dicha variable. Además hubo deficiente absorción de nitrógeno mineral por parte de la planta en el testigo fertilizado, quizás provocado por la falta de humedad necesaria para dicho proceso, derivada del estrés de sequía al que se sometió el cultivo experimental. Los valores de humedad en el período experimental debieron implicar incremento de la evapotranspiración de las plantas, lo que hace crecer la demanda de agua y por consiguiente, genera mayor estrés hídrico en los cultivos (CMP 2016). Nisha et al. (2007) comentaron que las regiones áridas y semiáridas, así como los desiertos, tienen propiedades físicas en el suelo que resultan muy pobres, además de baja fertilidad y deficiencia de agua.
Índice de eficiencia de la inoculación sobre la base del peso seco aéreo (%). Aunque en la variable que se discutió anteriormente, los valores de los tratamientos Trich.+Ho1315d. y Ho13 igualaron estadísticamente a los del control absoluto, el índice de eficiencia de la inoculación (tabla 4) mostró moderado incremento de estos valores (2.76 y 3.45 %, respectivamente) en comparación con el control absoluto. No obstante, estos porcentajes son inferiores a los que obtuvieron Antoun y Prévost (2000) con cepas comerciales de Bradyrhizobium japonicum, con incrementos en el PSA de la planta desde 6.7 % hasta 8.7. Contradictoriamente, Cassán et al. (2009) informaron sobre una cepa de Bradyrhizobium japonicum que estimuló la germinación y el desarrollo incipiente de la parte aérea de maíz. Esta cepa produjo abundante ácido indolacético, zeatina y ácido giberélico. Se infiere que la cepa de Bradyrhizobium utilizada en este experimento no ejerció el efecto necesario en la parte aérea de la planta, quizás por la insuficiente producción de dichas hormonas, pues se observó incremento negativo de los tratamientos con respecto al control absoluto.
Longitud de la mazorca (cm). En esta variable (tabla 5), los tratamientos inoculados con Ho13+Trich.15d. (20.38 cm) y Trich.+Ho1315d. (20.67 cm) mostraron superíndices superiores (P<0.001) al control absoluto (18.15 cm) y al testigo fertilizado (18.14 cm), así como al resto, excepto Ho13 (19.65 cm), con el que compartió superíndices comunes.
Table 5 Results obtained in corncob length, dry weight of the corncob, grain yield, inoculation efficiency index based on GY and weight of 1000 grains
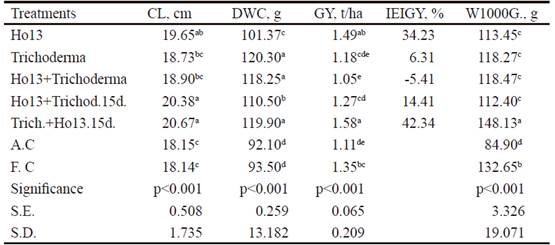
abcdDifferent letters per columndiffera at P<0.001 (Duncan 1955)
Es notable que estos tratamientos inoculados fueron superiores al testigo fertilizado, lo que se logró también en la longitud del tallo (tabla 4) con el tratamiento Ho13+Trichoderma. Diversos pueden ser los mecanismos mediante los cuales los rizobios pueden incidir positivamente en los cultivos. Ahmad et al. (2008) encontraron que 80 % de las bacterias fijadoras de dinitrógeno producen ácido indolacético. Esta sustancia de crecimiento conlleva al aumento de fenoles totales, contenido de calcio y actividad de la enzima polifenol oxidasa, que protege la planta contra patógenos y mejora su crecimiento mediante la eliminación de las especies reactivas del oxígeno que se forman en la planta a partir de un estrés hídrico (Chowdhury 2003).
Es obvio notar que la aplicación de Trichoderma en el momento de la siembra y a los 15 d conllevó a valores estadísticamente superiores, por lo que se infiere que este hongo ejerció efecto estimulador en esta variable. Según Gravel et al. (2006), T. atroviride puede producir y degradar ácido indolacético (AIA), la fitohormona auxínica más común en las plantas, además de poseer actividad de 1-aminociclopropano-1- ácido carboxílico diaminasa, que puede controlar la producción de etileno en la planta bajo estrés hídrico.
Peso seco de la mazorca (g). Para esta variable, los tratamientos inoculados con Trichoderma (120.30 g), Ho13+Trichoderma (118.25 g) y Trich. +Ho1315d. (119.90 g) fueron estadísticamente superiores (P< 0.001) al control absoluto (92.10 g) y al resto de los tratamientos (tabla 5).
Bécquer et al. (2011) obtuvieron resultados promisorios en esta variable, al inocular maíz en un experimento de campo con cepas de Bradyrhizobium sp., aisladas en ecosistemas ganaderos estresantes de Sancti Spíritus, Cuba. La aplicación simple de Trichoderma favoreció esta variable, lo que puede estar vinculado a que la producción de ácidos orgánicos por parte de Trichoderma favorece la solubilización de fosfatos, micronutrientes y cationes minerales, como hierro, manganeso y magnesio, por lo que la planta los absorbe mejor (Harman et al. (2004).
La combinación de la cepa de Bradyrhizobium sp. con Trichoderma influyó positivamente en la variable que se describe. Si se tiene en cuenta el estrés hídrico al cual se sometió el experimento, es completamente lógico inferir que la cepa de Trichoderma, aplicada, sobre todo, en sinergia con Bradyrhizobium, ejerció efecto positivo en las plantas sobre la base de estos fundamentos bioquímicos.
Rendimiento de grano (t/ha). Esta variable (tabla 5) mostró que el tratamiento inoculado con Ho13 (1.49 t/ ha) y el tratamiento inoculado con la combinación Trich.+Ho13. 15d. (1.58 t/ha) fueron superiores (P < 0.001) al resto, en los que se incluye el testigo fertilizado (1.35 t/ha).
En los tratamientos donde se aplicó, al mismo tiempo, la cepa de Bradyrhizobium y Trichoderma, así como Bradyrhizobium, de forma simple, mostraron resultados superiores, incluso con respecto al testigo fertilizado. Muchas rizobacterias contienen la enzima 1-aminociclopropano-1-ácido carboxílico (ACC) diaminasa, la cual escinde el precursor del ACC, el etileno, en α-cetobutirato y amonio. Por lo tanto, reduce los niveles de etileno en las plantas sometidas a estrés (van Loon 2007), lo que permite que el sistema radical pueda desarrollarse sin la inhibición propia de este compuesto. Esto propicia una mayor absorción de nutrientes por la planta.
Los resultados positivos del tratamiento con Trichoderma en el momento de la siembra y Bradyrhizobium sp. a los 15 d se pudiera deber al efecto celulolítico de Trichoderma en las raíces, lo que permitió la infección efectiva por parte de la bacteria.
Índice de eficiencia de la inoculación sobre la base del RG (IEIRG, %). En esta variable (tabla 5) se corroboraron los resultados en el rendimiento de grano, ya que los tratamientos Ho13 (34.23%) y Trich.+Ho13.15d. (42.34%) mostraron incrementos superiores al resto. Cardoso et al. (2007), informaron incrementos de 11% en el rendimiento de grano de maíz, al inocular con rizobios. Según Mia y Shamsuddin (2010), la inoculación con rizobios produjo incremento de 16 % en el rendimiento de grano en las diferentes variedades de arroz. La combinación Ho13+Trichoderma mostró resultados negativos, lo que indica nula influencia de dicho tratamiento en el rendimiento de grano. El hecho de que la combinación microbiana antes descrita no influyó positivamente en esta variable, a pesar de sus resultados superiores en longitud del tallo y peso seco de la mazorca, pudiera indicar que los metabolitos derivados de estos microrganismos en dicha combinación no intervinieron en el llenado de los granos. Salinas y Soriano (2014) observaron que la coinoculación de T. viride y Bradyrhizobium yuanmingense en Capsicum annuum no resultó en valores superiores para longitud de tallo, hoja, número de raíces laterales y peso seco de la parte aérea, y sí para longitud de raíz y peso seco de la parte radicular. Esto pudiera indicar cierta inconsistencia del efecto de las combinaciones microbianas en las plantas.
Peso de 1000 granos (P1000G). Se constató que el tratamiento inoculado con Trich.+Ho13.15d. (148,13 g) fue estadísticamente superior al resto (tabla 5). En esta variable también se observó que dicho tratamiento presentó resultados superiores, por lo que la calidad del grano tuvo también la influencia de los mecanismos descritos por Kumari et al. (2009) acerca de la absorción de nutrientes por la planta, debido a la acción estimuladora sobre la raíz por los PGPRs. Mehboob (2010), al aplicar cepas de Mesorhizobium ciceri en maíz en condiciones de invernadero, obtuvo valores estadísticamente superiores al control no inoculado. Es posible que la acción celulolítica de Trichoderma en las paredes del sistema radical, o su efecto biocontrolador, permitiera la supervivencia de Bradyrhizobium, así como su efecto estimulador en la planta.
Se concluye que, en general, se incrementó la productividad del cultivo al ser inoculado con la aplicación simple de Bradyrhizobium sp. (Ho13), como en combinación con Trichoderma harzianum. Las variables con mejor respuesta a los tratamientos inoculados fueron: peso seco de la mazorca, longitud de la mazorca y rendimiento de grano. El tratamiento fertilizado fue inferior a los tratamientos inoculados en las variables peso seco de la mazorca y peso de 1000 granos. Los tratamientos con resultados superiores en las variables estudiadas fueron Ho13 y Trich.+Ho13. 15 d., los que se recomiendan aplicar en la práctica agrícola en condiciones ambientales similares a las de este experimento.
References
Ahmad, F., Ahmad, I. & Khan, M. S. 2008. “Screening of free-living rhizospheric bacteria for their multiple plant growth promoting activities”. Microbiological Research, 163(2): 173-181, ISSN: 0944-5013, DOI: 10.1016/j.micres.2006.04.001. [ Links ]
Antoun, H. & Prévost, D. 2000. “PGPR activity of Rhizobium with nonleguminous plants”. In: V International PGPR workshop, Villa Carlos Paz, Córdoba, Argentina: International Crops Research Institute for the Semi-Arid Tropics (ICRISAT), p. 62, DOI: 10.13140/2.1.3093.7609, Available: Available: https://www.researchgate.net/publication/267041638_PGPR_ACTIVITY_OF_RHIZOBIUM_WITH_NONLEGUMINOUS_PLANTS , [Consulted: October 25, 2017]. [ Links ]
Bécquer, C. J., Galdo, Y., Ramos, Y., Peña, M. D., Almaguer, N., Peña, Y. F., Mirabal, A., Quintana, M. & Puentes, A. 2016a. “Rizobios aislados de leguminosas forrajeras de un ecosistema ganadero árido de Holguín, Cuba. Nodulación y evaluación morfocultural (fase I)”. Cuban Journal of Agricultural Science, 50(4): 607-617, ISSN: 2079-3480. [ Links ]
Bécquer, C. J., Lazarovits, G., Nielsen, L., Quintana, M., Adesina, M., Quigley, L., Lalin, I. & Ibbotson, C. 2015. “Efecto de la inoculación con bacterias rizosféricas y Trichoderma en trigo (Triticum aestivum L.)”. Pastos y Forrajes, 38(1): 29-37, ISSN: 0864-0394. [ Links ]
Bécquer, C. J., Puentes, A. B., Ávila, U., Quintana, M., Galdo, Y., Medinilla, F. & Mirabales, A. 2016b. “Efecto de la inoculación con Bradyrhizobium sp. y Trichoderma harzianum en triticale (X. Triticosecale Wittmack), en condiciones de estrés por sequía”. Pastos y Forrajes , 39(1): 19-26, ISSN: 0864-0394. [ Links ]
Bécquer, C. J., Salas, B., Ávila, U., Palmero, L., Nápoles, J. A., Ulloa, L., Suarez, Y. & Colina, O. L. 2011. “Selección de cepas de rizobios aisladas de ecosistemas ganaderos de Sancti Spíritus, Cuba; inoculadas en maíz (Zea mays L.). Fase II: Ensayo de campo”. Cuban Journal of Agricultural Science , 45(4): 445-449, ISSN: 2079-3480. [ Links ]
Cardoso, E. J. B. N., Nogueira, M. A. & Ferraz, S. M. G. 2007. “Biological N2 fixation and mineral N in common Bean-Maize intercropping or sole cropping in southeastern Brazil”. Experimental Agriculture, 43(3): 319-330, ISSN: 1469-4441, 0014-4797, DOI: 10.1017/S0014479707005029. [ Links ]
Cassán, F., Perrig, D., Sgroy, V., Masciarelli, O., Penna, C. & Luna, V. 2009. “Azospirillum brasilense Az39 and Bradyrhizobium japonicum E109, inoculated singly or in combination, promote seed germination and early seedling growth in corn (Zea mays L.) and soybean (Glycine max L.)”. European Journal of Soil Biology, 45(1): 28-35, ISSN: 1164-5563, DOI: 10.1016/j.ejsobi.2008.08.005. [ Links ]
Cho, S. M., Kang, B. R., Han, S. H., Anderson, A. J., Park, J.-Y., Lee, Y.-H., Cho, B. H., Yang, K.-Y., Ryu, C.-M. & Kim, Y. C. 2008. “2R,3R-butanediol, a bacterial volatile produced by Pseudomonas chlororaphis O6, is involved in induction of systemic tolerance to drought in Arabidopsis thaliana”. Molecular plant-microbe interactions: MPMI, 21(8): 1067-1075, ISSN: 0894-0282, DOI: 10.1094/ MPMI-21-8-1067. [ Links ]
Chowdhury, A. K. 2003. “Control of Sclerotium blight of groundnut by plant growth substances”. Crop Research (Hisar), 25(2): 355-359, ISSN: 0970-4884. [ Links ]
CMP (Centro Meteorológico Provincial) 2016. Resumen climático y estado de la sequía en la Estación Experimental de Pastos y Forrajes de Sancti Spíritus. Período enero 2016 - mayo 2016. Sancti Spíritus, Cuba: Instituto de Meteorología (INSMET), 15 p., Available: Available: http://www.cmpss.cu/ , [Consulted: October 25, 2017]. [ Links ]
Fisher, R. A. 1935. The design of experiments. call no. OCLC: 2417943, Edinburgh: Oliver and Boyd. [ Links ]
Gravel, V., Martinez, C., Antoun, H. & Tweddell, R. J. 2006. “Control of greenhouse tomato root rot (Pythium ultimum) in hydroponic systems, using plant-growth-promoting microorganisms”. Canadian Journal of Plant Pathology, 28(3): 475-483, ISSN: 0706-0661, DOI: 10.1080/07060660609507322. [ Links ]
Harman, G. E., Howell, C. R., Viterbo, A., Chet, I. & Lorito, M. 2004. “Trichoderma species--opportunistic, avirulent plant symbionts”. Nature Reviews. Microbiology, 2(1): 43-56, ISSN: 1740-1526, DOI: 10.1038/nrmicro797. [ Links ]
Hernández, J. A., Pérez, J. J. M., Bosch, I. D. & Castro, S. N. 2015. Clasificación de los suelos de Cuba 2015. Mayabeque, Cuba: Ediciones INCA, 93 p., ISBN: 978-959-7023-77-7. [ Links ]
Howell, C. R. 1998. “The role of antibiosis in biocontrol”. In: Harman, G. E. & Kubicek, C. P. (eds.), Trichoderma And Gliocladium: Enzymes, Biological Control and commercial applications, vol. 2, CRC Press, pp. 173-184, ISBN: 978-0-7484-0805-4, Available: https://www.crcpress.com/Trichoderma- And-Gliocladium-Volume-2-Enzymes-Biological-Control-and-commercial/Harman-Kubicek/p/ book/9780748408054 . [ Links ]
Kumari, B. S., Ram, M. R. & Mallaiah, K. V. 2009. “Studies on exopolysaccharide and indole acetic acid production by Rhizobium strains from Indigofera”. African Journal of Microbiology Research, 3(1): 10-14, ISSN: 1996-0808. [ Links ]
Mehboob, I. 2010. Plant growth promoting activities of rhizobium with non-legumes. Ph.D. Thesis, Institute of Soil and Environmental Sciences, University of Agriculture, Faisalabad, Pakistan, 211 p. [ Links ]
Mia, M. B. & Shamsuddin, Z. H. 2010. “Rhizobium as a crop enhancer and biofertilizer for increased cereal production”. African Journal of Biotechnology, 9(37): 6001-6009, ISSN: 1684-5315. [ Links ]
Montero, L., Cun, R., Pérez, J., Ricardo, M. P. & Herrera, J. 2012. “Riego con aguas residuales en la producción sostenible de granos para alimento animal”. Revista Ciencias Técnicas Agropecuarias, 21(2): 48-52, ISSN: 2071-0054. [ Links ]
Nisha, R., Kaushik, A. & Kaushik, C. P. 2007. “Effect of indigenous cyanobacterial application on structural stability and productivity of an organically poor semi-arid soil”. Geoderma, 138(1): 49-56, ISSN: 0016-7061, DOI: 10.1016/j.geoderma.2006.10.007. [ Links ]
Pecina-Quintero, V., Díaz-Franco, A., Williams-Alanís, H., Rosales-Robles, E. & Garza-Cano, I. 2005. “Influencia de fecha de siembra y de biofertilizantes en sorgo”. Revista Fitotecnia Mexicana, 28(4): 389-392, ISSN: 0187-7380. [ Links ]
Registro Central de Plaguicidas 2008. Lista oficial de plaguicidas autorizados 2008-2010. La Habana, Cuba, 421 p., Available: Available: https://es.scribd.com/doc/144559417/Lista-Oficial-Plaguicidas-Autorizados , [Consulted: October 25, 2017]. [ Links ]
Ruesga, G. I., Peña, E., Expósito, I. & Gardon, D. 2005. Libro de experimentación agrícola. La Habana, Cuba: Editorial Universitaria, 113 p., Google-Books-ID: nYxFnQAACAAJ, Available: Available: https://books.google.com.cu/books?id=nYxFnQAACAAJ , [Consulted: October 25, 2017]. [ Links ]
Saba, H., Vibhash, D., Manisha, M., Prashant, K. S., Farhan, H. & Tauseef, A. 2012. “Trichoderma-a promising plant growth stimulator and biocontrol agent”. Mycosphere, 3(4): 524-531, ISSN: 2077-7019, DOI: 10.5943/mycosphere/3/4/14. [ Links ]
Saber, W. I. A., El-Hai, K. M. A. & Ghoneem, K. M. 2009. “Synergistic effect of Trichoderma and Rhizobium on both biocontrol of chocolate spot disease and induction of nodulation, physiological activities and productivity of Vicia faba”. Research Journal of Microbiology, 4(8): 286-300, ISSN: 1816-4935. [ Links ]
Salinas, V. R. & Soriano, B. B. 2014. “Efecto de Trichoderma viride y Bradyrhizobium yuanmingense en el crecimiento de Capsicum annuum en condiciones de laboratorio”. Revista REBIOLEST, 2(2): 20-32. [ Links ]
Santillana, N., Zúñiga, D. & Arellano, C. 2012. “Capacidad promotora del crecimiento en cebada (Hordeum vulgare) y potencial antagónico de Rhizobium leguminosarum y Rhizobium etli”. Agrociencia Uruguay, 16(2): 11-17, ISSN: 2301-1548. [ Links ]
Shaban, W. I. & El-Bramawy, M. A. 2011. “Impact of dual inoculation with Rhizobium and Trichoderma on damping off, root rot diseases and plant growth parameters of some legumes field crop under greenhouse conditions”. International Research Journal of Agricultural Science and Soil Science, 1(3): 98-108, ISSN: 2251-0044. [ Links ]
Solano, O. & Vázquez, R. 1999. “Modelo Agrometeorológico de Evaluación de la Sequía Agrícola”. In: Congreso de Meteorología Tropical: Convención Trópico’99, La Habana, Cuba: Instituto de Geografía Tropical - Instituto de Meteorología (INSMET), Referencia MT026. [ Links ]
StatPoint Technologies 2010. Statgraphics Centurion. (ser. Centurion), version XVI, [Windows], Available: http://statgraphics-centurion.software.informer.com/download/ . [ Links ]
Stewart, A. & Hill, R. 2014. “Applications of Trichoderma in Plant Growth Promotion”. In: Biotechnology and Biology of Trichoderma, Amsterdam: Elsevier, pp. 415-428, ISBN: 978-0-444-59576-8, DOI: 10.1016/B978-0-444-59576-8.00031-X, Available: Available: https://www.sciencedirect.com/science/article/pii/B978044459576800031X , [Consulted: October 25, 2017]. [ Links ]
Stiens, M., Schneiker, S., Keller, M., Kuhn, S., Pühler, A. & Schlüter, A. 2006. “Sequence Analysis of the 144-Kilobase Accessory Plasmid pSmeSM11a, Isolated from a Dominant Sinorhizobium meliloti Strain Identified during a Long-Term Field Release Experiment”. Applied and Environmental Microbiology, 72(5): 3662-3672, ISSN: 0099-2240, DOI: 10.1128/AEM.72.5.3662-3672.2006. [ Links ]
Timmusk, S., Abd El-Daim, I. A., Copolovici, L., Tanilas, T., Kännaste, A., Behers, L., Nevo, E., Seisenbaeva, G., Stenström, E. & Niinemets, Ü. 2014. “Drought-Tolerance of Wheat Improved by Rhizosphere Bacteria from Harsh Environments: Enhanced Biomass Production and Reduced Emissions of Stress Volatiles”. PLoS ONE, 9(5): e96086, ISSN: 1932-6203, DOI: 10.1371/journal.pone.0096086. [ Links ]
Tsavkelova, E. A., Klimova, S. Y., Cherdyntseva, T. A. & Netrusov, A. I. 2006. “Microbial producers of plant growth stimulators and their practical use: A review”. Applied Biochemistry and Microbiology, 42(2): 117-126, ISSN: 0003-6838, 1608-3024, DOI: 10.1134/S0003683806020013. [ Links ]
van Loon, L. C. 2007. “Plant responses to plant growth-promoting rhizobacteria”. European Journal of Plant Pathology, 119(3): 243-254, ISSN: 0929-1873, 1573-8469, DOI: 10.1007/s10658-007-9165-1. [ Links ]
Vincent, J. M. 1970. A Manual for the Practical Study of Root-nodule Bacteria. (ser. International Biology Program Handbook, no. ser. 15), Oxford - Edinburgh: Blackwell Scientific Publ., 164 p., Google-Books- ID: dcQcAQAAIAAJ, DOI: 10.1002/jobm.19720120524, Available: Available: https://books.google.com.cu/books?id=dcQcAQAAIAAJ , [Consulted: October 25, 2017]. [ Links ]
Wolffhechel, H. & Funck-Jensen, D. 1992. “Use of Trichoderma harzianum and Gliocladium vitens for the Biological Control of Post-emergence Damping-off and Root Rot of Cucumbers Caused by Pythium ultimum”. Journal of Phytopathology, 136(3): 221-230, ISSN: 1439-0434, DOI: 10.1111/j.1439-0434.1992.tb01301.x. [ Links ]
Yang, J., Kloepper, J. W. & Ryu, C.-M. 2008. “Rhizosphere bacteria help plants tolerate abiotic stress”. Trends in Plant Science, 14(1): 1-4, ISSN: 1360-1385, DOI: 10.1016/j.tplants.2008.10.004. [ Links ]
Recibido: 21 de Junio de 2017; Aprobado: 05 de Marzo de 2018











 text in
text in