INTRODUCCIÓN
El cáncer gástrico ocupa el sexto lugar en incidencia y el tercero en mortalidad de todas las neoplasias en el mundo. Esto ocurre a pesar de los adelantos en los nuevos tratamientos médicos y de la cirugía, donde el 5,7 % de todos los nuevos cánceres diagnosticados son gástricos y donde el 8,2 % de las muertes por cáncer fueron originados en el estómago durante el 2018, con un riesgo acumulativo en la incidencia de 1.31 y de mortalidad de 0.95. 1
Entre un 1 y un 3 % de los pacientes presentan cáncer gástrico de origen genético y el 10 % tienen carácter familiar. 2 Estos datos hacen necesario modificar los factores de riesgo dependientes del paciente (oncogenómica, epigenética, proteoma, metabolómica) y del ambiente 3 con un manejo transdiciplinario, interdisciplinario y multidisciplinario donde se articulen los mejores conocimientos de esta enfermedad. Para lograrlo se necesita de la práctica de una medicina proactiva y traslacional que llegue a todos los ámbitos terapéuticos.
De esta manera la actuación médica para el tratamiento de los pacientes con cáncer se verá influenciada por factores a nivel celular que indicarán la viabilidad, operabilidad y resecabilidad, apoyadas por los nuevos conocimientos de la imagenología y de la física aplicada.
Se realizó una revisión durante los últimos 10 años (septiembre 2010 a septiembre 2020) para la que se utilizaron las bases de datos PubMed, Scopus y Web de la Ciencia, la guía de comprobación Preferred Reporting Items For Systematic Reviews And Meta-Analysis (PRISMA) (por sus siglas en inglés) para revisiones sistemáticas. Para esto se utilizaron como descriptores las palabras: cancer (cáncer gástrico/cirugía), biología molecular/cáncer gástrico y predisposición genética/cáncer gástrico). Los resultados de la revisión de las bases de datos arrojaron para cáncer gástrico y cirugía en PubMed: 29,270 artículos, Web de la Ciencia: 14,493 artículos y Elsevier: 694 artículos. Cuando se combinan los tres descriptores, es decir cáncer gástrico con cirugía, biología molecular y predisposición genética los resultados descendieron a 32 (PubMed), 10 (WC) y 3 (Elsevier). De estos se seleccionaron los artículos con revisiones sistemáticas, ensayos clínicos aleatorizados, reportes científicos, revisiones con utilización de bibliografías indexadas y estudios de evaluación, para obtener información con validez científica probada. Se utilizaron cuadros explicativos para condensar, agrupar y hacer más comprensible la información.
El objetivo de la presente revisión es articular los aspectos actuales más relevantes de la genética y la biología molecular en relación con el cáncer gástrico, para integrarlos en las guías de prácticas clínicas de pacientes y familiares con el diagnóstico o con riesgo de padecer este tipo de neoplasia.
DESARROLLO
Factores genéticos
La genética influye en el cáncer en general y en el gástrico en particular al participar de manera hereditaria (oncogenes) o de manera esporádica en la promoción o freno (genes supresores de tumores) de la transformación maligna de las células gástricas, así como en su crecimiento y multiplicación. La carcinogénesis es un proceso de enfermedad de múltiples etapas especificado por la adquisición gradual de mutaciones y alteraciones epigenéticas en la expresión de diferentes genes, que finalmente conducen a la aparición de una neoplasia maligna.
Estos genes tienen papeles diversificados con respecto al desarrollo del cáncer. Las vías intracelulares se asignan a la expresión de diferentes genes, transducción de señales, supervisión del ciclo celular, estabilidad genómica, reparación del ADN y destino celular, como apoptosis y senescencia. Las vías extracelulares abarcan la invasión tumoral, metástasis, angiogénesis. Estos patrones de expresión alterados llevan a las diferentes respuestas clínicas. 4
Los avances recientes refieren que existen en las células malignas, genes que son promotores del crecimiento y las metástasis (gen MYC) por lo que al estar presentes predicen un mal pronóstico y otros que en la fase inicial de la enfermedad juegan un rol defensivo al inhibir la proliferación celular. Estos dos aspectos ponen en juego la activación o no del proceso inmunológico. Así la proteína CDC25B es una fosfatasa que activa a las quinasas para inducir mitosis moviéndose entre el citoplasma y el núcleo direccionando esta acción. 5
Síndromes relacionados con el cáncer gástrico hereditario:
Constituyen mutaciones genéticas que aumentan el riesgo de padecer de cáncer gástrico. Los principales son:
La familia de genes reprimo (RPRM): es un grupo de genes de exón únicos, presentes dentro del linaje de los vertebrados. Dos de cada tres miembros de esta familia están presentes en humanos: RPRM y RPRM-Like (RPRML). RPRM induce la detención del ciclo celular en G2/M en respuesta a la expresión de p53. La pérdida de expresión de RPRM está relacionada con el aumento de la proliferación celular y el crecimiento del cáncer gástrico. Esta evidencia sugiere que RPRM tiene propiedades supresoras de tumores. 6
Síndrome de Lynch: inicialmente se denominó cáncer colorrectal hereditario no polipósipo (HNPCC) (por sus siglas en inglés) se describió por primera vez en 1913 por Warthin. 7 Más tarde, en 1991, el grupo colaborativo internacional ideó los criterios de Ámsterdam para el diagnóstico de HNPCC, que luego se amplió a criterios de Ámsterdam II para incluir tumores extracolónicos. 7 El síndrome de Lynch es causado por mutaciones de la línea germinal en el ADN en genes de reparación de desajuste (MMR) como MLH1, MSH2, MSH6 o PMS2. Los microsatélites son repeticiones en secuencias de ADN distribuidos por todo el genoma humano que se encuentran en el MLH. Desde el punto de vista clínico entre el 13 y 19 % tiene participación gástrica. 8 Esto muestra la necesidad de realizar colonoscopia, antígeno prostático específico y ecografía abdominal de alta resolución a pacientes con cáncer gástrico que clasifiquen con este síndrome para buscar neoplasias prostáticas, en ovario, endometrio, páncreas, hepatobiliar; al menos se debe realizar tomografía axial de cráneo para descartar lesiones cerebrales. El cirujano debe de dominar estos criterios y no debe dejarlo a criterio solamente del oncólogo pues la realización de histerectomía y ooforectomía profiláctica podría estar indicada. 9
Poliposis adenomatosa familiar: la poliposis adenomatosa familiar (APF) es un trastorno autosómico dominante penetrante, causado por una mutación hereditaria en el gen supresor tumoral adenomatous polyposis coli (APC) 5q21. El APC controla la transcripción de genes de la ciclina D1 y C myc, e inhibe la progresión de G0/ G1 a la fase S por inhibición de proteínas señalizadoras Wnt. Otras mutaciones que aparecen en pacientes sin tratamiento son en TP53 and KRAS. Clínicamente estos pacientes tienen una forma agresiva y una atenuada (APFa). Cuando se demuestra mutación del codón 1309 la enfermedad es muy agresiva. Existen tres tipos de acuerdo al número de pólipos: profusa (mayor de 5000), escasa (entre 100 y 5000) y atenuado (menor de 100). 10 Esto es importante conocerlo cuando el cáncer gástrico se asocia a una poliposis adenomatosa familiar, donde puede quedar oculto el diagnóstico que podría alterar el pronóstico de los pacientes.
Poliposis asociada a MUTYH: es causada por mutaciones alélicas en el genMUTYH, que codifica una proteína de reparación de escisión de base y la pérdida de esta proteína compromete la reparación de escisión de base y da como resultado transversiones de CG-AT en varios genes, incluidosAPCyKRAS, pudiendo ser causas potenciales de pólipos y predisposición al cáncer colónico 11 y en menor medida al gástrico.
Síndrome de Peutz-Jeghers (SPJ): se caracteriza por una hamartomatosis gastrointestinal con pigmentación cutánea fundamentalmente en mucosa oral y nariz. Rara vez cursa con neoplasias en glándulas sexuales (ovarios y testículos). En aproximadamente el 90 % de los pacientes con SPJ se puede encontrar una mutación de la línea germinal en el gen supresor tumoral LKB1/STK11 que codifica una serina/treonina quinasa en el cromosoma 19p13.3, siendo la STK11 un regulador importante del metabolismo celular, polaridad, apoptosis, proliferación y detención del ciclo celular. 12,13
Cáncer gástrico hereditario difuso: es una neoplasia donde están involucrados el estómago y en ocasiones la glándula mamaria. Los criterios clínicos han sido redefinidos. Las características genéticas están dadas por mutaciones de CDH1 en la línea germinal (pequeñas mutaciones con cambios de lectura en inserciones y eliminaciones de sitio de empalme sin sentido), grandes reordenamientos, metilación del promotor de la línea germinal.
Cáncer gástrico y poliposis proximal del estómago: debido al reciente descubrimiento de las mutaciones IB del promotor APC (c.-191T> C, c.-192A> G y c.-195A> C), que reducen la unión del factor de transcripción Yin Yang 1 (YY1) y la actividad transcripcional del promotor, como su perturbación genética subyacente, GAPPS se ha agregado a la creciente clase molecular de trastornos asociados a APC. Loa criterios diagnósticos están basados en: pólipos gástricos restringidos al cuerpo y al fondo sin evidencia de poliposis colorrectal o duodenal, > 100 pólipos alfombrando el estómago proximal en el caso índice, o > 30 pólipos en un pariente de primer grado de otro caso, histología predominantemente de FGP, algunas con regiones de displasia (o un miembro de la familia con FGP displásico o adenocarcinoma gástrico), un patrón de herencia autosómico dominante, exclusión de otros, poliposis gástrica heredable síndromes de una y el uso de los IBP. (12,13,14,15
Otros síndromes genéticos asociados al cáncer gástrico incluyen: ataxia cerebelosa/teleangiectasia, síndrome de Li- Fraumeni, síndrome de Bloom-Torre-Machacek, síndrome de Cowden y otras enfermedades de origen genético como el xeroderma pigmentoso. 2,7,8) (Tabla 1).
Tabla 1 Principales síndromes asociados al cáncer gástrico

Fuente: Adaptado de: Slavin TP, Weitzel JN, Neuhausen SL, Schrader KA, Oliveira C, Karam R. Genetics of gastric cancer: what do we know about the genetic risks? Transl Gastroenterol Hepatol. 2019;4(1):55. 15
Implicaciones futuras de la genética en el cáncer gástrico
En la actualidad existen más de 50 síndromes hereditarios de cáncer. Las pruebas para determinar los síndromes de Li-Fraumeni, Lynch, poliposis adenomatosa familiar están disponibles y se deben realizar a pacientes con antecedentes que hagan sospechar una afección heredada de cáncer, ayudando a descartar de manera sincrónica o metacrónica otras neoplasias, que al diagnosticarse de manera oportuna tendrán un mejor pronóstico. La terapia génica que aborda el tratamiento de la mutación de un solo gen, las que podrían ser tratadas con la eliminación del gen afectado y su sustitución por la expresión o copia del gen normal, con lo que podría ser potencialmente curado.
Clasificaciones moleculares y de biología molecular
La medicina personalizada ha dado origen a la medicina de precisión y a través de la medicina traslacional se pretenden articular de manera transdisciplinaria e interdisciplinaria los recursos existentes para mejorar los tratamientos de pacientes. La epigenética definida como “la adaptación estructural de las regiones cromosómicas para registrar, señalar o perpetuar estados de actividad alterados” y cuando las alteraciones son heredables algunos la nombran como memigenética. Existen cuatro subtipos del carcinoma gástrico según el atlas del genoma del cáncer: A. Tumores infectados por EBV (Epstein Barr virus), B. Tumores con inestabilidad de microsatélite (TMI), C. Tumores genómicamente estables (TGE) y D. Tumores con inestabilidad cromosómica (TIC). 14,15.16,17,18) (Fig. 1).
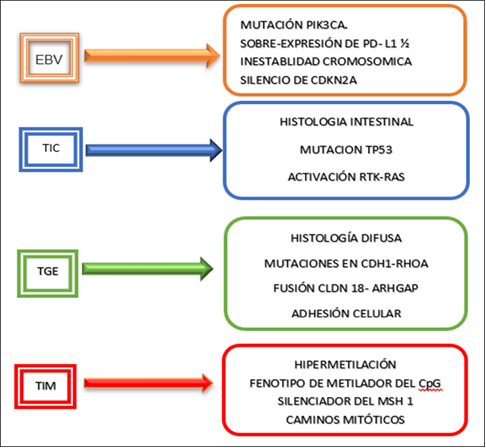
Fuente: Tomado de: Bass AJ,Thorsson V,Shmulevich I,Reynolds SM,Miller M,Bernard B, et al. Comprehensive molecular characterization of gastric adenocarcinoma. Nature.2014;513(7517):202-9. 18
Fundamentos del uso de la genética y de la epigenética en el cáncer gástrico. 2,17,19,20,21,22
Biomarcadores para uso clínico en el cáncer gástrico:
ACE: es útil para todos los cánceres del tubo digestivo, pero no tiene valor como cribado. Se utiliza actualmente midiéndolo inmunohistoquimicamente a la citología convencional incrementando su sensibilidad. Las mediciones en la citología peritoneal del micro RNA a través de la reacción en cadena de la polimerasa con transcriptasa inversa (RT-PCR).
CA 19-9: es un ligando de la molécula de adhesión endotelial de leucocitos (ELAM-1) (CD62E) que ha sido señalada en desórdenes vasculoproliferativos en procesos benignos como la artritis reumatoidea en varios cánceres como el gástrico. Muestra una sensibilidad de 65 % y especificidad del 71 % por lo que algunos no lo recomiendan en la práctica clínica.
CA 72-4: es uno de los mejores biomarcadores para el cáncer gástrico con una precisión de un 77 % 23 y junto al CA19-9 son predictores negativos de supervivencia en pacientes con toma de hasta seis ganglios linfáticos. 24) Es una proteína de alto peso molecular asociada a tumores (glucoproteína-72) similar a la mucina.
Ca 125: es una glicoproteina del tipo de las mucinas (mucin 16) que es codificada por el gen MUCIN 16. Asociada al dominio transmembrana, utilizada fundamentalmente como biomarcador del cáncer de ovario. Al glicosilarse crea un ambiente extracelular en cintra de cuerpos extraños y agentes infecciosos en la zona apical de células epiteliales. Estudios realizados en Corea del Sur demostraron su efectividad como indicador de resecciones curativas en el cáncer gástrico con mejor precisión que el CEA y el CA 19-9.
HER2: es el primer biomarcador molecular disponible para pacientes con GC en la práctica clínica. HER2, (un protooncogén codificado por ERBB2 en el cromosoma 17) es un receptor de tirosina quinasa unido a la superficie de la membrana celular y es uno de los cuatro miembros de la familia EGFR humana, incluidos EGFR/HER1, HER2/neu, HER3 y HER4. Se encuentra sobre expresado y amplificado más en el tipo intestinal, por lo que en esos pacientes mejoraría el pronóstico al ser inhibido por el Trastuzumab.
Receptores del factor de crecimiento fibroblástico (FGFR): la amplificación genética da origen a sobreexpresión, traslocación cromosómica y aumento de la actividad de la tirosin quinasa, actuando en la mitogénesis, diferenciación, proliferación celular, angiogénesis e invasión celular. Se ha documentado que la sobreexpresión es mayor que con el factor de crecimiento epidérmico (EGF), el Herb 2 y el MET. La amplificación de FGFR2 se asocia con un estadio pT más alto, un estadio pN más alto, metástasis en los ganglios linfáticos y se relaciona con una supervivencia general deficiente. 26,27,28
PI3K/Akt/mTOR (fosfatidilinositol-3-kinasa/proteína serina-treonina cinasa): los inhibidores de las señales de proliferación actúan impidiendo la formación de células malignas, La desregulación de esos caminos, como en la vía PI3K/Akt/mTOR originan la eliminación de ese freno promoviendo la formación neoplásica 26,27,28) encontrándose en el 80 % del subgrupo del EBV
MET: es un receptor transmembrana de tirosinquinasa que origina la fosforilación de varias vías de señalización que da origen a la predisposición, decrecimiento celular, angiogénesis, migración y metástasis. La validación de la vía HGF - MET como un factor crítico en el desarrollo / progresión del cáncer y la utilización de biomarcadores apropiados son claves para el desarrollo y la aprobación de los inhibidores de HGF - MET para uso clínico al estar involucrada en la carcinogénesis, la eficacia de la terapia y el resultado de GC. 28
Factor de crecimiento vascular y endotelial (VEGF): promueve la angiogénesis y vasodilatación a través de la inducción genética de su receptor (VEGFR). De esta manera la inhibición de este factor disminuye la progresión del tumor, supervivencia y metástasis.
Implicaciones en las guías de prácticas clínicas de los avances genéticos y moleculares. 26,27,28
La Sociedad Europea de Oncología Médica (SEOM) sugiere solamente derivar los casos a genetistas fundamentalmente aquellos con línea germinal CDH1. La Guía Clínica de Corea del Sur sobre el Cáncer Gástrico del 2018 y la Guía Japonesa de Tratamiento del Cáncer Gástrico en su quinta versión (2018) no reflejan conducta hacia los antecedentes genéticos de los pacientes aun cuando son estos países de alta incidencia. Sin embargo, en los últimos 10 años han comenzando a aparecer guías clínicas que especifican la conducta hacia la predisposición familiar y los factores genéticos presentes en los pacientes. Las guías National Comprehensive Cancer Network (NCCN) del 2020 ofrecen un recurso muy útil en la evaluación del riesgo genético en el cáncer gástrico, sin embargo, estas no son tenidas en cuenta en otras guías incluyendo las hospitalarias. Es así que existen recomendaciones que deben ser tenidas en cuenta:
Historia personal:
A. Paciente con cáncer gástrico menor de 40 años.
B. Paciente con cáncer gástrico de menos de 50 años con un familiar de primer o segundo grado afectado por cáncer gástrico.
C. Paciente afectado por cáncer gástrico que tiene familiar de primer y segundo grado afectado.
D. Paciente afectado de cáncer gástrico y cáncer de mama con uno de los diagnósticos antes de los 50 años.
E. Paciente con cáncer gástrico de cualquier edad y antecedentes de un familiar con poliposis juvenil o poliposis gastrointestinal.
F. Paciente con cáncer gástrico asociado a un familiar con síndrome de Lynch (colorrectal, endometrio, intestino delgado o cáncer del tracto urinario).
Historia familiar:
A. Mutación conocida de un gen susceptible de originar cáncer gástrico en parientes cercanos.
B. Cáncer gástrico en un familiar de primer y segundo grado con menos de 40 años.
C. Cáncer gástrico en 2 familiares de primer y segundo grado menores de 50 años.
D. Cáncer gástrico en tres familiares de primer o segundo grado independientemente de la edad.
E. Pariente cercano con cáncer gástrico y de mama con un diagnostico antes de los 50 años, poliposis juvenil o poliposis gastrointestinal.
Conducta sugerida ante la sospecha de cáncer de tipo hereditario. 26,27,28)
Estos pacientes deben tener una evaluación multidisciplinaria que incluya a genetistas, cirujanos, oncólogos clínicos, gastroenterólogos, psicólogos, imagenólogos y enfermeras especializadas en oncología. Se deberían valorar los estados clínico-nutricionales y psicológicos, además se deben discutir los resultados genéticos para ofrecer educación y orientación al respecto. Se debe obtener el consentimiento informado.
Los pacientes portadores de mutación en el gen CDH1 tienen indicación de una gastrectomía profiláctica sin linfadenectomía estándar (D2) entre los 18 y 40 años. Aquellos con edad inferior a los 18 años y con familiares diagnosticados de cáncer gástrico con esa mutación antes de los 25 años podrían beneficiarse también de una gastrectomía. Aquellos que no acepten la cirugía deberían realizarse estudios endoscópicos una o dos veces al año. Las mujeres deberían además realizarse autoexamen de mamas diariamente, examen físico por mastólogos cada 3 meses y ecografías anuales y a partir de los 40 años mamografías. En el resto de los síndromes sin afectación del gen CDH1 se debería realizar endoscopias digestivas altas extendidas (que incluyan duodeno y primeras asas yeyunales cada 2 o 3 años, comenzando a los 25 años excepto en el síndrome de poliposis juvenil que debería comenzar desde los 15 años). El razonamiento de esta conducta estaría dado por estas tres características que refiere Skill:
I - El HDGC que se diagnostica en el contexto de los síntomas rara vez se cura.
II - Si la gastrectomía se realiza en pacientes con CDH-1 mayores de 40 años, solo hay un 10 % de posibilidades de curación.
III - Las endoscopias preoperatorias son insuficientes para encontrar cánceres asintomáticos en pacientes con HDGC. En las muestras de gastrectomía, realizadas en el entorno profiláctico, el 27 % tenía evidencia de cáncer difuso a pesar de una endoscopia de vigilancia negativa.
En el caso de pacientes con síndromes asociados al cáncer gástrico y que presenten lesiones en otros órganos, pero aún no se diagnostica en el estómago, el criterio a seguir debe ser el de atender la necesidad quirúrgica si está indicada en otros órganos y lograr una recuperación que permita en un segundo tiempo evaluar la gastrectomía si estuviera indicada. Es indispensable explicarles bien los beneficios y las complicaciones de la actividad quirúrgica a estos pacientes y contar siempre con el consentimiento firmado ante la necesidad de realización de cualquier procedimiento invasivo.
CONCLUSIONES
En la práctica médica muy pocas veces se tienen en cuenta los factores moleculares y genéticos en el estudio del cáncer gástrico que propician la aparición de esta enfermedad de manera esporádica (sin relación genética), de carácter familiar (con participación genética asociada o no a otros síndromes neoplásicos. Existen marcadores moleculares que deben de ser usados. Además se debe realizar la clasificación no solo histopatológica sino genética y epigenética. Así como se realiza en los tumores de otras localizaciones se debe de evaluar la existencia de síndromes genéticos relacionados con el cáncer gástrico en los pacientes que se sospeche un carácter familiar. Existe una tendencia a enmarcar en las guías que son paradigmas mundiales en la utilización de los aspectos genéticos y moleculares, pero todavía las guías de prácticas clínicas cubanas en la atención sanitaria adolecen de estos apartados. En esta investigación se ofrecen sugerencias a tener en cuenta en el seguimiento de los pacientes con sospecha o con criterios de padecer de un cáncer gástrico de origen genético, lo cual podría incentivar esta conducta en América Latina.














