INTRODUCCIÓN
La Talquita es una clase de silicatos, subclase filosilicatos, con estructura laminar tipo 2:1, grupo pirofilita-talco, carga laminar cero y por tanto, las láminas se unen entre sí por fuerzas residuales de Van der Waals. Es un mineral rico en magnesio, ligado a rocas magnesianas (rocas ultramáficas y dolomías silíceas metamorfizadas) que se origina por metamorfismo o metasomatismo de este tipo de rocas. De grupo puntual 2/m; son infrecuentes los macrocristales; suele presentar aspecto pétreo, compacto, macizo, o en masas exfoliables. Cristaliza en el sistema monoclínico. Presenta un color blanco con matices amarillentos. Tiene brillo vítreo, con reflejo anacarado. Es graso al tacto. Las hojas son flexibles, pero no elásticas. La densidad picnométrica es de 2,7-2,8 g/cm3. La estructura cristalina y composición química condicionan en la talquita una dureza muy baja (1 en la escala de Mohs), exfoliación perfecta según 0,01 y poder lubricante. No es un material tóxico y presenta hidrofobicidad. Pulverizado, presenta poder adsorbente, adherente, protector y una alta inercia química a la mayoría de los ácidos (Milovsky y Kónonov, 1988).
Una manera de abordar la caracterización de los silicatos y que puede ser utilizada para el estudio de este mineral es la que se muestra a continuación: composición química, composición de fases, composición superficial, área superficial, tamaño y forma y repartición (Giannetto y col., 2000), (Rouquerol et al., 2006), (Gesmdgp, 2010), Worch (2012), (Thommes et al., 2015).
El cadmio es un tóxico que produce contaminación ambiental e industrial y, en el ser humano, causa alteraciones a nivel enzimático, renal, respiratorio y digestivo, con el agravante de tener una vida media muy prolongada. Para enfrentar el problema no basta con hacer un inventario de las principales fuentes de contaminación industrial, en metalurgia principalmente, para fiscalizarlas, sino lograr atenuar sus efectos nocivos al medio ambiente Ramírez (2002).
El objetivo general de la investigación es determinar el modelo cinético, la difusividad efectiva y las isotermas correspondientes a la adsorción en el sistema heterogéneo de masa solución acuosa de iones Cd (II) y talquita a las temperaturas de 298 y 333 K.
MATERIALES Y MÉTODOS
2.1 Técnicas empleadas en la caracterización parcial del adsorbente
Se determinan una serie de parámetros físicos como densidad picnométrica, aparente, aparente por aprisionamiento, compresibilidad, porosidad abierta y cerrada, velocidad de flujo, tortuosidad, radio de poro, volumen de poro y superficie específica. Además, se determinan los contenidos de los elementos en forma de óxidos.
La caracterización se completa con estudios de difracción de rayos X (DRX), análisis termogravimétrico (TG) y análisis espectroscópico cualitativo por serie de Fourier (FTIR).
El análisis de DRX se realiza con el equipo D8 Advance de la firma Bruker que presenta las siguientes condiciones: Geometría Bragg - Brentano (θ - 2θ), línea Kα del Cu (1,54183 Å), filtro de Ni, la potencia de la fuente de rayos X es de 2400 W, amperaje de la fuente de rayos X de 40 mA, voltaje de la fuente de rayos X: 30 kV, el tipo de detector es detector de área (conocido como ojo de Lince), paso de barrido: Δ2θ = 0,025 °, intervalo angular de medición: 2θ = 5 - 60°, tiempo de medición 0,5 s.
Para el análisis térmico se utiliza un analizador termogravimétrico: TGA Q 5000 de la firma TA Instruments, termopares Pt (Pt/Rh), crisoles de cerámica, como referencia (atmósfera estática) crisol vacío. TG = 100 mg, ATD = 250 μV, velocidad de calentamiento de 10 °C/min. La temperatura de trabajo es de 1000°C y la masa de la muestra 100 mg.
Para el análisis por espectrofotometría infrarroja se utiliza el equipo FTIR Bruker Vector 22 con software OPUS equipado con una celda de temperatura Eurotherm. Las muestras se hicieron según el método de discos de KBr, puro para espectroscopía, a una dilución del 1% de la muestra en el KBr. Se emplea una bomba de vacío durante la confección del disco para minimizar la influencia de factores ambientales. Se realiza un blanco con KBr para corregir la influencia de dichos factores.
2.2 Metodología para el estudio cinético de la adsorción de iones Cd (II) en talquita.
La evaluación del estudio cinético del proceso de adsorción se lleva a cabo por el método de absorción atómica. En este estudio se ponen en contacto la talquita con la solución de nitrato de cadmio (II) de concentración conocida (26,2 mg/L), durante un tiempo determinado. Para obtener los valores de concentración de iones Cd (II) a intervalos de tiempo de 1 hora durante 16 horas a las temperaturas de 298 y 333 K.
En cuanto a la determinación de los modelos de isotermas se preparan cinco soluciones de nitrato de cadmio (II) de concentraciones de 3,763; 2,073; 1,217; 0,616 y 0,370 mg/L.
Se utilizan los modelos de orden cero (OC), seudoprimer orden (SPO), seudosegundo orden (SSO), modelo de Elovich (ME) y los modelos de difusión en la película de líquido (DPL), difusión intrapartícula (DIP), modelo de Bangham (MB) y difusividad efectiva (De). Desde el punto de vista del equilibrio químico las isotermas de Langmuir, Freundlich, Toth, Redlich, BET y Flory-Huggins. Se realiza una evaluación a partir de los coeficientes de determinación (Liu y Liu, 2008), (Yanagisawa et al., 2010), (Prieto y Lestayo, 2017).
RESULTADOS Y DISCUSIÓN
3.1 Análisis químico de la talquita.
Se obtiene la composición química de la talquita mediante el análisis realizado a través de las diferentes técnicas, dicha composición se muestra en la Tabla 1.
3.2 Comportamiento químico de la talquita.
El comportamiento químico mostrado por la talquita frente a diferentes medios, obtenido experimentalmente, se muestra en la Tabla 2.
A través de dichos resultados se aprecia que la talquita tiene poca resistencia química ante medios ácidos y básicos, lo cual se puede evidencia en las pérdidas de masa que experimenta, frente a los demás medios es suficientemente resistente.
3.3 Parámetros físicos-mecánicos de la talquita.
Se observan los valores calculados para las diferentes propiedades físico-mecánicas del material en estudio en la Tabla 3.
Tabla 3 Resultados de los parámetros físico-mecánicos de la talquita
| Densidad real | (dr) | 2,750 | g/cm3 |
| Densidad aparente | (da) | 0,46 | g/cm3 |
| Densidad aparente por aprisionamiento | (dapa) | 0,71 | g/cm3 |
| Tortuosidad | (T) | 1,54 | - |
| Porosidad cerrada | (Pc) | 48,1 | % |
| Porosidad abierta | (Pa) | 35,2 | % |
| Compresibilidad | (C) | 37,4 | % |
| Velocidad de flujo | (Vf) | 0 | - |
| Superficie específica | Se | 41,82 | m2/g |
| Factor de forma | - | 0,3 | - |
| Radio de poro | - | 8,31·10-7 | cm |
| Volumen de poro | - | 0,17 | cm3 |
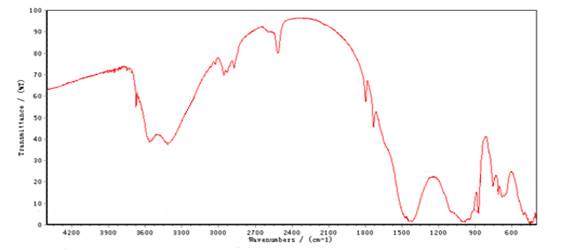
3.4 Análisis infrarrojo cualitativo de la talquita.
El análisis infrarrojo (IR) cualitativo para la talquita se muestra en la Figura 1. La asignación de las bandas de vibración IR en la región por debajo de 600 cm-1 los enlaces entre tetraedros sensibles a la estructura, al igual que la talquita. La región entre 600-900 cm-1 corresponde a la vibración de estiramiento simétrico. En 683 cm-1 aproximadamente corresponde a tetraedros internos insensibles a la estructura y 756 cm-1 que responde al enlace entre tetraedros sensible a la estructura. La banda aproximadamente en 1630 cm-1 y 3568 cm-1 son asignadas a OH estructurales. La banda en 3416 cm-1 es posible asignarla a la presencia de agua. La banda en 1462 cm-1 puede ser asignada a la presencia de compuestos orgánicos o sea a las vibraciones de los enlaces C-H, N-N=O, CS-NH- o P-O-Alquílico.
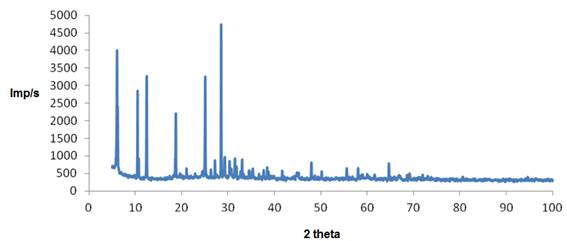
3.5 Difracción de rayos X para la talquita.
En Tabla 4 se expone el análisis realizado por difracción de rayos X donde se obtienen las fases por las que está compuesta la talquita. En la Figura 2 se muestra el difractograma correspondiente al sólido.
Tabla 4 Fases obtenidas por difracción de rayos X para la talquita
| Ca2(Mg, Fe)5 (Si, Al)8 O22 (OH)2 | Ca -Mg -Fe +2- Si O2 - OH |
| (Mg, Fe)6 (Si, Al)4 O10 (OH)8 | Ca0.5 (Mg, Fe)3 (Si, Al)4 O10 (OH)2.4 H2 O |
| Fe5 Al4 Si6 O22 (OH)2 | Mg1,252 Fe0,616 Al3,836 Si4,830 O18 (H2O)0,58 |
| H Al Si4 O10 |
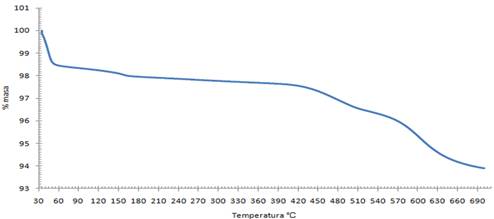
3.6. Análisis termogravimétrico de la talquita.
Con el objetivo de estudiar los procesos físicos y químicos que sufren tanto la talquita clara como la oscura por efectos del calor, se concibió un estudio termogravimétrico (TG). Para la talquita el estudio termogravimétrico expresa un comportamiento complejo debido a varias fases mineralógicas presentes, el primer efecto está asociado a agua adsorbida de la fase principal, el segundo efecto es muy probable que corresponda a agua asociada a hidróxidos de hierro o de aluminio. La tercera deflexión pertenece a un mineral filosilicato que corresponda a una estructura tipo clorita o pirofilita que deprenda esta agua estructural en dos etapas de temperatura cercanas. El cuarto efecto corresponde al agua hidroxílica de la talquita. El termograma se muestra en la Figura 3.
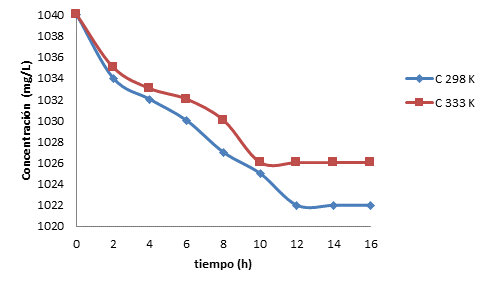
3.7 Resultados del estudio cinético para la talquita en solución de iones Cd (II).
En la Figura 4 se muestra el comportamiento de la adsorción en el tiempo a las temperaturas de 298 y 333 K.
En la Tabla 5 se muestran los resultados del estudio cinético realizado para la talquita en solución de iones Cd (II) a la temperatura de 298 K y 333K, de los que después de examinados, permite concluir que el proceso es físico. A continuación se muestran los resultados referentes a los modelos cinéticos y difusivos aplicados (Stoeckli, 2001), (Foo y Hameed, 2001), (Ho, 2006), (Chun-I y Li-Hua, 2008), (Karthikeyan y Sivakumar, 2010), (Prieto y Lestayo, 2017).
Como se evidencia en la tabla a 298 K el modelo cinético que mejor ajusta es el de seudoprimer orden, lo cual indica un proceso físico de adsorción, cuya constante “aparente” de velocidad de adsorción 0,18 s-1 y tiempo de vida media t1/2 = 3,96 segundos a 298 K. El valor de la capacidad de adsorción de los iones Cd (II) en solución acuosa es de 9,81 mg/g a 298 K. El valor de la concentración de equilibrio es de 1022 mg/L y por ello, la constante de equilibro es de 9,9 • 10-3 L/g. Lo anterior permite calcular la variación de energía libre, cuyo valor es ΔG= -12,4 J/mol.
Tabla 5 Resultados del estudio cinético y difusivo de la talquita en solución de iones Cd (II) a 298 K y 333 K
|
|
|
|
|---|---|---|
| Seudoprimer orden (SPO) | 0,962 | 0,947 |
| Seudosegundo orden (SSO) | 0,954 | 0,824 |
| Elovich (ME) | 0,825 | 0,901 |
| Difusión intrapartícula (DIP) | 0,892 | 0,965 |
| Difusión en la película de líquido (DPL) | 0,963 | 0,981 |
| Modelo de Bangham (MB) | 0,951 | 0,979 |
| Difusividad efectiva (De) | 0,941 | 0,966 |
Se aprecia que la difusión en la película de líquido es importante como mecanismo difusivo. La difusividad efectiva a 298 K es 9,79 • 10-15 m2/s. Este valor es pequeño en comparación con otras difusividades efectivas en otros sustratos sólidos y especies químicas (Prieto y col., 2016).
A 333 K el modelo de seudoprimer orden es el que mejor ajusta en concordancia con el coeficiente de determinación. La constante “aparente” de velocidad de adsorción 0,13 s-1 y tiempo de vida media t1/2 = 5,4 segundos a 333 K. La capacidad de adsorción para el equilibrio es 5,93 mg/g. La concentración de equilibrio de iones Cd (II) en el sistema heterogéneo de masas es 1026 mg/L. Lo anterior conduce a obtener una constante de equilibrio de 5,78 • 10-3 L/g. A partir de este valor se evalúa la energía libre ΔG= -13,1 J/mol.
A esta temperatura, 333 K, es significativa la difusión en la película de líquido y en los microporos, dado los relativamente altos coeficientes de determinación. La evaluación de la difusividad efectiva es de D333= 1,21 • 10-14 m2/s.
Al combinar los resultados de la energía libre obtenida a 298 y 333 K se obtiene la variación de entalpía ΔH= -6,10 J/mol y entropía ΔS= +0,021 J (/mol • K). Lo anterior demuestra que el proceso de adsorción es espontaneo, exotérmico y tiene un valor aleatorio insignificante. Este proceso puede ocurrir a cualquier temperatura, Liu (2009).
Al aplicar la ecuación de Arrhenius para obtener la energía de activación del proceso, se determina su valor en 7,1 J/mol. Este bajo valor relativo demuestra que el proceso es de naturaleza física. Una aplicación similar al proceso difusivo permite determinar que el valor para la difusión es de 4,9 J/mol o sea aproximadamente el 69 % de la energía de activación se emplea en el proceso difusivo.
La aplicación de las concentraciones iniciales y finales de iones Cd(II) en agua permite determinar el gradiente de potencial químico en el proceso cuyo valor es de 68 J/mol, lo cual refrenda un proceso de baja diferencia en estos valores a pesar de ser un proceso favorecido. Un hecho que debe dificultar la adsorción de iones Cd (II) debe ser la fortaleza relativamente alta de los enlaces Cd2+…..OH- cuyo ΔG = - 349,01 kJ/mol, lo cual está dado por la alta polarizabilidad del ion Cd2+ (0,96·10-24 cm), así como su poder polarizante que emana del diámetro del acuocomplejo (2,96·10-9 cm), (Cotton y Wilkinson, 1966).
3.8 Resultados del estudio termodinámico para la talquita en solución de iones Cd (II).
Los resultados obtenidos del estudio termodinámico se evalúan a través de los diferentes modelos, cuyos resultados se muestran en la Tabla 6 para 298 y 333 K.
Tabla 6 Resultados del estudio termodinámico para la talquita a 298 K
|
|
|
|
|---|---|---|
| Langmuir | 0,832 | 0,940 |
| Freundlinch | 0,753 | 0,971 |
| B.E.T. | 0,983 | 0,858 |
| Redlich | 0,677 | 0,844 |
| Dubinin-Radushkevich | 0,583 | 0,779 |
| Toth | 0,745 | 0,922 |
| Flory-Huggins | 0,923 | 0,992 |
A partir de los resultados obtenidos es posible considerar una adsorción en los microporos en la talquita. Al considerar la ecuación obtenida se tiene que la energía libre de adsorción por molécula de adsorbato β es 2∙ 10-7 J. A partir de este valor se obtiene el potencial de Polanyi PP= 1/[2β] ½, cuyo resultado es 2,2 kJ/mg. Lo anterior permite obtener la capacidad de adsorción máxima a partir del término independiente de la ecuación del modelo de DR de donde qm es igual a 1,07 mg/g, lo que se considera un valor relativamente elevado.
A la temperatura de 298 K el modelo que mejor ajusta es el de BET. Para el mismo la constante de equilibrio es de 2,10 • 10-3 y una monocapa de sustrato de 0,02 mg/g.
Para la temperatura 333 K, la isoterma que mejor ajusta es la de Flory-Huggins cuyas constantes son nF-H y KF-H son 0,32 y 3,56 L/mg. La cobertura en este caso es baja ya que Θ= 0,02.
CONCLUSIONES
La muestra de talquita empleada es de baja densidad (2,750 g/cm3), alta porosidad (48,1%), constituida por microporos. Presenta una superficie específica similar a las arcillas, cuya estructura de capas condiciona su capacidad de adsorción.
La cinética a ambas temperaturas de estudio responde a un modelo de seudoprimer orden. Los valores de la capacidad de adsorción es mayor para 298 K con una concentración de equilibrio de los iones Cd (II) en solución acuosa menor.
El proceso de adsorción es espontaneo, exotérmico y con baja aleatoriedad cuya energía de activación responde a un proceso físico y cuya difusión efectiva consume alrededor del 70% de la energía de activación.
Los modelos de isotermas responden a 298 K a BET y a 333 K al modelo de Flory-Huggins.
La talquita como adsorbente de iones plomo (II) presenta limitadas capacidades adsortivas.