Introducción
Uno de los problemas fundamentales que enfrenta humanidad actualmente, es la resistencia de los microorganismos patógenos frente a múltiples antibióticos convencionales, lo que representa un reto para las industrias biofarmacéutica y alimentaria.1 En países desarrollados como Estados Unidos e Inglaterra, más del 50 % de pacientes con enfermedades bacterianas infecciosas, están relacionados con cepas resistentes a uno o más antibióticos convencionales.2 Para enfrentar esta situación mundial, numerosas investigaciones se enfocan en el desarrollo de nuevos productos antibacterianos de origen vegetal, los cuales representan una alternativa viable para combatir la resistencia de los patógenos, debido a la diversidad de metabolitos secundarios que presentan con actividad antimicrobiana.3
El uso excesivo de plaguicidas químicos durante décadas, en la mayoría de los sistemas de producción agrícola, constituye también un problema a solucionar por la comunidad científica a nivel mundial. Estos productos, además de contaminar el medio ambiente, incrementan la resistencia de las plagas agrícolas y representan un riesgo para la salud del hombre.4 De manera similar, el desarrollo de plaguicidas botánicos constituye un área de constante investigación, debido a las ventajas que presentan estos productos como por ejemplo, son biodegradables, de perfil toxicológico bajo y amigables con el medio ambiente.5
Entre las principales plagas que afectan los organopónicos y otras áreas agrícolas están los moluscos, los cuales reducen notablemente el rendimiento de los cultivos. Los moluscos son vectores-transmisores de numerosas enfermedades en los humanos como disentería, desórdenes neurológicos y urogenitales y dolores abdominales entre otros.6 Los molusquicidas comunes que se utilizan para el control de caracoles y babosas son de origen sintético. Estos pesticidas elevan los costos de producción y a menudo los agricultores no disponen de los mismos; pueden ocasionar problemas de toxicidad en otros organismos beneficiosos lo que afecta el agroecosistema, y además, el uso indiscriminado y prolongado de los mismos incrementa la resistencia de los moluscos, lo que dificulta significativamente el control de estas plagas.7
El género Agave se considera una fuente importante de metabolitos secundarios con diferentes propiedades biológicas. Los estudios fitoquímicos de extractos de hojas y raíces realizados a varias especies de agaváceas, muestran una riqueza en metabolitos secundarios y primarios como flavonoides, alcaloides, saponinas, terpenos, esteroides, cumarinas, fenoles, azúcares reductores, inulina, fructanos, entre otros.8,9 La presencia de varios de estos compuestos se asocia con diferentes propiedades biológicas como antibacteriana9, insecticida y nematicida10,11, antioxidante 12 y molusquicida 5 entre otras. Sin embargo, la composición fitoquímica de las plantas depende de múltiples factores como el genotipo, la edad fisiológica y el órgano de la planta, el método de extracción y diversos factores ambientales.13 Por estas razones, es importante realizar estudios con la flora local en función de evaluar las potencialidades fitoquímicas y las propiedades biológicas de estas especies.
Agave americana L. y Agave angustifolia Haw. son agaves nativos de México con numerosos usos tradicionales en diferentes regiones tropicales y subtropicales del mundo. A. americana se utiliza para la extracción de fibras que se emplean en la fabricación de sogas, tela gruesa y papel. A partir de las hojas se produce jalea facial y agujas; mientras que de las raíces y las hojas se obtiene jabón debido a la presencia abundante de saponinas.14Agave angustifolia Haw. se emplea como planta ornamental y en la fabricación del mezcal.15
El objetivo del presente trabajo fue evaluar las propiedades fitoquímicas, antibacterianas y molusquicidas de extractos de hojas de Agave americana L. var. marginata Trelease y Agave angustifolia Haw. var. marginata Gentry, presentes en la provincia de Matanzas, Cuba.
Materiales y métodos
Reactivos
Los reactivos ácido 3,5-dinitrosalisílico (98%), reactivo fenólico de Folin-Ciocalteu (98%), Albúmina de Suero Bovino (BSA), D-glucosa (99,5%) y etanol (95%) se adquirieron de la firma Merk (Alemania) y los medios del cultivo Caldo Mueller-Hinton (MHB) y Agar Nutriente de la firma Biolife (Italia). Todos los reactivos utilizados fueron de calidad analítica.
Selección y colecta del material vegetal
Se seleccionaron plantas sanas de agave pulpo (Agave americana L. var. marginata Trelease) y agave espada marginata (Agave angustifolia Haw. var. marginata Gentry) de cuatro años de edad, presentes en las áreas del Jardín Botánico de Matanzas (JBM), localizado en la provincia de Matanzas, Cuba. Las especies se identificaron taxonómicamente por especialistas del Jardín Botánico de Matanzas y se colocó una muestra herborizada de cada especie en el herbario del JBM con los números 5402 y 5403. Se colectaron 1,5 kg de hojas de cada especie entre las 8:00 y las 9:00 de la mañana, en octubre de 2018. Las mismas se lavaron con agua corriente y destilada para eliminar las partículas de polvo. Posteriormente se secaron en una estufa (Boxun, China) a 45 ºC y se trituraron en un molino eléctrico hasta pulverizar.
Preparación de los extractos
Se realizaron extractos hidroalcohólicos con etanol (90 %) y acuosos según el procedimiento descrito por de Souza et al.16 Para ello se mezclaron 100 g de polvo de ambas especies y de disolvieron en 1 000 mL de ambos solventes en frascos ámbar. Los extractos se colocaron en agitación sobre una zaranda orbital (HDL® Apparattus, China) a 160 rpm, durante 24 h. Posteriormente las muestras se filtraron con tres capas de papel de filtro. Se realizó una segunda extracción del sólido en otros 1 000 mL de ambos solventes en las mismas condiciones. Los solventes se colectaron, concentraron con un rotoevaporador (Heidolph, Alemania) y se secaron a temperatura ambiente hasta sequedad. Los extractos se conservaron a 4ºC para las determinaciones químicas y los ensayos de actividad biológica.
El ensayo de actividad molusquicida se realizó con material vegetal fresco (hojas). Se prepararon extractos de 1 g mL-1 mediante maceración durante 20 min en agua destilada.
Composición química cualitativa y cuantitativa
Se determinó la presencia de flavonoides, terpenoides, antocianinas, taninos, antraquinonas, glucósidos cardiotónicos, antocianinas, flobataninos, esteroides, cumarinas y emodinas, mediante la metodología descrita por Chigodi et al.17 La presencia de estos compuestos se evaluó de manera cualitativa a través del sistema no paramétrico de cruces. Presencia: (+++ = abundante, ++ = moderado, + = bajo, - = ausencia).
Cuantificación de azúcares reductores
El contenido de azúcares reductores se determinó por el método del ácido dinitrosalisílico y se empleó la D-glucosa (Sigma) como azúcar patrón (0,1-1,0 mg mL-1).18 La absorbancia se medió a una longitud de onda de 456 nm en un espectrofotómetro Ultrospect 2000 (Pharmacia Biotech, Suecia).
Contenido de proteínas solubles totales
El contenido proteico se determinó colorimétricamente mediante el método descrito por Lowry et al. 19, con el uso de albúmina de suero bovino (BSA) como patrón (0,1-1,0 mg mL-1). Los valores de absorbancia se midieron a 750 nm y las concentraciones se determinaron mediante la curva patrón y se expresaron en mg mL-1.
Ensayo de actividad antimicrobiana
La actividad antimicrobiana in vitro de los extractos se evaluó frente a las bacterias de referencia Staphylococcus aureus ATCC 25923 (Gram positiva) y Escherichia coli ATCC 25922 (Gram negativa), suministradas por el Centro de Higiene y Epidemiología de la provincia de Matanzas. El ensayo se realizó mediante el método de difusión en pocillos.20 Las cepas bacterianas se rejuvenecieron previamente sobre el medio Agar Cerebro de Corazón a 37°C. Se inoculó el medio Agar Mueller- Hinton con células de turbidez equivalente al tubo 0,5 de la escala de Mc Farland (1,5*108 UFC mL-1) con el uso de un hisopo estéril.16 Los pocillos se realizaron con la ayuda de un oradador estéril de 8 mm de diámetro y se les adicionaron 100 µL de cada extracto (200 mg mL-1). Las placas fueron incubadas durante 24 h a 37°C. Se utilizó como control negativo la solución hidroalcohólica y como control positivo el antibiótico tetraciclina (45 μg μL-1). La actividad antibacteriana se obtuvo a partir del diámetro de la zona de inhibición del crecimiento bacteriano. Se realizaron tres réplicas por cada extracto evaluado.21
Evaluación de la actividad molusquicida
Para la determinación del efecto molusquicida de los extractos se colectaron caracolillos de la especie Praticolella griseola (Pfeiffer) en un organopónico presente en el campus de la Universidad de Matanzas. El experimento se realizó según la metodología de Morales-Rabanales et al.15 Se colocaron cinco gastrópodos por placas Petri (20 cm de diámetro) y se suministró alimento diario que consistió en hojas frescas de frijol. En cada placa se colocaron dos capas de papel de filtro humedecido con agua. Los moluscos se mantuvieron en estas condiciones durante cuatro días para su aclimatización. Las placas Petri se lavaron diariamente y se cambió el papel de filtro y el alimento con la misma frecuencia. Se utilizaron cuatro réplicas (placas) por tratamiento (extracto).
Se aplicaron 4 mL de cada extracto (1 mg mL-1 peso fresco) sobre toda la superficie de las placas Petri incluyendo el alimento y los animales. Se realizó una sola aplicación del extracto y se midió la mortalidad (%) durante 24 h a diferentes intervalos de tiempo. Como control negativo se utilizó agua destilada.
Análisis estadístico
Los experimentos de actividad antibacteriana y molusquicida se realizaron mediante un diseño completamente aleatorizado. La determinación cualitativa de los metabolitos secundarios se realizó por triplicado, al igual que las lecturas de absorbancia para la cuantificación de azúcares reductores y proteínas solubles totales.
Los datos se procesaron con el programa estadístico SPSS versión 18,0 para Windows. Se determinó el ajuste de los datos a una distribución normal mediante la Prueba de Kolmogorov-Smirnov y la homogeneidad de varianza mediante la Prueba de Bartlett. Se realizó un ANOVA simple para el análisis del contenido de azúcares reductores y proteínas solubles y las diferencias entre tratamientos se determinaron mediante Prueba de Rangos Múltiples de Tukey (P<0,05). Los datos de actividad antibacteriana se analizaron con la Prueba de Kruskal-Wallis (P<0,05) y diferencias entre los rangos promedios de las variables en cada uno de los tratamientos establecidos se determinó mediante la Prueba U de Mann Whitney.
Para el ensayo de la actividad molusquicida se estableció un diseño completamente aleatorizado con cuatro réplicas por tratamiento. Para el análisis estadístico de la mortalidad (%) se realizó un análisis de proporciones con el uso del programa CompaProp versión 3.01 sobre Windows.22
Resultados y discusión
Los resultados de la determinación química cualitativa se muestran en la tabla 1. Se observó la presencia de flavonoides, terpenos, saponinas y glucósidos cardiotónicos en extractos acuosos y etanólicos de ambas especies. Los esteroides y los taninos se detectaron en los extractos hidroalcohólicos, mientras que las cumarinas se observaron en ambos extractos acuosos. El etanol resultó un mejor solvente para la extracción de los metabolitos que el agua, a excepción de las cumarinas donde sólo se detectaron en el extracto acuoso y en bajas proporciones.
Tabla 1 Composición fitoquímica cualitativa de extractos hidroalcohólicos (Et) y acuosos (Ac) de hojas de Agave americana y Agave angustifolia
| Metabolitos | ||||
| Et | Ac | Et | Ac | |
| Flavonoides | ++ | + | ++ | + |
| Terpenos | +++ | ++ | ++ | ++ |
| Antocianinas | - | - | - | - |
| Esteroides | + | - | + | - |
| Saponinas | ++ | ++ | ++ | + |
| Taninos | + | - | + | - |
| Cumarinas | - | + | - | + |
| Flobataninos | - | - | - | - |
| Gluc. Cardiotónicos | ++ | + | + | + |
| Antraquinonas | - | - | - | - |
| Emodinas | - | - | - | - |
Presencia: +++: abundante, ++: moderado, +: bajo, - : ausencia.
Los resultados del estudio químico cualitativo coinciden con otros trabajos donde se detectó la presencia de estos compuestos en extractos de agaváceas. Las saponinas, los flavonoides, y los taninos se observaron en distintas agaváceas como A. americana23, A. angustifolia24, A. sisalana Perrine 25, A. lechuguilla Torr. 26 y A. fourcroydes Lem.9 Estudios fitoquímicos en el género Agave también refirieron la presencia de terpenos en extractos de hojas de A. sisalana27 y A. lechugilla26, cumarinas en A. sisalana17,25 y A. fourcroydes9; mientras que Jajere et al.28 detectaron la presencia de esteroides y glucósidos cardiotónicos en A. sisalana.
La presencia de estos metabolitos secundarios sugiere un uso potencial de estas plantas como fuente de compuestos bioactivos para el desarrollo de la industria farmacéutica y del sector agropecuario. Entre estos, las saponinas de los agaves son de gran utilidad en la industria farmacéutica para el desarrollo de nuevos fármacos.28 Estos compuestos se relacionaron con diferentes actividades biológicas como antibacteriana 29, diurética 8 y molusquicida.30
La tabla 2 muestra las concentraciones de azúcares reductores y proteínas solubles totales en los extractos acuosos y hidroalcohólicos de los agaves estudiados. A. angustifolia mostró las concentraciones más elevadas de proteínas solubles totales entre ambas especies, mientras que el agua resultó un mejor disolvente para la extracción de polipéptidos.
Tabla 2 Contenido de azúcares reductores (AR) y proteínas solubles totales (PST) en extractos hidroalcohólicos y acuosos de hojas de A. americana y Agave angustifolia.
| Especie | AR (mg mL-1) | PST (mg mL-1) | ||||||
|---|---|---|---|---|---|---|---|---|
| Etanólico | Acuoso | Etanólico | Acuoso | |||||
| Media | ±DE | Media | ±DE | Media | ±DE | Media | ±DE | |
|
|
6,38 a | 0,19 | 2,42 c | 0,11 | 5,53 c | 0,40 | 23,39 b | 0,63 |
|
|
3,70 b | 0,08 | 1,43 d | 0,07 | 4,10 c | 0,29 | 29,60 a | 0,84 |
Letras diferentes indican diferencias significativas entre extractos para un mismo metabolito, según Test de Rangos Múltiples de Tukey (P<0,05). ± DE: desviación estándar.
Los valores más altos de azúcares reductores se observaron en los extractos etanólicos en comparación a los respectivos extractos acuosos. Los mayores contenidos se obtuvieron en Agave americana L. La cuantificación de azúcares reductores en los agaves, además de contribuir a la caracterización química de estas especies, interfieren en la extracción de saponinas, las cuales son de interés comercial para la industria farmacéutica.31) De manera general, los metabolitos encontrados en extractos de hojas de Agave spp. se consideran compuestos con un uso potencial en la medicina, lo cual se atribuye a que la mayoría de los componentes identificados fueron referidos como agentes terapéuticos.
Actividad antibacteriana
Los resultados de la actividad antibacteriana de los extractos etanólicos de ambas especies evidenciaron un efecto inhibitorio frente a Staphylococcus aureus ATCC 25923 (Gram positiva) y Escherichia coli ATCC 25922 (Gram negativa) (tabla 3). Frente a S. aureus, los mejores resultados se obtuvieron con el extracto de A. angustifolia Haw., con valores similares al control positivo. En el ensayo frente a la bacteria Gram negativa E. coli, la mayor inhibición se obtuvo con el antibiótico, mientras los extractos mostraron una actividad antibacteriana similar.
Tabla 3 Actividad antibacteriana de extractos hidroalcohólicos de hojas de Agave americana y Agave angustifolia
| Extractos | |||||
|---|---|---|---|---|---|
| DZI (mm) | ± EE | DZI (mm) | ± EE | ||
| Solución hidroalcohólica | 0,0 c | 0,00 | 0,0 c | 0,00 | |
| Tetraciclina | 23,0 a | 0,57 | 18,7 a | 0,33 | |
|
|
19,0 b | 0,50 | 15,7 b | 0,88 | |
|
|
22,7 a | 0,66 | 16,0 b | 0,54 | |
DZI: diámetro de la zona de inhibición. Los datos representan medias de tres réplicas. Letras diferentes indican diferencia significativa según prueba U de Mann-Whitney (P<0,05).
Los resultados obtenidos coinciden con otros trabajos donde se observó un efecto antibacteriano de extractos de diferentes especies de agaves. KRISHNAVENI 23 refirió una actividad antibacteriana del extracto hidroalcohólico de Agave americana frente a Staphylococcus aureus y Escherichia coli; sin embargo, obtuvo una actividad similar para ambos patógenos con halos de inhibición de 19 y 20 mm, respectivamente. De manera similar, López-Romero et al. 3 observaron un efecto bactericida del extracto hidroalcohólico de Agave angustifolia frente a Escherichia coli y a Staphylococcus epidermidis a una concentración mínima inhibitoria de 60 mg mL-1. La evaluación de la actividad antibacteriana del extracto hidroalcohólico de hojas de Agave fourcroydes Lem. (200 mg mL-1), evidenció un efecto inhibitorio frente a los patógenos Staphylococcus aureus y Staphylococcus epidermidis9; sin embargo, en este estudio el extracto mostró halos de inhibición inferiores a los observados en la presente investigación, con valores de 15,5 mm y 12,0 mm, respectivamente. Por otra parte, el extracto no tuvo actividad frente a Escherichia coli, lo cual puede estar asociado a diferencias en la composición fitoquímica de ambas especies.
Los mayores halos de inhibición se obtuvieron frente a la bacteria Gram positiva S. aureus en comparación con la Gram negativa (E. coli). Esto puede estar relacionado con la mayor complejidad que presentan las paredes celulares de ésta última, que puede limitar la entrada de metabolitos secundarios con acción antibacteriana.32 Sin embargo, en trabajos similares realizados con A. americana L. se observó una mayor actividad de los extractos de hojas de esta especie frente a las bacterias Gram negativas E. coli y K. pneumoniae, en comparación con el efecto inhibitorio frente a S. aureus.23 Entre los factores que pueden incidir en este resultado están las diferencias genotípicas en el material vegetal utilizado y las condiciones ambientales. La interacción genotipo - ambiente modula fuertemente la expresión de los genes involucrados en la síntesis de los metabolitos secundarios y por tanto, el perfil metabólico de las plantas en un determinado momento. Otro factor que pudo incidir son las cepas bacterianas utilizadas, las cuales pueden tener diferencias genotípicas que impliquen distintos niveles de resistencia a los extractos vegetales.
La actividad antibacteriana de los extractos está relacionada con la presencia de determinados metabolitos secundarios identificados en las pruebas fitoquímicas. Entre estos compuestos, las saponinas pueden tener un efecto inhibitorio de bacterias patógenas, ya que provocan cambios en la hidrofobicidad, la carga superficial y la integridad de las membranas biológicas, lo que provoca un aumento en la solubilidad de las mismas y la salida de los componentes celulares en bacterias Gram positivas y Gram negativas.29,33) Esto es congruente con lo referido por López-Romero et al. 3, quienes asociaron el efecto bactericida del extracto hidroalcohólico de Agave angustifolia frente a E. coli y S. epidermidis a la presencia de saponinas.
Los taninos también pueden estar asociados con la actividad antibacteriana observada, ya que estos compuestos reaccionan con diferentes tipos de moléculas como proteínas y ácidos nucleicos, debido a la capacidad que tienen de unirse a grupos aminos, hidroxilos y carboxilos. La unión entre taninos y proteínas forma complejos irreversibles, lo cual provoca la inhibición de enzimas y del proceso de biosíntesis de proteínas.34 Los terpenos poseen diferentes actividades biológicas como antibacteriana y bacteriostática.35,36 Los mecanismos de acción antibacteriana propuestos para estas sustancias están relacionados con la inhibición de procesos vitales, como el uso del oxígeno y la fosforilación oxidativa, lo cual reduce la tasa respiratoria y la disponibilidad de energía metabólica para realizar los procesos metabólicos en los microorganismos patógenos.37
Los flavonoides constituyen un grupo amplio de compuestos que tienen diferentes actividades, como la antibacteriana frente a bacterias Gram positivas y Gram negativas 38,39 Estas sustancias ejercen su acción antibacteriana mediante diferentes mecanismos, como por ejemplo, la inhibición de diferentes enzimas microbianas y la formación de complejos con proteínas de la pared celular, que reducen la capacidad de adhesión de los microorganismos y el crecimiento y desarrollo normal de algunos patógenos.40 También provocan la despolarización de la membrana celular e inhiben de la síntesis de ácidos nucleicos y proteínas 41 o suprimen la síntesis de la pared celular 42 y la membrana citoplasmática.43
Actividad molusquicida
La figura 1 muestra los resultados del efecto molusquicida de los extractos durante 24 h de ensayo. Los mejores resultados se obtuvieron con A. americana donde se alcanzó un 100 % de mortalidad a las 4 h de aplicado el extracto. En el caso del extracto de A. angustifolia se observó una mortalidad del 40 % posterior a las 24 h, mientras que en el tratamiento control (agua) no hubo casos de mortalidad y los animales mostraron un comportamiento normal durante el tiempo del ensayo.
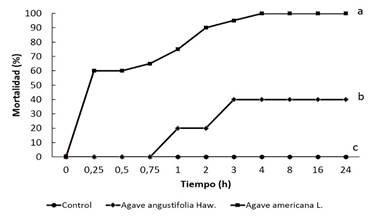
Fig. 1 Actividad molusquicida de extractos acuosos de hojas de Agave americana y Agave angustifolia frente a Praticolella griseola. Letras diferentes indican diferencia significativa según Prueba de Rangos Múltiples de Duncan (P<0,05).
Los resultados obtenidos coinciden con otros trabajos similares donde se observó una actividad molusquicida de extractos de diferentes especies de Agave. NODARSE et al. 44 refirieron una actividad molusquicida de los extractos acuosos de hojas de A. americana y A. legrelliana frente al gastrópodo Praticolella griseola Pfeiffer. A los siete días de aplicados los extractos se obtuvo un 97,5% de mortalidad con ambos extractos a una concentración de 12,5%. La actividad molusquicida de A. americana también se corroboró por Iannacone et al. 5 frente a Heleobia cumingii, con el uso de extractos acuosos al 1% preparados a partir del jugo del peridermo. Estos autores refirieron porcentajes de mortalidad de 70, 92,5 y 96% a las 24, 48 y 72 h, respectivamente. De manera similar, los extractos acuosos de Agave angustifolia30 y Agave filifera45 mostraron una toxicidad elevada frente al vector Biomphalaria alexandrina; mientras que MORALES-RABANALES et al. 15 refirieron un efecto molusquicida frente al molusco Fossaria obrussa con extractos de Agave angustifolia.
Los resultados obtenidos pueden estar relacionados con la presencia de varios metabolitos secundarios en los extractos analizados, como taninos, terpenos, flavonoides 29,46, y en particular las saponinas, las cuales poseen un efecto molusquicida bien documentado.30,47,48 La acción biológica de las saponinas se relaciona con un efecto tóxico sobre los músculos, la hemolinfa, los intestinos y el hepatopáncreas.49 Estos compuestos pueden producir irritación sobre el epitelio y la mucosa del tubo digestivo de los moluscos 50, y en dosis elevadas un aumento de la frecuencia cardíaca y la parálisis del músculo cardíaco.51 Abdel-Gawad et al. 30 refirieron un efecto molusquicida potente del extracto de Agave angustifolia debido a la acción letal de las saponinas esteroidales stigmasterol, tigogenina y rodeasapogenina.
Los taninos también tienen un efecto molusquicida. Estudios con plantas ricas en estas sustancias mostraron una actividad molusquicida fuerte frente a Biomphalaria glabrata.52 Los compuestos terpenoides pueden difundir fácilmente a través de las membranas biológicas y de esta forma, reaccionar con enzimas esenciales del metabolismo de los moluscos mediante reacciones de alquilación, lo que ocasiona la muerte del animal.53,54
La actividad molusquicida de los extractos puede estar asociado también al efecto irritante de los cristales de oxalato de calcio observados en el jugo de ambas especies.55 Esto coincide con los resultados observados en la presente investigación, ya que los animales expuestos al extracto acuoso de A. americana mostraron daños en el epitelio que recubre el pie musculoso, lo que puede provocar la pérdida de la hemolinfa y el contenido de agua en el cuerpo.49
Conclusiones
Los extractos etanólicos de hojas de Agave americana L. var. marginata Trelease y Agave angustifolia Haw, mostraron actividad antibacteriana frente a Staphylococcus aureus y Escherichia coli, relacionado con la presencia de varios metabolitos secundarios como saponinas, flavonoides, terpenos y taninos. El extracto acuoso de A. americana mostró una actividad molusquicida elevada frente al gastrópodo Praticolella griseola Pfeiffer, lo que evidencia las potencialidades de esta planta para el manejo integrado de moluscos plagas. Sin embargo, se recomienda otros estudios de toxicidad para un uso seguro de esta planta en el sector agrícola














