My SciELO
Services on Demand
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Tecnología Química
On-line version ISSN 2224-6185
RTQ vol.32 no.2 Santiago de Cuba Maio-Aug. 2012
ARTICULO ORIGINAL
Depuración por electrocoagulación en un lactosuero: Cinética del proceso
Purification by Electrocoagulation in a Whey: Kinetics of the Process
Lic. Judith Callejas-HernándezI, Dr. Francisco Prieto-GarcíaI, Dra. Yolanda Marmolejo-SantillánI, Dr. Víctor E. Reyes-CruzII, Dra. Erika Bustos BustosIII
I: Área Académica de Química. judith_callejas@yahoo.com.mx
II: Área Académica de Ciencias de la Tierra y Materiales
III: Centro de Investigaciones y Desarrollo en Tecnologías Electroquímicas, Querétaro, México
Resumen
Efluentes líquidos han sido tratados mediante electrocoagulación (EC), obteniendo resultados alentadores en remoción de contaminantes. El objetivo ha sido estudiar la aplicación de la EC para el tratamiento del lactosuero ácido, con reducción de carga orgánica. Se analizó en lactosuero valores de pH, pZ, punto isoeléctrico y DQO. Se usó un reactor electroquímico tipo batch de 2 L y se realizó un estudio volta y cronopotenciométrico para obtener condiciones de potencial y corriente empleando 3 electrodos soportados sobre placa de teflón y separación 10 mm; aluminio y hierro como ánodos, grafito y óxido de rutenio/titanio como cátodos y un electrodo de referencia. En y durante la EC se evaluó la cinética considerando como respuesta el mayor porcentaje de remoción de la DQO o porcentaje de eficiencia y variación del pH y pZ. Se concluye que el mejor arreglo de electrodos fue el del par Al-OxRut. Se obtuvo una variación del pH y pZ como resultado de reacciones anódicas y catódicas; las principales variaciones se producen con los arreglos Fe-OxRut y Al-OxRut. En las primeras 8 horas el pH incrementó de 4,82 a 8,67 y a 6,56 para las especies de Fe y Al. Entre las primeras 10 y 12 h de la EC se alcanza la máxima variación significativa así como la mayor remoción de la DQO por formación de coloides y emulsiones de oxihidróxidos de hierro y/o aluminio en los que se reincorporan por oclusión, las macromoléculas orgánicas. Las mayores remociones de DQO fueron con los pares Al-OxRut y Al-Graf, que presentaron un 83 % y 66 %, respectivamente a las 10 h. Para los arreglos de hierro no se llegó a alcanzar el 50 % de eficiencia.
Palabras clave: electrocoagulación, efluentes líquidos, demanda química de oxígeno, potencial zeta, eficiencia, lactosuero.
Abstract
Liquid effluents have been treated by electrocoagulation (EC), obtaining encouraging results in the removal of contaminants. The aim of this study was the application of the EC for the treatment of acid whey with reduced organic loading . Whey were analyzed for their pH, pZ, isoelectric point and COD. We used a batch-type electrochemical reactor of 2 L and a study volta and chronopotentiometric conditions for potential and current using 3 electrodes supported on Teflon plate separation of 10 mm, aluminum and iron as anode and graphite oxide ruthenium/titanium cathode and a reference electrode. In and for the EC was evaluated considering the kinetics in response the highest percentage of COD removal or efficiency percentage, and variation of pH and pZ. We conclude that the best arrangement of electrodes was the Al-OxRut. In the first 8 hours, the pH increased from 4,82 to 8,67 and 6,56 for Fe and Al species. Among the top 10 and 12 h of EC maximum is reached significant change and the increased removal of COD by the formation of colloids and emulsions oxyhydroxides of iron and/or aluminum in the occlusion re-entering the organic macromolecules. The COD removals were higher with the pairs Al-OxRut and Al-Graf, who had a 83 % and 66 % respectively at 10 h. To arrange for iron is not reached up to 50 % efficiency.
Keywords: electrocoagulation, liquid effluents, chemical oxygen demand, zeta potential, efficiency.
INTRODUCCION
La electrocoagulación (EC) es una técnica utilizada para el tratamiento de diversas aguas residuales. En este proceso son removidos los contaminantes que se encuentran suspendidos, emulsionados o disueltos en el medio acuoso, induciendo corriente eléctrica en el agua a través de placas metálicas paralelas de diversos materiales, siendo el hierro y el aluminio los más utilizados. En este caso la función de remoción de los contaminantes es llevada a cabo por la corriente eléctrica aplicada al medio contaminado (Arango etGarcés, 2009). Cuando esto ocurre, los contaminantes forman componentes hidrofóbicos que se precipitan o flotan, facilitando su remoción por algún método de separación secundario. Los iones metálicos se liberan y se dispersan en el medio líquido; estos iones metálicos tienden a formar óxidos metálicos que atraen eléctricamente a los contaminantes que han sido desestabilizados.
FUNDAMENTACION TEORICA
Efluentes líquidos de diferentes procesos industriales han sido tratados mediante electrocoagulación, obteniendo resultados alentadores en la remoción de contaminantes (Arango et Garcés, 2009); hecho que ha despertado el interés de la industria láctea por investigar e implementar esta tecnología en el tratamiento de sus aguas residuales y particularmente para el tratamiento de los residuos de quesería (suero lácteo).
Desde hace algunos años, en países como la ex Unión de Repúblicas Socialistas Soviéticas, Estados Unidos, Canadá, Alemania, Brasil y México, se está investigando y aplicando un sistema no convencional para remover los contaminantes de las aguas residuales industriales y domésticas al cual se le ha llamado Tratamiento Electroquímico de Efluentes. El tratamiento consiste en hacer pasar una corriente directa a través de dos electrodos que pueden ser de aluminio, cobre, hierro, titanio, grafito, acero, platino, entre otros, sumergidos en el efluente a tratar (Cristancho et al., 2010). Por otra parte, en las centrales lecheras se producen diariamente una considerable cantidad de aguas residuales, que suelen oscilar entre 4 y 10 L de agua por cada litro de leche tratada, según el tipo de planta. La mayor parte de éstas proceden fundamentalmente de la limpieza de aparatos, máquinas y salas de tratamiento, por lo que contienen restos de productos lácteos y productos químicos (ácidos, álcalis, detergentes, desinfectantes y otros), aunque también se vierten aguas de refrigeración que, si no se recuperan de forma adecuada, pueden suponer hasta 2-3 veces la cantidad de leche que entra en la central.
De la producción de queso se obtiene como residuo el lactosuero, suero de quesería o suero lácteo. Este residuo presenta factores de variabilidad, entre los que se señalan la especie de donde proviene la leche, el proceso tecnológico de fabricación del queso, con pasteurización o leche cruda, el corte de la cuajada y cocción para elaboración de quesos blandos, semiduros o duros, el prensado, la estación del año en que se produce, diluciones eventuales, procesos tecnológicos a que puede someterse el lactosuero para la recuperación de proteínas o lactosa, la evolución del producto durante el almacenamiento, entre otros. El lactosuero es definido como la sustancia líquida obtenida por separación del coágulo de leche en la elaboración de queso (Abaigar, 2009; Foegeding etLuck, 2002, Del Angel, 2009; CODEX STAN 289-1995, enmienda 2010; Parra, 2009). Es un líquido translúcido verde obtenido de la leche después de la precipitación de la proteína (caseína) (Parra, 2009).
El lactosuero que se libera, corresponde a cerca del 83 % del volumen de leche utilizada como materia prima. Este residuo corresponde al efluente que más contaminación provoca en las queserías si no se tiene un aprovechamiento posterior, ya que contiene gran cantidad de lactosa y proteínas. Por ello es aconsejable que estos sueros no sean vertidos de forma directa al cauce o a la depuradora, pues provocarían un enorme incremento de la DBO y la DQO. Algunas posibilidades de la utilización de este residuo han sido propuestas, pero las estadísticas indican que una importante porción de este residuo es descartada como efluente, el cual crea un serio problema ambiental (Aider et al., 2009; Arteaga et al., 2009; Miranda et al., 2009), debido a que afecta física y químicamente la estructura del suelo. En las plantas más modernas se deshidrata para obtener lactosuero en polvo, también puede obtenerse proteína y lactosa en polvo, productos con un alto valor añadido y de fácil venta (Koutinas et al., 2009; Almeida et al., 2009; Parra, 2009; Londoño et al., 2008). Además, contiene un perfil de minerales donde se destaca la presencia de potasio (K), lo que favorece la eliminación de líquidos y toxinas del organismo, dispone también de calcio (Ca), fósforo (P) y magnesio (Mg), y oligoelementos como zinc (Zn), hierro (Fe) y cobre (Cu), formando sales de gran biodisponibilidad para el organismo.
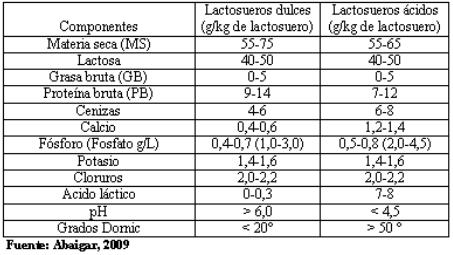
Dados los factores de variabilidad señalados, se puede encontrar una gama de lactosueros que fluctúan entre dos tipos extremos: ácidos y dulces. Sus características principales se muestran en la tabla 1. La composición del lactosuero en g/kg del producto bruto, se muestra en la tabla 2 (Abaigar, 2009). Ambos tienen altos contenidos de lactosa, proteínas y grasa.
Tabla 1
Origen y principales características de los lactosueros
derivados de la elaboración de quesos

Tabla 2
Composición promedio de los lactosueros dulces y ácidos
derivados de la elaboración de quesos
El objetivo de este trabajo ha sido estudiar la factibilidad de la aplicación de un proceso de EC para el tratamiento del lactosuero ácido, con la consecuente reducción de la carga orgánica, utilizando un reactor electroquímico tipo batch.
Metodología
El lactosuero a estudiar fue obtenido de la planta productora de lácteos San Francisco, situada en el municipio de Santiago de Anaya, Hidalgo, México. Fue trasladado y conservado en refrigeración en recipientes de vidrio previamente esterilizados para evitar su degradación.
Se analizó el lactosuero inicialmente en cuanto a sus contenidos y valores de pH, potencial zeta (pZ), punto isoeléctrico (pI) y demanda química de oxígeno (DQO). Las muestras fueron analizadas durante el proceso de EC y luego de finalizados dichos procesos, en el líquido depurado. La DQO se determinó según por el método de reflujo abierto (Clescerl et Eaton, 1992; APHA, 1998; NMX-AA-030-SCFI-2001). La determinación de pH se realizó con un potenciométro Conductronic (modelo PH10) y el potencial zeta (pZ) en equipo Zeta-sizer de la firma Malvern, modelo 3000 Hsa; se realizaron mediciones del pZ con variaciones de pH entre 1.0-10.0 para evaluar el punto isoeléctrico.
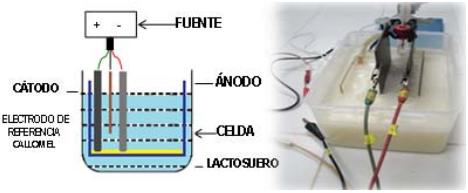
Se realizó un estudio voltamperométrico y cronopotenciométrico para obtener un primer acercamiento a los procesos de óxido-reducción que tienen lugar en los electrodos y en la solución de lactosuero y las condiciones energéticas de potencial y/o corriente. La microelectrólisis (MiE) se realizó en una celda tipo batch, con un volumen de 2 L, con recirculación como la que se muestra en la figura 1. En el estudio (MiE) se emplearon 3 electrodos (trabajo, auxiliar y referencia) soportados sobre una placa de teflón y con una separación de 10 mm (Arango etGarcés, 2007). Se probaron electrodos de aluminio y de hierro como electrodos de trabajo (ánodos), los electrodos auxiliares fueron de grafito y de óxido de rutenio/titanio (cátodos). Como electrodo de referencia se utilizó un electrodo de Calomel (mercurio-sulfato mercurioso). Se utilizó un potenciostato PARC 263A conectado a una fuente de poder KEPCO con capacidad de 2A. Se utilizó el software Power suite de la misma compañía.
Fig. 1 Reactor para electrocoagulación en batch.
Se valoraron las condiciones para la macroelectrólisis (MaE), a partir de las respuestas obtenidas durante la voltamperometría y cronoamperometría, además se determinaron las condiciones de potencial y/o corriente a tiempos prolongados en los cuales ocurre el proceso de EC con la mayor eficiencia en la remoción de la DQO. En y durante el proceso de EC Se evaluó la cinética considerando como factor de respuesta el mayor porcentaje de remoción de la DQO o porcentaje de eficiencia del proceso. Así mismo se evaluó la cinética de variación del pH y el pZ.
RESULTADOS Y DISCUSION
En la tabla 3 se observa un pH que clasifica al lactosuero como ácido ya que muestra un valor promedio de 4,82; según Panesar y colaboradores (Panesar at al., 2007; Abaigar, 2009) un lactosuero ácido es aquel que presenta un pH < 5. Al pH medido le corresponde un potencial redox (Eh) de 157,5 mV. No se ha encontrado en la bibliografía consultada ningún reporte que indique medidas de Eh en lactosueros. Sin embargo para el proceso de EC es un dato importante, ya que la solución presenta un potencial positivo y de baja magnitud, con ello la solución presenta carácter ligeramente oxidante por lo que favorecerá las reacciones de oxidación. La materia presente va a mostrar una tendencia a la oxidación y por lo tanto a descomponerse fácilmente.
Tabla 3
Valores de pH, pZ y CE en el lactosuero
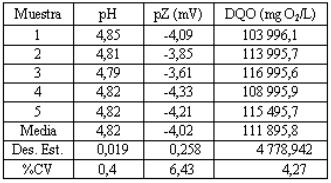
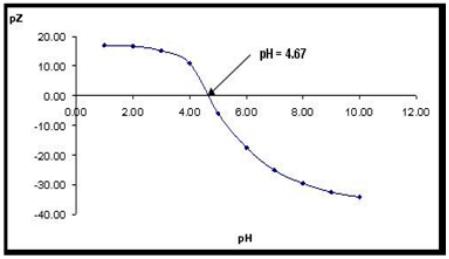
Se obtuvo un valor de pZ de -4,02 mV, el cual indica que aún existen productos suspendidos ya que el pI (donde pZ = 0,0) se obtuvo a pH 4,67 según se puede apreciar en la figura 2.
Fig. 2 Variación del pZ del lactosuero con el pH. Punto isoeléctrico a pH 4.67.
El valor del pI encontrado corresponde con lo reportado en la bibliografía como valor promedio en lactosueros ácidos luego de la precipitación de la caseína en la elaboración de quesos. Las proteínas que corresponden al lactosuero (20 % de las proteínas de la leche), son aquellas que se mantienen en solución tras precipitar las caseínas (a pH 4,6 y 20 °C) (Calvo, 1991; Jay, 2002, Calvo, 2004; Almecija, 2007).
En la tabla también se puede apreciar que la DQO es extremadamente elevada (> 110,000 mg de O2/L); estos contenidos corroboran que en la muestra de lactosuero pueden estar presentes restos de caseína sin precipitar ya que no se alcanzó un pH de 4.67 correspondiente al pI. Estos resultados son más elevados que los que se reportan (86,000 mg O2/L) para un lactosuero por Burhanettin y colaboradores (Burhanettin et al., 2004), por (80,000 mg O2/L) Najafpour y colaboradores (Najafpour et al., 2008) y casi el doble de lo reportado (60,000 mg O2/L) por Teniza (Teniza, 2008).
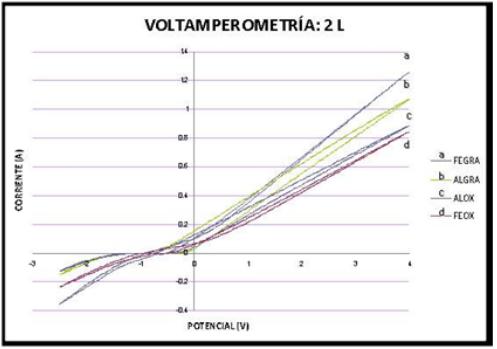
La figura 3 muestra el voltamperograma de los diferentes pares de electrodos Fe-Rut (d), Al-Rut (c), Fe-Gra (a) y Al-Gra (b) en 2 L de solución de lactosuero, donde el rango de estudio comprende -2,5 a +4, a una velocidad de 25mV/s. El barrido de potencial para los diferentes pares de electrodos se inició en dirección positiva (anódica) a partir del potencial de reposo, Ei= -650 mV, hasta el límite superior de potencial de +4 V; subsecuentemente, se invierte el barrido de potencial en dirección negativa (catódica) hasta -2,5 V.
Fig. 3 Voltamperometría cíclica para los diferentes pares de electrodos en una solución de
lactosuero. Para una velocidad de barrido de 25 mV s-1.
En los voltamperogramas correspondientes a los arreglos de hierro: Fe-Gra y Fe-OxRut (curvas a y d) se observa un proceso de oxidación en el intervalo de potencial de -550 a 3100 mV y -350 a 3600 mV respectivamente. Este proceso puede atribuirse a la disolución del electrodo de Fe principalmente y también a las características del medio, que es una solución que favorece reacciones de oxidación. Al invertir el potencial se aprecia el proceso de reducción del producto oxidado en el intervalo de -800 a -2300 mV y -800 a -2200 mV respectivamente. Por otra parte, comparando para un potencial de 4V se tiene la máxima corriente de oxidación en el arreglo de FeGra el cual corresponde a 1,i2A; mientras que FeOxRut presenta una corriente de 820 mA correspondiéndose así a la mínima; comparando con el resto de los arreglos.
Para los arreglos de aluminio, curvas b y c se observa un proceso de oxidación en los intervalos -200 a 3850 mV y -200 a 3700 mV de igual manera atribuido a la solución y en gran medida a los productos de oxidación en el barrido directo (disolución del electrodo) aunado a que se están utilizando potenciales muy positivos (hasta +4 V). El proceso de reducción presenta un intervalo de -1600 a -2300 mV y -1200 a -2300 mV respectivamente. Para estos arreglos de electrodos la corriente fue de 1,03 A y 868 mA.
A partir de los resultados mostrados se puede establecer el intervalo de potencial a utilizar en la siguiente etapa del estudio el cual corresponde a intervalos positivos, donde ocurren los procesos de oxidación. Para los arreglos de aluminio de -200 a 3850 mV y para hierro de +200 a 3600 mV.
Al comparar las corrientes de oxidación en el voltamperograma de los materiales utilizados como ánodos (Fe y Al) en los diferentes arreglos se tiene para Fe-Gra la mayor corriente de oxidación (1,2A) y en orden decreciente Al-Gra (1,03A), Al-Rut (868 mA) y finalmente Fe-Rut (820 mA).
Derivado de los resultados de la voltamperometría se fija una corriente de oxidación que permita no saturar la ventana de potencial del equipo (8V). Esta corriente fue de 400 mA.
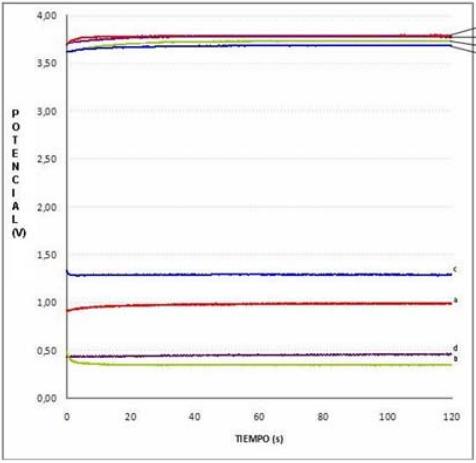
En la técnica cronopotenciométrica se impuso un pulso de corriente, obtenido de la voltamperometría (400 mA). Para ello se utilizó la misma celda electroquímica, bajo el arreglo de dos y tres electrodos para obtener el potencial de celda y el potencial teórico. La figura 4 muestra los transitorios de voltaje en un arreglo de 2 y 3 electrodos, obtenidos para los pares Al-Gra (b), Al-OxRut (c), y Fe-Rut (d) y en particular, de 500 mA para el arreglo de Fe-Gra (a).
Fig. 4 Curvas cronopotenciométricas de los diferentes pares de elctrodos con arreglos de 3 y 2
electrodos.
En la figura 4 se observa que las superficies de Fe y Al en los arreglos de 3 electrodos se establecen en una meseta de potencial; este comportamiento indica que se está oxidando una sola especie. Estas especies corresponden al Fe y Al, por la disolución de los electrodos en los diferentes arreglos, curvas a y d, b y c respectivamente de la parte superior. Para el arreglo de 2 electrodos se presenta un comportamiento similar (curvas de la parte inferior). El potencial de celda se realiza mediante los electrodos que interactúan en el proceso. El potencial de celda para Fe-OxRut correspondió a 3,783 V, para el par de electrodos Al-OxRut fue de 3,677 V, para Fe-Gra 3,660 V y finalmente para Al-Gra fue de 3,678 V. Se observa además, que el arreglo que mayor potencial de celda (2 electrodos) presenta es el de Fe-OxRut (3,783 V). Sin embargo, para el arreglo electroquímico de 3 electrodos (potencial teórico) el que mayor potencial presenta es Al-OxRut (1,290 V) y muestra el mismo comportamiento al presentar una sola meseta.
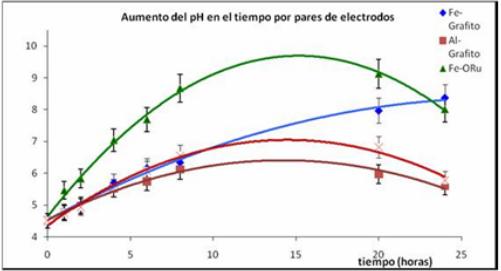
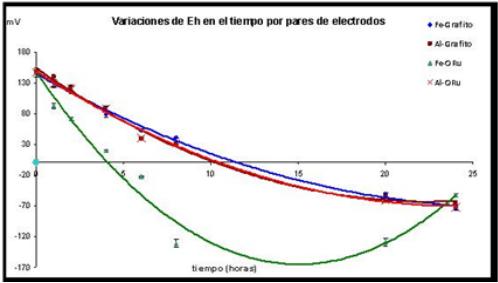
Con las condiciones predeterminadas se realizó el estudio cinético y se evaluó el comportamiento del sistema para los arreglos de electrodos mencionados. En las siguientes figuras (figuras 5 a la 8) se aprecian los resultados. Se puede observar la correlación inversa entre el pH y el Eh (figura 5 y 6). Así mismo se hace notar que en todos los casos y como resultado de la redisolución anódica, el aporte de las especies metálicas iónicas (Fe2+ y Al3+) y la reacción catódica de aporte en iones OH-, provoca un rápido incremento del pH, al menos durante las primeras 8 h (se incrementó de 4,82 a 8,67 para el caso de las especies de Fe y a 6,56 para el caso de las especies de Al). Este incremento aparentemente a partir de las 8 horas ya no se hace notable y hasta las 20 h sólo aumentó a 9,02 y 6,82 para Fe y Al respectivamente, es decir 0,35 y 0,26 unidades más de pH.
Fig. 5 Curvas cinéticas de variaciones del pH en el proceso de EC con arreglos de 2 electrodos.
Fig. 6 Curvas cinéticas de variaciones del Eh en el proceso de EC con arreglos de 2 electrodos.
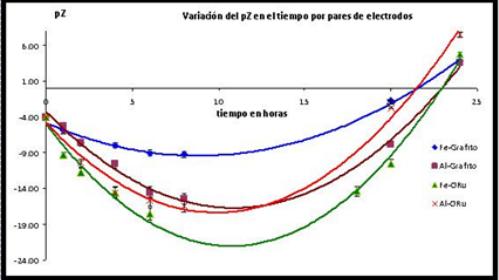
Fig. 7 Curvas cinéticas de variaciones del pZ en el proceso de EC con arreglos de 2 electrodos.
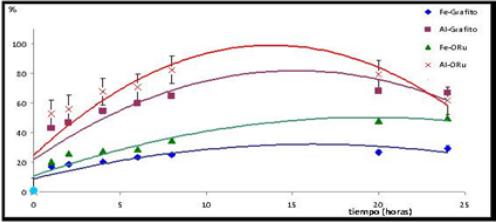
Fig. 8 Curvas cinéticas del porcentaje de eficiencia en la remoción de la DQO durante el
proceso de EC con arreglos de 2 electrodos.
Los incrementos del pH y la disminución del Eh que se dan como consecuencia de las reacciones catódica y anódica se explican para los arreglos con electrodos de Fe:
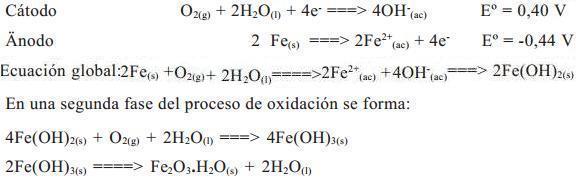
Tanto, en y durante la formación de las fases sólidas de las especies anteriores [Fe(OH)2(s); Fe(OH)3(s); Fe2O3.H2O(s)], se produce la coprecipitación de especies orgánicas solubilizadas o parcialmente en estado coloidal.
Para los arreglos con electrodos de Al:
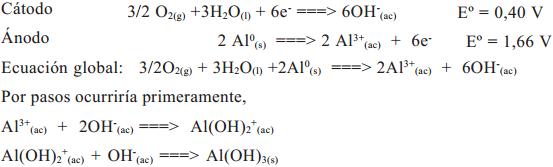
Igual que en el caso de electrodo de hierro, con el arreglo de electrodos de Al, en y durante la formación del Al(OH)3 se produce la coprecipitación por oclusión, de especies orgánicas solubilizadas o en forma coloidal; incluso se pueden llegar a formar especies poliméricas inorgánicas de oxihidróxidos de aluminio como podría ser, [AlO4Al12(OH)24(H2O)24] 7+, conocido como Al13 (Acevedo et al., 2008).
Todos los arreglos de electrodos mostraron un incremento del pH durante las primeras diez horas del proceso de EC; a partir de ese tiempo ya no aumenta notablemente esta tendencia, e incluso al prolongarse el tiempo se aprecia una disminución que se acentúa entre las 20 y 24 h. De forma similar se aprecia en la figura 7 la variación del pZ con el tiempo; que durante las primeras diez horas tiende a disminuir mostrando una tendencia a estabilizar las suspensiones coloidales que se forman y a partir de ese tiempo se invierte esta tendencia, lo que corrobora la ruptura de estabilidad de las emulsiones y su proceso de floculación y/o sedimentación.
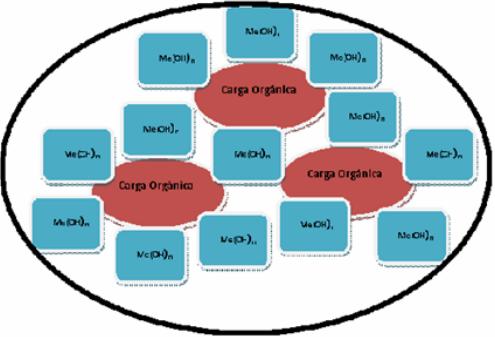
Esto permite confirmar la mayor remoción de la DQO durante las primeras diez horas del proceso de EC (figura 8), por formación de coloides y emulsiones de oxihidróxidos de hierro y/o aluminio en los que se reincorporan por oclusión, las macromoléculas orgánicas de grasas, proteínas, lactosa y otras presentes en el lactosuero (ver figura 9).
Fig. 9 Formación de agregados de partículas coloidales con oclusión de moléculas orgánicas
que posteriormente floculan o precipitan.
De la figura 8 se observa que el mejor arreglo de electrodos para la EC con la mayor remoción de DQO fue el par Al-OxRut, seguido del par Al-Graf, que presentaron un 81 % y 64 %, respectivamente en las primeras 8 horas. De la figura se puede asumir que entre las diez y doce horas se pueden alcanzar eficiencias entre 80 % y 90 % para los arreglos con aluminio en tanto los arreglos de hierro no sobrepasarían el 50 % de eficiencia.
CONCLUSIONES
La EC puede resultar en una técnica viable y económica para la remoción de carga orgánica en el lactosuero residual acuoso. Se concluye que el mejor arreglo de electrodos evaluados fue el del par aluminio-óxido de rutenio, con un potencial redox entre 0,2V y 4,0V y fijando una corriente de oxidación a 400 mA, que permitiera no saturar la ventana de potencial del equipo utilizado. Bajo estas condiciones se realizó el estudio cinético y se obtuvo primeramente una variación del pH, el Eh y el pZ como resultado de las reacciona anódicas y catódicas; las principales variaciones se producen con los arreglos Fe-OxRut y AlOxRut. Durante las primeras 8 horas se incrementó de 4,82 a 8,67 y a 6,56 para las especies de Fe y Al, respectivamente. Este incremento entre las 8 y las 20 h no es notable y sólo aumentó a 9,02 y 6,82 para Fe y Al respectivamente, es decir 0,35 y 0,26 unidades más de pH. Se concluye por tanto que entre las primeras 10 y 12 h del proceso de EC se alcanza prácticamente la máxima variación significativa. Entre las variaciones de Eh y pZ existe una relación directa. Se pudo confirmar la mayor remoción de la DQO durante las primeras diez horas del proceso de EC, por formación de coloides y emulsiones de oxihidróxidos de hierro y/o aluminio en los que se reincorporan por oclusión, las macromoléculas orgánicas de grasas, proteínas, lactosa y otras presentes en el lactosuero. El mejor arreglo de electrodos para la mayor remoción de DQO fue el par Al-OxRut, seguido del par Al-Graf, que presentaron un 83 % y 66 %, respectivamente a las 10 horas. Para los arreglos de hierro no se llegó a alcanzar el 50 % de eficiencia.
BIBLIOGRAFIA
1. ABAIGAR, A. El lactosuero en la alimentacion del ganado porcino. ITG Ganadero. Págs. 13-17. 2009.
2. ACEVEDO-SANDOVAL, O; PRIETO-GARCIA, F; GORDILLO-MARTÍNEZ, A. J. Identificar las fracciones de aluminio en un andosol del estado de Hidalgo, México. Revista de la Sociedad Geológica de España. 21(3-4). 2008. Págs. 125-132.
3. AIDER, M., HALLEUX, D. AND MELNIKOVA, I. Skim acidic milk whey cryoconcentration and assessment of its functional properties: Impact of processing conditions. Innovative Food Science and Emerging Technologies. 10(3):334-341. 2009.
4. ALMÉCIJA, M. C. Obtención de lactoferrina bovina mediante ultrafiltración de lactosuero. Tesis Doctoral. Universidad de Granada, Departamento de Ingeniería Química, España. 2007. Págs. 30-33.
5. ALMEIDA, K.E., A.Y. TAMIME and M.N. OLIVEIRA. Influence of total solids contents of milk whey on the acidifying profile and viability of various lactic acid bacteria. LWT-Food Science and Technology 42(2). 2009. Págs. 672-678.
6. APHA. Standar Methods for the examination of water and wastewater. Edición 20 Batilmore. 1998.
7. ARANGO, A., GARCÉS, L. F. Diseño de una celda de electrocoagulación para el tratamiento de aguas residuales de la industria láctea. Universidad Eafit, Vol. 43, N° 147:56-67. 2007.
8. ARANGO, A., GARCÉS, L. F. Influencia de la conductividad eléctrica en la electrocoagulación de aguas residuales de la industria láctea. Producción + Limpia-Julio-Diciembre, Vol.4, No.2:54-64. 2009.
9. ARTEAGA, M., MOLINA, L. H., PINTO, M., BRITO, C. Caracterización de queso Chanco enriquecido con suero lácteo en polvo. Rev Chil Nutr Vol. 36, Nº 1:53-62. 2009.
10. BURHANETTIN, F.; BULENT, K.; ERGUN, Y.; ALPER, N. Cheese whey treatment performance of an aerobic jet loop membrane bioreactor. Process Biochemistry Vol. 39(12):2283-2291. 2004.
11. CALVO, M. Microbiología de los alimentos. Editorial Acribia, Zaragoza, España. 1999. Págs.1-155.
12. CALVO, M. La Ciencia y la Tecnología de los Alimentos. Algunas notas sobre su desarrollo histórico. Alimentaria, 41 (359). 2004. Págs. 19-34.
13. CLESCERI, L. S. AND EATON, A. Standard methods for the examination of water and wastewater. 18 ed. Washington. 1992. Págs. 3-115.
14. CODEX STAN 289-1995. Norma del CODEX para sueros en polvo. Norma del CODEX Alimentarius. Argentina. 2010.
15. CRISTANCHO, D., MORALES, N. B., GARAVITO, J. Z., CHÁVEZ, A. "Descripción del comportamiento de un prototipo para tratamiento electroquímico de aguas residuales industriales". Revista Academia y Virtualidad Vol. 3(1). 2010. Págs. 125-136.
16. DEL ANGEL, J.A., HERNÁNDEZ J.M., JIMÉNEZ V.M., MUSULE, R. Tratamiento de lactosueros, diseño mediante la aplicación de un evaporador solar. 2009.
17. FOEGEDING, E. & P. LUCK. Whey protein products. New York. 2002.
18. JAY, J. M. Microbiología moderna de los alimentos. Editorial Acribia, Zaragoza, España. 4ta edición. 2002. Pág. 315.
19. KOUTINAS, A. A.; PAPAPOSTOLOU, H.; DIMITRELLOU, D.; KOPSAHELIS, N.; KATECHAKI, E.; BEKATOROU, A. AND BOSNEA, L.A. Whey valorisation: a complete and novel technology development for dairy industry starter culture production. Bioresource Technology. 100(15). 2009. Págs. 3734-3739.
20. LONDOÑO, M. "Aprovechamiento del suero ácido de queso doble crema para la elaboración de quesillo utilizando tres métodos de complementación de acidez con tres ácidos orgánicos. Perspectivas en nutrición humana". Revista Perspectivas en Nutrición Humana-Escuela de Nutrición y Dietética Universidad de Antioquia 16. 2006. Págs. 11-20.
21. MIRANDA, O., PONCE, I., FONSECA, P. L., CUTIÑO, M., DÍAZ, R. M., CEDEÑO, C. Características fisico-químicas de sueros de queso dulce y acido producidos en el combinado de quesos de Bayamo. Revista Cubana Aliment Nutr 19(1). 2009. Págs. 21-25.
22. NAJAFPOUR, G. D.; HASHEMIYEH, B. A.; ASADI, M.; GHASEMI, M. B. Biological Treatment of Dairy Wastewater in an Upflow Anaerobic. American-Eurasian J. Agric. & Environ. Sci., 4 (2). 2008. Págs. 251-257.
23. NMX-AA-030-SCFI-2001. Norma Mexicana. Análisis de agua-Determinación de fósforo total en aguas naturales, residuales y residuales tratadas-Método de prueba. 2001.
24. PARRA, R. A. Lactosuero: Importancia en la industria de alimentos. Rev. Fac. Nal. Agr. Medellín 62(1). 2009. Págs. 4967-4982.
25. TENIZA, O. Estudio Del suero de queso de leche de vaca y propuesta para el reuso del mismo. Tesis de Maestría en Tecnología. Instituto Politécnico Nacional. Centro de Investigación en Biotecnología aplicada, Unidad Tlaxcala, México. 2008. Pág. 62.
Recibido: Abril 2012
Aprobado: Agosto 2012
Lic. Judith Callejas-HernándezI. Área Académica de Química. judith_callejas@yahoo.com.mx