INTRODUCCIÓN
El cáncer de mama es la neoplasia más común en mujeres tanto en países desarrollados (794 000 casos) como subdesarrollados (883 000 casos). Las tasas de incidencia varían por regiones, desde 27 por 100 000 habitantes en África y Asia Oriental, hasta 96 en Europa Occidental. Esta neoplasia maligna representa la quinta causa de muerte de todos los cánceres con 324 000 muertes, 14,3% del total.1
A nivel mundial, el cáncer de mama representa aproximadamente un 23% de todos los cánceres diagnosticados y un 14% de las causas de muerte por cáncer. La sociedad americana del cáncer estima que 249 260 mujeres americanas han sido diagnosticadas con cáncer de mama invasivo y 40 890 murieron debido a este cáncer en el año 2016.2 En Estados Unidos el cáncer de mama es la neoplasia más frecuente en mujeres y la segunda causa de muerte por cáncer. Los países con mayor incidencia son Estados Unidos y el norte de Europa y con baja incidencia áreas como África y Asia.3
Según datos estadísticos de la Sociedad Americana del Cáncer de Estados Unidos el riesgo de cáncer de mama invasor se incrementa con la edad, este es de un caso por cada 206 mujeres (del nacimiento a los 39 años de edad), de uno en 27 (de los 40 a los 59 años), de uno en 29 (de los 60 a los 69 años) y de uno en 15 (de los 70 años en adelante), con un riesgo global de 12,08% durante toda la vida (una de cada ocho mujeres).4
En Cuba las tasas de incidencia y de mortalidad son elevadas a pesar de contar, desde hace más de veinte años, con un Programa de detección precoz del cáncer de mama. Según el Anuario estadístico del año 2020 en las féminas hubo una incidencia de cáncer localizada, en primer lugar, en la piel, y como segunda localización, en la mama, con 3 875 casos nuevos. En cuanto a la mortalidad el cáncer de mama se ubicó en el segundo lugar en el sexo femenino, con 1 718 defunciones por esta causa, con una tasa de 30,5 por cada 100 000 mujeres; solo fue desplazado por los tumores de tráquea, bronquios y pulmón (tasa de 39,5 por cada 100 000 habitantes del sexo femenino).5
En el diagnóstico anatomopatológico del carcinoma mamario se ha utilizado tradicionalmente la clasificación histológica basada en la morfología; el carcinoma ductal es la variante más común.2,6 Aunque esta clasificación no ha dejado de tener su utilidad, se ha observado con frecuencia que tumores con un perfil clínico, histopatológico y estadio semejantes pueden tener marcadas diferencias en el comportamiento clínico y en el pronóstico debido, básicamente, a factores moleculares.2
Actualmente, el conocimiento de la biología de los tumores de mama ha sufrido un cambio dramático porque se ha mostrado que esta enfermedad puede ser mejor comprendida desde el punto de vista biológico por los genes que expresa, por lo que esta neoplasia se puede clasificar desde el punto vista inmunohistoquímico.
La clasificación inmunohistoquímica fue descrita por primera vez por Perou, en el año 2000, y se basa en la capacidad de los tumores de expresar o no receptores hormonales para estrógeno, progesterona, factor de crecimiento epidérmico 2 (HER2), gen p53, catepsina de índice mitótico determinado por el antígeno Ki67.7
Según la expresión o no de los receptores hormonales existen subtipos inmunohistoquímicos que son: luminal A, luminal B, HER2/neu y tipo basal o triple negativo.3,8,9 Esta clasificación es particularmente útil en la actualidad porque permite al médico seguir un adecuado tratamiento y brindar información acerca del pronóstico, la tasa de recurrencia y la sobrevida de cada subtipo de cáncer; tienen los luminales un mejor pronóstico por su buena respuesta al tratamiento endocrino y los subtipos HER2/neu y triple negativo peor pronóstico por falta de respuesta a este tipo de terapia.10
El HER2 es un protooncogén localizado en el brazo largo del cromosoma 17, concretamente en la región 17q21.1, que codifica una glicoproteína de membrana de 185 kDa con actividad tirosina quinasa en su dominio intracitosólico. Se trata de un receptor para el factor de crecimiento de tipo epidérmico humano. Es clave para el crecimiento y la división normal de las células, por lo que su expresión anormal está vinculada a procesos cancerosos.11
La sobreexpresión de HER2 en el carcinoma de la mama está asociada a una incrementada actividad biológica del tumor, es decir, una tasa de división acelerada por mayor respuesta de la célula a los niveles normales de factores de crecimiento;6) generalmente indica una evolución desfavorable del cáncer de mama. Las pacientes con amplificación de HER2/neu presentan, habitualmente, una forma más agresiva de cáncer y mayor resistencia a tratamientos convencionales.2,12,13,14,15
En el Hospital “Celestino Hernández” de la Provincia de Villa Clara se diagnostican cada año nuevos casos de carcinoma mamario, los que son enviados al Instituto Nacional de Oncología y Radiobiología (INOR), en Ciudad de La Habana, para ser sometidos a estudio inmunohistoquímico usando cuatro marcadores básicos: receptores hormonales (estrógeno y progesterona), HER2 y Ki67 para determinar el índice de proliferación.
La presente investigación tuvo como objetivo determinar la incidencia de la sobreexpresión pura del oncogén HER2, es decir, sin coexpresión concomitante de receptores hormonales de estrógeno (RE) y progesterona (RP), en pacientes diagnosticadas con carcinoma de mama en el Hospital “Celestino Hernández” y la relación de la sobrexpresión del HER2, con otras variables clínico-patológicas de valor pronóstico.
MÉTODOS
Diseño y población
Se realizó un estudio descriptivo, retrospectivo en el Hospital Asistencial “Celestino Hernández Robau” de la Ciudad de Santa Clara, Provincia de Villa Clara, en el período comprendido de enero de 2017 a junio de 2019. La población de estudio estuvo conformada por las pacientes con diagnóstico histopatológico de carcinoma de mama infiltrante atendidas en el hospital en ese período de tiempo, las biopsias que se les realizaron fueron sometidas a estudio inmunohistoquímico para determinar el estado de los receptores estrogénicos, de progesterona, HER2 y el por ciento de proliferación de células malignas.
Se incluyeron en el estudio las pacientes con carcinomas mamarios que expresaron exclusivamente HER2 y que fueron negativos a receptores hormonales (subtipo HER2/neu),3,11,16 no fueron incluidas las pacientes con tumores que expresaron de forma concomitante uno o ambos receptores hormonales, denominados en algunas bibliografías subtipo luminal B (RE+ o RP+ -o ambos-, HER2+).11,16,17
Tampoco se incluyeron en el estudio las pacientes con:
Diagnóstico histopatológico de carcinoma mamario in situ (no invasivo) porque, en estos casos, la sobreexpresión del oncogén HER2 no tiene valor pronóstico.
Estudio inmunohistoquímico incompleto por encontrarse en falta algún marcador en el momento del procesamiento o presentar la muestra de tejido algún artefacto que imposibilitara su adecuado estudio.
Se identificaron los casos positivos para HER2 para determinar su incidencia dentro de todos los carcinomas mamarios diagnosticados en el hospital durante ese período y se determinó la relación existente entre la sobreexpresión del oncogén y otras variables clínico-patológicas de valor pronóstico.
Variables del estudio
0 (negativo): no hay tinción o existe tinción débil de membrana celular en menos de un 10% de las células tumorales
1+ (negativo): se aprecia una tinción débil, apenas perceptible, en más de un 10% de las células tumorales. Las membranas celulares se observan teñidas parcialmente y se observan en la misma célula porciones de su membrana que están teñidas y otras no
2+ (equívoco o dudoso): se observa una tinción débil o de intensidad moderada de toda la membrana celular en más del 10% de las células tumorales. En estos casos se requieren estudios moleculares adicionales con hibridación in situ fluorescente o técnica de FISH para determinar si el oncogén HER2 está realmente sobreexpresado
3+ (positivo): se observa una tinción intensa a nivel de toda la superficie celular en más del 30% de las células tumorales.
Edad: variable cuantitativa discreta. Se refiere a la edad en años que presentaba cada paciente en el momento del diagnóstico.
Talla de la lesión tumoral: variable cuantitativa continua. Se refiere al tamaño de la lesión tumoral. Fue dada en centímetros (cm). Aunque cada lesión fue medida en las tres dimensiones en el momento del estudio anatomopatológico, fue el diámetro mayor de cada lesión diagnosticada el que se tomó como referencia en este estudio. En el análisis de la talla tumoral se utilizaron los rangos siguientes: menor o igual a 2cm (≤2cm), mayor de dos y menor o igual a 5cm (˃2 y ≤5cm) y más de 5cm (˃5cm), los que fueron tomados de la clasificación TNM de los carcinomas mamarios.20
Tipo histológico: variable cualitativa nominal. Se refiere al tipo morfológico del tumor diagnosticado por microscopia óptica convencional. La histología de cada lesión tumoral diagnosticada se determinó de acuerdo a su morfología evaluada con técnica de rutina (hematoxilina-eosina). Se utilizó la clasificación de la OMS (Organización Mundial de la Salud) vigente de 2019.21
Grado histológico: variable cualitativa ordinal. Se refiere al grado de diferenciación del tumor. Las lesiones diagnosticadas fueron graduadas histológicamente a través del score histológico de Nottingham, que corresponde al sistema de graduación de Scarff-Bloom-Richardson, modificado por Elston y Ellis. De acuerdo a este score se evaluaron la formación de túbulos, el pleomorfismo nuclear y el conteo mitótico del tumor. A cada variable se le dio el score 1, el 2 o el 3 y con la suma de los mismos se obtuvo el grado histológico total, según el que el grado 1 (score total=3 a 5 puntos) se corresponde con tumores bien diferenciados con un pronóstico favorable; el grado 2 (score total=6 a 7 puntos) con tumores moderadamente diferenciados con pronóstico intermedio y el grado 3 (score total=8 a 9 puntos) se corresponde con lesiones tumorales poco diferenciadas, con un comportamiento biológico más agresivo y un pronóstico desfavorable.20
Proliferación celular: variable cuantitativa discreta. Es una manera de medir qué tan rápido crecen y se dividen las células cancerosas. Fue estudiada a través de técnicas de inmunohistoquímica mediante la determinación de Ki67 (proteína reguladora del ciclo celular), la que ha tenido un papel importante en la clasificación tumoral y, por lo tanto, es parte de los factores pronósticos y predictivos de los carcinomas mamarios. Valores altos de Ki-67 significan que muchas células se dividen, por lo que el cáncer probablemente crezca y se propague más rápido.20
Debido a la falta de consenso que aún existe sobre los puntos de corte para la evaluación del Ki67 y a la variabilidad de interpretación entre laboratorios y observadores20 se tomó, en este estudio, el punto de corte del 30% por debajo del que se considera índice de proliferación bajo y por encima índice de proliferación alto.
La investigación se organizó en cuatro etapas:
Se realizó una revisión documental de las boletas de solicitud de biopsias en el Departamento de Anatomía Patológica y de las historias clínicas archivadas en el Departamento de Estadística y Archivos.
Se realizó una revisión exhaustiva de los resultados de los estudios inmunohistoquímicos realizados en el INOR que se recibieron el Hospital “Celestino Hernández” por vía de correo electrónico.
Análisis estadístico
Las variables de interés fueron recopiladas en una base de datos Excel del paquete de Office 2016. Una vez obtenidos los datos se examinó individualmente la distribución de cada una de las variables, se utilizaron tablas para mostrar la información recolectada y se mostraron los datos obtenidos en expresión nominal y porcentual.
Aspectos éticos
El análisis fue documental, por lo que no se violó ninguno de los principios de la ética en la investigación. Se tuvo en cuenta, además, el consentimiento del Comité de Ética de la Investigación del Hospital “Celestino Hernández” y la debida autorización de los directivos y del Jefe del Departamento de Anatomía Patológica de esa institución para llevar a cabo la investigación.
RESULTADOS
En la presente investigación fueron incluidas 293 pacientes con diagnóstico de carcinoma mamario invasivo, de las que 22 (7,5%) presentaron sobreexpresión exclusiva del oncogén HER2/neu sin expresión concomitante de receptores hormonales.
De las 22 pacientes con carcinomas HER2/neu positivos 17 (77,3%) tenían edades superiores a 50 años en el momento del diagnóstico, con una media de 60,5 años; el grupo etáreo predominante fue el comprendido entre 51 y 60 años (36,4%) -Tabla 1-.
Tabla 1 Distribución de la sobreexpresión de HER2 en los carcinomas mamarios según el grupo de edad

Fuente: historias clínicas y boletas de solicitud de biopsia
En relación a la talla tumoral 20 pacientes (90,9%) presentaron lesiones tumorales mayores de 2cm; se reportaron con mayor frecuencia las lesiones con tallas mayores de dos y menores de 5cm (Tabla 2).
Tabla 2 Distribución de la sobreexpresión de HER2 en carcinomas mamarios según la talla tumoral (cm)

Fuente: historias clínicas y boletas de solicitud de biopsia
En cuanto al tipo histológico se informó el no especial (carcinoma ductal invasivo) en 21 pacientes (95,45%) con carcinomas HER2 positivo y en solo una (4,54%) la histología lobulillar.
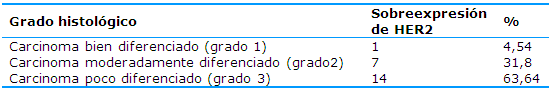
Con respecto al grado histológico de las pacientes con carcinomas HER2/neu positivos 14 (63,64%) presentaron variantes histológicas poco diferenciadas y solo una (4,54%) presentó una variante histológica bien diferenciada (Tabla 3).
Tabla 3 Distribución de la sobreexpresión de HER2 en carcinomas mamarios según el grado histológico
Fuente: historias clínicas y boletas de solicitud de biopsia
En cuanto al índice de proliferación tumoral el 77,3% de las pacientes con carcinomas HER2/neu positivos (17 casos) presentaron índices elevados (Ki67 ≥30%) -Tabla 4-.
DISCUSIÓN
Gracias a los resultados obtenidos en esta investigación se observó que la frecuencia de sobreexpresión de HER2/neu en pacientes con cáncer de mama fue del 7,5%, cifra inferior a las de estudios realizados en Perú, en los que el 23,1% de las pacientes estudiadas sobreexpresaron el oncogén HER2,22 y en México, en los que se halló en un 19,7% de casos;1 sin embargo, en otros estudios realizados en Colombia y en Cuba (Pinar del Río) se encontraron frecuencias similares, 7,2 y 10,6% de casos respectivamente.23,24
En cuanto a la edad la literatura plantea que los carcinomas que sobreexpresan HER2 tienen mayor incidencia en las mujeres posmenopáusicas (77, 86,6%),16,25 lo que coincide con los resultados de este estudio, en el que el 77,2% de las pacientes con tumores que expresaron HER2 eran mayores de 50 años. Resultados similares se obtuvieron en otro estudio que mostró una edad promedio de 58,1 años;8 sin embargo, en un estudio realizado en Lima, Perú, se obtuvieron resultados diferentes porque el mayor por ciento de las pacientes que sobreexpresaron HER2 (70,59%) tenían menos de 50 años de edad.12
Con respecto a la talla tumoral en este estudio el 90,9% de las pacientes con tumores HER2/neu positivos tuvieron en el momento del diagnóstico lesiones grandes de talla mayor de 2cm. Estas estadísticas son superiores a las informadas en la literatura en la que se plantea que un 53 a un 58% de las pacientes con carcinomas HER2/neu positivos presentan lesiones grandes o en estadio avanzado.25 Esta diferencia podría ser aparente si se tiene cuenta que el número de pacientes con carcinomas mamarios HER2/neu positivos en esta investigación es relativamente pequeño, lo que es una de las principales limitaciones del presente estudio.
En relación al tipo histológico la literatura refiere la asociación del tipo histológico ductal (tipo no especial en la clasificación de la OMS de 2019) con la sobreexpresión del oncogén HER2.25 Esta asociación se corroboró en la presente investigación, en la que el 95,45% de las pacientes fueron diagnosticadas con carcinomas ductales. En el Hospital Regional General “Ignacio Zaragoza”, México, también se demostró esta asociación porque se encontró el tipo histológico ductal en el 75% de las pacientes con tumores que sobreexpresaron HER2.1 Esta asociación se debe a la elevada incidencia de este tipo histológico (aproximadamente el 80%) del total de carcinomas mamarios diagnosticados cada año.11,25
En cuanto al grado histológico este estudio mostró que el 63,64% de las pacientes que sobreexpresaron HER2 tuvieron diagnóstico de carcinomas mamarios poco diferenciados, lo que concuerda con la literatura25 y con los resultados obtenidos en un estudio realizado en el Hospital México, en San José, Costa Rica, en el que el 54% de las pacientes diagnosticadas con carcinomas mamarios HER2 positivos tuvieron una histología ductal de alto grado (poco diferenciado).26
El índice de proliferación tumoral en las pacientes con carcinomas HER2/neu positivos fue elevado en más del 70% de las pacientes. La literatura refiere que los carcinomas HER2/neu positivos muestran valores altos de Ki67,18,25,27,28 según algunos autores entre un 50 y un 63,2% de los casos diagnosticados.25 Estas estadísticas son inferiores a las obtenidas en esta investigación, lo que también puede explicarse por el número limitado de los casos estudiados.















