INTRODUCCIÓN
La obesidad abdominal en la población común genera alteraciones metabólicas aún en ausencia de adiposidad general, la que durante el embarazo promueve el incremento de la resistencia a la insulina (RI),1 marcador de riesgo cardiometabólico para lo que la ultrasonografía constituye un método de gran utilidad porque permite discriminar los compartimientos adiposos del abdomen al inicio de la gestación y aproximarse a su diagnóstico.2
En la obesidad abdominal concurren alteraciones metabólicas como los bajos niveles de HDL (lipoproteínas de alta densidad) colesterol, altos valores de triglicéridos séricos y de colesterol total, alteraciones de la glucemia e hipertensión.3
Entre las adaptaciones del organismo femenino durante la gestación se encuentra la movilización del tejido adiposo de reserva que produce aumento del depósito adiposo tanto en las paredes abdominales como en su cavidad. En la cavidad se desencadenan los mayores desórdenes endocrino-metabólicos: alteraciones aterogénicas, protrombóticas e inflamatorias que incrementan significativamente el riesgo de desarrollar, consecutivamente, trastornos cardiovasculares.4
El incremento del tejido adiposo visceral en las gestantes conduce a la liberación desregulada de adipocitoquinas, ácidos grasos y marcadores inflamatorios que provocan RI, por lo que la triada obesidad, inflamación y embarazo representa una relación peligrosa para la salud materna y fetal.5
La inflamación crónica, el estrés oxidativo y la RI durante el embarazo, con el consecuente incremento de la glucemia, tienen la capacidad de alterar el crecimiento fetal.6 Las ecografías fetales, a pesar de ser los exámenes más importantes durante el embarazo, no han podido demostrar estabilidad del crecimiento fetal;7 sin embargo, se han realizado pocos estudios longitudinales del crecimiento intrauterino y de las repercusiones de diferentes variables analíticas maternas sobre el crecimiento del feto.8
Algunos estudios evaluan las diferencias de trayectoria en el crecimiento fetal referidos al estatus de exceso ponderal de la gestante o sus consecuencias, pero no se discrimina si las verdaderas causas de las afectaciones del crecimiento fetal son los excesos ponderales o las comorbilidades asociadas a ellos.9
Un estudio reciente propone la alternativa del uso de estándares de peso fetal y percentiles personalizados a las características maternas al encontrar mayor asociación con la predicción del peso fetal en las características materna que en las variaciones de las variables biométricas.10
El estudio de esta problemática constituye un tema de gran actualidad para el perfeccionamiento de las acciones de atención prenatal, que tiene como factor agregado el conocimiento de alteraciones del crecimiento fetal vinculadas con la distribución adiposa del abdomen. El presente trabajo tiene como objetivo determinar la asociación de la variación de los estratos adiposos de la pared abdominal anterior durante los trimestres primero y segundo con la presencia de resistencia a la insulina al inicio de la gestación y con la biometría fetal.
MÉTODOS
Diseño y población
Se realizó un estudio analítico longitudinal en el Policlínico Docente “Chiqui Gómez Lubián” de la Ciudad de Santa Clara, Provincia de Villa Clara, en una población de 144 gestantes de peso adecuado aparentemente sanas, con edad reproductiva óptima, nulíparas y embarazos simples, a las que se les realizó la captación antes de las 12,6 semanas de gestación, en el período de noviembre de 2018 a febrero de 2019. Se obtuvo una muestra no probabilística de 123 gestantes según criterios de inclusión (ciudadanía cubana, residencia en el Municipio de Santa Clara y consentimiento expreso de participar en la investigación), de exclusión (haber logrado el embarazo como resultado de estimulación de la ovulación, drogas o tecnología de reproducción asistida, consumo habitual de drogas lícitas o ilícitas en un período menor de un año) y de salida (pérdida fetal durante el embarazo, interrupción de la gestación por indicación genética, traslado de área de salud y abandono voluntario del estudio).
Técnicas y procedimientos para la recolección de la información
El estudio se realizó en las consultas médicas del área de salud programadas para la atención prenatal de la gestante desde el momento de la captación. Mediante revisión documental se obtuvieron los resultados de los exámenes de laboratorio indicados a la captación (glucemia y triglicéridos).
En coincidencia con la realización de la biometría fetal del primer y segundo trimestres se realizaron mediciones ultrasonográficas de los estratos adiposos de la pared abdominal anterior. Los resultados de la biometría del tercer trimestre se obtuvieron en correspondencia con la asistencia a su realización. Todas las mediciones ultrasonográficas se realizaron con un equipo de alta resolución marca Toshiba y con un transductor lineal 3.5 MGz, todas se realizaron por un mismo Especialista en Medicina General Integral diplomado en Ultrasonografía.
Toda la información se registró en una planilla de recolección de datos.
Variables del estudio
Variables maternas:
Resistencia a la insulina: determinada a través del índice de glucosa y triglicéridos (TGC). Estos resultados se obtuvieron a partir del procesamiento de muestras de sangre en el laboratorio clínico del área de salud. Índice glucosa y TGC= Ln [TGC (mg/dl)×glucosa (mg/dl)/2] (valor cuantitativo).11 Valor normal no definido para población gestante por este método. La variable se transformó a cualitativa en base al valor del 75 percentil de la población en estudio (8,43) y se consideró:
Grasa subcutánea abdominal (GrSubc) (mínima) (mm): panículo adiposo de la mitad superior de la pared abdominal anterior por encima del ombligo a nivel de la línea alba (grosor subcutáneo mínimo). Se mide en sentido perpendicular a la superficie entre la piel y la línea alba a partir del apéndice xifoideo desplazando el transductor perpendicularmente en dirección al ombligo.
Grasa preperitoneal (GrPrep) (máxima) (mm): capa de tejido adiposo entre la línea alba y la hoja visceral de peritoneo que reviste la cara diafragmática del hígado. Se mide colocando el transductor perpendicular a la superficie corporal, a nivel del apéndice xifoideo y desplazándolo sobre la línea alba en dirección al ombligo.
Variables ultrasonográficas biométricas fetales:
Diámetro biparietal (DBP): medición que se realiza entre las superficies externas de ambos huesos parietales en la porción más ancha del cráneo.12
Circunferencia cefálica fetal (CC): se calcula a partir del DBP y el diámetro fronto-occipital a través de la fórmula CC= π (DBP+DFO)/2.12
Circunferencia abdominal fetal (CA): calculada a partir de los diámetros anteroposterior y transverso del abdomen fetal con el uso de la fórmula
CA= π (APAD+TAD)/2.12
Longitud femoral (LF): tomada entre las superficies externas de los extremos del hueso sin medir el trocánter.12
Para estimar el tamaño fetal a través de parámetros biométricos (condición trófica ajustada) se tiene en cuenta que se considera normal la población en la que el peso se encuentra entre los percentiles 10 y 90 de la curva de crecimiento. Este procedimiento permite clasificar a los fetos según su edad gestacional en pequeño (PEG), adecuado (AEG) o grande (GEG) según se encuentre bajo el percentil 10, entre 10 y 90 o por encima de 90 por las tablas de crecimiento fetal vigentes en Cuba.13
Análisis y procesamiento de la información
La información se almacenó y se procesó en un fichero confeccionado en el paquete estadístico SPSS versión 20.0 para Windows según el objetivo propuesto.
Como medida de resumen para variables cuantitativas se utilizaron medidas de tendencia central y posición (mediana y rango intercuartílico). Previo al análisis de las variables cuantitativas se probó la distribución normal y, ante su ausencia, se utilizó la prueba no paramétrica U de Mann-Whitney en la comparación de variables independientes; en caso de muestras relacionadas se aplicó la prueba de los rangos con signo de Wilcoxon.
La variable cualitativa se expresa mediante distribuciones de frecuencias en valores absolutos y relativos (número y por ciento). Para explorar las diferencias entre las variables según la presencia de resistencia a la insulina se realizó la prueba de homogeneidad basada en la distribución Chi cuadrado; ante limitaciones de la prueba se utilizó la probabilidad exacta disponible en el programa.
Para todas las pruebas de hipótesis se prefijó un nivel de significación α=0,05 para la toma de decisión estadística.
Los resultados se expresaron en tablas estadísticas.
Aspectos éticos
La investigación se rigió por los principios éticos que guían las investigaciones médicas con seres humanos plasmados en la Declaración de Helsinki,14 y contó con el aval del Comité de Ética de las investigaciones del área de salud involucrada y el consentimiento informado de las gestantes.
RESULTADOS
En la Tabla 1 se describen los estratos adiposos de la pared abdominal anterior subcutáneo y preperitoneal en los dos primeros trimestres de la gestación. La grasa subcutánea disminuyó significativamente sus valores entre el primero y el segundo trimestre; también se presentaron valores más bajos en los límites inferior y superior de los rangos intercuartílicos en el segundo trimestre. La grasa preperitoneal mostró un incremento de la mediana entre los trimestres primero y segundo. En consecuencia se presentaron valores más altos en los límites inferior y superior de los rangos intercuartílicos en el segundo trimestre.
En ambos casos la comparación de la variable entre los dos trimestres al aplicar la prueba para muestras relacionadas de los rangos con signo de Wilcoxon arrojó diferencias estadísticas significativas (0,0001).
Tabla 1 Descripción de los estratos adiposos de la pared abdominal anterior subcutáneo y preperitoneal en los trimestres primero y segundo
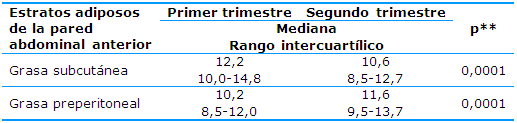
**significación de la prueba para muestras relacionadas de los rangos con signo de Wilcoxon
La variación de los estratos adiposos de la pared abdominal anterior subcutáneo y preperitoneal en los dos primeros trimestres de la gestación según la presencia o ausencia de RI al inicio del embarazo se observa en la Tabla 2. La prueba estadística para muestras relacionadas de los rangos con signo de Wilcoxon arrojó diferencias significativas para ambos estratos adiposos entre los trimestres primero y segundo, independientemente de la presencia o no de resistencia a la insulina; diferencias que fueron menos significativas para la grasa preperitoneal en las gestantes que tenían RI.
Los valores de la grasa subcutánea en el primer trimestre fueron similares entre las gestantes con o sin RI, mientras que en el segundo trimestre sus valores fueron ligeramente superiores en las que presentaron RI. La grasa preperitoneal del primer trimestre mostró valores ligeramente superiores en las gestantes con RI al inicio del embarazo, mientras que en el segundo trimestre los valores de la mediana y rangos intercuartílicos fueron muy similares en ambos grupos. En ninguno de los casos existieron diferencias estadísticas significativas al aplicar la prueba no paramétrica U de Mann-Whitney (p>0,05).
Tabla 2 Descripción de los estratos adiposos de la pared abdominal anterior subcutáneo y preperitoneal en los dos primeros trimestres de la gestación según la presencia de resistencia a la insulina
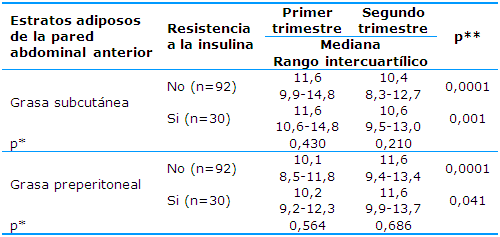
*significación de la prueba no paramétrica U de Mann-Whitney para muestras independientes
**significación de la prueba para muestras relacionadas de los rangos con signo de Wilcoxon
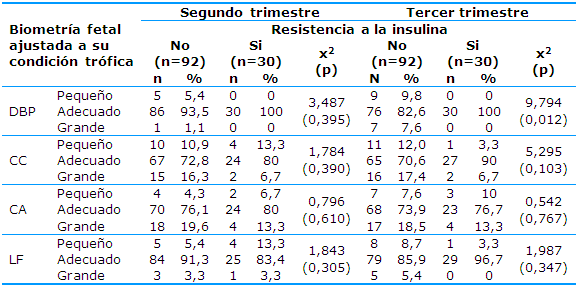
La Tabla 3 muestra la frecuencia de las variables biométricas fetales ajustadas a la condición trófica fetal de los trimestres segundo y tercero según la presencia de resistencia a la insulina al inicio de la gestación. En las gestantes sensibles a la insulina todas las variables biométricas disminuyen en la clasificación de adecuados para la edad gestacional del segundo al tercer trimestre e incrementan las frecuencias de pequeños y grandes, excepto la CA en la que la condición de grande disminuye ligeramente (de 19,6% a 18,5%).
En las gestantes con RI al inicio de la gestación varía el comportamiento de las variables: la variable DBP identifica a todos los fetos en la condición de adecuado para la edad gestacional en ambos trimestres, la CC disminuye la identificación de pequeño (de 13,3% a 3,3%) con estabilidad en la frecuencia de grandes (2, 6,7%), la CA incrementa la frecuencia de pequeño (de 6,7% a 10%) y se mantienen estables los grandes (cuatro, 13,3%), la LF disminuye tanto en el pequeño (de 13,3% a 3,3%) como en el grande (de 3,3% a cero).
DISCUSIÓN
La distribución adiposa abdominal, específicamente en el compartimento visceral, se reconoce como un importante condicionante de enfermedades cardiometabólicas,15 determinada por la disfunción del tejido adiposo en el que se producen cambios en el perfil secretor e hipertrofia de los adipocitos, así como infiltración del tejido adiposo por células inflamatorias, lo que provoca alteración de la comunicación con otros órganos.16
La movilización del tejido adiposo de reserva durante la gestación se relaciona con una parte importante de los cambios que se producen, fundamentalmente con el aumento de la adiposidad abdominal, que cuando ocurre en el compartimiento intrabdominal es causante de las principales desregulaciones del metabolismo de la glucosa, de la insulina, de los lípidos y de los aminoácidos que pueden ocasionar efectos perinatales.17,18
La disminución de la grasa subcutánea y el incremento de la preperitoneal del primero al segundo trimestres que se constató en el presente estudio es indicativo de la migración que se produce en el tejido adiposo de un compartimento a otro.
Existen diferencias en el depósito de tejido adiposo visceral durante la gestación en gestantes de diferentes estados nutricionales.19 Describen un patrón de evolución del tejido adiposo abdominal en el que la grasa preperitoneal aumenta significativamente a través de la gestación, mientras que la grasa subcutánea decrece, aunque esta última lo hace a un ritmo más acelerado en gestantes normopeso.
La acumulación de grasa intraabdominal, expresada en esta etapa de la gestación por la grasa preperitoneal, es mayor a la acumulación de grasa subcutánea, de lo que se infiere que los cambios en el metabolismo lipídico y en la sensibilidad a la insulina que ocurren son un reflejo de la mayor acumulación de grasa preperitoneal.20
En correspondencia, los resultados del presente estudio evidencian el vínculo entre la resistencia a la insulina al inicio la gestación y la evolución de los estratos adiposos subcutáneo y preperitoneal de la pared abdominal anterior al cumplirse, de forma más fisiológica, la disminución de la grasa subcutánea abdominal y el incremento de la preperitoneal ante la ausencia de RI al inicio de la gestación.
La pérdida de la sensibilidad a la insulina durante la gestación se traduce en un incremento del suministro de nutrientes como glucosa y lípidos al feto, lo que causa en él exceso de crecimiento y obesidad.21 Un estudio reciente refleja el impacto de la adiposidad central en la morbilidad perinatal y la antropometría infantil al asociar la medida ultrasonográfica del tejido adiposo visceral con un excesivo crecimiento y desarrollo fetal y con la condición trófica de grande para la edad gestacional al nacer.22
En el presente estudio, ante la presencia de resistencia a la insulina desde el inicio de la gestación, las variables biométricas CC y CA mostraron mayor estabilidad en la detección de fetos grandes para la edad gestacional. La CA fetal, al ser indicador del crecimiento de los órganos abdominales y del depósito de la grasa subcutánea, está fuertemente influenciada por el estado nutricional materno23 y se demuestra su asociación con los niveles séricos de triglicéridos y con medidas antropométricas neonatales,24 por lo que se considera de utilidad en la evaluación del crecimiento fetal en poblaciones específicas.
Con la presente investigación se contribuye a la explicación de la evolución de los estratos adiposos de la pared abdominal anterior y su asociación con la resistencia a la insulina en gestantes que inician el embarazo con peso adecuado, así como de las variaciones en el crecimiento y el desarrollo fetal expresado en las variaciones de las variables antropométricas básicas.
CONCLUSIONES
La variación de los estratos adiposos de la pared abdominal anterior entre el primer y segundo trimestre, debida al decrecimiento de la grasa subcutánea y al incremento de la preperitoneal, es menos marcada en gestantes con resistencia a la insulina al inicio de la gestación, en las que se asocia la variable biométrica fetal circunferencia abdominal con la identificación de los fetos grandes para la edad gestacional desde el segundo trimestre.