My SciELO
Services on Demand
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Cubana de Investigaciones Biomédicas
On-line version ISSN 1561-3011
Rev Cubana Invest Bioméd vol.36 no.1 Ciudad de la Habana Jan.-Mar. 2017
ARTÍCULO ORIGINAL
Liberación in vitro de fármacos desde cementos óseos acrílicos destinados a los recambios protésicos
In vitro drug release from acrylic bone cements used for prosthesis revisions
Lizette Morejón Alonso,I Ana Daymi Cabrera González,I Ivette Durán Ramos,I Nayrim Brizuela Guerra,I José Ángel Delgado García-Menocal,I Gastón Fuentes Estévez,I Oscar Ernesto Ledea Lozano,II Eduardo Mendizábal MijaresIII
I Centro de Biomateriales. Universidad de La Habana. La Habana, Cuba.
II Centro Nacional de Investigaciones Científicas. La Habana, Cuba.
III Departamento de Química, CUCEI. Universidad de Guadalajara. Guadalajara, Jalisco, México.
RESUMEN
Introducción: los cementos óseos acrílicos como portadores de fármacos representan hoy día una solución en la terapia local de infecciones músculo-esqueletales profundas. Sin embargo, en la actualidad no existe aún una definición clara de cuáles son las mejores alternativas de antibióticos a combinar con los cementos y las diferencias que existen entre ellos en cuanto a sus perfiles de liberación.
Objetivo: estudiar la liberación a largo plazo (tres meses) de diferentes principios activos con acción antibacterial desde matrices acrílicas: Ciprofloxacina, Cefalexina, Ceftriaxona, Meropenem, Cefazolina y Ceftazidima.
Métodos: se utilizó la espectroscopia Ultravioleta-Visible para el seguimiento de la liberación de los fármacos, los que se combinaron con el cemento en dosis de 1,25 g por estuche de 40 g de cemento. Intervalo de concentraciones que es recomendado (1-2 g) para la fijación de prótesis cuando ocurren recambios protésicos por antecedentes de infección.
Resultados: los resultados revelaron que en todos los casos a los 90 días (tres meses) la liberación se mantiene y no supera la cantidad del 20 % del fármaco total contenido en las matrices. Los perfiles de liberación indican que la liberación puede continuar en tiempos mayores. Ceftazidima y Cefazolina liberan rápido en las primeras horas; Ceftriaxona posee una velocidad de liberación intermedia, mientras Meropenem, Ciprofloxacina y Cefalexina poseen una cinética más lenta en comparación con el resto de las formulaciones ensayadas. En las primeras 24 horas se detecta elevadas concentraciones de los fármacos que oscilan entre los 100 y 500 µg/mL lo que supera las Concentraciones Inhibitorias Mínimas reportadas de algunos fármacos para gérmenes frecuentes en prótesis sépticas mientras que al séptimo día liberan sólo alrededor de 10 µg/mL para todas las muestras. A largo plazo, la liberación se mantiene en concentraciones mucho más bajas.
Conclusiones: se evaluaron los perfiles de liberación de diferentes fármacos y se proponen nuevas combinaciones de ellos.
Palabras clave: cementos óseos acrílicos con antibiótico; antibióticos; liberación.
ABSTRACT
Introduction: Nowadays antibiotic loaded bone cements represent an important clinical solution to deep musculoskeletal infections as local delivery systems. However, there has been a controversy about the type of antibiotic or the appropriate dose to add to acrylic cement for better results.
Objective: In this work, the longtime release behavior (3 months) from acrylic matrices of different active principles with antibacterial performance, such as Ciprofloxacin, Cephalexin, Ceftriaxone, Meropenem, Cefazolin and Ceftazidime was evaluated.
Methods: The release behavior of acrylic bone cements was followed by Ultraviolet-Visible spectroscopy. The antibiotic dose used was in accordance with the amount recommended (1-2 g) for prosthesis fixation in septic prosthesis revisions surgeries in 1, 2 or 3 steps, 1.25 g by 40 g package of bone cement.
Results: The results indicated that elution persists at 90 days of the releasing test and were lower than 20 % of the original antibiotic amount of drug for all acrylic matrices. The release profiles showed that Ceftazidime and Cefazolin have a fast elution, Ceftriaxone has a middle-elution rate while Meropenem, Ciprofloxacin and Cephalexin have the most slowly elution profile. It was detected high concentrations of drugs oscillating between 100 and 500 µg/mL in the first 24 hours of the experiments. These values surpass the Minimal Inhibitory Concentration (MIC) reported for different antibiotics used against the usually microorganism detected in infected prosthesis. Approximately, at the week samples only release around 10 µg/mL per day and for long times the amount decrease.
Conclusions: In vitro release of different drugs from acrylic bone cements was evaluated and new combinations thereof was proposed.
Key words: acrylic antibiotic-loaded bone cements; antibiotics; release.
INTRODUCCIÓN
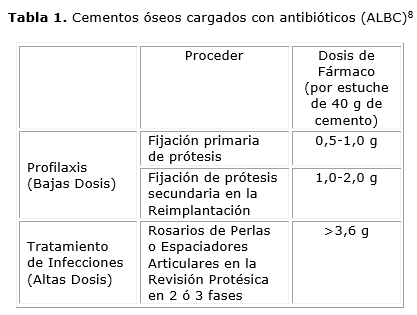
Los cementos óseos acrílicos formulados a base de poli(metacrilato de metilo) (PMMA) son materiales que se han utilizado en cirugía ortopédica para la fijación de prótesis de cadera desde la década de los 60's con una durabilidad promedio reportada que alcanza más del 70 % luego de 25 años.1 Los cementos acrílicos se pueden emplear sin fármacos o combinados con principios activos en bajas dosis para la prevención de procesos sépticos en la fijación primaria de implantes y también en la reimplantación protésica. Además, se utilizan en la terapia local cuando se detectan procesos infecciosos músculo-esqueletales profundos para lo cual se emplean como dispositivos temporales como los Rosarios de Perlas o los Espaciadores Articulares en los que se combinan con altas dosis de antibiótico.2
Las razones de estas aplicaciones se debe a que el tejido óseo es un tejido poco vascularizado y cuando se manifiestan procesos infecciosos después de una implantación protésica, fracturas óseas abiertas u osteomielitis, la terapia sistémica con antibióticos resulta insuficiente para el control del cuadro séptico. Debido a ello, el empleo adicional de la terapia in situ con cementos cargados con agentes antimicrobianos se convierte en una necesidad que permite garantizar concentraciones terapéuticas en el sitio de acción de 7 a 10 veces superiores a las conseguidas con la administración parenteral3 sin riesgos de toxicidad nefrotóxica, ototóxica o complicaciones alérgicas.4,5
Tanto los cementos para fijación de prótesis como los Rosarios de Perlas o los Espaciadores Protésicos hechos de cementos acrílicos cargados con antibióticos (ALBC, por sus siglas en Inglés) pueden ser prefabricados o preparados con el fármaco directamente de forma manual en el salón quirúrgico donde se les adicionan dosis significativas de antibióticos. La elección del tipo de antibiótico y qué dosis emplear ha sido un tema recurrente en la literatura y del cual aún no hay cantidades definidas,6,7 reportándose dosis tan altas como 12 g de antibiótico por estuche de 40 g de cemento. La tabla 1 indica concentraciones orientativas del fármaco según la aplicación del cemento.
A la fecha, el antibiótico más utilizado es la Gentamicina8,9 y se ha reportado el uso de Vancomicina, Tobramicina, Cefalosporinas, Clindamicina, Ticarcillina, Ciprofloxacina, Amikacina, Meropenem, Imipenem-Cilastina, Daptomicina, Plata y otros.10-14 El incremento de la resistencia bacterial a los antibióticos comunes y de manera especial a la Gentamicina, ha potenciado la necesidad de evaluar fármacos alternativos. Hoy día, se investiga la combinación de cementos con antibióticos con amplio espectro de acción debido a la diversidad o multiplicidad de gérmenes contaminantes de las prótesis sépticas, también antibióticos de última generación o incluso combinación de antibióticos para ampliar el espectro y el tiempo de acción.9,15 Las posibilidades son diversas, la dosis ideal aún está en discusión, así como, la influencia en las propiedades finales de los cementos.
En este trabajo se estudian cementos óseos con principios activos que poseen diferentes mecanismos de acción terapéutica, como: Ciprofloxacina, Cefalexina, Ceftriaxona, Meropenem, Cefazolina y Ceftazidima y se analiza la liberación en medio acuoso a largo plazo desde el cemento por espectroscopia Ultravioleta-Visible (UV-Vis). Se utilizó una dosis de 1,25 g/40 g de Parte Sólida de cemento las cuales serían apropiadas para la fijación secundaria de prótesis en casos clínicos con antecedentes de sepsis y donde se requiere de un compromiso entre la liberación del fármaco y las propiedades mecánicas.
MÉTODOS
PREPARACIÓN DE LOS CEMENTOS ÓSEOS
Se preparó la parte líquida del cemento con reactivos Aldrich: metacrilato de metilo (MMA, 97,3 % v/v), N,N dimetil-p-toluidina (DMpT, 2,7 % v/v) y 80 ppm de Hidroquinona (Hq); mientras que para la parte sólida se utilizaron perlas de PMMA B-866 con peróxido de benzoilo de la firma Bonar Polymer Ltd. (86,875 % m/m), Sulfato de Bario (10 % m/m) y 3,125 % de fármaco (1,25 g por estuche de 40 g de parte sólida de cemento). Se prepararon muestras cilíndricas de 6 mm de diámetro (Ø) por 12 mm de altura (h) mezclando 0,5 g de parte sólida y 250 µL de parte líquida a temperatura ambiente. Se colocó la pasta en moldes de vidrio con las dimensiones apropiadas y se dejaron fraguar por 15 min para después extraerlas.
ESTUDIO DE LIBERACIÓN ULTRAVIOLETA-VISIBLE (UV-VIS)
Para cada uno de los fármacos en estudio se determinó los máximos de absorción en medio acuoso utilizando un equipo Cintra 10e de procedencia australiana y se hicieron curvas de calibración a partir de diluciones de una solución madre de concentración 6,25 mg/mL.
Probetas de cada composición de ALBC y de cemento sin fármaco (por triplicado) se colocaron en tubos de ensayo con 2,5 mL de agua destilada y mantenidas a 37 ± 0,1 °C en un baño termostatado (BioBlock) por 90 días. La cinética de liberación de los fármacos se siguió mediante lecturas de la absorbancia UV-Vis a las longitudes de onda determinadas previamente a diferentes intervalos de tiempo en los que se extraía toda la solución y se reponía con 2,5 mL de agua destilada fresca. Se interpolaron los valores de absorbancia en las curvas de calibración realizadas, se calculó la concentración liberada de fármaco en cada periodo y considerando el volumen de elución se obtuvieron los datos de masa acumulada de fármaco (MA) en el tiempo. Se llevó a cabo la comparación estadística de las liberaciones de cada fármaco a diferentes intervalos de tiempo a través de la Prueba de Múltiples Rangos con 95 % de confianza y empleando el software Statgraphics Centurion XVI.II
RESULTADOS
Entre los requisitos que deben satisfacer los antibióticos para que puedan ser utilizados en formulaciones de ALBC destacan, desde el punto de vista microbiológico: que posean amplio espectro de acción antibacterial, incluyéndose organismos Gram-positivos y Gram-negativos, efecto bactericida en bajas dosis, baja velocidad de desarrollo de resistencia y que sean hipoalergénicos, mientras que desde el punto de vista químico-físico: que posean estabilidad química y térmica, se presenten en forma de polvos, así como que tengan buena solubilidad en medios acuosos que les permita una adecuada liberación desde los cementos en concentraciones terapéuticas.
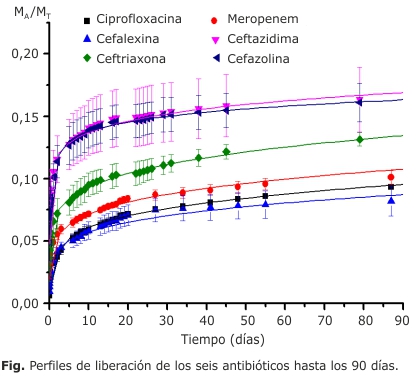
En este trabajo se utilizaron antibióticos de diversa naturaleza química, diferentes mecanismos de acción antibacterial, distinta solubilidad en agua aunque todos se presentan en estado sólido. De manera inicial se determinaron los máximos de absorción de cada uno de ellos: Ciprofloxacina 277 y 324 nm, Ceftazidima 256 nm, Meropenem 297 nm, Cefazolina 272 nm, Cefalexina 262 nm y Ceftriaxona 241 y 275 nm y se siguió la cinética de liberación de los mismos por 90 días. La figura muestra los perfiles de liberación obtenidos para cada uno de los antibióticos estudiados a partir de las medias de la relación de las masas acumuladas (MA) y la masa total inicial de antibiótico (MT) colocada de manera inicial. Se grafican las medias de las tres réplicas a cada período de tiempo con sus respectivos errores.
En la tabla 2 se resumen las cantidades liberadas de fármaco por cada 24 h en los primeros 7 días lo que representaría un postoperatorio inmediato. Se detecta que las concentraciones inciales oscilan entre 500 y 100 µg/mL mientras que para el séptimo día en todos los casos sólo alcanza alrededor de 10 µg/mL de antibiótico en solución.
La tabla 3 resume los porcientos de liberación a diferentes periodos de tiempo hasta los 90 días. Se aprecia que la Ceftazidima y la Cefazolina son los fármacos que se liberan en mayor proporción, mientras que la Ciprofloxacina y la Cefalexina son los que eluyen en menor proporción.
DISCUSIÓN
Los cementos óseos acrílicos cargados con antibióticos resultan imprescindibles hoy día en los procedimientos de profilaxis o tratamiento de infecciones profundas de músculos y huesos. Ellos se emplean de manera directa en la fijación de prótesis primarias o secundarias o como dispositivos temporales para controlar cuadros sépticos profundos dado que garantizan localmente una alta actividad antimicrobiana.16 Los ensayos realizados en este trabajo demuestran que la elución ocurre de forma inicial rápida en una primera etapa lo que se corresponde con la solubilización del fármaco en la superficie de las probetas de ensayo y a posteriormente ocurre una liberación más lenta que puede proceder desde las capas más próximas a la superficie por difusión o a través de los canales que ha dejado abierto el fármaco que se ha liberado previamente.17 Para todos los casos, a los 90 días la liberación se mantiene y no supera la cantidad del 20 % del fármaco total contenido en las matrices. Esta baja recuperación del contenido total del fármaco incluido en las probetas se debe a que el poli(metacrilato de metilo) es un polímero hidrófobo que no permite la entrada de agua al sistema y la mayor parte del fármaco queda ocluida en la matriz.
Los perfiles de liberación indican que la liberación puede continuar en tiempos mayores. Ceftazidima y Cefazolina liberan rápido en las primeras horas; Ceftriaxona posee una velocidad de liberación intermedia, mientras Meropenem, Ciprofloxacina y Cefalexina poseen las liberaciones más lentas de todas las formulaciones ensayadas.
En las primeras 24 h se detectan elevadas concentraciones de los fármacos que oscilan entre los 100 y 500 µg/mL. Según reportes de la literatura, la Ceftazidima es efectiva in vitro contra la mayoría de las cepas de Staphylococcus aureus y Staphylococcus sp. coagulasa negativo, con una CIM de 4-8 µg/mL y 8-16 µg/mL respectivamente.18 Para el caso de la Cefazolina y la Ciprofloxacina en un estudio de 37 cepas 100 % sensibles de Staphylococcus aureus y Staphylococcus sp. coagulasa negativo se determinó que los mismos poseían una CIM ≤ 8 µg/mL (Cefazolina) y ≤ 0,5 µg/mL (Ciprofloxacina).19 Tomando en cuenta estos valores, las concentraciones detectadas en este trabajo superan en las primeras 24 h (en varias veces) las Concentraciones Mínimas Inhibitorias reportadas para gérmenes frecuentes en prótesis sépticas lo que resulta positivo, mientras que al séptimo día liberan sólo alrededor de 10 µg/mL para todas las muestras. Según la literatura la concentración de Gentamicina que se libera desde rosarios de perlas acrílicas comerciales es próxima a los 300 µg/mL20 en rosarios de perlas que pueden tener más de 30 perlas enlazadas lo cual resulta suficiente para combatir la mayoría de los microorganismos.21 Las formulaciones ensayadas en este trabajo se evaluaron en probetas individuales y al menos el primer día son equivalentes a los rosarios aunque según la dosis utilizada estos materiales resultarían recomendados para la reimplantación protésica y no serían retiradas del lecho óseo pues su función primaria es la fijación protésica. De ahí, la necesidad de estimar por cuánto tiempo se mantiene la liberación y en que concentraciones se mantiene la misma. A largo plazo, en el caso de los rosarios de perlas comerciales la liberación disminuye rápidamente también, lo que podría ser contraproducente en la generación de resistencia bacteriana, la propia literatura indica que sobre las perlas puede desarrollarse un biofilm en un periodo entre los 10-14 días.21
El que los antibióticos muestren diferentes velocidades de elución es positivo cuando se quiere preparar cementos con mezclas de antibióticos. Ello se debe a qué además de seleccionar los fármacos por tener efectos complementarios en cuanto a espectro de acción farmacológico, uno de ellos puede garantizar actividad bactericida más intensa en el período más inmediato a la colocación del dispositivo y el otro de manera más tardía. El análisis de los perfiles obtenidos resultó orientativo de cuáles parejas pudieran ser investigadas a futuro, como por ejemplo: Ciprofloxacina-Meropenem o Ciprofloxacina-Ceftazidima que combinan velocidades de liberación diferentes, parejas que además no poseen superposición en los máximos de absorción por UV-Vis y podrían funcionar desde el punto de vista farmacológico.
APOYO FINANCIERO
Centro de Biomateriales, Universidad de La Habana.
DECLARACIÓN DE CONFLICTOS DE INTERESES
Los autores declaran no tener conflictos de intereses de ninguna naturaleza.
REFERENCIAS BIBLIOGRÁFICAS
1. Charnley J. Anchorange of the femoral head prosthesis of the shaft of the femur. J. of Bone Joint Surgery. 1960;42:28-30.
2. Magnan B, Bondi M, Maluta T, Samaila E, Schirru L, Dall'Oca C, et al. Acrylic bone cement: current concept review. Musculoskelet Surg. 2013;97:93-100.
3. Lara J, Irribarra L, Mardones R. Diagnóstico y manejo de la artroplastia de cadera infectada. Rev Chil Infec. 2000;17(12):92-100.
4. Freddy R, Teske V. Uso prolongado de espaciador en infección de cadera. Nueva modalidad de tratamiento en dos tiempos. Rev Méd Urug. 2012;28(1):13-20.
5. Villanueva-Martínez M, Ríos Luna A, Pereiro J, Fahandez-Saddi H, Villamor A. Hand made articulating spacers in two stage revision for infected total knee arthroplasty: good outcome in 30 patients. Acta Orthop. 2008;79(5):674-82.
6. Caro I. Cementos óseos con antibiótico. Panorama Actual del Medicamento. 2016;40(394):634-8.
7. Nelson C.L. The current status of material used for depot delivery of drugs. Clin. Orthop. Relat. 2004;427:72-8.
8. Bistolfi A, Massazza G, Verné E, Massè A, Deledda D, Ferraris S, et al. Antibiotic-loaded cement in orthopedic surgery: a review. ISRN Orthop. 2011;:290851. doi: 10.5402/2011/290851
9. Webb JC, Spencer RF. The role of polymethylmethacrylate bone cement in modern orthopaedic surgery. J Bone Joint Surg Br. 2007;89(7):851-7.
10. Soares D, Leite P, Barreira P, Aido R, Sousa R. Antibiotic-loaded bone cement in total joint arthroplasty. Act Orthop Belg. 2015;81:184-90.
11. Brien WW, Salvati EA, Klein R, Brause B, Stern S. Antibiotic impregnated bone cement in total hip arthroplasty. An in vivo comparison of the elution properties of tobramycin and vancomycin. Clin. Orthop. Relat. 1993;296:242-8.
12. Cerretani D, Giorgi G, Fornara P, Bocchi L, Neri L, Ceffa R, et al. The in vitro elution characteristics of vancomycin combined with imipenem cilastatin in acrylic bone cements: a pharmacokinetic study. J. Arthroplasty. 2002;17(5):619-26.
13. Samuel S, Mathew BS, Veeraraghavan B, Fleming DH, Chittaranjan SB, Prakash JA, et al. In vitro study of elution kinetics and bio-activity of meropenem-loaded acrylic bone cement. J Orthopaed Traumatol. 2012;13:131-6.
14. Salehi A, Gladius L, Cox Parker A, Haggard WO. Modeling of Daptomycin Release from Medium-Dose Daptomycin-Xylitol-Loaded PMMA Bone Cements. J. Biomedical Science and Engineering. 2014;7:351-60.
15. Slane J, Vivanco J, Rose W, Ploeg H, Squire M. Mechanical, material, and antimicrobial properties of acrylic bone cement impregnated with silver nanoparticles. Materials Science and Engineering C. 2015;48:188-96.
16. Lalremruata R. Prosthetic joint infection: A microbiological review. J Med Soc. 2015;29:120-8.
17. Jasso C, Morejón L, Mendizábal E. Bone Cements (Acrylics). Encyclopedia of Biomedical Polymers and Polymeric Biomaterials. Ed. Taylor & Francis Group. 2015;1025-52.
18. Anagnostakos K, Kelm J. Enhancement of antibiotic elution from acrylic bone cement. J Biomed Mater Res - Part B Appl Biomater. 2009;90 B: 467-75.
19. Salas JL, Herrera ML, Guevara J, Lizano C. Sensibilidadin vitro de Staphylococcus sppa la Ceftazidima. Costa Rica: Méd. Hosp .Nal. Niños. 1987;1(22):41-4.
20. Ruiz JD, Ramírez NF, Arroyave O. Determinación de concentraciones inhibitorias mínimas a algunosantibióticos de las bacterias aisladas de glándula mamaria bovina en San Pedro de los Milagros, Antioquia: Col. Cienc. Pec. 2001;14:2.
21. Barth RE, Vogely HC, Hoepelman AI, Peters EJ. 'To bead or not to bead?' Treatment of osteomyelitis and prosthetic joint-associated infections with gentamicin bead chains. Int J Antimicrob Agents. 2011;38:371-5.
Recibido: 14 de noviembre de 2016.
Aprobado: 10 de diciembre de 2016.
Lizette Morejón Alonso. Departamento de Biomateriales Poliméricos. Centro de Biomateriales. Universidad de La Habana. La Habana, Cuba.
Correo electrónico: lizette@biomat.uh.cu