My SciELO
Services on Demand
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Vaccimonitor
Print version ISSN 1025-028X
Vaccimonitor vol.22 no.3 Ciudad de la Habana Sept.-Dec. 2013
ARTÍCULO ORIGINAL
Reducción de la toxicidad del lipopolisacárido de Neisseria meningitidis serogrupo B y estudio de su estabilidad estructural
Reduction of the toxicity of the lipopolysaccharide from Neisseria meningitidis serogroup B and study of its structural stability
Osmir Cabrera,* Rander Pérez, Michel Acosta, Rubén Adonis Cabrera, Maydelis Álvarez, Oliver Pérez, Maribel Cuello
Instituto Finlay, Centro de Investigación-Producción de Vacunas. Ave. 27, No. 19805, La Lisa, A.P. 16017 Cod. 11600. La Habana, Cuba.
email: ocabrera@finlay.edu.cu
* Lic. en Química, Doctor en Ciencias Químicas e Investigador Titular.
RESUMEN
La búsqueda de adyuvantes está dentro de las líneas de investigación más importantes para el desarrollo de vacunas en las últimas décadas. Uno de los adyuvantes, en etapa de investigación en el Instituto Finlay, tiene en su composición al lipopolisacárido (LPS) de Neisseria meningitidis serogrupo B, el cual es altamente tóxico. Por ello nos propusimos modificarlo estructuralmente, para reducir su toxicidad y evaluar su estabilidad durante tres meses. Se utilizó un LPS purificado por el método de extracción con agua y fenol y se modificó estructuralmente por una hidrólisis básica controlada. El LPS resultante fue evaluado en el momento de la hidrólisis, al mes y a los tres meses. Se midió la concentración de grupos amino generados y la toxicidad por el método del lisado de amebocitos del limulus (LAL); se determinó el patrón electroforético y la constante de distribución (Kd) por cromatografía de exclusión molecular, como parámetros indicativos de la integridad estructural. Los resultados mostraron un aumento de los grupos amino, una reducción de la toxicidad en más de cinco mil veces que la inicial del LPS nativo y un incremento de la Kd, determinada por cromatografía. Todos los parámetros estudiados durante los tres meses se mantuvieron constantes. Se puede concluir que el LPS, modificado estructuralmente por medio de una hidrólisis básica controlada y almacenado en solución acuosa a temperaturas entre 2 y 8 °C, permaneció sin cambios en su estructura al menos por tres meses.
Palabras clave: LPS, Neisseria meningitidis, hidrólisis básica, adyuvantes.
ABSTRACT
The search of adjuvants has been one of the most important lines of the research in the development of vaccines in the last decades. One of the adjuvants under research at Finlay Institute uses lipopolysaccharide (LPS) from Neisseria meningitidis serogroup B in its composition and it is very toxic. For this reason we aim to make a structural modification of LPS from N. meningitidis serogroup B to reduce its toxicity and to study its stability for three months. A LPS purified by water and phenol extraction method was modified structurally by a controlled basic hydrolysis. The modified LPS was controlled at moment of the hydrolysis, a month and three months later. The evaluations consisted on the determination the concentrations of amine groups generated, the toxicity by Limulus Amoebocyte Lysate (LAL), the determination of the electrophoretic pattern and the constant of distribution (Kd) by chromatography of molecular exclusion as indicative parameters of structural integrity. The obtained results showed an increase of amine groups, a reduction of more than 5 000 times of the initial toxicity of native LPS and an increase of the Kd determined by chromatography. Studied parameters remained constant in the three studied months. In summary, modified structurally LPS by means of a controlled basic hydrolysis and stored in watery solution and temperatures from 2 to 8 °C remains without changes in their structure at least for three months.
Key words: LPS, Neisseria meningitidis, basic hydrolysis, adjuvants.
INTRODUCCIÓN
Neisseria meningitidis es una bacteria gramnegativa que se encuentra comúnmente en la nasofaringe de humanos sanos y es una causa significativa de infecciones invasivas, tales como meningitis en jóvenes y adolescentes (1).
La respuesta inmune asociada a las vacunas depende de la inmunogenicidad inherente a los antígenos y de la disponibilidad de adyuvantes eficientes. Los adyuvantes vacunales se caracterizan por su habilidad de aumentar la inmunogenicidad in vivo (respuesta antígeno-específica) de los antígenos con los cuales son adyuvados. De esta forma, los adyuvantes constituyen componentes imprescindibles en las vacunas modernas. Sin embargo, muy pocos adyuvantes han sido aprobados para el uso humano debido fundamentalmente a su elevada reactogenicidad, por lo que la evaluación de nuevos candidatos es de gran importancia y actualidad.
El Instituto Finlay se encuentra desde hace varios años trabajando en la obtención de nuevos adyuvantes para el uso humano y veterinario. Uno de los adyuvantes que está en etapa de investigación utiliza en su composición al lipopolisacárido (LPS) de N. meningitidis serogrupo B.
Los LPS son componentes mayoritarios de la membrana externa de las bacterias gramnegativas (2) y por su ubicación son importantes mediadores de las interacciones entre estas bacterias con su medio ambiente y otros organismos (3).
Desde su descubrimiento los LPS fueron reconocidos como moléculas con una potente acción endotóxica, hasta ser identificadas como los principales responsables del shock inducido por bacterias gramnegativas.
Más recientemente, se les atribuyen otras funciones, entre las que se incluyen: mantenimiento y organización de la membrana externa, mimetismo molecular, variaciones antigénicas, activador del sistema inmune y mediación en la adherencia a las células y tejidos hospederos, entre otras (4-6).
La estructura de los LPS puede dividirse en tres dominios bien definidos:
· El antígeno O: Se encuentra fuera de la célula, actuando como receptor para muchos bacteriófagos, siendo también el que desencadena junto con el lípido A la respuesta inmunitaria por parte del individuo infectado (7).
· El núcleo (también llamado "inner core", o región "R"): Formado por una serie de monosacáridos de seis carbonos como la glucosa, ramnosa y galactosa, entre otros, y por monosacáridos poco usuales como los didexosiazúcares. En esta parte del LPS es donde se encuentra el ácido 3-keto-3-dioxioctanoico, conocido como KDO que además de ser el componente más utilizado para la determinación de los LPS, es quien une a la región central con el antígeno O y el lípido A (7, 4).
· El lípido A: Es la parte de la molécula cuya estructura es la más conservada dentro de todas las especies bacterianas. Este es el principal causante de la pirogenicidad de estas moléculas y consta básicamente de una molécula disacarídica de glucosamina, la cual está altamente sustituida por ácidos grasos de cadena larga, unidos a través de un enlace amido o éster.
Con los LPS en medio básico ocurre la reacción de saponificación, aunque también puede ocurrir la ruptura de los enlaces que unen al KDO con el lípido A. No obstante, los resultados obtenidos por Niwa y cols. (8) no muestran una correlación entre la pérdida de actividad con la pérdida de moléculas de KDO o ácidos grasos, pero pudieron concluir que la mayor modificación química que ocurría era la saponificación de los ácidos grasos presentes en el lípido A. También señalan la importancia de la conservación de la conformación tridimensional en la actividad biológica (8).
El objetivo del presente trabajo fue reducir la toxicidad del LPS de Neisseria meningitidis serogrupo B por medio de una hidrólisis básica controlada y evaluar su estabilidad estructural por tres meses.
MATERIALES Y MÉTODOS
LPS de N. meningitidis serogrupo B. Se utilizó un LPS inmunotipo L3,7, 9 proveniente de N. meningitidis serogrupo B y purificado en el Instituto Finlay por el método de extracción descrito por Balboa y cols. (9). En el momento de realizar este trabajo el LPS se encontraba liofilizado y almacenado a -20 °C.
Modificación estructural del LPS. Se realizó según metodología estandarizada por Cabrera y cols. (10): en una hidrólisis básica controlada para la eliminación parcial de los ácidos grasos presentes en la región del lípido A. El LPS (4 mg/mL) se hizo reaccionar con NaOH 0,7 M a 100 ºC por 4 h. Posteriormente se enfrió a temperatura ambiente (TA), se neutralizó el pH con HCl 1M y se conservó a 4 °C hasta su posterior utilización.
Determinación de la concentración de LPS. Se realizó mediante la determinación del KDO por el método descrito por Osborn (11). Se evaluaron muestras del LPS de partida (LPSn) disuelto en agua purificada y del LPS modificado estructuralmente (LPS*), fue evaluado inmediatamente después de la modificación y uno, dos y tres meses después de realizada la hidrólisis del mismo.
Determinación de los grupos amino. El grado y consistencia del proceso de modificación estructural del LPS fueron evaluados por medio de la determinación de grupos amino, generados por el método descrito por Church y cols.
(12). Para esta determinación se utilizó el LPSn como control. La muestra se ajustó a 1 mL de volumen final con agua destilada y se mezcló con 1,5 mL de solución tampón de Borax (0,2 M) + 2-mercaptoetanol (0,05%) y 0,5 mL de O-phtaldialdehido (1 mg/mL en etanol). Se dejó reposar 10 min a TA y se leyó la absorbancia a 335 nm en un espectrofotómetro contra una curva patrón de glicina en un rango de concentración de 0,1-0,5 mmoL.
Determinación de la toxicidad. La toxicidad de los lipopolisacáridos se determinó mediante el ensayo del lisado de amebocitos del limulus (LAL) (13), por el método cromogénico y la utilización del "kit Coatest Endotoxin® de la Compañía sueca Chromogenix AB. El ensayo se corrió según la técnica del fabricante, con una curva patrón entre 0,15 y 1,2 UE (unidades de endotoxinas) por la opción en tubos de ensayos procesados en un termobloque Stuart Scientific para 24 tubos. Para el desarrollo del método se emplearon tubos de reacción de borosilicato de 10 x 75 mm (Pyrotubes®) de la compañía Associates of Cape Cod, tubos de centrífuga de 15 mL de poliestireno marca Costar para la curva patrón y puntas de pipetas Rainin. Todos estos materiales eran libres de endotoxinas.
Determinación del patrón electroforético de los LPS. Se realizó una electroforesis en gel de poliacrilamida con dodecil sulfato de sodio (SDS-PAGE), según Laemmli (14), con un gel separador al 15% de poliacrilamida y tinción con plata específica para LPS. Se evaluaron muestras del LPSn disuelto en agua purificada y de LPS*. Todas las muestras utilizadas fueron ajustadas a concentraciones de LPS de 1 mg/mL.
Densitometría. Una vez concluida la corrida de electroforesis se realizó un análisis densitométrico para determinar el peso molecular (PM) en un densitómetro GS-800 (Bio-Rad con el programa "Quantity One", Versión 4.6.9 para la captura y análisis de geles de electroforesis. Se utilizó un patrón de peso molecular de bajo rango (Bio-Rad , compuesto por: fosforilasa B de 97,4 KDa, albúmina sérica de 66,2 KDa, ovoalbúmina de 45 KDa, anhidrasa carbónica de 31KDa, inhibidor de tripsina de 21,5 KDa y lisozima de 14,4 KDa.
Determinación de la constante de distribución de los LPS antes y después de modificados. Para la determinación de la Kd se utilizó un sistema cromatográfico de baja presión compuesto por un controlador modelo LCC-501 plus, con dos bombas P-500 de alta precisión y un detector UVICORD S-II de longitud de onda fija. La columna utilizada fue una HR 10/30, empacada con "Sepharose CL-4B". La eficiencia de la columna, la asimetría del pico y el volumen total se determinaron con acetona (Lichrosolv) al 10% en agua destilada y se leyó a 280 nm; mientras que el volumen muerto (Vo) de la columna se determinó con dextrana azul a 1 mg/mL a 280 nm (15)
Cálculos realizados:
Eficiencia de la columna (Platos teóricos por metro):
N = 5,54 * (Ve/Wh)2 * 1000/L
Donde:
N= Platos teóricos por metro
Ve = Volumen de elución de la acetona
Wh = Ancho a la mitad de la altura del pico.
L = Altura del gel en mm
Cada muestra de LPS se preparó en NaCl 0,2 M a una concentración de 4 mg/mL y se aplicó en la columna 0,1 mL de cada LPS. Las corridas se realizaron a un flujo de 0,3 mL/min, con NaCl 0,2 M como tampón de elución y se monitorearon a la longitud de onda de 206 nm.
Cálculos realizados para la determinación de las Kd:
Kd = (Ve-Vo) / (Vt-Vo)
Donde: Ve= volumen de elución de la muestra problema.
Vo= volumen muerto determinado con dextrana azul.
Vt= volumen de elución total determinado con acetona.
Análisis estadístico. La significación estadística de la varianza entre los grupos en estudio se realizó aplicando ANOVA de un factor seguido del estudio de comparaciones múltiples de Tukey, mediante el programa GraphPad Prism 4 (CA, USA). Se consideró que había diferencia significativa para una p < 0,05. Los resultados mostrados son representativos de experimentos realizados en días diferentes.
RESULTADOS Y DISCUSIÓN
Modificación estructural del LPS. Producto de la hidrólisis básica realizada al LPSn se obtuvieron LPS* a los que se les realizaron los controles durante tres meses para verificar su estabilidad.
Se realizó la determinación de grupos amino en los LPS en estudio (Tabla 1); se obtuvieron valores de 0,19 mmoles de NH2/mg de LPS para el LPSn y 0,92 mmoles de NH2/mg de LPS en el LPS*, lo que representa cinco veces más la cantidad de grupos amino en el LPS* respecto al LPS de partida. Por otra parte, no se observaron diferencias significativas (p > 0,05) entre los tres lotes estudiados de LPS modificados estructuralmente. Los valores de grupos amino obtenidos en los LPS constituyen una evidencia de cambios ocurridos en la estructura del LPSn.
Estos resultados concuerdan con los obtenidos en trabajos previos, donde se utilizó este procedimiento de modificación de LPS con el objetivo de disminuir la toxicidad de los mismos, además de generar grupos amino, útiles para una posterior conjugación a proteínas (16). También concuerda con lo planteado por Niwa y cols. (8) con que la mayor modificación estructural que ocurre en los LPS sometidos a hidrólisis básica es la saponificación de los ácidos grasos presentes en el lípido A de estas moléculas.
Después de la hidrólisis de los LPS, estos se ajustan a pH neutro con ácido clorhídrico diluido con agua (1:1) y se almacenan a temperaturas entre 2 y 8 °C. Estas condiciones son desfavorables para la regresión de los enlaces amidos, lo cual se corroboró en este trabajo al encontrar la misma cantidad de grupos amino (0,92 mmoles de NH2/mg de LPS) en el LPS* tres meses después de haber sido sometido a la hidrólisis básica.
Determinación de la toxicidad por el método del lisado de amebocitos del limulus (LAL). Es conocido que el LPS en las bacterias gramnegativas es el principal causante de la actividad endotóxica, por tanto, es necesario conocer si el método de hidrólisis realizado redujo la toxicidad del LPS y en qué medida ocurre esta disminución.
Al realizar el ensayo del LAL para determinar la actividad endotóxica, se obtuvo para el LPS nativo un valor de 1,34 x 106 UE/ng, mientras que para el LPS* fue de 2,26 x 102 UE/ng. Este valor equivale a una reducción de más de 5 000 veces la toxicidad inicial del LPS nativo.
Estos resultados concuerdan con los resultados previos (8, 16), donde al realizarles la hidrólisis básica a los LPS de Vibrio cholerae y de N. meningitidis serogrupo B también se obtuvieron reducciones de más de 5 000 veces de UE/ng de LPS.
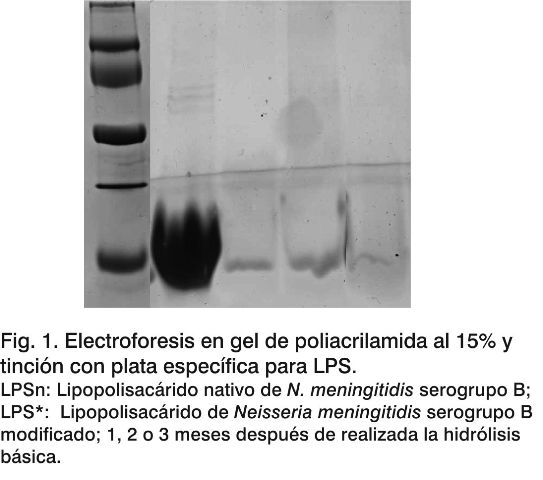
Determinación del patrón electroforético de los LPS. Se observan las bandas correspondientes al movimiento electroforético de las diferentes muestras en estudio (Fig. 1). En la misma podemos ver que la banda electroforética que se obtuvo para el LPSn se corresponde con el tipo de banda característica para este tipo de sustancia; es una banda ancha y poco definida. En cambio, para los LPS* las bandas son finas y un poco más definidas, lo cual pudiera estar asociado con los cambios estructurales en la molécula del LPS. Los resultados que se obtuvieron para el LPSn concuerdan con los obtenidos por Balboa JA y cols (9), quienes purificaron y caracterizaron el LPS de N. meningitidis serogrupo B. No hay diferencias entre los patrones electroforéticos obtenidos para el LPS* en los tres meses de estudio, lo cual es una evidencia de la estabilidad estructural de esta sustancia.
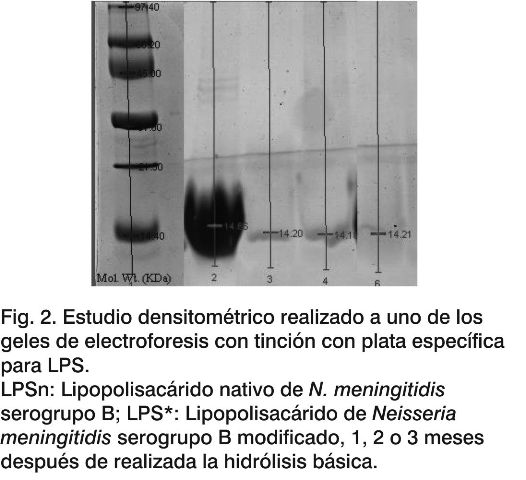
Densitometría. Con el objetivo de conocer el grado de afectación del peso molecular del LPSn después de someterlo al proceso de hidrólisis básica, se procedió a realizar un análisis del peso molecular de los LPS por densitometría, comparando las muestras en estudio con un patrón de peso molecular comercial (Tabla 2). El peso molecular para el LPSn es de 14,66 KDa (Fig. 2). Se observó una ligera reducción de los pesos moleculares (14,20 KDa) para los LPS*, con diferencias significativas (p < 0,001) entre el LPSn con respecto a los LPS* en estudio. Esta reducción del peso molecular es una evidencia de la pérdida de grupos funcionales en la estructura de la molécula del LPSn.
También el peso molecular del LPS* permanece constante en el tiempo (LPS*1; LPS*2; LPS*3) (Fig. 2), lo cual constituye una evidencia más de que los enlaces amidos no vuelven a formarse en el tiempo estudiado (tres meses) y en las condiciones de almacenamiento utilizadas (solución acuosa a 2-8 °C), lo que favorece la estabilidad del LPS*.
Determinación de la constante de distribución de los LPS antes y después de modificados. Otro de los parámetros estudiados que nos brinda información de cambios estructurales en las moléculas y que está relacionado con el tamaño de las mismas es la constante de distribución (Kd).
Al determinar la eficiencia de la columna empaquetada con "Sepharose CL4B" obtuvimos una N = 3340 y una simetría de 1,1. Estos resultados se encuentran dentro de los parámetros que se establecen para este tipo de cromatografía. El Vo que se obtiene con dextrana azul de la columna fue de 9,2 mL; mientras el volumen total de la columna fue de 24,75 mL determinada con acetona.
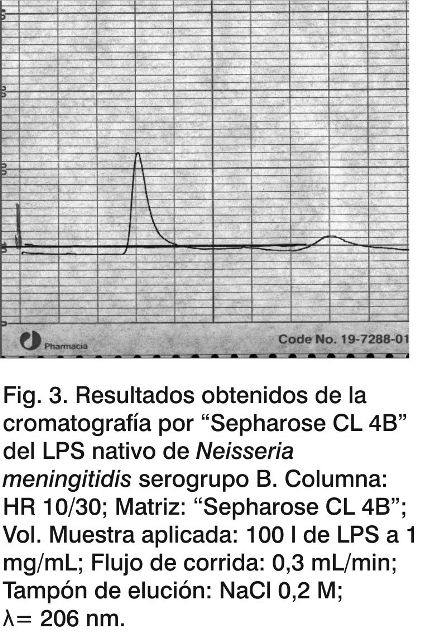
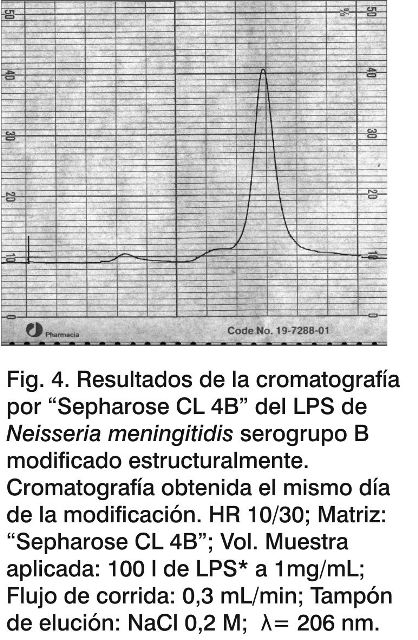
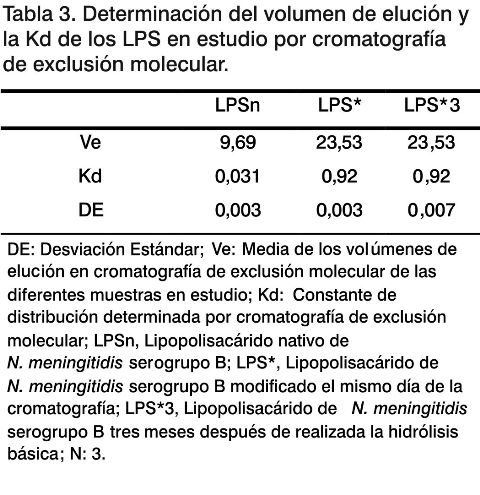
En las Figuras 3, 4 y 5 se observan los perfiles cromatográficos para el LPSn y el LPS* el mismo día de la modificación y tres meses después de hidrolizado; mientras que en la Tabla 3 aparecen reflejados los valores del volumen de elución y la Kd determinada para las muestras en estudio.
Se pudo observar que después de la hidrólisis (Fig. 4), la fracción mayoritaria del LPS* eluyó a volúmenes cercanos al volumen total de la columna, determinado con la acetona (23,53 mL para el LPS*) con una Kd de 0,92; mientras que la señal mayoritaria correspondiente al LPSn (Fig. 3) aparece cercano al volumen muerto de la columna (9,69 mL) con una Kd de 0,031. Estos datos muestran una disminución del peso molecular del LPS debido a la eliminación de los ácidos grasos de la región del lípido A, como resultado de la hidrólisis, lo que está en concordancia con los resultados de la densitometría mostrados anteriormente (Fig. 2).
Los patrones cromatográficos que se obtuvieron en este trabajo fueron similares a los obtenidos en trabajos previos del laboratorio con este LPS (16). Al realizar la cromatografía del LPS* tres meses después de la hidrólisis básica (Fig 5), se puede observar que el volumen de elución y la Kd permanecen constantes: 23,53 mL y 0,92 respectivamente (Tabla 3), lo cual es una evidencia de la estabilidad estructural del LPS después de la hidrólisis básica a que fuera sometido y en las condiciones de almacenamiento utilizadas.
Podemos concluir que el LPS modificado estructuralmente por medio de una hidrólisis básica controlada y almacenado en solución acuosa a temperatura entre 2 y 8 °C, permanece sin cambios en su estructura tres meses después de ser sometido al proceso de hidrólisis. No obstante, si fuera de interés mantener por más de tres meses almacenado el LPS*, sería prudente realizar un estudio de estabilidad por más tiempo y analizar la temperatura de almacenamiento de dicho producto.
Agradecimientos
Agradecemos al doctor Julio A. Balboa, trabajador de la dirección de Investigaciones del Instituto Finlay, por el suministro de LPS proveniente N. meningitidis serogrupos B.
REFERENCIAS
1. Mueller JEL, Sangare´BM, Njanpop-Lafourcade Z, Tarnagda Y, Traore S, Yaro R, et al. Molecular characteristics and epidemiology of meningococcal carriage, Burkina Faso. Emerg Infect Dis 2003;13:847-54.
2. Rietschel ET, Westphal O. History of Endotoxins. In: Brade H, Opal SM, Vogel SN, Morrison DC, editors. Endotoxins in Health and Disease. New York: Marcel Dekker; 1999. p.1-30.
3. Ormeño-Orrillo E. Lipopolisacáridos de Rhizobiaceae: estructura y biosíntesis. Rev Latinoamericana de Microbiología 2005;47(3-4):165-75.
4. Raetz CRH, Whitfield C. Lipopolysaccharide endotoxins. Annu Rev Biochem 2002;71:635-700.
5. Jaques M. "Role of lipo-oligosaccharides and lipopolysacharides in bacterial adherence". Trends and Microbiology 1996;4:408-10
6. Harvill E, Preston A, Cotter P, Allen A, Maskell D, Miller J. "Multiple roles for Bordetella lipopolysaccharide molecules during respiratory tract infection". Infect and Immun 2000;68:6720-8.
7. Kahler CM, Martín LE, Shih GC, Rahman MM, Carlson RW, Stephens DS. The (2- 8)-Linked Polysialic Acid Capsule and Lipooligosaccharide Structure Both Contribute to the Ability of Serogroup B Neisseria meningitidis to Resist the Bactericidal Activity of Normal Human Serum. Infect and Immun 1998;66(12):5939-47.
8. Niwa M, Milner KC, Ribi E, Rudbach JA. Alteration of physical, chemical, and biological properties of endotoxin by treatment with mild alkali. J Bacteriol 1969;97:1069-74.
9. Balboa JA, Estrada J, Nápoles LD, González H, Hernández D, Aranguren Y, et al. Purificación de lipopolisacárido de Neisseria meningitidis a partir de una fracción colateral del proceso de producción de VA-MENGOC-BC . Vaccimonitor 2008;17(1):17-26.
10. Cabrera O, Martínez ME, Cuello M, Soto CR, Valmaseda T, Cedré B, et al. Preparation and evaluation of Vibrio cholerae O1. EL Tor Ogawa lipopolysaccharide-tetanus toxoid conjugates. Vaccine 2006;24(S2):74-5.
11. Osborn MJ. Studies on the gran-negative cell in the lipopolysaccharides of Salmonella typhimurium. Proc Natl Acad Sci USA 1963;50:499-506.
12. Church FC, Porter DH, Calignani GL, Swaisgood HE. An o-phthalaldehyde spectrophotometric assay for proteinases. Anal Biochem 1986;146(2):343-8.
13. Weary M. Pyrogen Testing of parenteral products-status report. J Parenteral Sci Technol 1984;38(1):20-3.
14. Laemmli UK. Cleavage of structural proteins during the assambly of the head of bacteriophage T4. Nature 1970; 227:680-5.
15. British Pharmacopoeia. Volumen V Production and Testing of Vaccines. Appendix XV: Composition of Polysaccharide Vaccines. Ph. Eur. Method 2.5.31. London, UK: British Pharmacopoeia Online (BP) Edition. 2012. Disponible en: http//bp2012.infostar.com.cn/Bp2012.aspx?tab=browse&a=display&n=6&id=874
16. Cabrera O. Neoglicoconjugados de origen bacteriano con fines vacunales obtenidos por un nuevo método (Tesis Doctoral). La Habana, Cuba: Facultad de Química, Universidad de La Habana; 2005.
Recibido: Marzo de 2013
Aceptado: Mayo de 2013