My SciELO
Services on Demand
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Cubana de Medicina
Print version ISSN 0034-7523
Rev cubana med vol.53 no.1 Ciudad de la Habana Jan.-Mar. 2014
TRABAJO ORIGINAL
Susceptibilidad antimicrobiana y mecanismos de resistencia de Escherichia coli aisladas a partir de urocultivos en un hospital de tercer nivel
Antimicrobial susceptibility and mechanisms of resistance of escherichia coli isolated from urine cultures in a tertiary level
Dra. Bettsy Suárez Trueba, Dra. Yoslaine Milián Samper, Dr. Fidel Espinosa Rivera, Dra. Marcia Hart Casares, Lic. Neima Llanes Rodríguez, Dra. María Luisa Martínez Batista
Hospital Clinicoquirúrgico "Hermanos Ameijeiras". La Habana, Cuba.
RESUMEN
Introducción: la infección del tracto urinario es una importante causa de sepsis nosocomial y la segunda en la consulta de asistencia médica comunitaria. Escherichia coli constituye el principal microorganismo aislado.
Métodos: se realizó un estudio descriptivo prospectivo de todas las cepas de E. coli aisladas de urocultivos en el período del 1 al 31 de marzo del 2012, del Hospital Clinicoquirúrgico "Hermanos Ameijeiras". Todas las cepas fueron identificadas por métodos convencionales y, posteriormente, se les realizó Kirby Bauer con interpretación de antibiograma, según la tabla de fenotipos de resistencia de la Sociedad Española de Microbiología.
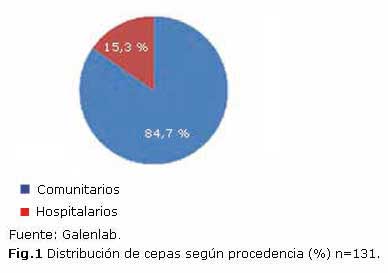
Resultados: el mayor porcentaje de muestras procedió del medio comunitario (84,7 %). Los mejores resultados de sensibilidad para este grupo estuvieron representados por nitrofurantoína (98,2 %), cloranfenicol (80,2 %) y ceftriaxone (83,8 %) y el grupo de las quinolonas con cifras entre 65 % y 77 % mientras que las nosocomiales respondieron mejor in vitro a la amikacina y las piperazilina/tazobactam (90 %). Frente a betalactámicos, el mecanismo más frecuente en el medio comunitario, fueron las OXA y en el nosocomio, las OXA y las betalactamasas de espectro extendido, indistintamente. La enzima ANT (2¨) fue la más frecuente, tanto en el medio comunitario como en el nosocomio, con 18,9 % y 25 %, respectivamente, con respecto a los aminoglucósidos.
Conclusiones: la nitrofurantoína ha demostrado ser, in vitro, un antibiótico potente frente a infecciones urinarias comunitarias por E. coli. Las betalactamasas OXA y las espectro extendido son las enzimas con más frecuencia aparecen frente a betalactámicos.
Palabras clave: resistencia bacteriana, Escherichia coli, urocultivo.
ABSTRACT
Introduction: Urinary tract infection (UTI) is an important cause of nosocomial sepsis and the second in the healthcare community consultation. Escherichia coli is the main organism isolated.
Methods: a prospective study of all strains of E. coli was performed which were isolated from urine cultures during March 2012, at Hermanos Ameijeiras Clinical and Surgical Hospital. All these starins were identified by conventional methods and subsequently underwent Kirby Bauer susceptibility testing with interpretation, according to the table resistance phenotypes of the Spanish Society for Microbiology.
Results: the highest percentage of samples came from the community (84.7 %). The best sensitivity results for this group were represented by nitrofurantoin (98.2 %), chloramphenicol (80.2 %), and ceftriaxone (83.8 %). The group of quinolones move between 65 % and 77 % while nosocomial responded better in vitro to amikacin and piperacillin/tazobactam (90 %). Against beta-lactams, the most common mechanism in the community were OXA while in hospital, OXA and extended spectrum beta-lactamases were the most frequent. ANT enzyme (2¨) was the most common in both the community and in hospital (18.9 % and 25 % respectively), compared to aminoglycosides.
Conclusions: tn vitro nitrofurantoin has proved to be a potent antibiotic against E. coli community urinary infections. OXA beta-lactamases and extended spectrum enzymes are the most frequent against beta-lactams.
Key words: bacterial resistance, Escherichia coli, urine.
INTRODUCCIÓN
La infección del tracto urinario (ITU) es una importante causa de sepsis nosocomial y la segunda en la consulta de asistencia médica comunitaria, constituye alrededor del 40 % de las consultas de urología.1 Las enterobacterias con gran frecuencia son las responsables de estas infecciones y, dentro de ellas, Escherichia coli ocupa el primer lugar de los aislamientos en pacientes con esta afección.2
Múltiples son las formas de presentación, desde la bacteriuria asintomática hasta la pielonefritis con todos los signos y síntomas que pueden presentarse en los diferentes tipos de pacientes, dígase pacientes pediátricos, ancianos, gestantes, oncológicos, etcétera.3 Los mecanismos por los cuales se produce la infección urinaria son variados y complejos y no solo dependen de los factores del huésped sino también de los mecanismos de patogenicidad con los que cuentan las bacterias.
La adhesión de E. coli, mediada generalmente por fimbrias P u otros tipos de factores de colonización que presentan actividad hemaglutinante en presencia de manosa es tal vez el evento más importante en la patogenia de las ITU. Además de la adherencia, se ha demostrado que pueden contribuir a la patogenicidad otros factores de virulencia, tal es el caso de la producción de alfa-hemolisina y la síntesis del factor necrosante citotóxico tipo 1, la resistencia al suero y la expresión del sideróforo aerobactina.4
Todos estos factores traen consigo que E. coli durante muchos años haya estado sometida a la acción de múltiples antimicrobianos. Betalactámicos (con inhibidores o sin ellos), fluoroquinolonas, aminoglucósidos, furanos, entre otros, todos, han estado presentes en algún momento en los esquemas terapéuticos de las ITU,5 motivo por el cual esta bacteria ha ido desarrollando evolutivamente mecanismos de resistencia que la hacen incluirse en la actualidad dentro del grupo llamado ESCAPE junto a microorganismos tan invasivos como Acinetobacter baumannii, Staphylococcus aureus meticillin resistente, Clostridium difficcile, Enterococco resistente a vancomicina y Pseudomona aeruginosa.6
Por estas razones nos propusimos determinar la susceptibilidad antimicrobiana en aislamientos de E. coli proveniente de muestras de urocultivo, así como interpretar sus mecanismos de resistencia.
MÉTODOS
Se realizó un estudio descriptivo prospectivo de todas las cepas de E. coli aisladas de urocultivos en el período del 1 al 31 de marzo del 2012, del Hospital Clinicoquirúrgico "Hermanos Ameijeiras". Se consideraron positivos aquellos que tuvieron un conteo mayor de 100 000 UFC/mL. Todas las cepas (una por paciente), fueron aisladas e identificadas según las normas convencionales del laboratorio , posteriormente, se les realizaron las pruebas de susceptibilidad por el método de Bauer Kirby, según el manual de procedimientos del laboratorio,7 utilizando los siguientes discos de antimicrobianos: betalactámicos: ampicillina 10 µg (AMP), amoxicillina/ácido clavulánico 30 µg (AUG), ticarcilina 75 µg (TIC), piperazilina 100 µg (PRL), ticarcilina/ácido clavulánico 85 µg (TICC), piperazilina/tazobactam 110 µg (TZP), cefalotina 30 µg (KF), cefoxitina 30 µg (FOX), cefuroxima 30 µg (CFX), cefotaxima 75 µg (CTX), ceftriaxona 30 µg (CRO), ceftazidima 30 µg (CAZ), cefepime 30 µg (FEP), meropenem 10 µg (MRP), aztreonam 30 µg (ATM). Aminoglucósidos: gentamicina 10 µg (GN), amikacina 30 µg (AK), neomicina 30 µg (NEO), torbamicina 10 µg (TOB). Quinolonas: ácido nalidíxico 30 µg (AN), cirpofloxacina 5 µg (CIP), norfloxacina 10 µg (NOR). Otros: cloranfenicol 30 µg (C), nitrofurantoina 100 µg (F), sulfametoxazol/trimetoprim 25 µg (SXT). Los mecanismos de resistencia fueron interpretados según la tabla de fenotipos de resistencia de la Sociedad Española de Microbiología.8
RESULTADOS
En la figura 1 se muestra la distribución de las cepas teniendo en cuenta su procedencia, las de origen comunitario fueron las más frecuentes.
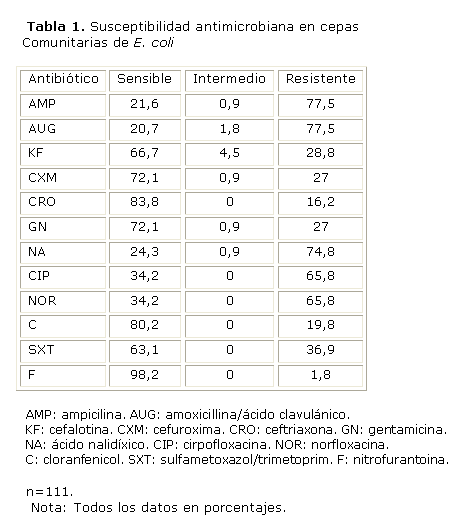
Los resultados de susceptibilidad de E. coli adquirida en la comunidad se muestran en la tabla1.
Los mejores resultados de sensibilidad para este grupo estuvieron representados por nitrofurantoína (98,2 %), cloranfenicol (80,2 %) y ceftriaxone (83,8 %) y los más bajos correspondieron a ampicilina, amoxicillina/ácido clavulánico y el grupo de las quinolonas con cifras entre 65 % y 77 %.
En la tabla 2 se muestra la susceptibilidad de las cepas intrahospitalarias. En el grupo de los betalactámicos, la piperazilina/tazobactam mostró los mejores resultados de sensibilidad con cifras de 90 % y en el grupo de los aminoglucósidos la amikacina, con igual porcentaje. Los betalactámicos como ampicilina, amoxicillina/ácido clavulánico, ticarcilina, ticarcilina/ácido clavulánico, piperazilina y aztreonam; quinolonas como ácido nalidíxico, ciprofloxacina y norfloxacina; aminoglucósidos como la tobramicina y el sulfametoxazol/trimetoprim mostraron baja sensibilidad, todos con resultados inferiores al 50 %.
Los resultados de susceptibilidad in vitro nos permiten reconocer, a través de la lectura interpretada del antibiograma, los posibles mecanismos de resistencia presentes en las cepas estudiadas frente a betalactámicos, aminoglucósidos y quinolonas.
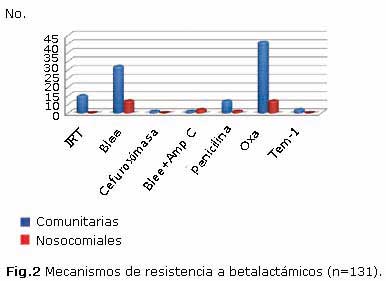
Los mecanismos de resistencia a betalactámicos en ambos grupos se muestran en la figura 2.
Las betalactamasas tipo OXA fueron las más frecuentes en el medio comunitario, representaron el 46,1 %, seguidas de las betalactamasas de espectro extendido (BLEE) con 30,3 %. En menor porcentaje se identificaron las betalactamasas resistente a inhibidores (IRT) y las penicilinasas de alto nivel con 11,2 % y 7,9 %, respectivamente. En el ambiente intrahospitalario, el comportamiento de las OXA y de las BLEE fue similar ambas representadas en 41,2 %. Menos usuales se encontraron las BLEE más AmpC y las penicilinasas de alto nivel.
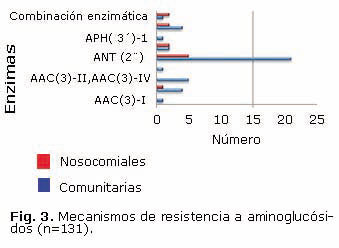
La sensibilidad a los aminoglucósidos estuvo afectada en 52 cepas de las estudiadas, su comportamiento se muestra en la figura 3.
La enzima ANT (2¨) fue la más frecuente, tanto en el medio comunitario como en el nosocomio con 18,9 % y 25%, respectivamente, confiriendo resistencia a aminoglucósidos como kanamicina, tobramicina y gentamicina. Otras enzimas como las acetiltranseferasas (6´), (3)-IV y (3)-II también fueron identificadas, pero en menor cuantía en ambos grupos.
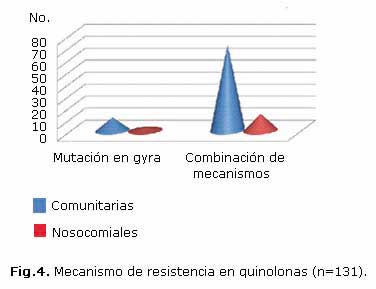
La integración de mecanismos de resistencia en las quinolonas hace difícil la lectura interpretada del antibiograma. Aun así se puede hacer un análisis teniendo en cuenta la susceptibilidad a algunos antimicrobianos. Estos resultados se muestran en la figura 4.
La combinación de mecanismos fue lo más frecuente en ambos grupos, expresada en 72 cepas comunitarias (64,9 %) y en 14 nosocomiales (70 %). Este fue el grupo de antimicrobiano más afectado por la resistencia.
DISCUSIÓN
Las penicilinas constituyen un grupo de antimicrobianos muy utilizado en la práctica asistencial a través de la historia. Las ITU, durante muchos años, también fueron tratadas con medicamentos como la ampicilina, la cual en la actualidad queda excluida del esquema terapéutico en los medios intrahospitalario y extrahospitalario por el bajo porcentaje de sensibilidad. Estos resultados coinciden con los encontrados por Ponce en el año 2011 en Cuba9 y están por encima de los reportados por Seija y otros, en un hospital de tercer nivel (47 %).10
La introducción de las combinaciones betalactámicos/inhibidores por un tiempo constituyeron la mejor opción frente a aquellas cepas capaces de producir enzimas que hidrolizaban las penicilinas, sin embargo, en nuestro estudio se encontró una baja sensibilidad a este grupo con excepción de la piperazilina/tazobactam la cual puede ser utilizada en infecciones intrahospitalarias. Los resultados de esta última pueden estar relacionados con su utilización exclusiva en infecciones graves de origen nosocomial. Silva y otros, en Chile, obtuvieron porcentajes similares al nuestro (99,9 %).11
Las cefalosporinas, antimicrobianos de gran utilización, tanto en el medio hospitalario como en el extrahospitalario, mostraron resultados de sensibilidad por encima del 50 %, por lo que continúan siendo una opción terapéutica efectiva en las ITU. En particular, ceftriaxone está indicado en casos de pielonefritis con criterio de ingreso y sin él, aunque algunos autores refieren que debe prescindirse de él cuando las cifras de resistencia superen el 20 %.3
Un grupo activo frente a bacilos gramnegativos aerobios (E. coli), continúan siendo los aminoglucósidos y se excretan por vía renal, de ahí su utilización en las ITU.12 La gentamicina, en monodosis diaria, constituye en la actualidad la mejor opción frente a infecciones comunitarias que no se solucionan con antibióticos orales y en el caso de las hospitalarias, junto a la amikacina también podría seguir utilizándose. Estos resultados se corresponden con los publicados por Flores y otros.13
Las fluoroquinolonas comparten algunas propiedades farmacodinámicas con los aminoglucósidos, ya que ambos grupos ejercen su acción bactericida luego de penetrar en el interior de la célula.14 Sin embargo, el uso indiscriminado o el mal uso de ellas, ha traído consigo una disminución sustancial de los porcentajes de sensibilidad y la han desplazado del arsenal terapéutico frente a las ITU, tanto en el medio intrahospitalario como en el extrahospitalario, por lo que en la actualidad no son recomendables como primera línea de tratamiento.
El sulfametoxazol/trimetoprim todavía se indica en las ITU comunitarias no complicadas con resultados expectantes. Los porcentajes encontrados en este estudio son comparados con los publicados por Villarroel y otros, en Venezuela.15
Especial atención requieren antibióticos que habían sido olvidados desde hace algún tiempo por los efectos adversos que producen y que en estos momentos constituyen, in vitro, la mejor opción en las ITU de origen comunitario producidas por E. coli, tal es el caso de la nitrofurantoína y el cloranfenicol, los cuales para utilizarse deben ser evaluados en cuanto al riesgo y el beneficio que aporten. Estos resultados se corresponden con los publicados en un estudio multicéntrico, en España, por Andreu y otros.16
Teniendo en cuenta los resultados de susceptibilidad se puede hacer la lectura interpretada del antibiograma para identificar fenotípicamente los mecanismos que intervienen en la aparición de perfiles de resistencia.
Múltiples son las enzimas capaces de hidrolizar los betalactámicos, entre ellas las OXA fueron las más identificadas. Este grupo afecta antibióticos como aminopenicilinas, carboxipenicilinas y ureidopenicilinas, y son insensibles a la acción de los inhibidores de betalactamasas. Estos resultados se corresponden con los publicados por Navarro y otros.8
En orden decreciente, se encontraron las BLLE, que a su vez han ido ocupando un lugar protagónico en las infecciones del tracto urinario y que limitan las opciones terapéuticas porque modifican antibióticos como penicilinas, oximino-cefalosporinas (cefotaxima, ceftriaxona, ceftazidima, cefepima) y monobactámicos (aztreonam), pero no a cefamicinas (cefoxitina) ni a carbapenémicos (imipenem, meropenem y ertapenem), son inhibidas por el ácido clavulánico. En el año 2007, González y otros, en La Habana, reportaron 10 % de cepas productoras de BLEE,17 cifras inferiores a las encontradas en este estudio, sin embargo se aproximan a las encontradas por Andrade-Almaraz y otros, en México.18
La resistencia enzimática a los aminoglucósidos puede deberse a dos mecanismos distintos, a la producción de una o varias enzimas inactivantes (acetiltransferas [AAC], fosfotransferasas [APH]y nucleotidiltransferasas [ANT]) y a la presencia de metiltransferasas (ArmA, Rmt o Npm). En las cepas productoras de BLEE, la resistencia a este grupo, probablemente sea el resultado de la expresión de enzimas modificantes inducidas por el amplio uso de gentamicina, tanto en el medio hospitalario como en el comunitario.19
Diversos son los estudios realizados en el mundo donde una u otra enzima resulta predominante. En este estudio, al igual que en Estados Unidos y en Europa, existe mayor prevalencia de ANT (2´´); sin embargo, en Asia predomina la AAC(6´) y en Chile, la AAC(3)-V.20
La nucleotidiltransferasa 2´´ afecta los halos de inhibición de kanamicina, gentamicina y tobramicina, mientras que la AAC (6´) se muestra sensible a amikacina, pero con sensibilidad intermedia o resistente a tobramicina y/o netilmicina y sensible a gentamicina.8
Navarro y otros refieren que en las quinolonas, tras una primera mutación en un QRDR generalmente de GyrA, la cepa aparecerá resistente al ácido nalidíxico, pero sensible a fluoroquinolonas y que posteriores mutaciones en este u otro QRDR harán que la cepa pase a ser resistente a fluoroquinolonas.8 Los principales mecanismos de resistencia descritos en las fluoroquinolonas son consecuencia de mutaciones en los genes de la ADNgirasa y la topoisomesasa IV, mutaciones que afectan las porinas o el lipopolisacárido e impiden la penetración del antimicrobiano al interior de la bacteria; y/o la presencia de bombas que expulsan el antimicrobiano hacia su exterior.21 El empleo indiscriminado de estos "nuevos" fármacos, trajo consigo una serie de mutaciones sucesivas en las topisomerasas que condujeron a una mayor resistencia de los antibióticos pertenecientes a este grupo; aunque en los últimos años se describen también las resistencias mediadas por plásmidos (PMQR).22 Este grupo de fármacos ha desarrollado mecanismos inverosímiles y diversos que los hacen inefectivos en el tratamiento actual de la mayoría de las ITU.
Casellas, en un artículo sobre América Latina refirió: "los mecanismos de resistencia no son sino la expresión de los medios ancestralmente logrados por ciertas especies bacterianas para sobrevivir en un ambiente que les resulta agresivo".23 Reafirmando sus palabras podemos resumir que se está originando un descenso significativo de la sensibilidad de E. coli a la mayor parte de los antibióticos, por lo que una correcta interpretación de la susceptibilidad y de los mecanismos de resistencia harán más efectiva la adecuada terapéutica.
REFERENCIAS BIBLIOGRÁFICAS
1. Junquera S, Loza E, Baquero F. Evolución del patrón de sensibilidad de aislados de Escherichia coli en urocultivos procedentes del medio hospitalario y extrahospitalario. Enferm Infecc Microbiol Clin. 2005;23(4):197-201.
2. Murray PR, Rosenthal KS, Pfaàer MA. Microbiología médica. 5ta ed. Madrid: Geo Consultoria; 2005.
3. Mensa J. Protocolos clínicos SEIMC, infección urinaria. [citado 12 dic. 2012]. Disponible en: http://www.seimc.org/contenidos/documentoscientificos/procedimientosclinicos/seimc-procedimientoclinicoiv.pdf
4. Blanco M, Blanco J, Blanco JE, Alonso MP, Abalia I, Rodríguez E, et al. Factores de virulencia y serogrupos 0 de Escherichia coli causantes de infecciones urinarias comunitarias. Enferm Infecc Microbiol Clin. 1995;13:236-41.
5. Ehevarria-Zarate J, Sarmiento E, Osores-Plengue F. Infección del tracto urinario y manejo antibiótico. Acta méd. Peruana, ene./abr. 2006;23(1):26-31.
6. Labarca J, Araos R. Resistencia antimicrobiana: problema en aumento y soluciones escasas. Rev Chil Infect. 2009;26:8-9.
7. Hart M, Espinosa F, Llanes N. Marchas técnicas para la realización del antibiograma por el método Bauer-Kirby. Laboratorio de Microbiología Hospital "Hermanos Ameijeiras". La Habana; 2012. [citado 12 dic. 2012]. Disponible en: http://www.hha.sld.cu
8. Navarro F, Calvo J, Cantón R, Fernadez-Cuenca F, Mirelis B. Detección fenotípica de mecanismos de resistencia en micoorganismos gramnegativos. Enferm Infecc Microbiol Clin. 2011;29(7):524-34.
9. Ponce M. Identificación y susceptibilidad antimicrobiana de las principales bacterias aisladas en urocultivos de pacientes ambulatorios y hospitalizados [tesis]. Facultad de Biología. Universidad de la Habana; 2011.
10. Seija V, Frantchez V, Pintos M, Bataglino MN, Torales M, Díaz Á, et al. Etiología de la infección urinaria de adquisición comunitaria y perfil de susceptibilidad de Escherichia coli a los principales agentes antimicrobianos. Rev Méd Urug. [revista en Internet]. Mar. 2010 [citado 12 dic. 2012];26(1):14-24. Disponible en: http://http://www.scielo.edu.uy/scielo.php?script=sci_arttext&pid=S0303-32952010000100003&lng=es&nrm=iso&tlng=es
11. Silva F, Cifuentes D, Pinto ME. Resultados de la vigilancia de susceptibilidad antimicrobiana en Chile: Consolidando una red. Rev Chil Infect. 2011; 28(1):19-27.
12. Leibovici L, Vidal L, Paul M. Aminoglycoside drugs in clinical practice: an evidence-based approach. J Antimicrob Chemother. 2009;63:24651.
13. Flores S, Marjorie K, Perez LM, Trelles MG, Malaga G, Loza C, et al. Infección urinaria intrahospitalaria en los servicios de hospitalización de Medicina de un Hospital General. Rev Med Hered (Lima). abr./jun. 2008;19(2): 42-5.
14. Sánchez M, Sayalero M, Marinero M. Ciprofloxacina en las infecciones urinarias. [citado 21 abr. 2010]. Disponible en: http://www.intramed.net/contenidos.asp?contenidoID=58267
15. Villarroel E, Navarro P, Ramos R, Andrade E, Bolívar A, Marcano J. Escherichia coli identificadas en pacientes con infecciones urinarias: Sensibilidad antimicrobiana. Rev Soc Ven Microbiol. [revista en Internet]. ene. 2002[citado 12 dic. 2012];22(1):18-21. Disponible en: http://www.scielo.org.ve/scielo.php?script=sci_arttext&pid=S1315-25562002000100005&lng=es
16. Andreu A, Alos JI, Gobernado M, Marco F, De la Rosa M, García-Rodríguez JA. Etiología de la infección urinaria baja adquirida en la comunidad y resistencia de Escherichia coli a los antimicrobianos de primera línea. Estudio Nacional Multicentrico. Med Clin (Barc.). 2008;130(13):481-6.
17. González L, Ramos A, Nadal L, Morffi J, Hernández E, Álvarez AB, et al. Identificacion fenotípica y molecular de b-lacatmasas de espectro extendido TEM y SHV producidas por Escherichia coli y Klebsiella spp. aislados clínicos de hospitales. Rev Cubana Med Trop. [en línea].2007;59(1)[citado 22 jun. 2012]. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0375-07602007000100010&lng=es&nrm=iso&tlng=es
18. Andrade-Almaraz V, Sanchez-Francia D, Garcia-Pinzón C, Sanchez-Rogel J, Garrido-Rodriguez JR. Incidencia de betalactamasas de espectro extendido en aislamientos causantes de infecciones en las vías urinarias adquiridas en la comunidad. Rev Bioq. 2006;31(SA):104.
19. Díaz P, Bello H, Domínguez M, Trabal N, Mella S, Zemelman R, et al. Resistencia a gentamicina, amikacina y ciprofloxacina en cepas hospitalarias de Klebsiella pneumoniae subespecie pneumoniae productoras de betalactamasas de espectro extendido. Rev Méd Chile. 2004;132(10):1173-8.
20. Álvarez J. Mapa bateriológico de bacilos gramnegativos [tesis doctoral]. Universidad complutense de Madrid. España, 2002.
21. Robicsek A, Jacoby G, Hooper D. The worldwide emergence of plasmid-mediated quinolone resistance. Lanc Infect Diseas. 2006;6(10):629-40.
22. Hopkins KL, Davies RH, Threlfall EJ. Mechanisms of Quinolone Resistance in Escherichia coli and Salmonella. Antimicrob Agent Chemother. 2005;25(5):358-73.
23. Casellas JM. Resistencia a los antibacterianos en América Latina: consecuencias para la infectología. Rev Panam Salud Pública. 2011;30(6):51928.
Recibido: 7 de noviembre de 2013.
Aprobado: 20 de noviembre de 2013.
Dra. Bettsy Suárez Trueba. Hospital Clinicoquirúrgico "Hermanos Ameijeiras", San Lázaro No. 701 entre Belascoaín y Marqués González, Centro Habana, La Habana, Cuba. CP 10 300.