My SciELO
Services on Demand
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Cubana de Endocrinología
On-line version ISSN 1561-2953
Rev Cubana Endocrinol vol.27 no.1 Ciudad de la Habana Jan.-Apr. 2016
Rev Cubana Endocrinol. 2016;27(1)
ARTÍCULO ORIGINAL
Correspondencia clínica, hormonal y ecográfica en el diagnóstico del síndrome de ovarios poliquísticos
Clinical, hormonal and echographic correspondence in the diagnosis of polycystic ovary syndrome
Juan Carlos Vázquez Niebla,I Jorge Luis Calero Ricardo,II Juan Pablo Carías,I Gilda Monteagudo PeñaI
IInstituto Nacional de Endocrinología (INEN). La Habana, Cuba.
IIInstituto de Ciencias Básicas y Preclínicas “Victoria de Girón”. La Habana, Cuba.
RESUMEN
Introducción: el síndrome de ovarios poliquísticos es el trastorno endocrino más frecuente en la mujer en edad reproductiva. Se caracteriza por trastornos menstruales, hiperandrogenismo y ovarios poliquísticos por ultrasonido, y afecta la fertilidad y el metabolismo femeninos.
Objetivo: determinar la frecuencia de aparición de los criterios diagnósticos de síndrome de ovarios poliquísticos en mujeres con sospecha de esta afección, y la posible correspondencia entre el diagnóstico clínico, hormonal y ecográfico.
Métodos: se realizó un estudio descriptivo correlacional en 140 mujeres. Se les practicó interrogatorio y examen físico, ultrasonido diagnóstico y estudio de las hormonas folículo estimulante, luteinizante y testosterona. Para el análisis estadístico se utilizaron tablas de frecuencia y la prueba de chi cuadrado (p< 0,05).
Resultados: la edad media fue 26,3 años. De 96 mujeres (68,5 %) con alteraciones del ciclo menstrual, 76 (79,2 %) refirieron oligomenorrea. Hubo sobrepeso en 64 pacientes (45,7 %). La testosterona elevada fue la alteración hormonal predominante (52,7 %). El 84,3 % presentó volumen ovárico ≥ 10 cc. Hubo asociación significativa entre las alteraciones menstruales y la presencia de ovarios poliquísticos (p= 0,000), hirsutismo (p= 0,001) y acné (p= 0,000), pero no ocurrió así con las variables hormonales. Hubo coincidencia entre el diagnóstico ecográfico y la testosterona elevada en el 46,2 % de las pacientes.
Conclusiones: Existe asociación entre las variables clínicas y el diagnóstico de síndrome de ovarios poliquísticos, pero no así entre los criterios diagnósticos ecográficos y hormonales, ni entre las alteraciones hormonales y el diagnóstico clínico y ecográfico del síndrome de ovarios poliquísticos, en estas pacientes.
Palabras clave: SOP; diagnóstico; ultrasonido; hiperandrogenismo.
ABSTRACT
Introduction: polycystic ovary syndrome is the most common endocrine disorder in a woman at reproductive age. It is characterized by menstrual disorders, hyperandrogenism and CT-detected polycystic ovaries and it has an effect on fertility and metabolism.
Objective: to determine the frequency of occurrence of diagnostic criteria of polycystic ovary syndrome in women suspected of suffering this disease, and the possible correspondence among the clinical, hormonal and echographic diagnoses.
Methods: a correlational descriptive study was conducted in 140 women. They were questioned and physically examined in addition to performing diagnostic ultrasound and study of the follicle-stimulating hormone, the luteinizing hormone and testosterone. For the statistical analysis, the frequency tables and the Chi-square test (p< 0.05) were used.
Results: the average age was 26.3 years. Of 96 women (68.5 %) with menstrual disorders, 76 (79.2 %) said they had oligomenorrhea. Sixty four were overweighed (45.7 %). Elevated testosterone was the predominant hormonal alteration (52.7 %). In the group, the ovary volume was equal to or higher than 10 cc in 84.3 % of the group. Significant association was observed between the menstrual disorders and the presence of polycystic ovaries (p= 0.000), hirsutism (p= 0.001) and acne (p= 0.000), but this did not occur with the hormonal variables. The echographic diagnosis and the elevated testosterone showed correspondence in 46.2 % of patients.
Conclusions: there is association between the clinical variables and the diagnoses of polycystic ovary syndrome, but neither the echographic and hormonal diagnostic criteria, nor the hormonal alterations and the clinical and echographic diagnosis of polycystic ovary syndrome were related.
Keywords: PCOS; diagnosis; ultrasound; hyperandrogenism.
INTRODUCCIÓN
El síndrome de ovarios poliquísticos (SOP) es el trastorno endocrino más frecuente en la mujer en edad reproductiva.1 En una revisión realizada en 1 042 pacientes, la prevalencia fue del 23 %, y prácticamente la mitad de las mujeres entre los 15 y los 25 años presentaba ovarios con morfología poliquística.2 En Europa la prevalencia fue similar entre los países (Grecia 6,8 %, 8 % en el Reino Unido, España 6,5 %),3-5 y en Estados Unidos se han informado cifras de hasta el 6 %.6
La etiología no está muy bien definida. Se ha informado la aparición del síndrome con una distribución familiar, aunque no se ha podido determinar un claro patrón de herencia. Se considera que el SOP representa un rasgo complejo similar al de la diabetes tipo 2 y la obesidad, y que los factores genéticos y ambientales contribuyen a su patogénesis.7,8
Con frecuencia se encuentran concentraciones elevadas de hormona luteinizante (LH), con niveles de hormona folículo estimulante (FSH) bajos, o en el límite bajo.9 La concentración elevada de LH se debe, en parte, al aumento de la sensibilidad de la hipófisis a la estimulación de la hormona liberadora de gonadotropinas (GnRH), que se manifiesta por un aumento de la frecuencia y la amplitud de los pulsos de LH,10 entre otros.
En las pacientes con anovulación persistente aumenta la producción de estrógenos y andrógenos. Esto provoca elevadas concentraciones de testosterona, androstendiona, dehidroepiandrosterona (DHEA), 17-hidroxiprogesterona y estrona.9 La combinación de concentraciones elevadas de andrógenos suprarrenales y obesidad hace que se incremente la formación de estrógenos extraováricos, que ejercen retroalimentación positiva sobre la secreción de LH y negativa sobre la de FSH, por lo que la tasa plasmática de LH/FSH puede ser mayor de 3, aunque no se ha identificado un perfil hormonal constante.11,12
Clínicamente, el SOP se caracteriza por amenorrea u oligomenorrea, hirsutismo, infertilidad, y en ocasiones, obesidad y resistencia a la insulina.11
La definición del SOP ha variado con los años,2,13 y se deben excluir otras entidades que también cursan con hiperandrogenismo. Su diagnóstico se basa en la presencia de dos de los tres criterios siguientes: alteraciones menstruales (oligo/amenorrea, amenorrea, etc.); hiperandrogenismo clínico (hirsutismo, virilismo o ambos); y bioquímico (testosterona libre, androstenediona y DHEA), así como hallazgos ultrasonográficos (crecimiento bilateral, más de 10 folículos menores de 9 mm de diámetro y volumen ovárico mayor de 10 cc).2,14-16 Estos son los criterios fundamentales para el diagnóstico del síndrome, pero otros hallazgos también pueden estar presentes, aunque por su inconstancia y su carácter subjetivo, no se reconocen internacionalmente como criterios diagnósticos; entre ellos, se encuentran el incremento del estroma ovárico, la distribución periférica de las estructuras sonoluscentes, la relación útero-ovario < 1,1 y, en la flujometría Doppler, el aumento de la impedancia de las arterias uterinas, y la presencia de resistencia vascular moderada obtenida en el estroma hiperecogénico y que no muestra cambios cíclicos.17
La frecuencia de los diferentes signos y sintomas descritos en el SOP varía. Según Slowey,18 el hirsutismo se presenta entre el 60 y el 90 % de las pacientes, y el acné entre el 24 y el 27 %. La oligomenorrea aparece entre el 50 y el 90 % de los casos, y la amenorrea entre el 26 y el 51 %. Alrededor del 22 % tendrán un patrón menstrual normal. La infertilidad es frecuente (55-75 %). La obesidad se describe entre el 40 y el 60 % de los casos. Se puede observar hemorragia uterina disfuncional en el 30 % de las pacientes. La presencia de ovarios poliquisticos por ultrasonido, aunque frecuente, no es constante, pues aparece en entre el 50 y el 75 % de las mujeres.
Debido a esta gran variabilidad, las pacientes con sospecha de SOP no presentarán toda la constelación de síntomas y signos que se consideran criterios diagnósticos de esta afección.18,19 En nuestro país se han realizado varios estudios relacionados con el SOP, centrados fundamentalmente en su relación con el síndrome metabólico o la resistencia a la insulina.20-23 El síndrome también se ha estudiado desde el punto de vista genético.24 Acosta y otros25 realizaron un estudio sobre el patrón hormonal de 30 mujeres con diagnóstico clínico y ecográfico de SOP, y concluyeron que la asociación de hiperandrogenismo clínico y signos ecográficos del SOP no predice los hallazgos hormonales.
El objetivo del presente estudio fue determinar la frecuencia de aparición de los criterios diagnósticos de SOP en las mujeres con sospecha de esta afección que se atienden en el INEN, y la posible correspondencia entre el diagnóstico clínico, hormonal y ecográfico del SOP.
MÉTODOS
Se realizó un estudio descriptivo correlacional en 140 pacientes con signos y síntomas sugestivos de SOP, referidas de las consultas INEN para realizarles el ultrasonido diagnóstico.
Los criterios de inclusión seguidos fueron: mujeres con sospecha de SOP según los rasgos clínicos de los criterios del consenso de Rotterdam, y la edad entre 18 y 45 años; y los de exclusión: mujeres con diagnóstico previo de SOP que hubieran recibido tratamiento; embarazo 6 meses antes del estudio; así como la presencia de otras causas de hiperandrogenismo (hiperplasia adrenal congénita, neoplasias secretoras de andrógenos, uso de fármacos anabólicos, etcétera).
A las pacientes se les realizó un interrogatorio que contempló antecedentes personales, familiares, historia obstétrica y ginecológica; y un examen físico que incluyó peso y talla, distribución del vello y presencia de acné, además del ultrasonido diagnóstico. Se indicó FSH, LH y testosterona total entre los días 3 y 5 del ciclo en las participantes que presentaban menstruación, y en cualquier momento si existía amenorrea. Los datos se recogieron en una planilla confeccionada al efecto.
A las pacientes se les explicaron las razones para realizar el estudio y se les solicitó su consentimiento para participar en él. El estudio fue evaluado por el comité de ética de investigación del centro.
Con una población de mujeres con diagnóstico clínico presuntivo de SOP de aproximadamente 200 casos, una estimación de una posible correspondencia del 50 % entre los parámetros clínicos, hormonales y ecográficos, una variación del 5 % en esta suposición y una probabilidad de error alfa de 0,05, se calculó un tamaño muestral de 140 pacientes.
Para el análisis estadístico se utilizaron tablas de frecuencia absoluta y relativa para las variables socio-demográficas, así como para las variables clínicas, hormonales y ultrasonográficas. Para determinar la posible correspondencia entre el diagnóstico clínico, hormonal y ecográfico se utilizó la prueba de chi cuadrado de dos colas, con un valor de p< 0,05 para la significación estadística.
RESULTADOS
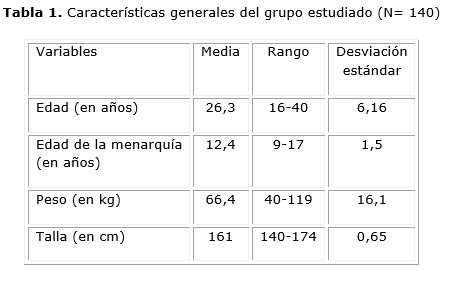
En la tabla 1 se aprecian las características clínicas del grupo estudiado. La media de la edad de estas pacientes fue 26,3 años (rango 16-40 años, desviación estándar [DE] 6,16). La edad de la menarquia estuvo entre 9 y 17 años (media 12,4 años, DE 1,5). El peso varió entre 40 y 119 kg (media 66,4 kg, DE 16,1), y la talla estuvo entre 140 y 174 cm (media 161 cm, DE 0,65).
El 60,7 % de las pacientes (n= 85) no tenía antecedentes de enfermedades. En cuanto a los antecedentes obstétricos, 92 pacientes estudiadas (65,7 %) nunca se habían embarazado y 48 (34,3 %) habían tenido al menos un embarazo. De estas, 17 (12,1 %) tenían al menos un parto anterior, y 37 (26,4 %) se habían realizado al menos un aborto.
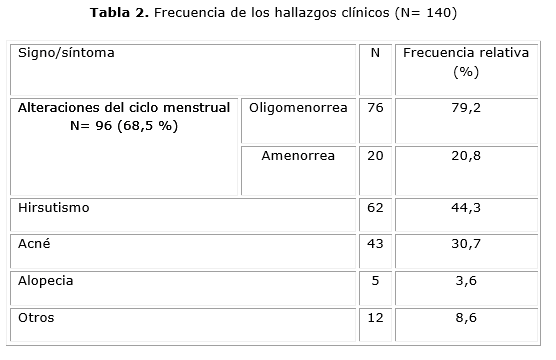
La tabla 2 muestra los hallazgos clínicos. Las alteraciones del ciclo menstrual referidas por 96 pacientes (68,5 %) fueron el hallazgo más frecuente. De todas estas mujeres, 76 (79,2 %) refirieron oligomenorrea, y la amenorrea fue referida por 20 pacientes (20,8 %). El hirsutismo se comprobó en 62 pacientes (44,3 %), el acné en 43 (30,7 %) y la alopecia en solo 5 (3,6 %). Finalmente, de las mujeres que refirieron otros síntomas o signos, solo 4 acudieron por infertilidad.
Se encontró que 64 pacientes (45,7 %) presentaron un índice de masa corporal (IMC)≥ 25, correspondiente a sobrepeso según la clasificación de la OMS,26 y que 30 pacientes (21,4 %) presentaron un IMC≥ 30, correspondiente a obesidad.
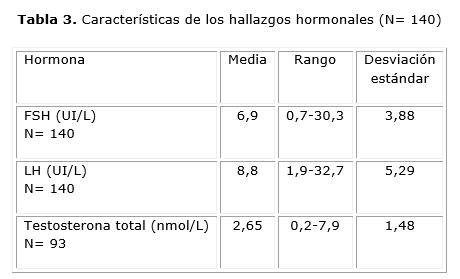
En la tabla 3 se muestra que la FSH tuvo una media de 6,9 UI/L (rango 0,7-30,3 UI/L). La LH se encontró entre 1,9 UI/L y 32,7 UI/L (media 8,8 UI/L), y la testosterona total entre 0,2 nmol/L y 7,9 nmol/L (media 2,65 nmol/L).
En 20 pacientes (14,3 %) los valores de FSH estuvieron por encima de los considerados normales (≥ 9,5 UI/L), y en 57 (40,7 %) los valores de LH fueron mayores de 9,0 UI/L. De las mujeres en las que se determinó testosterona total (n= 93), 49 (52,7 %) presentaron valores elevados. En el 8,5 % de las pacientes el cociente LH/FSH estuvo por encima de 3.
La tabla 4 presenta los hallazgos ecográficos. El volumen ovárico mayor o igual de 10 cc se observó en 118 pacientes (84,3 %), y la presencia de 12 folículos o más en 86 pacientes (61,4 %). La combinación de ambos elementos se encontró en 78, lo que representa el 55,7 % de las mujeres en estudio.
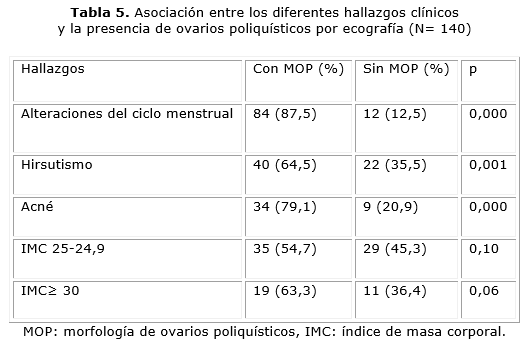
La tabla 5 muestra la asociación de los diferentes parámetros clínicos encontrados con la presencia de ovarios poliquísticos por ecografía. Con excepción del IMC, se encontró una fuerte asociación entre los parámetros clínicos estudiados y la presencia de ovarios poliquísticos.
En la tabla 6 se muestra que ninguna de las variables hormonales estudiadas mostró asociación con la presencia de ovarios poliquísticos por ecografía (p> 0,05).
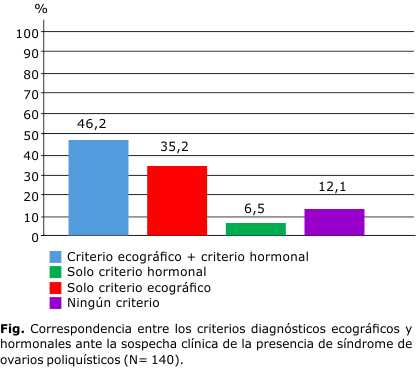
El análisis para determinar la correspondencia entre los criterios diagnósticos ecográficos y hormonales (Fig.), mostró que en este grupo de pacientes con sospecha clínica de presencia de SOP, hubo coincidencia con respecto al diagnóstico ecográfico y el hormonal (testosterona sérica > 2,25 nmol/L) en 46,2 %. En 35,2 % los criterios diagnósticos por ecografía estaban presentes, pero no los hormonales, y en el 6,5 % hubo alteraciones en los parámetros hormonales, aunque no se encontraron criterios ecográficos que apoyaran el diagnóstico. En el 12,1 % de las pacientes, ambos exámenes complementarios coincidieron en que, a pesar de existir elementos clínicos de SOP, no hubo criterios hormonales ni ecográficos que confirmaran la presencia de esta entidad.
DISCUSIÓN
A pesar del tiempo transcurrido desde la primera descripción del SOP por Stein y Leventhal,27 aún es motivo de controversia cuáles son los elementos clínicos, hormonales y ecográficos que mejor definen la entidad.
Los motivos de consulta que llevan al diagnóstico de SOP son variados, y van desde trastornos menstruales hasta dificultades para la concepción; además, están relacionados fundamentalmente con la edad y las metas de la paciente. En este estudio el hallazgo clínico más frecuente fueron las alteraciones del ciclo menstrual, y de estas, la oligomenorrea, lo que coincide con resultados similares de otros trabajos.28 En esta investigación el hirsutismo fue el segundo hallazgo en cuanto a frecuencia dentro de las manifestaciones clínicas, lo que contrasta con otros autores que lo señalan como el síntoma predominante.29
Con respecto a la historia reproductiva, aunque la mayoría de las pacientes no se había embarazado con anterioridad, un grupo no predominante sí había tenido al menos un embarazo. En general, fueron pocas las pacientes cuya consulta fue motivada por infertilidad, lo que presupone que las pacientes con SOP no son completamente anovuladoras, aspecto verificado en otros estudios.30-32 Lo anterior pudiera estar asimismo relacionado con la edad promedio de las pacientes estudiadas, ya que es posible que en este grupo el interés por la fertilidad no haya sido predominante.
Este trabajo muestra que las diferentes variables clínicas son las que mostraron una fuerte asociación con el diagnóstico de ovarios poliquísticos. Lo anterior coincide con varios autores y estudios en otros países,15,33 en los que la aparición conjunta de amenorrea y manifestaciones de hiperandrogenismo ha demostrado una fuerte asociación con la presencia de morfología de ovarios poliquísticos por ecografía. Guo y otros28 indican que la presencia de los elementos clínicos obtenidos a partir del interrogatorio y otros aspectos relacionados con la afección pero que actualmente no constituyen elementos diagnósticos (como la obesidad, la distribución de la grasa corporal, el síndrome metabólico o la resistencia a la insulina), orientarán hacia el diagnóstico de SOP en un importantísimo número de casos, sin necesidad de esperar por demorados y costosos exámenes complementarios. De ahí la recomendación que se deriva de este estudio, relacionada con la necesidad de individualizar las indicaciones de exámenes hormonales, que una gran parte de las veces no serán imprescindibles para establecer un esquema de tratamiento y seguimiento.
Aunque se ha informado la asociación del SOP con la obesidad, la resistencia a la insulina y el síndrome metabólico,2,22,31,34-36 en el presente estudio el IMC≥ 30 no se asoció con la presencia de ovarios poliquísticos, lo que contrasta con otros estudios, en los cuales se ha observado que la obesidad es prevalente entre las mujeres con SOP, con cifras que varían entre el 30 y el 75 %, y exacerba sus manifestaciones clínicas.2,11,35 No obstante, consideramos que es necesario realizar investigaciones con muestras mayores, que permitan apoyar o rechazar con seguridad la asociación o no de la obesidad con el SOP.
Los valores hormonales medios se encontraron dentro de límites normales, aunque en la población estudiada hay algunos valores máximos extremos de FSH y LH. Los valores elevados de LH fueron mucho más frecuentes en este grupo. Se conoce que el incremento de las concentraciones de LH produce hiperplasia de las células del estroma y de la teca del ovario, lo que da lugar al aumento de la producción de andrógenos, que a su vez, aumenta la aromatización periférica y perpetúa la anovulación crónica.2,12,37 Con respecto al índice LH/FSH≥ 3, reportado habitualmente, la frecuencia fue mínima en este grupo, lo que coincide con otros estudios.7,25
Tampoco se encontró asociación entre las variables hormonales medidas y la presencia de ovarios poliquísticos por ecografía. Se confirma, una vez más, la limitada utilidad de las determinaciones de FSH, LH y del cociente LH/FSH, lo que se señala también en otras publicaciones.38
Aunque varios autores recomiendan la medición de otros andrógenos como androstenediona, dihidroepiandrosterona y sulfato de dihidroepiandrosterona,39-41 la falta de asociación de los niveles elevados de la testosterona total con el ovario poliquístico, coincide con otros estudios realizados en Cuba. Por ejemplo, Acosta y otros señalan que la presencia de hiperandrogenismo clínico y signos ecográficos de SOP, no se corresponde necesariamente con valores anormales de dicha hormona.25
Hubo una alta frecuencia de aparición de alteraciones en los hallazgos ultrasonográficos indicadores de ovarios poliquísticos, pero nuevamente es necesario llamar la atención acerca de que no se trata de la población general, sino de una población que se atiende en una institución de tercer nivel. El aspecto ecográfico de los ovarios en este estudio fue variable, pues no hubo un patrón que estuviera presente en todas las pacientes estudiadas, aunque lo más predominante fue el volumen ovárico ≥ 10 cc.
Es importante mencionar que se encontró una fuerte asociación entre los criterios clínicos y ecográficos de SOP. Pudiera plantearse entonces que, junto con el cuadro clínico, la incorporación de la ecografía transvaginal como criterio diagnóstico aumenta la sensibilidad diagnóstica en esta entidad, lo que se verifica en otros estudios.42,43
Los resultados del análisis estadístico muestran que la mejor correspondencia con los criterios clínicos de SOP se logró cuando convergieron los criterios diagnósticos ecográficos y hormonales, aunque esa coincidencia se logró en poco menos del 50 % de las pacientes estudiadas. Esto también se verifica en otros estudios, en los cuales, además, las pacientes tienen un promedio de edad similar al del grupo de este estudio, y en los que se ha verificado la presencia de SOP en pacientes con perfiles hormonales normales.44 Otros autores25 han demostrado la falta de correspondencia entre los hallazgos clínicos y hormonales en pacientes con diagnóstico de SOP, así como la frecuencia variable de hallazgos ecográficos sugestivos en estas pacientes.16,18,38,45
Se concluye que la oligomenorrea y la amenorrea son los hallazgos más frecuentes en este grupo de pacientes, además de la presencia de hirsutismo y acné. La alopecia es un hallazgo muy poco frecuente. Los valores medios de las hormonas estudiadas no difieren de los valores considerados normales, aunque los rangos son amplios. La alteración ecográfica predominante es el volumen ovárico mayor o igual a 10 cc. En este grupo no se encuentra asociación entre las alteraciones de los valores de FSH y LH, del cociente LH/FSH y de los niveles elevados de testosterona total, con el diagnóstico clínico y ecográfico de poliquistosis ovárica. No se encuentra una coincidencia diagnóstica significativa cuando convergen los criterios diagnósticos ecográficos y hormonales en las pacientes con sospecha clínica de SOP.
RECOMENDACIONES
1. Hacer énfasis en la importancia del interrogatorio cuidadoso y del examen físico exhaustivo para la orientación diagnóstica en el SOP.
2. Se recomienda limitar las indicaciones de estudios hormonales de determinación de FSH y LH en pacientes con sospecha de SOP, ya que no constituyen criterios diagnósticos de esta afección, y no han mostrado estar significativamente asociados al diagnóstico clínico o ecográfico de SOP.
3. Realizar estudios adicionales con un número mayor de participantes, para aclarar otros aspectos del diagnóstico del SOP, como su asociación con la obesidad y la resistencia a la insulina.
REFERENCIAS BIBLIOGRÁFICAS
1. Sirmans SM, Pate KA. Epidemiology, diagnosis, and management of polycystic ovary syndrome. Clin Epidemiol. 2014;6:1-13.
2. Azziz R. Position statement: criteria for defining polycystic ovary syndrome as predominantly hyperandrogenic syndrome: An Androgen Excess Society Guideline. J Clin Endocrinol Metab. 2006;91:4237-45.
3. Diamanti-Kandarakis E, Kouli C, Bergiele A, Filandra F, Tsianateli T, Spina G, et al. A survey of the polycystic ovary syndrome in the Greek island of Lesbos: hormonal and metabolic profile. J Clin Endocrinol Metab. 1999;84:4006-11.
4. Mahesh VB. Hirsutism, virilism, polycystic ovarian disease, and the steroid-gonadotropin-feedback system: a career retrospective. Am J Physiol Endocrinol Metab. 2012;302(1):E4-E18.
5. Álvarez F. Prevalencia del síndrome del ovario poliquístico y de factores de riesgo cardiovascular en mujeres obesas premenopáusicas [tesis doctoral]. Universidad de Alcalá, Madrid; 2009.
6. Knochenhauer ES, Key TJ, Kahsar-Miller M, Waggoner W, Boots LR, Azziz R. Prevalence of the polycystic ovary syndrome in unselected black and white women of the southeastern United States: a prospective study. J Clin Endocrinol Metab. 1998;83:3078-82.
7. Tehrani FR, Rashidi H, Khomami MB, Tohidi M, Azizi F. The prevalence of metabolic disorders in various phenotypes of polycystic ovary syndrome: a community based study in Southwest of Iran. Reprod Biol Endocrinol. 2014;12(1):89.
8. Kosova G, Urbanek M. Genetics of the polycystic ovary syndrome. Mol Cell Endocrinol. 2013;5;373(0):29-38.
9. Serdar EB. Fisiología y patología del eje reproductor femenino. En: Kronenberg HM, Melmed S, Polonsky KS, Larsen PR, eds. Tratado de Endocrinología de Williams. Madrid: Elsevier; 2009. p. 569-89.
10. Hayes FJ. Use of a gonadotropin-releasing hormone antagonist as a physiologic probe in polycystic ovary syndrome: assessment of neuroendocrine and androgen dynamics. J Clin Endocrinol Metab. 1998;83(7):2343-9.
11. Hirschberg AL. Polycystic Ovary Syndrome, Obesity and Reproductive Implications [homepage en Internet] [citado 24 de agosto de 2010]. Disponible en: http://cme.medscape.com/viewarticle/707476
12. Matalliotakis I, Kourtis A, Koukoura O, Panidis D. Polycystic ovary syndrome: etiology and pathogenesis. Arch Gynecol Obstet. 2006;274(4):187-97.
13. ESHRE/ASRM. Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome. Fertil Steril. 2004;81:19-25.
14. The Rotterdam ESHRE/ASRM-sponsored PCOS. Consensus Workshop Group Revised 2003. Consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome (PCOS). Hum Reprod. 2004;19:41-7.
15. Ahmed S, Pahwa S, Das CJ, Mir FA, Nisar S, Jehangir M, et al. Comparative evaluation of sonographic ovarian morphology of Indian women with polycystic ovary syndrome versus those of normal women. Indian J Endocrinol Metab. 2014;18(2):180-4.
16. Pacheco J. Manejo del síndrome de ovario poliquístico en la mujer infértil. Rev Per Ginecol Obstet. 2008;54:143-8.
17. Oliva-Rodríguez JA. Diagnóstico ultrasonográfico de las afecciones ováricas. En: Oliva-Rodríguez JA, ed. Ultrasonografía diagnóstica fetal, obstétrica y ginecológica. La Habana: Editorial Ciencias Médicas; 2009. p. 351.
18. Slowey MJ. Polycystic Ovary Syndrome: New Perspective on an Old Problem. South Med J. 2001;94(2):190-6.
19. Iturra A. Síndrome de ovario poliquístico y la evaluación ultrasonográfica en la práctica diaria. Rev Chil Ultrasonog. 2008;11:18-21.
20. García Y, Monteagudo G, Padrón RS, González R. Evaluación de la sensibilidad a la insulina en el síndrome de ovarios poliquísticos. Rev Cubana Endocrinol. 2009;20(3):131-40.
21. García Y, Monteagudo G, Padrón RS, González R. Evaluación de las alteraciones lipídicas en el síndrome de ovarios poliquísticos y su relación con la resistencia a la insulina. Rev Cubana Endocrinol. 2010;21(2):145-53.
22. Ovies G, Domínguez E, Verdeja OL, Zamora H. Frecuencia y características clínicas, hormonales y ultrasonográficas sugestivas de síndrome de ovarios poliquísticos en un grupo de mujeres con síndrome metabólico. Rev Cubana Endocrinol [serie en Internet]. 2008 [citado 8 de octubre de 2012];19(1). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1561-29532008000100004&lng=es&nrm=iso&tlng=es
23. Ovies G, Domínguez E, Verdeja OL, Zamora H. Asociación entre variables hormonales y clínicas y el resultado del ultrasonido ginecológico en mujeres con síndrome metabólico. Rev Cubana Endocrinol [serie en Internet]. 2008 [citado 8 de octubre de 2012];19(2). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1561-29532008000200003&lng=es&nrm=iso&tlng=es
24. Ovies G, Martínez A, Monteagudo G, Sardiñas I. Bases genéticas del síndrome de ovarios poliquísticos. Rev Cubana Endocrinol. 2011;22(3):255-65.
25. Acosta A, Monteagudo G, Menocal A. Patrón hormonal de mujeres con diagnóstico clínico y ecográfico del síndrome de ovarios poliquísticos. Rev Cubana Endocrinol [serie en Internet]. 2004 [citado 8 de octubre de 2012];15(2). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1561-29532004000200003&lng=es&nrm=iso&tlng=es
26. Klein S. Obesidad. En: Kronenberg HM, Melmed S, Polonsky KS, Larsen PR, eds. Tratado de Endocrinología de Williams. Madrid: Elsevier; 2009. p. 1579.
27. Stein IF, Leventhal ML. Amenorrhea associated with bilateral polycystic ovaries. Am J Obstet Gynecol. 1935;29:181-91.
28. Guo M, Chen Z, Eijkemans M, Goverde A, Fauser B, Macklon N. Comparison of the phenotype of Chinese versus Dutch Caucasian women presenting with polycystic ovary syndrome and oligo/amenorrhoea. Hum Reprod. 2012;27(5):1481-8.
29. Motta A. Report of the international symposium: polycystic ovary syndrome: first Latin-American consensus. International Journal of Clinical Practice. 2010;64:544-57.
30. Brassard M, Baillargeon J. Basic infertility including polycystic ovary syndrome. Med Clin North Am. 2008;92:1163-92.
31. Johnstone EB, Rosen MP, Neril R, Trevithick D, Sternfeld B, Murphy R, et al. The Polycystic Ovary Post-Rotterdam: A Common, Age-Dependent Finding in Ovulatory Women without Metabolic Significance. J Clin Endocrinol Metab. 2010;95(11):4965-72.
32. Teede H, Deeks A, Moran L. Polycystic ovary syndrome: a complex condition with psychological, reproductive and metabolic manifestations that impacts on health across the lifespan. BMC Medicine. 2010;8:41-7.
33. Pedersen SD, Brar S, Faris P, Corenblum B. Polycystic ovary syndrome. Validated questionnaire for use in diagnosis. Can Fam Physician. 2007;53:1041-7.
34. Moran C, Tena G, Preciado R, Ruiz P, Reyna R, Moran S. Prevalence of polycystic ovary syndrome in Mexican women. Gynecol Obstet Invest. 2010;69(4):274-80.
35. Fábregues-Gasol F. Epidemiología y conceptos generales. En: Checa-Vizcaíno MA, Espinós-Gómez JJ, Matorras-Weining R, eds. Síndrome del ovario poliquístico. Madrid: Médica Panamericana; 2006. p. 13-24.
36. Baptiste CG, Battista MC, Trottier A, Baillargeon JP. Insulin and hyperandrogenism in women with polycystic ovary syndrome. J Steroid Biochem Mol Biol. 2010 October;122(0):10.
37. Guastella E, Longo RA, Carmina E. Clinical and endocrine characteristics of the main polycystic ovary syndrome phenotypes. Fertil Steril. 2010;94(6):2197-201.
38. Builes CA, Diaz I, Castañeda J, Perez LE. Caracterización clínica y bioquímica de la mujer con Síndrome del ovario poliquístico. Rev Colombiana Obstet Ginecol. 2006;57(1):36-44.
39. Vargas M, Sánchez G, Herrera J. Síndrome de ovarios poliquísticos: abordaje diagnóstico y terapéutico. Rev Biomed. 2003;14:191-203.
40. Lerchbaum E, Schwetz V, Giuliani A, Pieber TR, Obermayer-Pietsch B. Opposing effects of dehydroepiandrosterone sulfate and free testosterone on metabolic phenotype in women with polycystic ovary syndrome. Fertil Steril. 2012 Nov;98(5):1318-25.
41. Golbahar J, Al-Ayadhi M, Das NM, Gumaa K. Sensitive and specific markers for insulin resistance, hyperandrogenemia, and inappropriate gonadotrophin secretion in women with polycystic ovary syndrome: a case-control study from Bahrain. Int J Womens Health. 2012;4:201-6.
42. Kar S. Anthropometric, clinical, and metabolic comparisons of the four Rotterdam PCOS phenotypes: A prospective study of PCOS women. J Hum Reprod Sci. 2013;6(3):194-200.
43. Franks S. Controversy in clinical endocrinology. Diagnosis of polycystic ovarian syndrome: in defense of the Rotterdam criteria. J Clinical Endocrinol Metab. 2006;91:786-9.
44. Carvajal R, Herrera C, Porcile A. Espectro fenotípico del síndrome de ovario poliquístico. Rev Chil Obstet Ginecol. 2010;75(2):124-32.
45. Saxena P, Prakash A, Nigam A, Mishra A. Polycystic ovary syndrome: Is obesity a sine qua non? A clinical, hormonal, and metabolic assessment in relation to body mass index. Indian J Endocrinol Metab. 2012;16(6): 996-9.
Recibido: 7 de mayo de 2015.
Aprobado: 26 de septiembre de 2015.
Juan Carlos Vázquez Niebla. Instituto Nacional de Endocrinología (INEN). Calle Zapata y D, Vedado, municipio Plaza de la Revolución. La Habana, Cuba. Correo electrónico: vazquezj@infomed.sld.cu