INTRODUCCIÓN
El cáncer, enfermedad que puede afectar a cualquier parte del organismo. Se caracteriza por un crecimiento y división más allá de los límites normales de algunas células, afectando partes cercanas del cuerpo u otros órganos; un proceso llamado metástasis (www.cancer.gov, 2021; Tusell, 2022), siendo este la principal causa de muerte por cáncer (Tusell, 2022; OMS, 2022). Los citostáticos son los fármacos capaces de inhibir este crecimiento desordenado de las células, alterando su división celular. La Gemcitabina está dentro del grupo de estos medicamentos, sintetizada por primera vez en los laboratorios Eli Lilly a principios de 1980, décadas más tarde los ensayos clínicos mostraron que podía acabar con las células de leucemia in vitro demostrando su efectividad contra el cáncer. Es un antimetabolito pirimidínico, de administración intravenosa. Estudios posteriores revelaron que este medicamento antineoplásico podía ser usado en diversos tipos de tumores sólidos, como el carcinoma de pulmón localmente avanzado o metastásico, adenocarcinoma pancreático localmente avanzado o metastásico, cáncer de vejiga localmente avanzado o metastásico, carcinoma epitelial de ovario y adenocarcinoma de mama (Tusell, 2022).
En el mundo, se comercializa en diferentes presentaciones: como polvo liofilizado o solución inyectable a la concentración de 40 mg/mL. En Cuba, la Unidad Empresarial de Base Citostáticos de la Empresa Laboratorios AICA elabora este producto en solución inyectable, envasado en bulbos de vidrio incoloro 50R y almacenados de 2-8 °C (Tusell, 2022). El fabricante de un producto farmacéutico es el responsable de que este mantenga su calidad durante el tiempo de vida útil, en las condiciones de envase y almacenamiento propuestos. De ahí la importancia de garantizar que los estudios de estabilidad realizados sean precisos y confiables (Regulación No. 23 CECMED, 2000; www.ispch.cl, 2006; Norma Oficial Mexicana, 2016). Así pues, se requiere velar por el cumplimiento de las buenas prácticas de almacenamiento, particularmente lo relacionado a mantener la refrigeración que se necesita para este tipo de producto, con el uso de unidades debidamente calificadas (USP 43, 2020).
Otro aspecto a destacar es la calidad de los medicamentos, esta es una garantía de la seguridad del paciente. Se mide fundamentalmente por la eficacia y seguridad del producto. En tal sentido, la eficacia es la capacidad de alcanzar la acción terapéutica, y la seguridad es la confianza de que el medicamento no constituya un riesgo para el paciente más allá del riesgo-beneficio (ASEFARMA, 2019).
La estabilidad de los medicamentos, desde su fabricación hasta su utilización, se ve afectada por muchos factores, entre ellos la temperatura. Su incremento, está relacionado con un aumento en los productos de degradación (ASEFARMA, 2019). En este sentido, los medicamentos termolábiles son aquellos que deben conservarse en nevera de 2-8 °C, lo que asegura su actividad farmacológica desde su producción hasta su consumo (ICH Q1E, 2003; ICH Q1A R2, 2003). Para estos, el control de la temperatura es significativo. Al conjunto de procesos que garantiza este control se le denomina cadena de frío, la cual consiste en un grupo de acciones de tipo logísticas, que aseguran el almacenamiento de los medicamentos desde su fabricación hasta su administración (PDA, 2007; PDA, 2011; mireceta.com, 2020; Periáñez et al, 2011).
Las excursiones de temperatura son eventos que ocurren durante la cadena de frío, que pueden ocasionar afectaciones de estabilidad al producto, económicas a las empresas y de disponibilidad del medicamento para los pacientes (Periáñez et al, 2011; García, 2020). Pueden afectar la actividad (eficacia) del medicamento de forma parcial o total y producir toxicidad (Periáñez et al, 2011). Es por ello que es de vital importancia que el fabricante evalué el grado de afectación que puede tener el producto, y el tiempo permitido de las excursiones, aportando suficientes datos de estabilidad (Periáñez et al, 2011; García, 2020).
En el desarrollo del producto Gemcitabina solución inyectable, se analizaron los resultados de los estudios de estabilidad desde los lotes elaborados a escala de laboratorio, y se estableció una correlación entre estos resultados con lo reportado en la literatura para este producto y forma farmacéutica. Se decide almacenar de 2-8 °C, lo que garantizó su estabilidad durante el tiempo de vida útil fijado por los estudios de estabilidad realizados en vida estante (Tusell, 2022). Debido a esto, el producto se califica como termolábil, siendo de vital importancia su conservación en la temperatura óptima durante su fabricación, almacenamiento, distribución y utilización en la práctica médica (Bovaira, Lorente, de la Rubia, San Miguel, 2004).
Durante el almacenamiento y transporte de los productos termosensibles constituye un riesgo las excursiones de temperatura, siendo una problemática que impacta negativamente en la calidad de estos. Es por ello que, como parte de la estabilidad acelerada, teniendo en cuenta que la Gemcitabina se almacena de 2-8 °C, se decide someter a un estudio de estrés de temperatura o estudio de excursión de temperatura. Con este se pretende obtener información adicional que sustente los procesos de distribución y almacenamiento en la cadena de frío (Tusell, 2022). El objetivo fue evaluar a través de un estudio de estrés de temperatura al producto Gemcitabina, solución inyectable.
MATERIALES Y MÉTODOS
El estrés de temperatura se realizó mediante el desarrollo de un estudio experimental de excursión de temperatura, tomando como referencia el presentado por otros autores. Para ello se utilizaron muestras de tres lotes elaborados a escala piloto, durante el desarrollo del producto (Machado et al, 2007).
Condición óptima de almacenamiento del producto en vida de estante: las muestras de cada lote fueron seleccionadas aleatoriamente, y se colocaron para su almacenamiento a temperatura de 2 a 8 ºC.
Condiciones del estudio de estrés térmico: se tomaron muestras aleatorias de cada lote, provenientes de las almacenadas para el estudio de vida estante (conservadas de 2 a 8 ºC). Las muestras seleccionadas fueron extraídas luego de haber transcurrido seis meses de la fecha de fabricación. Se colocaron estas muestras en congelación a -20 °C y posteriormente en horno o mufla, a 40 ºC (Memmert, Alemania).
Equipos: se utilizó un cromatógrafo líquido de alta resolución (CLAR, Shimadzu, Japón) con detector UV, en el que se trabajó a la longitud de onda de 275 nm. Se empleó un inyector automático para aplicar un volumen de inyección de 20 µL y una bomba cuaternaria con flujo de 1,2 mL/min. La separación se realizó usando una columna C-18 sobre sílica gel (5 µm, 150 x 4,6 mm, Shimadzu Japón).
Reactivos: metanol para cromatografía (Merck), dihidrogenofosfato de sodio monohidratado (Merck), ácido ortofosfórico (Merck), sustancia de referencia clorhidrato de gemcitabina (USP), sustancia de referencia citosina (USP) y muestras de lotes pilotos EP20001, EP20002, EP20003.
Procedimiento: se realizó el estudio de estrés de temperatura a través de un estudio experimental de temperatura cíclica, según el reporte técnico número 53 de la bibliografía Parenteral Drug Association (PDA, 2011). Para lo cual se colocaron las muestras en congelación a -20 ± 5 °C durante dos días, y se trasladaron a una cámara climática a 40 ± 2 °C, durante dos días. Se repitió tres veces el proceso, para un total de 12 días de estudio (cuadro 1). Las mediciones se realizaron al final de cada ciclo. Los tres lotes elaborados a escala piloto se evaluaron con los parámetros físico-químicos especificados por la Farmacopea de los Estados Unidos de América (USP 43, 2020), los que se refieren en el cuadro 2.
Preparación de las disoluciones
Aptitud del sistema: se pesaron 10 mg de clorhidrato de gemcitabina y se disolvieron en 4 mL de una solución de hidróxido de potasio en metanol (168 mg/mL). Se calentó a 55 °C durante 6 a 16 h, posteriormente se completó a volumen (100 mL) con ácido ortofosfórico al 1% (0,02 mg/mL de anómero α de gemcitabina) (USP 43, 2020).
Valoración: se realizó por CLAR. Se empleó como fase móvil una mezcla de 15,9 g de dihidrogenofosfato de sodio monohidratado y 2,5 mL de ácido ortofosfórico en 1 L de agua ultrapura. El pH de esta solución quedó incluido en el intervalo de 2,4 a 2,6. Se preparó la muestra del inyectable a una concentración de 0,1 mg/mL de clorhidrato de gemcitabina y la sustancia de referencia clorhidrato de gemcitabina USP a 0,1 mg/mL, ambos en agua ultrapura (USP 43, 2020).
Impurezas orgánicas: se procedió por CLAR, en un sistema de gradiente (Tabla 3) compuesto por la fase móvil A (preparada como en la valoración) y la fase móvil B, metanol. Se preparó la sustancia de referencia a una concentración de 2 µg/mL de clorhidrato de gemcitabina USP y citosina USP; y la muestra a una concentración de 2 mg/mL de clorhidrato de gemcitabina. Ambas en agua ultrapura (USP 43, 2020).
Se acondicionó el cromatógrafo empleando la fase móvil preparada para cada ensayo, con las condiciones anteriormente descritas. Se inyectó la solución de aptitud del sistema, en cada día de trabajo. Se comprobó que la resolución no fuera menor de 8,0 entre el anómero α de gemcitabina y la Gemcitabina, y que el factor de asimetría no fuera más de 1,5 para la señal correspondiente a la Gemcitabina. Se inyectaron cinco réplicas de la sustancia de referencia, en cada día de trabajo, y se confirmó que la desviación estándar relativa no fuera mayor de 1,0 %. Se inyectaron tres réplicas de la muestra y se registraron los cromatogramas y las respuestas de los picos principales. El estudio duró 12 días, cada dos días se tomaron las muestras de la condición de temperatura en que se encontraban, fueron analizadas y se colocaron en la condición de almacenamiento que correspondía (USP 43, 2020).
Interpretación: Para ello se plantearon las interrogantes siguientes (PDA, 2011):
¿Los resultados de los productos de degradación están fuera de los límites especificados?
¿Se identificaron otros productos de degradación?
¿Difiere de forma notable la valoración del medicamento, respecto al inicio del estudio?
¿El estudio cíclico de congelación-descongelación incidió en la calidad del sistema envase-cierre?
¿Se observaron cristales en el medicamento?
RESULTADOS Y DISCUSIÓN
Algunos autores describen en su procedimiento de estudio cíclico sobre la incidencia de los cambios de temperatura en los medicamentos durante su almacenamiento y/o distribución, que tuvieron en cuenta las características del medicamento en estudio, los intervalos de temperaturas, la frecuencia de evaluación de los parámetros analizados en este; y la cantidad de ciclos estudiados (Iturriaga, Bustos, 2018; Nguyen et al, 2019). Los resultados del estudio de estrés de temperatura que se exponen en las Tablas 4, 5 y 6, aportaron información sobre el comportamiento del producto ante períodos cortos, fuera de las condiciones de almacenamiento establecidas; lo que ayudó en la predicción de sus afectaciones ante cualquier cambio que pudiera ocurrir en la cadena de frío de este medicamento. La interpretación de los estudios cíclicos de temperatura se centró en cualquier cambio observado en los indicadores de estabilidad.
Al examinar las interrogantes antes planteadas, se apreció que el producto Gemcitabina en solución inyectable mantuvo sus índices de calidad: descripción, pH y valoración; dentro de los límites establecidos durante el tiempo que duró el estudio. Las impurezas orgánicas no tuvieron similar comportamiento, y mostraron a partir del ciclo 2 un incremento por encima del límite especificado en las impurezas inespecíficas; lo cual indica que se afectó la estabilidad del producto (Tablas 4, 5 y 6).
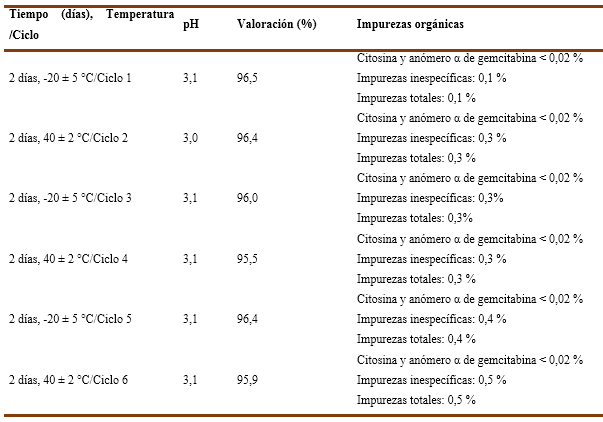
En la tabla 2 se observan los resultados del estudio cíclico de temperatura para el lote EP20001. En el tiempo inicial del estudio, se obtuvieron unidades de pH de 3,0, de valoración 97,1 % y en las impurezas orgánicas los picos secundarios observados estuvieron por debajo de 0,02 %; por lo que no se tuvieron en cuenta. Concluido el Ciclo 1, -20 °C, el producto cumplió con la descripción especificada manteniéndose durante el tiempo que permaneció el estudio. Los resultados de pH se mantuvieron estables y dentro del límite especificado (2,7 - 3,3) y los de valoración estuvieron por debajo de un 5 %, por lo que no se considera un cambio significativo en este parámetro (Regulación No. 23 CECMED, 2000); manteniéndose dentro del intervalo especificado (95,0 - 105,0 %), en el tiempo del estudio. En el ensayo de impurezas orgánicas, los resultados para los productos de degradación citosina y anómero α de gemcitabina no se tuvieron en cuenta, debido a que las señales resultaron inferiores al límite de rechazo (0,02 %). Una vez concluido el ciclo 1 se percibieron impurezas inespecíficas cuyos valores se encontraron por encima del límite establecido, lo que afecta la calidad del producto. Este comportamiento da respuesta a una de las interrogantes referidas con anterioridad. No se identificaron otros productos de degradación.
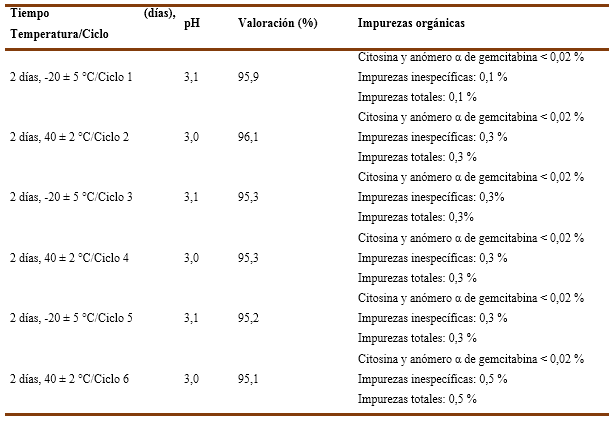
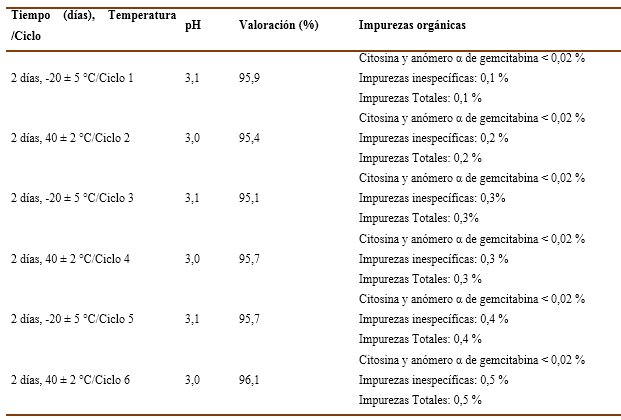
Al analizar los resultados de los lotes EP20002 y EP20003 (Tabla 5 y 6), estos tuvieron comportamiento similar a los del lote EP20001 en todos los parámetros evaluados. En el tiempo de inicio del estudio comenzaron con 3,1 unidades de pH cada uno. Así pues, de valoración 98,4 % y 97,0 % (respectivamente), además de cumplir con la descripción y las impurezas orgánicas.
Posterior al ciclo 1 de congelación a -20 °C, en los tres lotes en estudio se apreció cristalización que se disolvió por agitación; sin afectar la calidad del producto. Este comportamiento está descrito en la literatura en el Folleto de información al profesional: GEMCITABINA concentrado para solución para perfusión (200 mg/5mL y 1000 mg/25mL) (SANDOZ, 2019), referente a que el producto no se debe almacenar por debajo de 2 °C para evitar la formación de cristales. Al analizar esta referencia bibliográfica, la PDA número 53 del 2011 y los resultados del estudio; se confirmó lo descrito en estos documentos relacionado a la congelación.
Almacenar el producto por debajo de esta temperatura conlleva a la aparición de cristales. En este sentido se respondió una de las interrogantes del estudio, en el que se pudo confirmar que se observaron algunos, en el medicamento. Conviene subrayar que durante los análisis efectuados estos se disolvieron por agitación, sin afectar la concentración del activo. Se debe agregar que los procesos de congelación-descongelación no incidieron en la calidad del sistema de envase cierre, en ninguno de los tres lotes.
La Conferencia Internacional sobre Armonización (por sus siglas en inglés, ICH) publicó pautas referidas a las condiciones de almacenamiento, mientras que el Informe Técnico PDA número 53, orienta sobre los estudios de estabilidad para apoyar la transportación y distribución (ICH Q1A (R2), 2003; PDA, 2011). Estas regulaciones establecen que el ciclo de congelación puede descartarse para aquellos productos refrigerados, pruebas previas indiquen que la calidad del producto se afecta por el proceso de congelación. Además, en otro trabajo (Periáñez et al, 2011) se implementó un procedimiento de actuación en caso de la rotura de la cadena de frío, durante el almacenamiento de medicamentos termolábiles en un hospital. Asimismo, se realizan mapeos de temperatura, con una frecuencia establecida mediante un protocolo, en droguerías, para cumplimentar con las Buenas Prácticas de Almacenamiento y Distribución de los medicamentos que requieren refrigeración (Montes, Bolaños, 2019). Por otro lado, en la Empresa Comercializadora y Distribuidora de Medicamentos (EMCOMED), cubana, se planteó la implementación de mejoras en la gestión de calidad durante la distribución para el manejo de las excursiones de temperatura (García, 2020).
Por lo antes expuesto se asevera que el producto objeto de estudio no puede sufrir durante su fabricación, almacenamiento y distribución eventos fuera de su condición óptima de almacenamiento. Es decir, durante la cadena de frío no puede sufrir excursiones de temperatura. Esos resultados no son concluyentes para garantizar que en toda situación de excursión de temperatura se afecte la calidad del producto, por lo que se debe seguir monitoreando las muestras estresadas a largo plazo; debido a que no tienen el mismo comportamiento las muestras en la etapa de desarrollo que las muestras al final de su vida útil. No obstante, se pudo estimar con esos resultados, junto al estudio de estabilidad acelerada y a las referencias consultadas; que el producto es estable a la temperatura de 2 a 8 °C y fuera de esta condición se afecta su eficacia y seguridad.
CONCLUSIONES
El producto Gemcitabina inyectable en solución, se afecta por los cambios bruscos de temperatura. Por lo que se debe evitar la aparición de excursiones de temperaturas durante su almacenamiento y distribución en la cadena de frío; y así con ello llegue el medicamento al paciente con la calidad requerida.