Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Médica Electrónica
versión On-line ISSN 1684-1824
Rev.Med.Electrón. vol.39 supl.1 Matanzas 2017
PRESENTACIÓN DE CASOS
Tumor del estroma gastrointestinal de localización gástrica. Presentación de un caso
Gastrointestinal stromal tumor of gastric location. Case presentation
Dr. Yunier Acosta Hernández, Dr. Oxmany Lantigua Hernández, Dr. René Luis Escaig Olivares, MSc. María Victoria Vega Somonte
Hospital General Docente Dr. Mario Muñoz Monroy. Matanzas, Cuba.
RESUMEN
Los tumores estromales gastrointestinales son neoplasias que se originan en el tejido mesenquimal de la pared del tracto gastrointestinal. Se ha postulado que las células que originan estos tumores son las células intersticiales de Cajal, las cuales constituyen el marcapaso del tracto digestivo, se hallan en el plexo mientérico de Auerbach y responden al oncogén CD117, c-KIT. Pueden presentarse a cualquier edad pero tienen un pico de incidencia durante la sexta década de la vida. La localización más frecuente es en estómago. Tienen variedad de tamaños desde pocos milímetros hasta 20 cm o más. En este trabajo se presenta un paciente de 56 años de edad que fue ingresado en el centro hospitalario del territorio de Colón por presentar un cuadro de sangrado digestivo alto en forma de melena. Se le realizaron exámenes de laboratorio, estudios imagenológicos (Rx contrastado de estómago-duodeno, ultrasonido y TAC abdominal) y endoscopia digestiva superior. Se comprobó la presencia de una tumoración polipoide de 5 cm de diámetro en la región prepilórica gástrica. Fue sometido a operación quirúrgica y los resultados definitivos de Anatomía Patológica arrojaron un tumor del estroma gastrointestinal de bajo grado de malignidad.
Palabras clave: tumor del estroma gastrointestinal, neoplasias.
ABSTRACT
Gastrointestinal stromal tumors are neoplasias originated in the mesenchymal tissue of the gastrointestinal tract wall. It has been stated that cells originating these tumors are the Cajal´s interstitial cells, the digestive tract pacemaker, that are located in he Auerbach´s myoenteric plexus and answer to CD117, c-KIT oncogen. They may occur at any age but have an incidence peak during the sixth decade of life. The most common location is the stomach. There is a variety of sizes, from few millimeters to 20 cm or more. The case of a 56-years-old patient is presented in this work; he was admitted in the territorial hospital of Colon for presenting a high digestive bleeding in a melena form. Laboratory tests, imagine studies (contrasted Rx of stomach and duodena, abdominal ultrasound and CAT) and high digestive endoscopy were made. It was proved the presence of a 5 cm polypoid tumor in the gastric pre-pyloric region. It was surgically operated and the final results of Pathologic Anatomy showed a gastrointestinal stromal tumor of low level malignancy.
Keywords: gastrointestinal stromal tumor, neoplasias.
INTRODUCCIÓN
Los tumores estromales gastrointestinales (GIST) son consideradas las neoplasias del tejido mesenquima más comunes de la pared gastroentérica. Se originan de las células intersticiales de Cajal localizadas en el plexo mioentérico de Auerbach, las cuales responden al oncogén CD117, c-KIT. Constituyen el marcapaso del tubo digestivo por actuar sobre la motilidad intestinal coordinando la peristalsis.(1,2)
Son raros y representan 0,1 al 3 % de las neoplasias gastrointestinales. La localización más frecuente es en estómago (60-70 %), seguido de intestino delgado (20-30 %), colorrectal 5 % y esófago menos del 5 %. Estos tumores pueden surgir desde el omento e intestino mesentérico, pero también retroperitoneales. Tienen variedad de tamaños desde pocos mm hasta 20 cm o más.(3-8)
Su incidencia global es de 10 a 20 por millón de habitantes. En EUA se confirman aproximadamente, entre 2 000 y 5 000 nuevos casos cada año, entre 7 y 20 por millón de habitantes. En Suecia entre 1998 y 2004 mostró una incidencia anual de 14,5 e Islanda reporta 11 casos por millón de habitantes y el Reino Unido se registra 10 casos anuales por millón de habitantes.(2,9)
Pueden presentarse a cualquier edad pero tienen un pico de incidencia durante la sexta década de la vida. Afectan de forma uniforme a todos los grupos étnicos y sexos en igual proporción. (3-5,7)
Entre 30 y 50 % de los portadores de un GIST son asintomáticos al momento del diagnóstico, principalmente cuando la neoplasia es de pequeño tamaño. Cuando son sintomáticos, la presentación clínica más común es la hemorragia digestiva secundaria a ulceración de un tumor de crecimiento endofítico, que puede ser aguda en forma de hematemesis y/o melena o crónica, además manifestarse con un síndrome anémico. Otros signos incluyen náuseas, vómitos, dolor abdominal, pérdida de peso, distensión abdominal y obstrucción intestinal. (3,10-12)
El diagnóstico generalmente se puede sospechar cuando existe historia de sangrado digestivo asociado a una lesión tumoral en la pared gastrointestinal, evidenciada por estudios de imágenes, endoscópicos y confirmada su naturaleza por inmunohistoquímica.(6,11)
PRESENTACIÓN DEL CASO
Paciente masculino de 56 años de edad, raza blanca y procedencia urbana, con antecedentes de EVE (ictus isquémico con secuela motora hace 3 años), que acude al hospital por episodio de sangrado digestivo alto en forma de melena. Se le realiza endoscopia de urgencias encontrándose en región prepilórica gástrica, una masa tumoral de aspecto polipoide de aproximadamente 5 cm de diámetro, pediculado, ulcerado en su superficie, sin estigmas de sangrado activo ni reciente en el momento de la exploración, con biopsia endoscópica negativa.
Se ingresó en sala de cirugía (HC 666120) para mejor estudio y tratamiento, se realizó exámenes de sangre, Rx de tórax y otros estudios imagenológicos como: Rx de estómago y duodeno, ultrasonido y tomografía axial computarizada (TAC) abdominal. Todos mostraron la lesión tumoral gástrica en la ubicación descrita por endoscopia, sin evidencias de infiltración a estructuras vecinas ni metástasis a órganos a distancia. Se decide conducta quirúrgica.
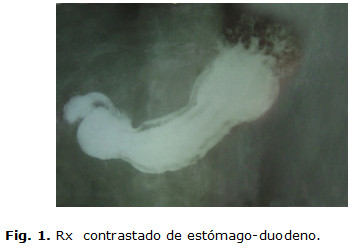
En el Rx contrastado de estómago-duodeno se apreció imagen de defecto de lleno prepilórica que se prolapsa a través de la mitra provocando efecto de pelota. (Fig. 1)
Estudios complementarios
- Hemoglobina:100g/l,Hto:0.30v/l
- Leucocitos totales: 6,6 x 109 /L
- Eritrosedimentación: 42 mm/h
- Coagulograma: Plaquetas 210 x 103 /L , TP: 13/13”, TS: 1´, TC: 8´
- Glicemia: 5.4 mmol/l
- Colesterol: 6.1 mmol/l
- TG: 1.8 mmol/l
- Creatinina: 80.3 mmol/l
- Enzimas hepáticas: TGP: 4.2 UI, TGO: 1.4 UI
- Albúmina: 40 g/l, Proteínas totales: 76 g/l
Ultrasonido de abdomen
Hígado, vesícula, vías biliares, bazo, páncreas y ambos riñones sin alteraciones ecográficas. Entre estómago y primera porción del duodeno se observa una imagen protuyente de paredes gruesas y ecorrefringentes que mide 38 x 51 mm. No adenopatías ni líquido libre en cavidad abdominal.
Durante la cirugía se constató la lesión tumoral gástrica descrita en los estudios imagenológicos y endoscópico, sin adenopatías visibles ni palpables, no metástasis, ni infiltraciones a órganos vecinos. (Fig. 2).
Se realizó gastrectomía distal con gastroduodenostomia (Billroth I). Se envió la muestra al Departamento de Anatomía Patológica que confirmó el diagnóstico del tumor gastrointestinal estromal (GIST) de localización gástrica de bajo grado de malignidad. El paciente presentó una evolución satisfactoria y fue egresado a los seis días. Se realizó seguimiento clínico, analítico, endoscópico y ecográfico a los 6 meses y al año sin apreciar alteraciones.
Diagnóstico anatomopatológico
Biopsia endoscópica: gastritis crónica atrófica folicular moderada.
Descripción macroscópica: tumor sólido de aspecto polipoide, de 40x 38x50 mm, pediculado, ulcerado en su superficie como se puede apreciar en la figura anterior. Al corte localización submucoso, bien delimitado, superficie regular, color blanco-grisáceo, con zonas de congestión y hemorragias focales.
Inmunohistoquímica
Tumor del estroma gastrointestinal tipo GIST de bajo grado de malignidad de la pared gástrica. Indice mitótico menor de 2x10 campos de mayor aumento. IHQ-CD117 positivo, CD4 positivo intenso, Alfa Actina- negativa.
DISCUSIÓN
Los GIST representan el grupo más grande de tumores no epiteliales de estómago e intestino delgado. La localización gástrica más frecuente es en la parte media seguida del antro, casi el 20 % aparecen en el píloro.(2)
La endoscopia, en los casos gastroduodenales o esofágicos, suele mostrar una lesión elevada submucosa, con o sin ulceración de la mucosa. La biopsia endoscópica generalmente no proporciona el material suficiente para establecer el diagnóstico debido a su localización submucosa.(9)
Desde el punto de vista imagenológico, la ecografía suele ser la técnica inicial y más accesible de diagnóstico en muchos pacientes con GIST, evidenciando habitualmente tumores de baja ecogenicidad. La tomografía axial computarizada (TAC) con contraste vía oral e intravenosa, método de elección ante todo paciente con sospecha de tumoración abdominal, pone de manifiesto en estos casos tumoraciones de crecimiento exofítico, heterogéneas y vascularizadas con la presencia asociada de hemorragia, necrosis o transformación quística.(9)
El mejor estudio para el diagnóstico de los tumores submucosos es el ultrasonido endoscópico, ya que puede diferenciar entre lesiones propias de la pared gastrointestinal o compresiones extrínsecas, además puede determinar la capa de origen, tamaño y presencia de adenopatías con una sensibilidad entre el 64 % y 80 %.(13,14) Este proceder asociado a la biopsia aspirativa con aguja fina (BAAF) ofrecen de un 96 a 100 % de eficacia, considerado junto a los estudios inmunohistoquímicos los de mayor confiablidad para el diagnóstico de los tumores submucosos tipo GIST.(2,7,12)
Otros exámenes imagenológicos como la tomografía de emisión de positrones (TEP) y la resonancia magnética constituyen al igual que la ecoendoscopia y la TAC con doble contraste valiosos medios para la detección y estadificación de estas lesiones. La TEP se emplea además para monitorizar respuesta terapéutica en pacientes sometidos a terapia sistémica y en el seguimiento posoperatorio.(9,10,12)
Debido al amplio diagnóstico diferencial histológico de los GIST con otros tumores no epiteliales del tracto gastrointestinal, como: tumores del músculo liso, tumores desmoides, schwannomas, tumores fibrosos solitarios, pólipos inflamatorios, tumores metastásicos y sarcomas primarios, así como melanoma, angiosarcoma y el liposarcoma su confirmación se apoya en técnicas de inmunohistoquímica y biología molecular.(11,15)
Se emplean anticuerpos específicos que marcan la molécula CD117 (factor de crecimiento de la tirosina kinasa), también conocida como c-kit. Aproximadamente 95 % de los tumores son c-kit positivos, mientras que 60-70 % son positivos para CD34, 30-40 % para actina, 5 % para proteína S-100 y 1-2 % para desmina o queratina.(6,16)
Entre el 70 y 80 % tienen un comportamiento biológico benigno y cerca del 30 % muestran un comportamiento clásico maligno, con metástasis e infiltraciones, siendo el hígado el sitio más frecuente para las metástasis, seguido del peritoneo y pulmón.(1,2,9,17)
Se han propuesto varios sistemas pronósticos de malignidad, pero el revisado en 1993 por la Unión Internacional para el Control del Cáncer (UICC) es el más ampliamente aceptado, dicho sistema comprende: el tamaño del tumor, el compromiso de los ganglios linfáticos, la presencia de metástasis a distancia y examen immunopatológico.(18)
No obstante numerosos autores consideran en sus investigaciones sobre estos tumores, la clasificación de Fletcher,(16) del 2002, y modificada en 2006 por Miettienen y Lasota,(20)que tiene al recuento mitótico, (mayor que 5x50 campos de alto valor) y al tamaño tumoral, (mayor de 5 cm) como los principales factores morfológicos-pronósticos relacionados con la progresión de la enfermedad; de ahí que los GIST se clasifiquen en la actualidad, en muy bajo, bajo, intermedio y alto riesgo de comportamiento agreivo o malignidad.(3,7,9-17,19)
La cirugía constituye el tratamiento de elección de estas neoplasias. Consiste en la remoción completa del tumor por laparotomía o laparoscopia, con márgenes microscópicos libres y seudocápsula intacta, evitando la fragmentación o la hemorragia, situaciones que se asocian con alta tasa de recurrencia o con el desarrollo de siembra peritoneal. No se obtiene beneficio alguno con márgenes de resección amplios y la linfadenectomía no está indicada porque las metástasis ganglionares son raras. En general se recomienda la extracción de las metástasis de hígado o peritoneo que sean resecables porque aumenta la supervivencia en estos pacientes en aproximadamente el 50 % a los 5 años.(2,6,19,21-24)
Con el desarrollo actual de la cirugía mínimamente invasiva, existen pacientes con tumores GIST que se han beneficiado con estas técnicas, utilizando abordajes específicos según la localización de la neoplasia en el tubo digestivo, principalmente cuando estos se localizan en estómago.(25-29)
En el año 2008 Privette y cols,(30) describen una clasificación simple de los GIST gástricos de acuerdo a su localización en la pared gástrica, y conforme a ella propusieron el abordaje quirúrgico laparoscópico apropiado y asociado a control endoscópico. La resección en cuña para las lesiones del fundus y curvatura mayor, gastrectomía distal para los tumores del antro o pre-pilóricos y el abordaje intragástrico para los GIST localizados en curvatura menor o en la región de la unión esófago-gástrica. Existen publicaciones constituidas por casos clínicos que demuestran la seguridad y validez de esta última técnica o abordaje, entre ellas, las de los autores Beltrán y cols,(23) en el año 2014.
Los GIST son resistentes a la quimioterapia convencional y la radiación. En los enfermos con enfermedad metastásica, localmente irresecable o recurrencia local está indicado el mesilato de imitanib. Medicamento que pertenece al grupo de los inhibidores de la tirosina quinasa y se emplea no solo en el tratamiento de esta neoplasia, sino también en la leucemia mieloide crónica y otros tipos de cáncer. Su efecto terapéutico se basa en que la exposición de las células tumorales positivas para el receptor c-KIT a este fármaco conduce al bloqueo de su actividad tirosina-quinasa considerada como crítica en la patogenia de estos tumores deteniendo su proliferación e induciendo a la apoptosis.(2,9,1219,24,30)
REFERENCIAS BIBLIOGRÁFICAS
1- Gómez Zuleta M. Paciente con lesión gástrica subepitelial. Rev Col Gastroenterol [Internet]. 2010 [citado 12 Dic 2015];25(4):371-78. Disponible en: www.scielo.org.co/pdf/rcg/v25n4/v25n4a09
2- Haliberto Armenteros B. Presentación de un paciente con tumor estromal gastrointestinal de localización gástrica. CCM [Internet]. 2014 [citado 12 Dic 2015];18(4):785-92. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1560-43812014000400021&nrm=iso
3- Montero León JF, Silveira Pablos JM, Figueroa AJ, et al. Tumor del estroma gastrointestinal. Rev Cubana de Cir [Internet]. 2012 [citado 21 Dic 2015];51(1):90-5. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0034-74932012000100012&nrm=iso
4- Eisenberg B, Pipas J. Gastrointestinal stromal tumor-background, pathology treatment. Hematol Oncol Clin North Am. 2012;26(6):1239-59. Citado en PubMed; PMID: 23116579.
5- Oliveros R, Pío Quintero Á, Sánchez R, et al . Tumores estromales gastrointestinales (GIST) en el Instituto Nacional de Cancerología, Bogota D.C., Colombia 2000-2008. Rev Colomb Cancerol [Internet]. 2011 [citado 21 Dic 2015];15(4):202-11. Disponible en: http://linkinghub.elsevier.com/retrieve/pii/S0123901512700501?via=sd&cc=y
6- Gordillo VR, Beltrán NJ, Díaz M. Tumor del estroma extra gastrointestinal (E-GIST) gigante de omento. Rev Chil Cir [Internet]. 2013 [citado 10 Dic 2015];65(2):166-71. Disponible en: http://www.scielo.cl/scielo.php?pid=S0718-40262013000200011&script=sci_arttext
7- Melo Peñaloza M, Williamson D, Vargas L. Tumor GIST grande en estómago: hallazgo incidental posterior a laparotomía. Presentación de un caso y revisión de la literatura. Rev Col Gastroenterol [Internet]. 2014 [citado 21 Dic 2015];29(1):63-8. Disponible en: http://www.scielo.org.co/scielo.php?script=sci_arttext&pid=S0120-99572014000100009&nrm=iso
8- Beltrán M, Cortés V, Tapia R, et al. Desarrollo de resistencia secundaria a imatinib y tratamiento quirúrgico de un GIST gástrico maligno. Gastroenterol Latinoam [Internet]. 2012 [citado 21 Dic 2015];23(2):84-8. Disponible en: http://gastrolat.org/desarrollo-de-resistencia-secundaria-a-imatinib-y-tratamiento-quirurgico-de-un-gist-gastrico-maligno/
9- Acín D, Pereira F, Castaño A, Durán M, Antequera A, Miliani C. Tumores estromales gastrointestinales: diagnóstico y tratamiento. Cir Cir [Internet]. 2012 [citado 21 Dic 2015]; 80(1):44-51. Disponible en: http://www.medigraphic.com/pdfs/circir/cc-2012/cc121h.pdf
10- Beltrán MA, Vicencio OA, Barra MM, et al. Resultados del Tratamiento Quirúrgico de los tumores del estroma gastrointestinal (GIST) en la IV Región de Chile. Rev Chil Cir [Internet]. 2011 [citado 2015 Dic 21];63(3):290-96. Disponible en: http://www.scielo.cl/scielo.php?script=sci_arttext&pid=S0718-40262011000300009&nrm=iso
11- Mendívil R, Cabanillas JL, Lozano N, et al. Tumor estromal gastrointestinal. An fac med [Internet]. 2010 [citado 12 Dic 2015];71(2):127-31. Disponible en: http://www.scielo.org.pe/scielo.php?script=sci_arttext&pid=S1025-55832010000200010&nrm=iso
12- Lowy D. Tumores de estroma gastrointestinal: Tratamiento para profesionales de salud [Internet]. Estados Unidos: Instituto Nacional del cáncer; 2015 [actualizado 29 Ene 2015; citado 8 Dic 2015]. Disponible en: http://www.cancer.gov/espanol/tipos/sarcoma-de-tejido-blando/pro/tratamiento-tegi-pdq
13- Kim M, Kang S, Kim S, et al. Prediction of risk of malignancy of gastrointestinal stromal tumors by endoscopic ultrasonography. Gut Liver. 2013;7(6):642-7. Citado en PubMed; PMID: 24312703.
14- Cañadas R, Galiano M. Enfoque epidemiológico, clínico y endoscópico.GIST 2013. En: Oliveros R, editor. Temas Escogidos en gastroenterología: Asociación Colombiana de gastroenterología; 2013 p. 19-34.
15- Laurini J, Carter J. Gastrointestinal stromal tumors: a review of the literature. Arch Pathol Lab Med [Internet]. 2010 [citado 12 Dic 2015];134(1):134-41. Disponible en: www.ncbi.nlm.nih.gov/pubmed/20073618
16- Fletcher CD, Berman JJ, Corless C, et al Diagnosis of gastrointestinal stromal tumors: a consensus approach. Hum Pathol [Internet]. 2002 [citado 12 Dic 2015];33(5):459-65. Citado en PubMed; PMID: 12094370.
17- Barreda B, Liu B, Sánchez L, Landeo A, et al. Survival factors in 152 patients with gastrointestinal stromal tumors. Rev Gastroenterol Peru [Internet]. 2010 [citado 12 Dic 2015]; 30(4):305-23. Citado en Pubmed; PMID: 21263758.
18- Yan H, Marchettini P, Acherman Y, et al. Prognostic assessment of gastrointestinal stromal tumor. Am J Clin Oncol. 2003;26(3):221-8. Citado en PubMed; PMID: 12796588.
19- Ortega L. Tumor del estroma gastrointestinal. Puesta al día. Rev Esp Patol [Internet]. 2015 Sept 23 [citado 11 Dic 2015];48(1):35-40. Disponible en: http://www.sciencedirect.com/science/article/pii/S1699885514001081
20- Miettinen M, Lasota J. Gastrointestinal stromal tumors: review on morphology, molecular pathology, prognosis, and differential diagnosis. Arch Pathol Lab Med. 2006; 130(10):1466-78. Citado en PubMed; PMID: 17090188.
21- Correa JC, Morales CH, Sanabria Á. Tratamiento quirúrgico de tumores del estroma gástrico:¿ es mejor el abordaje laparoscópico? Rev colombia cir [Internet]. 2014 Jun 17 [citado 20 Dic 2015];29(2):131-9. Disponible en: http://www.scielo.org.co/pdf/rcci/v29n2/v29n2a8.pdf
22- Roggin KK, Posner MC. Modern treatment of gastric gastrointestinal stromal tumors. World j gastroenterology [Internet]. 2012 Dic 14;18(46):6720. Citado en PubMed; PMCID: PMC3520160.
23- Beltrán SMA, Yamile Haito C, Ramón Díaz J, et al. Resección mixta laparoscópica y endoscópica de un tumor del estroma gastrointestinal de la unión gastroesofágica. Rev chil cir [Internet]. 2014 Abr 19 [citado 2015 Dic 10];66(6):586-91. Disponible en: http://www.scielo.cl/scielo.php?pid=S0718-40262014000600013&script=sci_arttext&tlng=pt
24- Pérez Tauriaux O, González Bernardo R. Tumor del estroma gastrointestinal de localización gástrica. Medisan [Internet]. 2015 Oct 6 [citado 10 Dic 2015];19(2):256-60. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1029-30192015000200015
25- Sasaki A, Koeda K, Obuchi T, et al. Tailored laparoscopic resection for suspected gastric gastrointestinal stromal tumors. Surg [Internet]. 2010 Oct 2;[citado 21 Dic 2015]; 147(4):516-20. Disponible en: http://www.sciencedirect.com/science/article/pii/S003960600900645X
26- Sahm M, Pross M, Lippert H. Intraluminal resection of gastric tumors using intragastric trocar technique. Surg laparosc endosc percutan tech [Internet]. 2011 Ago 15;[citado 21 Dic 2015];21(4):169-72. Disponible en: http://journals.lww.com/surgical-laparoscopy/Abstract/2011/08000/Intraluminal_Resection_of_Gastric_Tumors_Using.26.aspx
27- De Vogelaere K, Van De Winkel N, Simoens C, et al. Intragastric SILS for GIST, a new challenge in oncologic Surgery: First experiences. Anticancer research [Internet]. 2013 Ago 6;[citado 21 Dic 2015];33(8):3359-63. Disponible en: http://ar.iiarjournals.org/content/33/8/3359.short
28- Na JU, Lee SI, Noh SM. The single incision laparoscopic intragastric wedge resection of gastric submucosal tumor. J gastric cancer [Internet]. 2011 Dic 29;[citado 2015 Dic 21]; 11(4):225-9. Disponible en: http://synapse.koreamed.org/DOIx.php?id=10.5230/jgc.2011.11.4.225
29- Lever-Rosas CD, Silva-Ortiz J, Camacho-Alcalá L, Rebollo-Hurtado V, Limón-Alferez B, Martínez-López H, et al. Resección laparoscópica de un tumor del estroma gastrointestinal mayor de 10 cm cerca de la unión esofagogástrica. Reporte de un caso. Rev sanid mil [Internet]. 2012 Nov 10 [citado 10 Dic 2015];68(3):200-4. Disponible en: http://search.ebscohost.com/login.aspx?direct=true&db=lth&AN=97417417&lang=es&site=ehost-liveSpanish
30- Privette A, McCahill L, Borrazzo E, Single RM, Zubarik R. Laparoscopic approaches to resection of suspected gastric gastrointestinal stromal tumors based on tumor location. Surgical Endoscopy [Internet]. 2008 Abr 13;[citado 21 Dic 2015];22(2):487-94. Disponible en: http://link.springer.com/article/10.1007/s00464-007-9493-4
Recibido: 22 de diciembre de 2015.
Aceptado: 16 de febrero de 2016.
Yunier Acosta Hernández. Hospital General Docente “Dr. Mario Muñoz Monroy”. Martí esquina López Coloma. Matanzas, Cuba. Correo electrónico: michel10@fcmc.sld.cu