Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Tecnología Química
versión On-line ISSN 2224-6185
RTQ vol.35 no.3 Santiago de Cuba set.-dic. 2015
ARTICULO ORIGINAL
Construcción y Validación Experimental de un Biorreactor Artesanal Tipo Tanque Agitado para Fermentaciones Sumergidas a Escala de Laboratorio
Construction and Experimental Validation of a Homemade Stirred Tank Bioreactor for Lab-scale Submerged Fermentations
Dr.C. Manuel Serrat Díaz, Lic. Abelardo Allán Méndez Hernández
Centro de Estudios de Biotecnología Industrial. Facultad de Ciencias Naturales. Universidad de Oriente. Santiago de Cuba. Cuba. mserrat@cebi.uo.edu.cu
RESUMEN
Los biorreactores a pequeña escala son ampliamente utilizados para la experimentación en los laboratorios microbiológicos. Su precio actual es del orden de los € 20 000, lo que dificulta su adquisición. En este trabajo se presenta la construcción de un sistema de tanque agitado artesanal, elaborado con instrumentación y recursos disponibles en cualquier laboratorio, teniendo como premisa el cumplimiento de los requisitos indispensables para el establecimiento de procesos fermentativos microbianos a pequeña escala. El biorreactor construido garantizó la esterilidad del sistema durante 24 horas de funcionamiento continuo y bajo condiciones reales de manipulación, incluidas tres tomas de muestra. Se determinó el coeficiente de transferencia de oxígeno (kla) mediante el método del sulfito bajo diferentes condiciones de aireación-agitación, obteniéndose valores de 0.058 s-1 y 0.033 s-1 bajo flujo de aire 0.67 L·h-1 y agitación de 850 min-1y 650 min-1, respectivamente, los que resultan suficientes para un crecimiento microbiano óptimo en la mayoría de las situaciones. El biorreactor mostró una satisfactoria capacidad de mezclado, dada esta por su capacidad de mantener constante en el tiempo la concentración de un sólido insoluble finamente dividido y de alta densidad (BaSO4) en suspensión. Los resultados obtenidos avalan la aptitud del biorreactor artesanal para su uso en el estudio de fermentaciones microbianas a escala de laboratorio.
Palabras clave: biorreactor, tanque agitado, fermentación, transferencia de oxígeno, mezclado.
ABSTRACT
Small-scale bioreactors are widely used for experimentation in microbiological laboratories. Currently, the price of these systems is in the order of € 20 000, which obstructs its acquisition. A homemade stirred tank system, with easily available and inexpensive resources, was designed and assembled so that meets the essential requirements for the establishment of microbial fermentation processes on a small-scale. In this regard, the sterility of the system was checked by applying sterility controls during 24 hours of continuous operation under real conditions of handling, including three samplings. The oxygen transfer coefficient (kla) was determined by the sulfite method, under different aeration-agitation conditions, yielding values of 0.058 s-1 and 0.033 s-1 under 0.67 L·min-1 of air flow rate and stirring rates of 850 min-1 and 650 min-1, respectively, which result usually sufficient for optimal microbial growth. The bioreactor exhibited a satisfactory mixing performance, which is expressed by its ability to maintain the temporal stability of the concentration of an insoluble, high density and finely divided solid (BaSO4). These results show the practical potentialities of this homemade bioreactor to the study of microbial fermentation at lab-scale level.
Keywords: biorreactor, stirred tank, fermentation, oxygen transfer coefficient, mixing.
INTRODUCCION
Cuando se diseña una fermentación industrial se necesita de un gran número de experimentos para seleccionar una cepa, mejorar el medio de cultivo y, en general, optimizar el procedimiento de fermentación [1]. Durante los últimos 50 años, los científicos han utilizado los frascos erlenmeyers para el cultivo celular como centro del desarrollo de procesos a pequeña escala, con volúmenes que oscilan comúnmente entre los 10 mL y 500 mL. El uso de los mismos se estima en un 90 % de todos los experimentos de este tipo realizados en la industria biotecnológica y en estudios académicos [2].
Estos cultivos a menudo se encuentran limitados por un control impreciso de la temperatura, donde las variaciones alcanzan en ocasiones los 5 ºC o más de la temperatura inicial. Además, presentan otras limitaciones relacionadas con el intercambio gaseoso, implicado en procesos vitales como la transferencia y consumo de oxígeno u otros gases por microorganismos que así lo requieran. Por otra parte, son sensibles a pérdidas por evaporación en cultivos ‘calientes’, típicamente un 10 % en 24 h a 37 ºC, todo lo cual modifica la densidad del cultivo y limita operaciones de larga duración [3].
Los biorreactores de tanque agitado para la experimentación surgieron (hace más de medio siglo) con el propósito de lidiar con muchas de estas limitaciones y se han ido perfeccionando en busca del control más preciso de los ambientes de desarrollo de cultivos vivos, estableciéndose como un estándar en la industria biotecnológica. El empleo de sensores en el interior del vaso, conectados a dispositivos de control automático, permite mantener los valores de temperatura, pH, oxígeno disuelto y otros parámetros de interés, dentro de los límites estrechos necesarios para el éxito de las fermentaciones. Por otro lado, el empleo de sistemas eficientes de aireación y agitación garantiza niveles óptimos en la transferencia de oxígeno y en el mezclado. Dentro de estos, los biorreactores de pequeña escala han resultado vitales en procesos de escalado y desescalado, optimización de cepas, caracterización y desarrollo de procesos [3, 4].
Existe una interesante diversidad de biorreactores comerciales con elevados estándares de calidad; sin embargo, el elevado precio de venta que persiste aún en los diseños más económicos representa una inobjetable limitante. Importantes firmas comercializadoras, como Infors HT® (Suiza), ofertan estos equipos en precios que rondan los € 20 000 y € 75 000 en biorreactores de tanque agitado de pequeña escala (Minifors®) y escala piloto (Techfors-S®), respectivamente. Estos precios dificultan de forma considerable su adquisición en países en vías de desarrollo y, especialmente, en instituciones científicas y académicas dentro de estos.
El objetivo de este trabajo estuvo dirigido al diseño y construcción de un biorreactor artesanal tipo tanque agitado, utilizando para ello materiales, equipamiento e instrumentación de laboratorio asequible y de bajo costo, así como a la validación experimental de su desempeño a partir del cumplimiento de los requisitos indispensables requeridos para el cultivo de microorganismos.
MATERIALES Y METODOS
La investigación se desarrolló en los laboratorios del Centro de Estudios de Biotecnología Industrial (CEBI), perteneciente a la Facultad de Ciencias Naturales de la Universidad de Oriente.
Diseño y Construcción del Biorreactor
Vaso del biorreactor. Para este fin se utilizó un balón de 2 L de capacidad, de fondo redondo (geometría esférica) y provisto de una sola boca, con las siguientes dimensiones específicas: diámetro interior = 16 cm; altura hasta cuello = 14 cm; altura de la columna líquida para 1 L de volumen = 7.5 cm.
La boca del balón está dispuesta sobre un cuello cilíndrico corto de 7×7 cm (diámetro×altura). La boca se cerró con un tapón de goma multihoradado, al cual se insertaron la flecha del agitador (con su cojinete y junta de goma), el termómetro, el condensador (salida de gases) y los tubos (puertos) para los restantes sistemas de transporte de gases y líquido hacia dentro y fuera del biorreactor.
Sistema de suministro de aire. Se constituyó por una bomba de vacío (Sartorius, Alemania) operando en reversa, con capacidad máxima de bombeo de 0.67 L·min-1, acoplada a un rotámetro de gas (VEB MLW PRÜFGERATE-WERK, Alemania), el que se conectó mediante una manguera de silicona a un filtro microbiológico (Midisart® 2000, Alemania) de membrana hidrofóbica (0.2 µm de tamaño de poro y 20 cm2 de área de filtrado), para garantizar la esterilidad del aire. El filtro se unió mediante una manguera a la tubería de vidrio que se introduce al biorreactor por la parte superior y que termina en un dispersor de vidrio horadado, de extremo en forma de espiral (dorificios ≈ 3 mm), ubicado justo por debajo del impelente.
Agitación. La agitación del sistema se estableció por medio de un agitador mecánico portable (IKA® EUROSTAR Power control-vis, Alemania), de 150 W de potencia y rango de agitación de 50-2000 min-1, al cual se acopló un impelente de acero inoxidable tipo turbina abierta de cuatro paletas planas verticales [5] de 2×0.6 cm (largo×ancho), ubicado a una distancia del fondo del vaso y del dispersor de 3.5 cm y 2.5 cm, respectivamente. Un cojinete fijó el eje del agitador al tapón de goma del vaso para propiciar su libre movimiento y evitar vibraciones; este se lubricó con grasa sólida de alto vacío. Para garantizar la hermeticidad del biorreactor durante su operación, se situó una junta de goma tipo O-ring por debajo del rodamiento. El impelente se posicionó excéntricamente para prevenir el flujo circulatorio y evitar la formación de vórtices.
Sistema de salida de gases. Se conformó por un condensador de reflujo de 30×3 cm (largo×diámetro) acoplado directamente al vaso del biorreactor. Este se conectó a una trampa química, para evitar la entrada de contaminantes desde el exterior y contribuir a regular la presión interna. Dicha trampa estuvo integrada por un balón de dos bocas donde se depositaron 150 mL de una solución microbicida (ácido benzoico saturado, pH 4.0). La boca superior del balón se conectó al condensador y la lateral a un dispositivo soxhlet (24.5 cm de largo) para garantizar el reflujo de la solución microbicida y evitar así su pérdida en el aerosol.
Sistema para la toma de muestra. Se dispuso de un embudo separador de vidrio provisto con llave de rosca de teflón. La tapa del embudo se reemplazó por un tapón de goma con dos orificios, por los cuales se introducen sendos tubos de vidrio. Uno de ellos penetra al interior del embudo hasta la altura donde comienza su cuerpo y por su parte externa se acopló mediante una manguera de silicona al tubo que, penetrando a través del tapón del vaso del biorreactor, llega hasta el fondo del mismo, pero sin tocar con él, sirviendo de conducto para el trasvase de la muestra hacia el embudo separador. El segundo tubo solo penetra en el embudo 1 cm por debajo del tapón y por su extremo externo se une con una manguera a un filtro bacteriológico; su función es mantener el sistema abierto a la atmósfera y evitar sobrepresiones en el interior del embudo. La colecta de la muestra se realiza taponando el extremo distal de la salida de gases, provocando un incremento de la presión en el interior del vaso que empuja al líquido contenido en el biorreactor hacia el embudo separador. Se dispuso también de un sistema alternativo para la extracción manual de la muestra, mediante el acoplamiento de una jeringuilla al filtro bacteriológico ubicado en la parte superior del embudo separador. Este último sistema resulta idóneo cuando se trabaja con cultivos no aireados.
Control de temperatura. El vaso del biorreactor se sumergió en un baño de agua isotérmico constituido por una desecadora cargada con agua destilada. La constancia de la temperatura se estableció por medio del dispositivo de calentamiento y recirculación de agua de un baño termostático (VEB MLW PRÜFGERATE-WERK, Alemania; precisión ± 0.1 ºC) y se midió mediante termómetros de mercurio convencionales sumergidos en el cultivo y el baño de agua, respectivamente.
Sistema para la entrada de inóculo. Como reservorio del inóculo se dispuso de un kitasato, a cuya salida lateral se conectó un filtro microbiológico (0.2 µm), en tanto en la boca se colocó un tapón de goma al cual se insertó un tubo de vidrio que llega hasta muy cerca del fondo del frasco. En el momento de la inoculación, la parte superior del tubo se acopló, asépticamente, a una manguera estéril conectada al biorreactor. Insuflando aire al kitasato través del filtro, el inóculo es empujado hacia el interior del biorreactor.
Materiales utilizados en la construcción del biorreactor. Se utilizaron instrumentos y accesorios construidos a base de vidrio borosilicato (balones, condensador, soxhlet, embudo separador y tuberías), tapones de caucho vulcanizado para uso químico y mangueras de silicona. El sistema de agitación se construyó de acero inoxidable.
Determinación del Coeficiente Volumétrico Global de Transferencia de Oxígeno (kla).
Se realizó por el método del sulfito [6]. Para ello, el reactor se llenó con 1 L (50 % del volumen total y 80 % del volumen de trabajo máximo) de una solución de sulfito de sodio a 0.25 mol·L-1, conteniendo CuSO4·5H2O a 1 g·L-1 como catalizador, recién preparada en agua destilada desgasificada. El ensayo se realizó a temperatura constante (36 ºC), empleando diferentes condiciones de agitación (0-850 min-1) y aireación sostenida de 0.67 vvm. La concentración residual de sulfito se determinó por el método yodimétrico según los procedimientos recomendados [7].
Determinación de la Capacidad de Mezclado del Sistema
La eficiencia de mezclado dentro del biorreactor se determinó mediante el análisis del comportamiento temporal de la concentración de un sólido insoluble finamente particulado y con un alto coeficiente de sedimentación (precipitado de BaSO4) en un punto fijo del biorreactor (punto de toma de muestra), bajo diferentes combinaciones de aireación/agitación. El precipitado de BaSO4 se obtuvo in situ al mezclarse volúmenes iguales (500 mL) de soluciones de BaCl2 y Na2SO4, ambas a 0,29 mol·L-1. Una vez formado el precipitado, se puso en marcha el sistema a una temperatura fija de 36 ºC, bajo diferentes condiciones de agitación (0 min-1, 350 min-1, 650 min-1 y 850 min-1), con aireación (0.67 L·min-1) y sin ella. Se tomaron muestras del interior del biorreactor a intervalos regulares de 5 min durante 30 min, luego de una colecta inicial (t0), realizada a los 5 min de ponerse en funcionamiento el biorreactor. La concentración de sólidos en las muestras colectadas se determinó gravimétricamente, luego de secar el sedimento a 105ºC durante 12 h.
Prueba de Esterilidad del Sistema
El biorreactor se cargó con 1 L de caldo nutriente (UNI-CHEM), se acoplaron los demás accesorios y se esterilizó en autoclave (121 ºC, 15 min). Una vez alcanzada la temperatura ambiente, el sistema se puso en funcionamiento a temperatura sostenida de 37 ºC, flujo de aire de 0.67 L·min-1 y agitación de 650 min-1. Se establecieron tres puntos temporales de control de esterilidad (0, 12 y 24 horas), en los cuales se extrajeron aproximadamente 30 mL del medio contenido en el interior del vaso por el sistema de toma de muestra. La primera toma (tiempo cero), se efectuó a los cinco minutos de funcionamiento del sistema con el objetivo de descartar contaminaciones al inicio del proceso o durante la esterilización.
Para la detección de posibles contaminantes, las muestras colectadas se sembraron (100 µL) en placas Petri conteniendo agar nutriente (UNI-CHEM).
En paralelo a la siembra directa en placas, se adicionó asépticamente 1 mL de la muestra colectada a un frasco erlenmeyer conteniendo 24 mL de caldo nutriente estéril. Este se incubó en zaranda orbital durante 24 h a 150 min-1 y temperatura ambiente. A continuación se sembraron alícuotas de 100 µL en placas Petri con agar nutriente. Todas las siembras se realizaron por triplicado y las placas se incubaron a temperatura ambiente durante 24 h.
Se establecieron controles de esterilidad complementarios para descartar posibles contaminaciones durante el trabajo en el flujo laminar y en la manipulación general.
RESULTADOS Y DISCUSION
Diseño y Construcción del Biorreactor
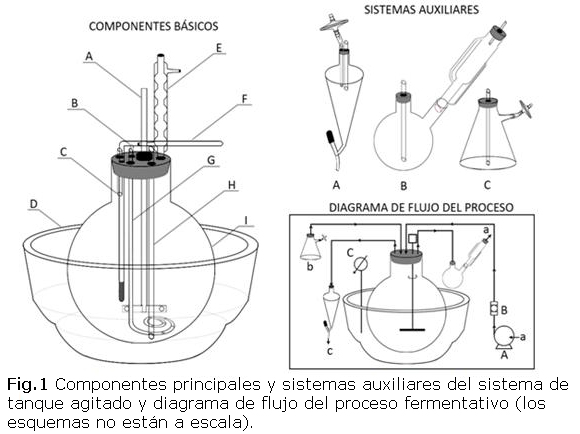
La estructura del sistema de tanque agitado construido con sus componentes básicos y dispositivos auxiliares, así como el diagrama de flujo del proceso, se exponen en las figuras 1 y 2. En el diseño de este biorreactor artesanal se enfatizó en tres cuestiones esenciales de su funcionamiento: capacidad de garantizar la esterilidad en su interior durante un intervalo de tiempo relativamente largo y la realización de muestreos periódicos, buena transferencia de oxígeno y mezclado uniforme de la suspensión celular. Los dos últimos aspectos se relacionan muy estrechamente con los procesos de agitación y aireación y serán discutidos a continuación.
En la figura 1 se pueden observar los componentes básicos, los sistemas auxiliares y el diagrama de flujo del proceso:
COMPONENTES BÁSICOS: A: Agitador, B: Tubo de entrada de antiespumante, C: Tubo de entrada de inóculo, D: Desecadora, E: Condensador, F: Termómetro, G: Dispersor de gas, H: Tubo de colecta, I: Vaso.
SISTEMAS AUXILIARES: A: Sistema de toma de muestra, B: Trampa química, C: Frasco de inoculación.
DIAGRAMA DE FLUJO DEL PROCESO: A: Bomba de aire, B: Filtro microbiológico, C: Termostato, a: Aire, b: Inóculo, c: Muestra de cultivo.
Aireación. Cuando se dispone de pocas posibilidades de manejar los niveles de flujo y presión de aire suministrados al biorreactor, como es el caso que nos ocupa, resulta indispensable que el dispersor de aire suministre un gran número de burbujas de pequeño tamaño. En este caso se optó por un diseño en espiral del dispersor, portando tres líneas equidistantes de orificios de »3 mm de diámetro, en posicionamiento alterno. El tamaño de las burbujas y su dispersión a través del volumen de líquido, afectan los procesos de transferencia de masa; así, mientras más pequeñas sean las burbujas, mayor área superficial por unidad de volumen se obtendrá. Además, las burbujas pequeñas presentan menor velocidad de ascenso y, en consecuencia, permanecen más tiempo en contacto con el líquido, todo lo cual deriva en una mejor transferencia de oxígeno al medio. Este parámetro crítico en el desempeño de un biorreactor [8].
Agitación. Un mezclado apropiado es importante para evitar los gradientes de temperatura y concentración, además de mejorar la eficiencia de la transferencia de masa y calor [9]. Los agitadores de palas y las turbinas de placas planas, como fue el caso empleado en el biorreactor construido, producen buenos flujos radiales en el plano del rodete; las corrientes generadas se desplazan hacia fuera, hasta la pared del tanque, formando modelos distintos de circulación: una parte fluye hacia abajo a lo largo de la pared y retorna hacia el centro del rodete desde el fondo, mientras que otra asciende hacia la superficie y retorna al rodete desde la parte superior, todo lo cual beneficia la dispersión del gas que se introduce al medio, propiciando la ruptura fina y uniforme de las burbujas [5]. En general, los impelentes tipo turbina de palas resultan los más usados, dada su capacidad de operar a velocidades de agitación altas y un amplio rango de viscosidades. En líquidos de baja viscosidad las turbinas generan fuertes corrientes que persisten en todo el tanque, destruyendo bolsas de fluido estancado [10].
En los tanques de gran tamaño, con agitadores verticales, el método más conveniente de reducir los remolinos es instalar placas deflectoras, que impiden el flujo rotacional sin afectar al flujo radial y longitudinal. La agitación excéntrica fue la opción utilizada en nuestro caso, al ser especialmente recomendable en biorreactores de pequeña escala, puesto que se evita el uso de deflectores [10, 11].
Transferencia de oxígeno en el biorreactor
La transferencia de oxígeno es el parámetro más importante implicado en el diseño, operación y escalado de biorreactores. Una concentración de oxígeno superior a la crítica es necesaria para conseguir un crecimiento microbiano y formación de productos óptimos. En consecuencia, el conocimiento del valor del coeficiente volumétrico de transferencia de masa (kla) bajo determinadas condiciones de operación, resulta indispensable.
En todas las variantes analizadas se apreció que los valores del kla aumentan a medida que se incrementan los niveles de agitación (fig.3), alcanzándose a 850 min-1 niveles de transferencia de oxígeno de 0.058 s-1, los cuales resultan superiores en un 42 % a los obtenidos a velocidades de 650 min-1 y 0 min-1(kla= 0.034 s-1). Cuando la agitación fue de 350 min-1 se obtuvo un kla inferior al obtenido en el sistema sin agitación, lo que resulta aparentemente contradictorio. Esto pudiera estar relacionado, de un lado, con una reducción significativa de los niveles de turbulencia a estas velocidades de agitación (téngase en cuenta que la relación diámetro del impelente/diámetro del vaso está lejos de ser la óptima), limitando la posibilidad de que se produzca una disminución significativa en el tamaño de las burbujas como consecuencia de su ruptura por las fuerzas de corte; por otro lado, la agitación favorece la velocidad de ascensión de las burbujas como consecuencia de los flujos axiales ascendentes que se originan, lo que podría resultar en un tiempo medio de retención inferior al del sistema no agitado.
Ver a continuación la figura 3.
El aumento del kla a medida que se aumenta la velocidad de agitación es un hecho comprobado en numerosos estudios. Kim y col. [12], utilizando el método del sulfito e impelentes tipo turbina Rushton de seis hojas, registraron un aumento en los valores del kla a medida que se aumentó la velocidad de agitación. Así, a velocidades de 800 min-1, 650 min-1, 500 min-1 y 300 min-1 obtuvieron valores de 0.086 s-1, 0.083 s-1, 0.072 s-1 y 0.04 s-1, respectivamente, en biorreactores de 20 L y flujo de aire de 1 vvm, atribuyendo estas diferencias al hecho de que una mayor velocidad de agitación ofrece un mayor nivel de mezclado turbulento. Por otra parte, Karimi y col. [13] resolvieron que el mezclado más eficiente se obtiene a velocidades de agitación de más de 400 min-1 y menores que 800 min-1. Para agitaciones menores de 400 min-1 la turbulencia no es suficiente para atrapar y mantener las burbujas de aire en la fase líquida por mucho tiempo y, consecuentemente, el valor del kla no se incrementa notablemente. Además, estos autores determinaron que el flujo de aire, entre 1-5 L·min-1, correlaciona positivamente con la transferencia de oxígeno, pero su influencia no resulta determinante.
Todos estos estudios son congruentes con los resultados obtenidos con el biorreactor artesanal. Por otro lado, el óptimo del kla en el biorreactor construido es un 30-60 % de los valores informados para fermentadores comerciales tipo tanque agitado de 100 L de volumen efectivo y similares a los alcanzados en reactores de 1.2 m3, determinados por el mismo método [14]. Tales resultados apuntan a una influencia negativa derivada de las limitaciones geométricas del sistema construido (configuración esférica del vaso, baja relación diámetro del impelente/diámetro del vaso), que implican una menor potencia de agitación y a que la altura de la columna líquida sea inferior al diámetro del vaso, lo que conduce finalmente a un menor tiempo de retención de las burbujas de gas en el seno del líquido y, con ello, a una reducción en la transferencia de masa en la interfase gas-líquido.
No obstante, el valor del kla obtenido en el biorreactor artesanal, a una velocidad de agitación de 850 min-1, resulta suficiente para garantizar un 20 % de saturación de oxígeno en el medio, concentración esta usualmente requerida en muchos cultivos microbianos exigentes, como son los de bacterias, levaduras y actinomicetos. Según Chisti [15], se precisa de valores del orden de 0.01 s-1 para el crecimiento óptimo de hongos y de 0.1 s-1 para bacterias y levaduras. Para fermentaciones de la levadura Kluyveromyces marxianus, considerado el organismo eucariota que más rápido crece [16], se han informado concentraciones de oxígeno óptimas del orden del 20 % de saturación [17, 18].
Capacidad de Mezclado del Biorreactor
Dentro de las funciones básicas de los biorreactores está la de garantizar un mezclado eficiente. La técnica empleada en este estudio permitió comprobar la adecuación de los dispositivos destinados a tal fin en el diseño del sistema, mediante el registro del comportamiento temporal de la concentración de una suspensión de un sólido finamente dividido y de alta densidad (precipitado de BaSO4) en el punto de colecta de muestras del vaso del biorreactor.
El BaSO4 presenta una serie de características que lo hacen adecuado para este propósito. Su bien conocida rápida cinética de formación, estabilidad morfológica y de tamaño de sus partículas (9.53×5.79 µm) [19-21], unido a su inocuidad, bajísima solubilidad en agua (3.1 mg·L-1) y alta densidad (4.5 g·cm3) [19], que lo hacen particularmente sensible a la sedimentación, condicionaron su elección para este ensayo.
El experimento estuvo dirigido a determinar la eficiencia del biorreactor en el proceso de mezclado, mediante la determinación de su capacidad de mantener en suspensión uniforme partículas de elevada densidad, bajo diferentes niveles de agitación y aireación. Este modelo simula el comportamiento de un cultivo microbiano donde deben permanecer en suspensión micropartículas (células microbianas, agregados de ellas o fragmentos de micelio) más densas que el medio líquido.
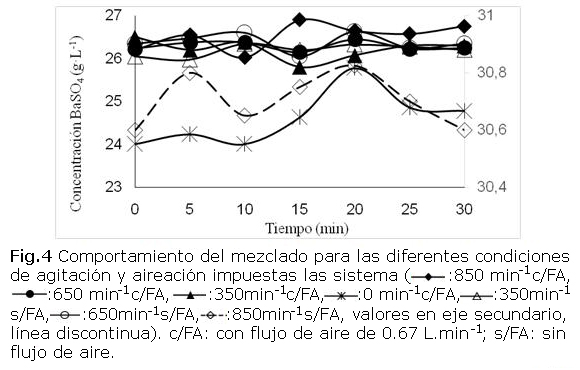
En todas las variantes evaluadas se registraron comportamientos sinusoidales, con límites estrechos de dispersión, en la concentración de sólidos suspendidos con respecto al tiempo (fig. 4), lo que sugiere una marcada ausencia de tendencias temporales de variación de la concentración. El análisis de regresión lineal simple de la “concentración de BaSO4 vs. tiempo” (tabla) corroboró esta apreciación, al no observarse tendencias temporales de variación en la concentración del sólido en suspensión (p > 0,05 para la estimación de la pendiente). En cambio, los interceptos resultaron altamente significativos estadísticamente, coincidiendo, dentro del margen del error estadístico, con el valor medio (Y media) de las observaciones temporales realizadas. Solo en la variante sin agitación (valor p para la pendiente igual a 0,106 y R=0,66) pudiera suponerse la existencia de una cierta tendencia a la sedimentación, aunque estadísticamente no significativa para un 95 % de confianza.
La variante sin agitación, pero con flujo de aire constante, aunque presenta la menor capacidad de mezclado, podría garantizar eficazmente procesos fermentativos con microorganismos o tejidos celulares particularmente sensibles a situaciones de estrés hidrodinámico, donde se precise de la ausencia de agitación mecánica. Se debe tener presente que las partículas de sulfato de bario son unas ocho veces más densas que cualquier célula microbiana y que flujos de aire de esta magnitud presentan, por sí solos, una capacidad adecuada de mezclado dada la cinética de ascenso y transferencia de energía propia de las burbujas al medio [22]. Los resultados obtenidos en esta experiencia avalan la eficiencia del mezclado en el biorreactor y sus potencialidades para el cultivo intensivo de microorganismos.
Prueba de Esterilidad
El control de esterilidad se llevó a cabo a partir de la exposición continua (durante 24 h) del sistema a condiciones de fermentación microbiana reales y luego de la esterilización previa en autoclave del biorreactor y sus sistemas auxiliares. No se observó la presencia de contaminantes en ninguna de las placas Petri inoculadas directamente, para las 0, 12 y 24 h de funcionamiento continuo. Estos resultados corresponden a un índice probable de contaminantes inferior a 3 cél·mL-1, no determinable para el caso de la siembra directa, según las tablas estadísticas del Número Más Probable [23].
Para corroborar la esterilidad de las muestras tomadas, estas se propagaron en caldo nutriente durante 24 horas (5 % de muestra como inóculo) y se sembraron nuevamente en placas con agar nutriente, repitiéndose la observación de ausencia de colonias microbianas indicadoras de contaminación. Suponiendo un tiempo de duplicación de 2 h, para un nivel de contaminación del orden probable de 0.1-3 cél·mL-1 era de esperar positividad en estos ensayos (de 40-120 ufc por placa). La negatividad observada demuestra la esterilidad del biorreactor para 24 horas de funcionamiento continuo, con tres operaciones de toma de muestra.
Estos resultados garantizan la fiabilidad del biorreactor para su uso en fermentaciones con cultivos puros, sin riesgo potencial de contaminación, siempre y cuando se garanticen aspectos claves como el correcto autoclavado de todos los componentes del sistema y los cuidados generales en la manipulación de inóculos y tomas de muestra. Por otra parte, la hermeticidad del sistema, dependiente de su correcto ensamblaje, permite el mantenimiento de una presión positiva en el interior del vaso, requisito indispensable para evitar la entrada de contaminantes.
CONCLUSIONES
El biorreactor de tanque agitado se diseñó partiendo de la premisa de que el mismo reuniera los requisitos indispensables para el éxito de una fermentación microbiana, esto es: adecuada capacidad de transferencia de oxígeno, mezclado eficiente, control efectivo de la temperatura y mantenimiento de la esterilidad. Se construyó usando materiales e instrumentación comunes a cualquier laboratorio, integrados en los sistemas de entrada y salida de gases, agitación, toma de muestra, control de temperatura y entrada aséptica de inóculo, acoplados a un vaso esférico de 2 L de capacidad. Los estudios de validación experimental realizados mostraron la aptitud del biorreactor para el desarrollo de investigaciones en el campo de las fermentaciones y fisiología microbianas, dada la eficiencia observada en los procesos de mezclado y transferencia de oxígeno, así como en el mantenimiento de la esterilidad y la temperatura durante el tiempo de duración de la fermentación.
BIBLIOGRAFIA
1. SELETZKY, J., NOAK, U., FRICKE, J., WELK, E., EBERHARD, W., KNOCKE, C., BÜCHS, J. “Scale-up from shake flasks to fermenters in batch and continuous mode with Corynebacterium glutamicum on lactic acid based on oxygen transfer and pH. Biotechnology and Bioengineering. 2007, vol 98, Nº4, p. 800-811.
2. BÜCHS, J. “Introduction to advantages and problems of shaken cultures”. Biochemical Engineering Journa. 2001, vol 7, p. 91-98.
3. NAJAFPOUR, G. Biochemical Engineering and Biotechnology. Elsevier, Amsterdam. 2007.
4. MATTHEWS, G. Fermentation Equipment Selection: Laboratory Scale Bioreactor Design Considerations. Chapter 2. McNeil B y Harvey L Eds. New York. 2008.
5. MCCABE, W., SMITH, J., HARRIOTT, P. Operaciones Unitarias en Ingeniería Química. 4ta Ed. España. 1991. 690 p.
6. LINEK, V., VACEK, V. “Chemical engineering use of catalyzed sulfite oxidation kinetics for the determination of mass transfer characteristics of gas-liquid contactors”. Chemical Engineering Science. 1981, vol 36, p. 1747-1768.
7. ALEXÉIEV, V. Análisis Cuantitativo. Editorial Mir, Moscú. 1976.
8. GENCK, W. Perry's Chemical Engineers' Handbook. 8th Ed. McGraw-Hill, New York. 2008.
9. ZLOKARNIK, M. Bestimmung des Mischgrades und der Mischzeit. Rührtechnik, Theorie und Praxis. Berlin. 2002.
10. ZLOKARNIK, M. Stirring Theory and Practice. New York. 2001.
11. WALAS, S. Chemical Process Equipment. Selection and Design. Amsterdam. 1990.
12. KIM, M., KRAGL, F., THOMPSON, R. “Oxygen mass transfer coefficient (kla) consideration for scale-up fermentation systems at the biotechnology laboratory US Army Edgewood Chemical Biological Center (No. ecbc-tr-846)”. 2011.
13. KARIMI, A., GOLBABAEI F, MEHRNIA M, NEGHAB M, MOHAMMAD K, NIKPE A Y POURMAND M. “Oxygen mass transfer in a stirred tank bioreactor using different impeller configurations for environmental purposes”. Iranian Journal of Environmental Health Sciences & Engineering. vol 10, Nº 6. 2013lang=EN-US style='font-size:10. 0pt;font-family:"Arial","sans-serif";color:purple'>.
14. HATCH R. Fermenter design. Tannenbaum S y Wang D Eds. Cambridge. 1975.
15. CHISTI Y. Mass Transfer. Fermentation, Biocatalysis, and Bioseparation. Volumes 1-5. Flickinger M y Drew S Eds. New York. 1999.
16. GROENEVELD, P., STOUTHAMER, A., WESTERHOFF, H. “Super life - how and why ‘cell selection’ leads to the fastest-growing eukaryote”. FEBS Journal. 2009, 276, 254-270.
17. SIGNORI, L., PASSOLUNGHI, S., RUOHONEN, L., PORRO, D., BRANDUARDI, P. “Effect of oxygenation and temperature on glucose-xylose fermentation in Kluyveromyces marxianus CBS 712 strain”. Microbial Cell Factories. 2014, vol 13, Nº 51.
18. PARRONDO, J., GARCÍA, A., DÍAZ, M. “Nutrient balance and metabolic analysis in a Kluyveromyces marxianus fermentation with lactose-added whey”. Brazilian Journal of Chemical Engineering. 2009, vol 26, Nº 3, p. 445-456.
19. STEYER, C. Precipitation of Barium Sulfate in a Semi-batch Stirred Tank Reactor: Influence of Feeding Policy on Particle Size and Morphology. Magdeburg Universität, Germany. 2012.
20. YANG, B., ZHANG, X., SHI, X., GUO, J., WANG, Q., GAO, G., JIN, H. “Study in kinetics of barium sulfate crystallization process of oil field injection”. Advanced Materials Research. 2014, vol 962, p. 757-761.
21. JUDAT, B., KIND, M. “Morphology and internal structure of barium sulphate-derivation of a new growth mechanism”. Journal of Colloid and Interface Science. 2004, vol 269, Nº 2, p. 341-353.
22. GARCIA-OCHOA, F., GOMEZ, E. “Bioreactor scale-up and oxygen transfer rate in microbial processes: an overview”. Biotechnology Advanced. 2009, vol 27, p. 153-176.
23. CLESCERI, S., GREENBERG, A., EATON, A. Standard Methods for the Examination of Water and Wastewater, 20th Ed. American Public Health Association, Washington D.C. 1998.
Recibido: Febrero de 2015
Aprobado: Junio de 2015
Dr.C. Manuel Serrat Díaz. Centro de Estudios de Biotecnología Industrial. Facultad de Ciencias Naturales. Universidad de Oriente. Santiago de Cuba. Cuba. mserrat@cebi.uo.edu.cu