Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Química
versión On-line ISSN 2224-5421
Rev Cub Quim vol.30 no.1 Santiago de Cuba ene.-abr. 2018
ARTICULOS
Estudio de estabilidad de tabletas de carbón y pepsina obtenidas con carbón activado cubano
Stability study of carbon and pepsine tablets obtained with cuban activated carbon
Dr. C. Carlos A. Rey-MafullI, Dr. C. Julio César Llópiz-YurellI, Dr. C. Dachamir HotzaII, MSc. Raquel García-GallardoIII
IInstituto de Ciencia y Tecnología de Materiales, Universidad de la Habana, La Habana, Cuba, mafull@imre.oc.uh.cu, jcllopiz@imre.oc.uh.cu
IIUniversidad Federal de Santa Catarina, Florianopolis-SC, Brasil, dhotza@gmail.com
IIILaboratorio Farmacéutico "Reinaldo Gutiérrez", La Habana, Cuba, r.garcia@rg.medsol.cu
RESUMEN
El presente trabajo tiene como objetivo realizar un estudio comparativo entre dos lotes preliminares de 5 440 tabletas de carbón-pepsina c/u, para zona climática IV, empleando carbón activado de producción nacional (CA/ML) y de un proveedor calificado: Norit E (Holanda). Los materiales fueron caracterizados con N2 a 77 K reportando áreas superficiales de 721 m2/g (CA/ML) y 869 m2/g (CA/NE) respectivamente. Una vez evaluados todos los parámetros físico-químicos y tecnológicos de las tabletas, las que fueron envasadas para estudio acelerado y vida de estante,se evalúa las propiedades físico-mecánicas, tecnológicas, químicas y microbiológicas. Un estudio T-test para la media entre ambos lotes demostró que no existe diferencias significativas (α=95 %) para ambos estudios: acelerado y vida de estante. Ambos lotes presentaron muy buena estabilidad en todos los parámetros establecidos. Los resultados indican que CA/ML puede ser considerado posible candidato que garantice un medicamento con buena calidad hasta los treinta meses.
Palabras clave: carbón y pepsina, carbón activado, estabilidad acelerada, vida de estante.
ABSTRACT
In this work is realized a comparative study among two preliminary lots of 5 440 pills of carbon-pepsina each, for climatic zone IV, using cuban activated carbon (CA/ML) and a qualified supplier Norit E, Holland (CA/NE). These materials were characterized with N2 reporting superficial areas of 721 m2/g and 869 m2/g respectively. Once evaluated all the physical-chemical and technological parameters of the pills are realized. The packed tablets were subjected to quick study (six months) and shelf life (30 months,) evaluating them the physical-mechanical, technological, chemical properties and microbiological content. A T-test study was realized for the stocking between both lots, demonstrated there was not significant differences (95 %) as much in quick study as in shelf life. Both lots presented very good stability in all the established parameters. All results reveal that CA/ML it can be considered a possible candidate that guarantees a medication with good quality until the 30 months.
Keywords: carbon and pepsin, activated carbon, quick study, shelf life.
INTRODUCCIÓN
La búsqueda de materias primas con calidad y la obtención de un producto farmacéutico terminado a partir de estas, es un reto para la industria química-farmacéutica en cualquier parte del mundo. Por tales razones, la industria médico-farmacéutica cubana dentro de su agenda de proyectos ha priorizado objetivos concretos como: sustitución de importaciones, desarrollo de nuevos productos y transformación de materias primas naturales y sintéticas producidas en el país, para ser empleados en formulaciones farmacéuticas y disminuir los costos de producción.
La producción de tabletas de carbón y pepsina en Cuba asciende a 43 millones u/año. La aplicación terapéutica de este medicamento es aliviar desarreglos gastrointestinales que son múltiples y generados por disímiles causas, entre las que podemos citar: dispepsia, flatulencias, acidez, diarrea, disentería y distensión abdominal. La acción principal ocurre durante la adsorción de gases en exceso que se producen en el estómago y los intestinos. El precio de una de sus materias primas principales, carbón activado (CA), en el mercado internacional oscila entre 6 500-8 000 USD/t. El carbón activado, Norit E Supra (CA/NE), es un material de importación que la industria farmacéutica cubana viene empleando desde hace más de diez años.
Para asegurar la eficacia y seguridad terapéutica de un producto farmacéutico se debe determinar su calidad, la que depende de la estabilidad del producto final. La estabilidad puede definirse como "la capacidad para permanecer dentro de las especificaciones establecidas para asegurar la identidad, fuerza, calidad y pureza de un producto farmacéutico". Los estudios de estabilidad proporcionan una garantía de la integridad de la formulación durante un periodo de tiempo (3-5 años), donde la formulación (excipientes y principio activo) debe permanecer estable. Estos estudios, se dividen en dos etapas fundamentales: estabilidad acelerada y vida de estante (estabilidad a tiempo real o control de estanterías) [1, 2].
Es por ello que el objetivo principal del presente trabajo es valorar la estabilidad de las tabletas de carbón-pepsina, producidas empleando carbón activado de producción nacional (CA/ML), con vista a la sustitución de importación. Para ello fueron abordados diferentes etapas evaluativas: a) caracterización por las normas USP 31 NF27 de los polvos iniciales de carbón activado como material de partida b) obtención de granulados y tabletas preliminares c) estudio acelerado (6 meses, 40±2 ºC y HR 75±5 %) y vida de estante (30 meses, 30±2 ºC y HR 70±5 %) a los dos lotes de tabletas obtenidos (5 440 c/u) en zona climática IV [3]. En todas las etapas siempre se comparan, en paralelo, ambos materiales (CA/ML y CA/NE). Los resultados obtenidos del estudio de estabilidad sustentan un período de validez para esta forma terminada de al menos treinta meses en condiciones de zona climática IV. Todos los resultados avalan la posibilidad de que CA/ML pueda ser considerado un material adecuado para la producción de tabletas de carbón y pepsina.
MATERIALES Y MÉTODOS
Carbones activados
Los CA empleados fueron obtenidos a escala industrial. El CA/NE es un material que la industria farmacéutica cubana viene utilizando hace más de diez años en hospitales y centros farmacéuticos en Cuba. Es un material que ya ha sido probado industrialmente como materia prima y producto terminado, así como su calidad terapéutica como comprimido de carbón y pepsina y antídoto [4]. El CA/ML es un material obtenido en la Planta Industrial de Carbón Activado, ubicada en el municipio de Baracoa, Provincia de Guantánamo y purificado por lixiviación ácido/base [5-7].
Caracterización del carbón activado por las normas USP
La caracterización del carbón activado, como material de partida fue realizada bajo las normas USP 31 NF27 [8] y normas cubanas [3].
Caracterización del carbón activado por adsorción de N2
Las isotermas de adsorción de N2 a 77 K fueron realizadas en un equipo Quantachrome Autosorb (sistema analizador de superficies). Para el análisis de los datos se empleó la ecuación BET para la determinación del área superficial (ASN2) utilizando el software del equipo y el Método de microporo (MP) para el cálculo de la distribución de poros y tamaño medio de poro.
Método de elaboración de tabletas
En la elaboración de las formulaciones ensayadas se empleó el método de vía húmeda y se procedió, según los pasos que se describen en el Expediente Maestro del producto: Especificaciones de calidad de producto terminado de carbón y pepsina, tabletas [9]. En la formulación de los comprimidos se emplearon los ingredientes presentados en la tabla 1 y las técnicas analíticas y el equipamiento enumerado en la tabla 2.
TABLA 1. MATERIAS PRIMAS FUNDAMENTALES UTILIZADAS EN LA FABRICACIÓN DE TABLETAS DE
CARBÓN-PEPSINA, CON FORMULACIÓN CUBANA

TABLA 2. TÉCNICAS ANALÍTICAS UTILIZADAS Y CARACTERÍSTICAS DEL EQUIPAMIENTO EMPLEADO
Estudio comparativo de estabilidad de los lotes de comprimidos de carbón y pepsina obtenidos con CA/ML y CA/NE
Se produjeron dos lotes (CA/ML y CA/NE) de 5 440 comprimidos cada uno con formulación cubana. El proceso de obtención de los comprimidos fue realizado como se describe en el registro de medicamento y registro maestro para carbón y pepsina [3, 9] y las normas de la Farmacopea Americana [8]. A continuación se explican los dos estudios de estabilidad empleados:
Estabilidad acelerada (6 meses)
Consiste en someter los frascos con comprimidos de carbón-pepsina a temperatura drástica de 40±2 °C y humedad 75±5 % durante un período de seis meses, en un horno (Vacioten, modelo: T-4001489) de origen español. Durante este ensayo, los comprimidos fueron extraídos y evaluados en diferentes períodos de tiempo: 0 (inicial), 2, 4, 6 meses, considerando los parámetros de control de calidad mostrados en la tabla 3. En esta prueba no se considera la estabilidad microbiológica del producto terminado.
Vida de estante (30 meses)
Este es un estudio más prolongado que el anterior descrito. Los valores de temperatura y humedad fueron: 30±2 °C y 70±5 % respectivamente, los que se mantuvieron constantes durante todo el período de prueba (30 meses). Con esta prueba se puede definir si estos comprimidos se mantendrán estables en el tiempo. Los parámetros tecnológicos y de control considerados en esta etapa del estudio, son mostrados en la tabla 3. Las características microbiológicas del producto, en este caso, desempeñan un papel muy importante debido a que el producto terminado debe permanecer siempre libre de patógenos durante el tiempo programado. Los análisis fueron realizados cada 3 meses.
TABLA 3. ESPECIFICACIONES ESTABLECIDAS PARA LAS PROPIEDADES FÍSICO-QUÍMICAS Y TECNOLÓGICAS DE LOS COMPRIMIDOS DE CARBÓN ACTIVADO PARA ESTUDIO DE ESTABILIDAD
RESULTADOS Y DISCUSIÓN
Caracterización textural del carbón activado
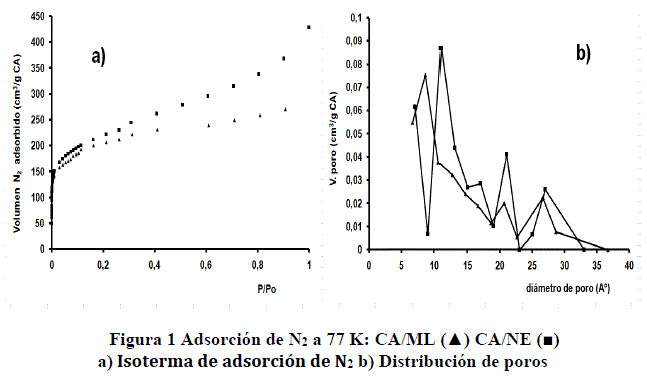
Las isotermas de adsorción de N2 a 77 K obtenidas por la ecuación BET, son mostradas en la figura 1a. Ambas ASN2 720 m2/g (CA/ML) y 869 m2/g (CA/NE) pueden ser consideradas del mismo orden. Se puede observar que los dos materiales muestran una distribución polimodal de poros, figura 1b. Este aspecto es relevante para materiales de este tipo, porque permite la adsorción de moléculas de diferentes tamaños y estructuras. La distribución de poros y tamaño medio de poros fueron calculados por el método MP (tabla 4). Las diferencias que puedan observarse en el área superficial y distribución de poros responden principalmente a la materia prima empleada y a la historia tecnológica durante la producción de ambos CA. Por ejemplo, CA/ML fue obtenido a partir de madera y CA/NE a partir de turba.
TABLA 4. CARACTERIZACIÓN DE LA SUPERFICIE DEL CA POR ADSORCIÓN DE N2 A 77 K USANDO LA ECUACIÓN BET Y MÉTODO MP*

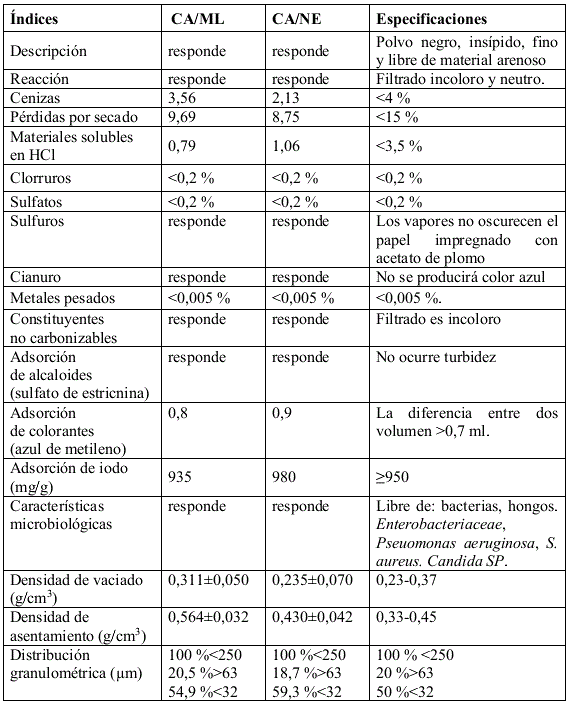
Aplicación de las normas USP para CA/ML y CA/NE en polvo
Uno aspecto muy importante y el primero a tener en cuenta fue el análisis microbiológico, ya que el lote de materia prima sería rechazado antes de realizarle cualquier análisis químico-físico o pasar el mismo a cualquier etapa de producción, evitando con ello la contaminación de los equipos de proceso.
El cumplimiento del análisis microbiológico confirma además, que el procedimiento de obtención de CA/ML es confiable en ese sentido, lo que se traduce en que cada etapa de del proceso fue realizada sin violar las buenas prácticas de producción [5-20]. De acuerdo con los resultados mostrados en la tabla 5, todos los parámetros son aceptables, aunque se pueden observar algunas diferencias menores que no afectan en lo mínimo la calidad de ambas materias prima.
Los resultados obtenidos (tabla 5) definen si el material analizado puede o no estar dentro de los estándares de calidad para ser utilizado como materia prima en la industria farmacéutica. Es de resaltar que este es solo el primer paso en el desarrollo del protocolo general para la producción de tabletas como se apreciará más adelante [13-18].
TABLA 5. RESULTADOS DE LA CARACTERIZACIÓN POR USP DE LOS POLVOS DE CA/ML Y CA/NE
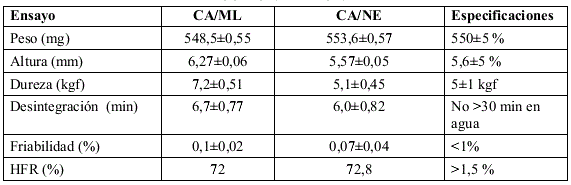
Obtención de tabletas preliminares
Los comprimidos obtenidos inicialmente con CA/ML cumplen con la mayoría de las especificaciones establecidas, excepto para el parámetro altura de comprimido, lo que no es un problema crítico, desde el punto de vista del envasado de las tabletas (ver tabla 6), ya que las mismas serán envasadas en frascos plásticos, lo cual permite una mayor flexibilidad durante esta operación. La resistencia a la dureza también fue superior al valor de la norma y a la del patrón de referencia (CA/NE). Sin embargo, no se observan efectos negativos en la desintegración de la tableta que es el parámetro que más se afectaría en este caso, y que se mantiene dentro de la especificación establecida, lo que permitió pasar al de estabilidad acelerada.
TABLA 6. EVALUACIÓN FÍSICO-MECÁNICA Y TECNOLÓGICA INICIAL REALIZADA A LAS TABLETAS PRELIMINARES OBTENIDAS CON CA/ML Y CA/NE
Estudio comparativo de estabilidad de los lotes de comprimidos de carbón-pepsina producidos con CA/ML y CA/NE con formulación cubana
En ambos estudios, los comprimidos producidos, 5 440 tabletas para cada lote (CA/ML y CA/NE), fueron envasados en frascos plásticos de alta densidad HDPE, de 50 ml, con tapa de polietileno y anillo de seguridad, conteniendo cada frasco 40 comprimidos c/u, (figura 2).
Estabilidad acelerada (6 meses)
Ambos lotes de comprimidos fueron evaluados bajo las mismas condiciones experimentales ya mencionadas con anterioridad, (tabla 3) (sin considerar el análisis microbiológico). Los resultados alcanzados son resumidos en la tabla 7. Todos los resultados obtenidos pueden considerarse positivos para este tipo estudio y producto en particular, lo cual permitió dar continuidad con la prueba de vida de estante cuyos requerimientos de control son más exigentes.
Estabilidad de vida de estante
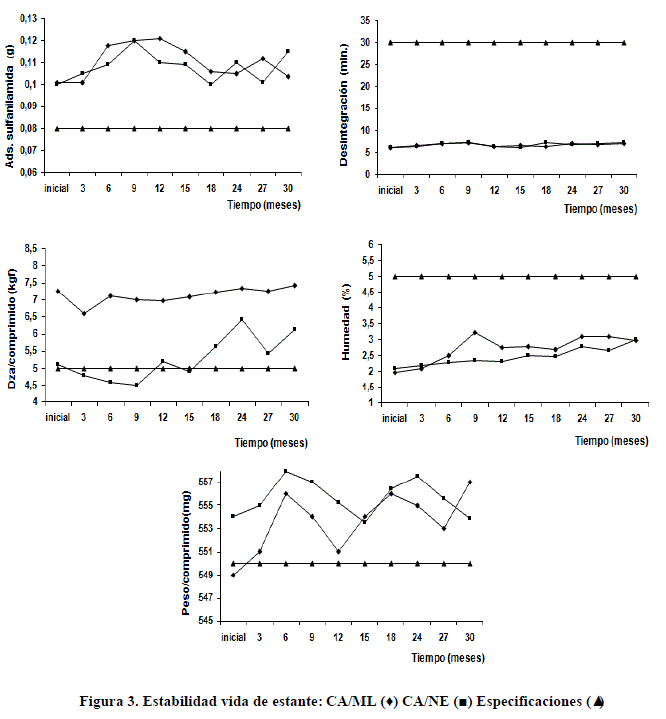
Los resultados presentados son m0strados en la tabla 8-9 y figura 3. Ambos productos presentaron buen desempeño en todos los parámetros establecidos, así como, comparativamente entre los dos lotes producidos.
Ambos productos presentaron buen desempeño en todos los parámetros establecidos, así como, comparativamente entre los dos lotes producidos. Para ello se realizó un estudio de significación estadística (T-test) para la media de cada parámetro de ambos lotes, en el que no se encontraron diferencias significativas para un 95 % de confiabilidad (tabla 9). Este resultado confirma la calidad de la tableta cubana obtenida, lo que garantiza hasta el término de treinta meses una elevada probabilidad de poder emplear este material para los fines propuestos. Este resultado, además, pone a relieve positivamente todo el proceso de obtención del carbón activado cubano desde su purificación hasta el proceso de tableteado, considerando que tanto la purificación como el tableteado son dos tecnologías independientes en las que se deben considerar múltiples factores de control de proceso y calidad.
TABLA 7. ESTABILIDAD ACELERADA (6 MESES)
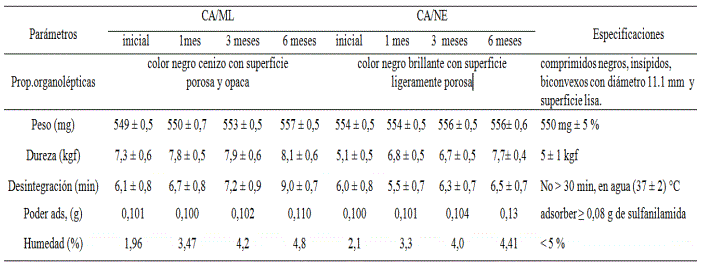
TABLA 8. ESTABILIDAD EN VIDA DE ESTANTE (30 MESES)

TABLA 9. PRUEBA T-test (α = 95 %) PARA LOS VALORES MEDIOS DE LAS TABLETAS OBTENIDAS CON CA/ML Y CA/NE DURANTE LA ESTABILIDAD VIDA DE ESTANTE (30 MESES)

CONCLUSIONES
Los polvos de CA cumplieron con los requisitos establecidos por la USP como materia prima. Los comprimidos de CA/ML obtenidos con formulación cubana a escala de banco, mantuvieron sus parámetros estables durante el estudio acelerado y vida de estante. No se observaron diferencias significativas entre los comprimidos obtenidos con CA/NE y CA/ML. Por los resultados alcanzados con el CA cubano este pudiera ser considerado candidato para la industria médico farmacéutica, tanto como materia prima como forma terminada.
AGRADECIMIENTOS
Los autores desean agradecer el apoyo brindado por el Programa de Estudantes-Convênio de Pós-Graduação (PEC/PG), Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (Capes), Brazil, Laboratorio Farmacéutico Reinaldo Gutiérrez, Cuba, La Habana y Proyecto Luces IMRE-MES, Cuba.
REFERENCIAS BIBLIOGRÁFICAS
1. FAIRWEATHER, W. et al. "Regulatory, design and analysis aspects of complex stability studies". J. Pharm. Sci. 1995, 84(11), 1322-1326.
2. WATERMAN, K. et al. "Accelerated again: Prediction of chemical stability of pharmaceuticals". Int. J. Pharm. 2005, 293(1-2), 101-125.
3. Centro para el Control Estatal de la Calidad de los Medicamentos en Cuba (CECMED). Requerimientos de los estudios de estabilidad para el registro de productos farmacéuticos nuevos y conocidos. Reg.23/2000. Cuba. 2000.
4. MAFULL, C. Obtenção e caracterização de carvão ativado cubano qualidade United States Pharmacopeia (USP) para uso farmacéutico. [Tese de Doutorado em Ciência e Engenharia de Materiais]. Florianópolis. Universidade Federal de Santa Catarina (UFSC), 2015.
5. MAFULL, C. R. et al. "Comparative study of the adsorption of acetaminophen on activated carbons in simulated gastric fluid". Springer Plus. 2014, 3 (48), 1-12.
6. MAFULL, C. R et al. "Procedimiento tecnológico para la obtención de carbón activado calidad USP 30 para uso médico farmacéutico". Revista CENIC. Ciencias Químicas. 2010, 41 (3), 167-175.
7. MAFULL, C. R. et al. "Estudio comparativo del carbón activado M1 de producción nacional para su uso como antídoto". Revista CENIC Ciencias Químicas. 2007, 8 (3), 389-398.
8. United States Pharmacopeia Convention. National Formulary 27. USP-NF 27. USA. 2009. v. 32.
9. CENTRO PARA EL CONTROL ESTATAL DE LA CALIDAD DE LOS MEDICAMENTOS EN CUBA (CECMED). Especificaciones de calidad de producto terminado de Carbón y Pepsina. tabletas: PNO L1 -172E. Cuba. 2012.
10. CHRISTIANE, G. et al. "Teste de dissolução para avaliação de liberação de glibenclamida em Comprimido Brasileira de Ciências Farmacêuticas Brazilian". Journal of Pharmaceutical Sciences. 2007, 43(3), 95-101.
11. PHUONG, H. L. et al. "Investigation of physicochemical factors affecting the stability of a pH-modulated solid dispersion and a tablet during storage". International Journal of Pharmaceutics. 2011, 414(1-2) 48-55
12. GONZÁLEZ, V. et al. "Estudios organolépticos, fisicoquímicos microbiológicos e interacción con excipientes farmacéuticos de un extracto purificado de cera de Apis mellifera". Revista Cubana Farmacia. 2010, 44(3), 354-359.
13. VILA, J. Tecnología Farmacéutica, Vol. I: Aspectos fundamentales de los sistemas farmacéuticos y operaciones básicas. Madrid: Síntesis, 1997 vol. 1, pp. 7-105.
14. ALLEN, L. V. Jr. "Secundum Artem. In: Currem and Practical Compounding Information for the Pharmacist. Compounding, Stability and Beyond-Use Dates". Quebec, 2009, 7(3), 100-205.
15. ALLEN, L. V, Jr. The Art, Science, and Technology of Pharmaceutical Compounding., Third edition, Washington D.C: Am Pharm Assoc, 2002.
16. WATERMAN, K.; ADAMI, R. "Accelerated again: Prediction of chemical stability of pharmaceuticals". International Journal of Pharmaceutics. 2005, 293(1-2), 101-125.
17. YOSHIOTA, S. Stability of drugs and dosage forms. 1ra Edición, New York: Kluwer Academic Publishers, 2002.
18. FLORENCE, A. T. et al. Physicochemical Principles of Pharmacy. 5 ta Edición. Great Britain: Pharmaceutical Press, 2006.
19. SIGRID, M. et al. "Estudio de la estabilidad química de comprimidos de ácido acetilsalicílico mediante un control de estanterías en farmacias de Concepción". Rev. Méd. Chile. 2002, 130(4), 409-415.
Recibido: 11/04/2017
Aceptado: 13/05/2017
Dr. C. Carlos A. Rey-Mafull, Instituto de Ciencia y Tecnología de Materiales, Universidad de la Habana, La Habana, Cuba, mafull@imre.oc.uh.cu












 Curriculum ScienTI
Curriculum ScienTI