Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Hematología, Inmunología y Hemoterapia
versión impresa ISSN 0864-0289
Rev Cubana Hematol Inmunol Hemoter vol.27 no.3 Ciudad de la Habana jul.-set. 2011
ARTÍCULO ORIGINAL
Validación de la capacidad del proceso de pasteurización de la albúmina humana para inactivar virus
Validation of the capacity of the human albumin pasteurization process for virus inactivation
Ms. C. Marta Dubed Echevarría,I Dr. C. Enrique Noa Romero,I Lic. Ana Teresa Ramírez Más,II Dr. Yordank Sánchez Martínez,I Dra. Leonor Navea Leyva,I Dra. C. Leonor Lobaina Leyva,I Lic. Giselle Álvarez SeguíI
ILaboratorio de Investigaciones del SIDA. La Habana, Cuba.
IIEmpresa Productora de Sueros y Hemoderivados "Alberto Pessant". La Habana, Cuba.
RESUMEN
La validación de la capacidad de aclaramiento viral de los procesos de fabricación de productos biológicos constituye un requisito regulatorio en Cuba. Se recomienda introducir la pasteurización en los procesos de producción de la albúmina como un método capaz de inactivar virus; por ello, el objetivo del estudio fue validar la capacidad de inactivación viral de la etapa de pasteurización del proceso de producción de la albúmina humana al 20 y 25 %. Los modelos virales que abarcan los posibles contaminantes de la materia prima, se diluyeron 1:10 en la albúmina en sus 2 concentraciones y se sometieron a tratamiento térmico a 60 °C durante 10 h. Se tomaron muestras a diferentes intervalos de tiempo para la confección de las curvas de cinética de inactivación. Se determinó el factor de reducción aportado por la pasteurización para cada virus. El tratamiento a 60 °C de la albúmina al 20 y 25 % disminuyó significativamente la carga viral inicial con que se retó la etapa, con valores de p< 0,002 y p< 0,021, respectivamente, y se obtuvieron factores de reducción superiores a 4 log del título de todos los virus. La etapa de pasteurización le aportó a la albúmina humana al 20 y 25 % un adecuado nivel de seguridad.
Palabras clave: validación, pasteurización, factor de reducción.
ABSTRACT
The validation of the capacity of viral clearance in the manufacturing processes of biopharmaceuticals is a regulatory requirement in Cuba. It is recommended to introduce the pasteurization in the manufacturing processes of serum albumin as a method of inactivating viruses. The objective of this study was to validate the capacity of viral inactivation in the phase of pasteurization of the 20 % and 25 % human albumin production process The viral models covering the possible pollutants of the raw materials were diluted at 1:10 in albumin in 2 concentrations and they were heat-treated at 60 °C for 10 h. Several samples at different time intervals were taken to design the inactivation kinetic curves. The reduction factor of pasteurization for each virus was estimated. The treatment of 20 % and 25 % albumin at 60 °C decreased significantly the initial viral load in the stage, with p< 0.002 and p< 0.021 respectively. The reduction factors exceeded 4 log of the titers of all viruses. The stage of pasteurization gave adequate level of safety to the 20 % and 25 % human albumin.
Key words: validation, pasteurization, reduction factors.
INTRODUCCIÓN
La albúmina humana es un agente de uso terapéutico que se emplea también como un estabilizador de otros productos medicinales. Este producto biológico se obtiene a escala industrial mediante el procesamiento de grandes mezclas de plasma humano por lo que constituye una posible fuente de transmisión de agentes infecciosos.
Los derivados de la sangre han sido responsables de numerosos casos de transmisión de infecciones virales a los receptores de los hemoderivados, como las que causan las hepatitis A, B y C, el sida y otras.1 Por tanto, durante todo el proceso se tienen en cuenta una serie de elementos para disminuir el riesgo de contaminación viral, entre los que se encuentran la cuidadosa selección de los donantes y las materias primas, el control de los lotes finales del producto biológico, la introducción en el proceso de producción de pasos específicos para el aclaramiento viral y la validación de estas etapas o del proceso de fabricación completo, lo que le concede fortaleza al diseño de obtención del producto en relación con su seguridad.
En la validación viral, el proceso de producción o las etapas de este con capacidad para remover o inactivar virus son retadas con altas dosis infectivas de diferentes modelos virales, representativos de una amplia gama de los posibles contaminantes de la materia prima, por lo que proporciona información sobre la seguridad del producto biológico y brinda confianza para su uso, porque demuestra que los agentes virales que pudieran entrar al proceso de fabricación es posible eliminarlos.1-4
La pasteurización es un método físico que emplea calor y es altamente confiable para inactivar una gran variedad de virus, por lo que se recomienda por las autoridades regulatorias su introducción como una etapa robusta en los procesos de producción de las albúminas.4,5
En la Empresa Productora de Sueros y Hemoderivados "Alberto Pessant" (EPSH), para la obtención de las albúminas se utiliza la metodología del fraccionamiento alcohólico de las proteínas reportado por Cohn y tiene incorporado la pasteurización en la formulación final. El estudio previo de validación de la capacidad de aclaración viral de este proceso demostró que es seguro, porque es capaz de inactivar y de remover agentes virales en lotes obtenidos a partir de 250 L de plasma.2,6
Los cambios introducidos en el proceso de producción antes relacionados, necesitan estudios de revalidación para demostrar que no afectan la seguridad del producto,7 por lo que el objetivo de este trabajo es revalidar la capacidad para inactivar virus de la etapa de pasteurización a que se somete la albúmina humana a 20 y 25 %.
MÉTODOS
Escalado inverso del proceso industrial
La conformación de los lotes de albúmina se realizó en la EPSH, para lo cual los donantes de sangre se seleccionaron según la Regulación 16/2006: Directrices sobre las buenas prácticas para la fabricación de productos farmacéuticos. El plasma se colectó si resultaba no reactivo para anticuerpos contra los virus de la inmunodeficiencia humana tipos 1 y 2 (VIH 1 y 2), virus de la hepatitis C (VHC), negativo al antígeno de superficie del virus de la hepatitis B (VHB) y negativo para ácido ribonucleico (ARN) de VIH y VHC.
La albúmina se obtuvo a partir de 1 000 L de plasma mediante el método de fraccionamiento alcohólico de las proteínas que se alternó con períodos de agitación, reposo y centrifugación para la separación de los sobrenadantes y precipitados. El precipitado final se purificó, liofilizó y formuló a las concentraciones del 20 y 25 % de albúmina. El producto se dosificó en frascos de 50 mL y se sometió a 60 °C de temperatura durante 10 h. Posteriormente se almacenó durante 14 d a una temperatura entre 25 y 32 °C hasta su liberación por la autoridad nacional reguladora.
Para la validación en el laboratorio, el proceso productivo se sometió a un escalado inverso de 0,08 %, por lo que para el estudio de la etapa de pasteurización se analizaron 2 frascos de albúmina equivalente al desescalado de la cantidad de frascos que integran un lote final en la industria.
Selección de los modelos virales
Los modelos virales se seleccionaron de acuerdo con el grado de relevancia de transmisión por la sangre y por su resistencia a los agentes físicos y químicos (tabla 1).
Sistema virus-células
El VIH-1 se replicó en la línea de células continuas de linfoblastos de una leucemia aguda infantil (CEM) en medio RPMI-1640 suplementado con 10 % de suero fetal bovino (SFB), 2 mM de L-glutamina, 2 µg de polibrene/mL y 40 µg/mL de gentamicina.
El virus de la diarrea viral bovina (VDVB) y el parvovirus canino (PVC) se multiplicaron en las líneas celulares de riñón bovino (MDBK) y de fibroblasto de curiel (LFBC), respectivamente, mientras que el virus de la encefalomiocarditis porcina (EMC) y el virus herpes porcino tipo 1 (VHP-1) se replicaron en la línea celular de riñón de mono verde africano clon 1008 (Vero 1008); todos se cultivaron en medio MEM (Gibco) con 5 % SFB, 7,5 % de bicarbonato de sodio, L-glutamina y gentamicina, en las concentraciones antes referidas.
Ensayo de infectividad
Para la titulación de cada inóculo viral se realizaron diluciones seriadas de base 4 (6 réplicas) en placas de 96 pozos, a las cuales se añadieron 5 x 105 células CEM/mL y 2 x 105 células/mL para el resto de los sustratos celulares y se incubaron a 37 ºC en atmósfera húmeda con 5 % de CO2; se incluyó además un control celular sin virus. Los virus se cuantificaron mediante determinación de la dilución final en la que se visualizó el efecto citopático (ECP); en el caso del VIH se calculó la cantidad de proteína 24 (p24) en el sobrenadante del cultivo libre de células por el sistema ELISA de captura de antígeno (DAVIH Ag p24, DAVIHLAB, Cuba), según las instrucciones del fabricante. Las dosis infectivas medias en cultivo de células (DICC50/mL) se determinaron por el método de Reed y Muench. Cada cepa viral se utilizó a una multiplicidad de infección de 0,3 (MOI= 0,3) El ensayo tiene un límite de detección de 101.301 DICC50/mL.8-10
Desafío viral
Cada modelo viral se diluyó en una proporción 1:10 con albúmina 20 o 25 %. Se incluyó siempre un control viral (KV) que se diluyó de igual forma a la mencionada, pero en el medio de cultivo específico para cada virus. La mezcla se homogenizó y se tomó una muestra inicial para determinar la carga viral inicial (CVi). Posteriormente se puso en baño termostatado a 60 °C con un control interno de temperatura; cuando las muestras alcanzaron 60 °C se colectó una alícuota para calcular la carga viral (CV) en tiempo cero (CV0). Se monitoreó además a los 0,5; 1; 2; 4; 7 y 10 h para determinar la CV final (CVf) y establecer la cinética de inactivación de la etapa de pasteurización para cada virus. Cada reto se realizó por duplicado.
Todas las muestras se titularon mediante el ensayo de infectividad antes referido y en las que se detectó virus infectivo al nivel del límite de detección del ensayo se les realizaron 3 pases ciegos; para ello, los sustratos celulares se cultivaron en placas de 24 pozos, a las 48 h se eliminó el sobrenadante y se añadió 0,2 mL del sobrenadante libre de células procedente del ensayo de reto viral y 1,8 mL de medio de cultivo, según el tipo de células. Al séptimo día se titularon como se señaló antes.
Análisis de los resultados
Los factores de reducción (FR) para cada virus se expresaron en log10 y se calcularon según la fórmula:
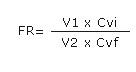
Para comparar los valores de la CVi y la CVf a las 0,5 h del reto de la pasteurización de la albúmina para cada virus, se realizó prueba t de Student y U Mann- Witney para datos pareados y no pareados, con un intervalo de confianza de 95 %; se utilizó el programa Statistica versión 6.0.
RESULTADOS
En la tabla 2 se muestran los FR obtenidos después de la pasteurización y el tiempo en que se inactivó totalmente la CV de cada modelo. Los FR fueron superiores a 5 log, independientemente de las concentraciones de la albúmina. Como se aprecia, tanto para los modelos envueltos como no envueltos no se detectó virus infectivo incluso antes de culminar el ciclo completo de pasteurización. El más termolábil resultó ser el VHP-1, porque después de 1 h de tratamiento de la albúmina al 20 y 25 % a 60 °C, no se detectó virus infectivo.
En la figura aparecen las curvas de la cinética de inactivación de cada modelo viral durante la pasteurización del hemoderivado en sus 2 concentraciones. Los virus envueltos como los no envueltos tuvieron una cinética con comportamiento bifásico después de ser sometidos a 60 °C durante 10 h, con caídas bruscas de los títulos virales iniciales, que se mantuvieron a bajos niveles por poco tiempo, independiente de la concentración de la albúmina.
A la 0,5 h de pasteurización se obtuvo una disminución significativa de la CV para todos los modelos virales, con valores muy significativos de p< 0,002 y significativos de p< 0,021 para las albúminas al 20 y 25 %, respectivamente. Los títulos de los KV mostraron una caída más rápida que las muestras estudiadas, excepto el VHP-1, cuya cinética coincidió con la curva de pasteurización de la albúmina 25 %.
En los pases ciegos no se detectó virus infectivo para todos los modelos virales.
DISCUSIÓN
El comportamiento de los modelos virales está relacionado con la mayor o menor resistencia a los métodos de inactivación. Las características del VHP-1 como modelo altamente sensible se correspondieron con la rápida y total pérdida de la infectividad después de la primera hora de tratamiento con calor.6
El virus de la EMC, considerado de alta resistencia, se inactivó por completo en igual período que el VDVB de resistencia media; Sofer y otros (2003) señalan que este último se estabiliza ligeramente con las proteínas de la albúmina y resiste más el tratamiento con calor.11,12
El VIH-1, a pesar de ser de baja resistencia al igual que el VHP-1, mostró una inactivación más lenta independiente de la concentración de la albúmina. Este hallazgo pudiera estar relacionado con el método de detección de Ag p24 utilizado para la cuantificación de la carga viral. Patton y otros, así como Cimeran y otros reportan que el antígeno p24 es una proteína termorresistente que se degrada a temperaturas superiores a 100 ºC13,14 y en el estudio se sometió a 60 ºC durante un período de tiempo largo. Aunque se logra una disminución significativa de la CV de este retrovirus a la media hora de pasteurización, otros autores refieren la inactivación de títulos virales superiores a los 20 min de tratamiento a 60 ºC.11,12
El comportamiento del parvovirus pudiera atribuirse a características propias de la cápsida viral de la cepa utilizada en el estudio.1,15 Resultados diferentes encontraron Hattori y otros, así como Yunoki y otros, quienes con un régimen similar de tratamiento térmico de la seroalbúmina humana no alcanzaron a inactivar completamente este virus. Los parvovirus animales son agentes menos sensibles al calor que el parvovirus B19, por lo que se recomiendan como modelos de este posible contaminante de la sangre.15
Los resultados mostrados coinciden con los publicados por Ruibal y otros para la pasteurización de la albúmina 20 %, pero obtenidos a partir de lotes de plasmas de 250 L; ellos demostraron la capacidad del proceso de producción para inactivar los posibles contaminantes virales del hemoderivado.6 Por tanto, el aumento del tamaño del lote de materia prima introducido en el proceso de producción no compromete la seguridad del producto.
Al aportar más de 5 logs de FR de los títulos de los virus envueltos y no envueltos analizados, el tratamiento a 60 ºC por 10 h a que es sometida la albúmina constituye una etapa segura.1
REFERENCIAS BIBLIOGRÁFICAS
1. Darling AJ. Validation of biopharmaceutical purification processes for virus clearance evaluation. Mol Biotechnol. 2002;21:57-83. Disponible en: http://www.springerlink.com/content/c2p4258572138273/fulltext.pdf
2. Ruibal I, Noa E, Martín ZR, González N, Ramirez AT. Inactivación de virus ADN envueltos en la producción de hemoderivados (albúminas e inmunoglobulinas). Rev Cubana Farm. 1999;33(2):89-97. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0034 -75151999000200002&lng=es&nrm=iso
3. Brorson K. Advances in viral clearance. En: Abhinav A, Shukla M, Etzel R, editors. Process scale bioseparations for the biopharmaceutical industry. CRC Press; 2007. p. 449-62.
4. Hattori S, Yunoki M, Tsujikawa M, Tachibana Y, Yamamoto I, et al. Variability of parvovirus B19 to inactivation by liquid heating in plasma products. Vox Sang. 2007;92:121-4. Disponible en: http://onlinelibrary.wiley.com/doi/10.1111/j.1423-0410.2006.00879.x/full
5. Yunoki M, Urayama T, Tsujikawa M, Sasaki Y, Abe S. Takechi K, et al. Inactivation of parvovirus B19 by liquid heating incorparated in the manufacturing process of human intravenous immunoglobulin preparations Br J Haematol. 2004;128:401-4. Disponible en: http://onlinelibrary.wiley.com/doi/10.1111/j.1365-2141.2004.05309.x/full
6. Ruibal I, Noa E, Martin Z, Ramirez A, Hernandez AT. Viral validation study of a modified manufacturing method of human purified albumin J Validation. 2002;8(2):151-61.
7. Alemán MR, Noa E, Tamayo A, Dubed M, Padilla S, Alvarez G, et al. A revalidation study of viral clearance in the purification of monoclonal purification of monoclonal antibody CB.Hep-1. Biopharm Int. 2007;20(1):46-55.
8. Johnson VA, Brington RE. Infectivity assay (virus yield assay). In: Aldovani A, Walker BD, editors. Techniques in HIV research. New York: Stockton Press; 1990. p. 71-76.
9. Álvarez G, Dubed M, Noa E, Navea L, Pérez MT, Gónzalez A, et al. Evaluación de la utilidad del método de titulación viral empleado para validar procesos de producción de biológicos. Biotecnología Habana. 2006; ISBN: 959-282-31-8.
10. Álvarez G, Dubed M, Noa E, Navea L, Pérez MT, Gónzalez A, et al. Validación del método de titulación del virus de la inmunodeficiencia humana tipo 1. Rev Cubana Med Trop. 2009;63(2):1-8. Disponible en: http://scielo.sld.cu/scielo.php?pid=S0375-07602009000200002&script=sci_arttext&tlng=en
11. Sofer G. Virus Inactivation in the 1990s - and into the 21st Century: Part 3a, Plasma and plasma products (Heat and solvent/detergent treatments) BioPharm Int. 2003;15(9):28-42.
12. Sofer G, Lister DC, Boose JA. Virus inactivation in the 1990s -and into the 21st century. Part 6, Inactivation methods grouped by virus. BioPharm Int. 2003;16(4):42-52.
13. Patton JC, Sherman GG, Coovadia AH, Stevens WS, Meyers TM. Ultrasensitive human immunodeficiency virus type 1 p24 antigen assay modified for use on dried whole-blood spots as a reliable, affordable test for infant diagnosis. Clin Vaccine Immunol. 2006;13(1):152-5. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC1356617/
14. Cimeran S, Araripe MC, Lewi DS, Díaz RS. Less sensitive HIV-1 Enzyme Immunoassay as an adjuvant method for monitoring patients receiving antiretroviral therapy. AIDS patient care STDs. 2007;21(2):100-5. Disponible en: http://www.liebertonline.com/doi/pdfplus/10.1089/apc.2006.0035
15. Blumel J, Schmidt I, Willkommen H, Lower J. Inactivation of parvovirus B19 during pasteurization of human serum albumin. Transfusion. 2002;42:1011-8. Disponible en: http://onlinelibrary.wiley.com/doi/10.1046/j.1537-2995.2002.00158.x/pdf
Recibido: 10 de enero de 2011.
Aprobado: 31 de marzo de 2011.
Marta Dubed Echevarría. Laboratorio de Investigaciones del SIDA. La Habana, Cuba. Correo electrónico: lisida@infomed.sld.cu














