INTRODUCCIÓN
El pie diabético se puede considerar como la presencia de ulceración, infección o gangrena del pie asociada a la neuropatía diabética y diferentes grados de enfermedad vascular periférica, resultados de la interacción compleja de diferentes factores inducidos por una hiperglucemia mantenida.1
La infección del pie diabético es importante por dos motivos; por un lado, es casi 10 veces más frecuente que en los pacientes no diabéticos y es la causa principal de hospitalización; por otro, a pesar de que la mayoría de las infecciones implican tejidos blandos, en 20‐60 % de los casos se observa afectación de estructuras óseas, mientras que 30‐80 % se corresponden con un proceso inflamatorio de naturaleza infecciosa que afecta a la médula ósea y hueso cortical circundante denominado osteomielitis.9,10,11,12) Aunque virtualmente cualquier microorganismo puede causar osteomielitis, este término se reserva para la infección causada por bacterias piógenas.11
Se trata de una de las infecciones más frecuentes en el pie del diabético que puede estar presente entre el 10-15 % de las infecciones leves y casi en el 50 % de las infecciones graves;11,12 se desarrolla cuando la úlcera del pie diabético penetra a nivel del hueso o la articulación, la ubicación más frecuente son las cabezas de los metatarsianos y la articulación metatarso falángica del primer dedo.13,14 La osteomielitis del pie diabético suele producirse por contigüidad, resultado de la penetración en profundidad de una infección contigua de partes blandas o a partir de una herida.15,16,17,18,19,20
El hueso sano es muy resistente a la infección. El desarrollo de osteomielitis está relacionado con factores que disminuyen las defensas del huésped a nivel local (cuerpo extraño, traumatismo local, fracturas o microfracturas), situaciones favorecedoras de bacteriemia y factores bacterianos tales como el inóculo, adhesinas, glucocálix y flora cutánea.5 Hasta el momento la literatura revisada demuestra que la osteomielitis puede ser causada por una gran variedad de microorganismos, de los cuales las bacterias constituyen los agentes etiológicos principales, siendo el Staphylococcus aureus el patógeno aislado con mayor frecuencia en los cultivos óseos, bien de forma aislada o en presencia de otro agente patógeno.21,22,23,24
El principal determinante en la estrategia terapéutica en pacientes con pie diabético infectado con compromiso de tejidos blandos es la presencia de osteomielitis.25,26,27 sin embargo, el diagnóstico de osteomielitis en este grupo de enfermos sigue siendo un reto.28,29
Se debe considerar la osteomielitis como una complicación potencial de cualquier úlcera profunda, es diagnosticada en primer lugar por la clínica;30 constituye una de las principales causas de amputación asociada a las úlceras de pie diabético. Su retraso diagnóstico y terapéutico siguen siendo hoy en día un problema sin resolver por la falta de estudios que demuestren de forma adecuada su presencia.24,25,26
Uno de los aspectos más controvertidos en el manejo de la osteomielitis está relacionado con las pruebas necesarias que hay que realizar para obtener un diagnóstico adecuado del proceso.17,19,27 La prueba estándar para el diagnóstico de la osteomielitis es la biopsia ósea. La mayoría de los autores coinciden en que la resonancia magnetica nuclear (RMN), tomografìa axial computarizada (TAC), gammagrafías con tecnecio o con leucocitos marcados con Indio 111, o incluso las tomografías por emisión de positrones (PET) son pruebas muy caras,7 con mucha demora en su realización,13,19 que no están al alcance de todos los centros y que por lo tanto, su justificación de utilización estandarizada pudiera tener condicionantes éticos.22 Los medios de diagnóstico avanzado por imagen han mejorado la evaluación de la osteomielitis en el pie diabético, pero esto no significa que se tengan que utilizar de forma sistemática, sino que deben ser una herramienta para casos difíciles y complicados en los que existan dudas diagnósticas.25
El diagnóstico definitivo y la identificación del agente etiológico requieren la obtención de muestras óseas para su estudio histológico y cultivo.27 Si el hueso no es fácilmente accesible (es decir, si no queda expuesto) y los signos clínicos y hallazgos analíticos son sospechosos, el paciente debe someterse a la resonancia magnética para confirmar o descartar el diagnóstico. Los hallazgos combinados de diferentes técnicas pueden ser útiles en llegar a un alto grado de sospecha y para orientar investigaciones adicionales.31
La presencia de signos clínicos sugestivos de osteomielitis como una úlcera que no cicatriza tras seis semanas de tratamiento adecuado, la aparición de un dedo “en salchicha”, la profundidad, la presencia de hueso expuesto y una úlcera con un área mayor de 2cm2 o la palpación del hueso a través de la úlcera, son signos clínicos muy sugestivos de osteomielitis en el pie diabético.6,14,27 Esta última prueba, la palpación del hueso a través de la úlcera denominada “probing to bone” ha mostrado una sensibilidad de 66 %, una especificidad de 85 % y un valor predictivo positivo de 89 % para el diagnóstico de osteomielitis.7,9,11 En los últimos años han aparecido numerosas publicaciones que han intentado desvelar cuál es el procedimiento idóneo que permita diagnosticar esta infección de forma precoz, sencilla, barata y reproductible, pero para lograrlo debemos determinar cuáles son las expresiones clínicas de los marcadores serológicos de inflamación e imagenológicas que permitirían sospechar su presencia en las lesiones del pie del diabético.
Por todo lo anterior el objetivo de este trabajo fue determinar las características clínicas, serológicas e imagenológicas presentes en los pacientes con úlcera del pie diabético complicada con osteomielitis.
MÉTODOS
Se realizó un estudio observacional prospectivo, en un total de 280 pacientes ingresados en el servicio de Angiología del Hospital Provincial Universitario "Comandante Faustino Pérez Hernández" de Matanzas por presentar úlceras del pie diabético en cualquiera de sus variantes etiopatogénicas (neuropáticas o neuroisquémicas) con sospecha de infección y de osteomielitis de las úlceras.
La osteomielitis se diagnosticó mediante histología del hueso, la muestra para la biopsia se obtuvo mediante cirugía.
El período de estudio duró cinco años oscilando entre enero de 2013 y diciembre de 2017, ambos incluidos.
Criterios de inclusión:
Pacientes mayores de 18 años que aceptaron voluntariamente incorporarse a la investigación
Pacientes portadores de una o más úlceras del pie diabético de etiología neuropática o neuroisquémica con diagnóstico clínico de infección según la clasificación Infectious disease Society of America (IDISA) y sospecha clínica de osteomielitis según los criterios de los estudios: Diabetic Foot Study Group (DFSG) y European Association for the Study of Diabetes (EASD), con indicación de desbridamiento quirúrgico y/o cirugía mutilante.
Criterios de exclusión:
Pacientes que presenten criterios de isquemia crítica, según la clasificación de Fontaine [pacientes con un índice de presiones tobillo brazo (ITB) menor a 0,5 y dolor en reposo o presencia de úlceras con ausencia conjunta de pulsos pedio, tibial posterior y poplíteo].
Pacientes con signos clínicos o radiológicos compatibles con neuroartropatía de Charcot.
Mujeres embarazadas.
Pacientes con las capacidades cognitivo metales alteradas.
Pacientes que se negaron a la conducta quirúrgica propuesta en casos de criterios de diagnóstico clínico probable y/o definitivo de osteomielitis
Todos los pacientes incluidos en el estudio firmaron el documento de Consentimiento Informado.
Las variables de estudio fueron: procedencia, sexo, edad, tipo de Diabetes Mellitus (DM) según clasificación de la ALAD,9 tiempo de evolución de la DM (años), tratamiento de la DM, glucemia al ingreso, tiempo de evolución de la lesión (días), área de la lesión (cm2), grado de infección según la clasificación IDISA (Infectious Disease Society of America),9Test de contacto óseo con sonda acanalada (Probe to bone, denominación en inglés), leucograma con diferencial, eritrosedimentación (velocidad de sedimentación globular), rayos X del pie, diagnóstico histopatológico de osteomielitis y toma de la muestra ósea mediante cirugía.
Las variables cuantitativas se resumieron mediante la media, mediana, desviación estándar y valores mínimo y máximo; las cualitativas mediante frecuencias y porcentajes. Se utilizó el estadígrafo Ji-Cuadrada ((2) para analizar la relación de dependencia entre las variables. Se estimaron los intervalos de confianza al 95 %, se usó un nivel de significación de (= 0,05.
Los datos se procesaron con el Paquete Estadístico para las Ciencias Sociales (SPSS) versión 15.0.
RESULTADOS
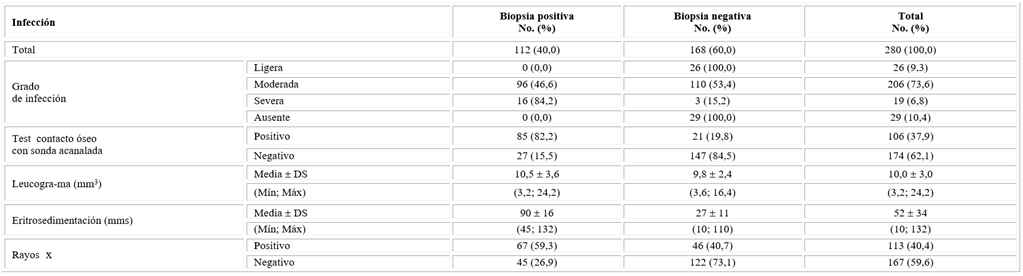
Se encontró que fueron significativamente mayor las biopsias positivas en los pacientes que residen en la zona rural en comparación con los de la zona urbana y en los mayores de 59 años (tabla 1).
Se constató que la mayoría de los pacientes eran diabéticos de tipo 2 (96,8 %) con un tiempo medio de evolución de la diabetes de 14 años (( 5 años), demostrándose asociación entre el tiempo de evolución de la DM mayor de 14 años con el resultado de biopsia positiva (tabla 2). Al ingreso hospitalario más de 60 % de los pacientes con biopsias positivas presentaban valores de glucemias superiores a 10,3 mmol/L (tabla 2).
Tabla 2 Características de los pacientes diabéticos estudiados según el estado de la biopsia

DS= Desviación estándar; Mín= Mínimo; Máx. = Máximo.
Se observó un menor porcentaje de pacientes en el grupo de biopsias positivas, con respecto a las negativas, un tiempo de evolución de la lesión mayor a los 22 días a pesar de tener ese grupo una mayor frecuencia de enfermos con un área mayor de la lesión (tabla 3).
Tabla 3 Distribución de los pacientes según características de la lesión
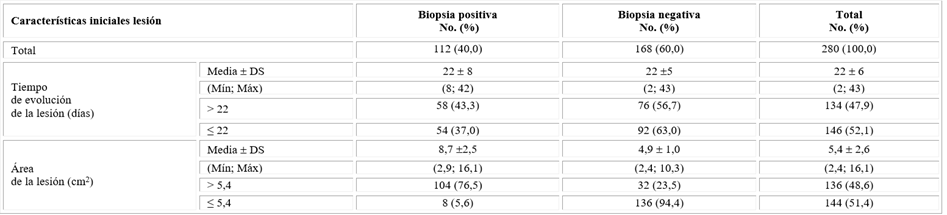
DS= Desviación estándar; Mín= Mínimo; Máx. = Máximo.
Se determinó una elevada frecuencia de pacientes con infección moderada (73,6 %) sin diferencias significativas entre la proporción de biopsias positivas y negativas, mientras que la infección severa fue más significativa en las biopsias positivas (84,2 %). En este grupo hubo una mayor frecuencia de pacientes con test de contacto óseo con sonda acanalada (probe to bone) positivo (82,2 %). La eritrosedimentación fue significativamente superior en el grupo con biopsias positiva sin diferencias importantes en los valores del leucograma entre los grupos con biopsia positiva y negativa (tabla 4).
DISCUSIÓN
La infección de las úlceras del pie diabético conduce a un cataclismo final de eventos deletéreos tales como: la gangrena y la amputación.1 Esta alteración es más difícil de diagnosticar y tratar en el diabético porque la glucemia elevada interfiere con la respuesta inmune humoral y celular y dificulta o impide el transporte de antitoxinas, citocinas y antibióticos.2)
La distribución observada en relación con la edad y el sexo, así como las características clínicas (tipo de diabetes mellitus, tiempo de evolución y tratamiento al ingreso hospitalario) se corresponde a la habitualmente determinada en la población diabética, la literatura internacional considera que la mayor parte de los pacientes que desarrollan esta complicación son de avanzada edad (59‚1±14‚6 años);11,15 grupo en el cual resulta más difícil para mantener un oportuno control endocrino-metabólico, a su vez, el tiempo de evolución medio de la DM suele ser de 12‚3 ± 9‚6 años.22 Si bien en el sexo femenino predomina para la aparición de la enfermedad, el masculino es más propenso al desarrollo de complicaciones crónicas.5,7
El tamaño de la úlcera mayor de 2 cm es un factor predictivo de los resultados del tratamiento en la úlcera del pie diabético, por lo que resulta aconsejable su evaluación en todas las investigaciones relacionadas con la identificación del pronóstico.18,29,30) Aspectos que han sido descritos como factores de riesgo para una infección son: heridas o úlceras que han profundizado hasta hueso, heridas de larga evolución (más de 30 días) y traumatismos severos asociados a un gran daño tisular.10,19,23
Se debe considerar la osteomielitis como una complicación potencial de cualquier úlcera profunda, diagnosticada en primer lugar por la clínica en función de la presencia de signos y síntomas locales de inflamación e infección (dos o más signos tales como: dolor, rubor, calor, impotencia funcional, además de la presencia de supuración o incluso fragmentos óseos), sin embargo, pueden verse reducidos en pacientes con un componente isquémico importante.29
Bajo estos conceptos a veces el diagnóstico positivo de la osteomielitis crónica es sencillo, si existe una fístula que comunica el hueso con el exterior y en la radiología simple se pueden observar signos tales como reabsorción ósea, secuestro o involucro (neoformación ósea).30) Un punto esencial en la evaluación clínica lo constituye el test de contacto óseo con sonda acanalada con sensibilidad de 75,8 %, especificidad de 87,5 %, valor predictivo positivo 80 % y valor predictivo negativo 15,5 %. Si bien la prueba ha sido considerada un método diagnóstico con alto valor predictivo para osteomielitis de 90 %,14 cuando Grayson la describió obtuvo una sensibilidad de 66 % y una especificidad de 85 %, con un valor predictivo positivo (VPP) del 89 % y un valor predictivo negativo (VPN) de 56 %, pero sin confirmar la existencia de osteomielitis mediante cultivo óseo o estudio histopatológico.15 Afirman que si el hueso es palpable con el test no es necesario realizar técnicas de radiodiagnóstico y, que el sondaje del hueso se debería incluir en la evaluación clínica de todos los pacientes diabéticos con úlceras infectadas.31,32,33,34,35,36,37,38,40
El diagnóstico no microbiológico de la osteomielitis se basa en la realización de las siguientes pruebas:
Ecográficas para el diagnóstico de osteomielitis son: colección adyacente al hueso y elevación del periostio de 2 mm, engrosamiento del periostio con zonas hipoecoicas, e inflamación de la musculatura y los tejidos blandos adyacentes.9
Radiología simple. Cuando existe compromiso óseo. Los cambios radiográficos pueden comenzar a observarse a los 10-14 días aproximadamente, y son más evidentes a partir del día 21.34,35,36 El rayos x tiene una sensibilidad de 55 % y especificidad de 75 % para el diagnóstico de osteomielitis crónica. Los hallazgos iniciales compatibles con osteomielitis aguda son la tumefacción de tejidos blandos y la elevación perióstica.31) Resultados similares exhibe el estudio donde apareció una sensibilidad de 59,8 %, especificidad 72,6 %, valor predictivo positivo 72,6 % y valor predictivo negativo 59,8 %. Si hay dudas diagnósticas se debe repetir en forma seriada cada 10-15 días.31,32,33 No es sencillo distinguir entre osteomielitis y la neuropatía artropática aséptica, por lo que los hallazgos radiológicos deben interpretarse en el contexto clínico.34
Técnicas gammagráficas. Es el método diagnóstico más rápido.35 Tiene una sensibilidad de 90 % pero una especificidad de 50 %. Lo importante es el alto valor predictivo negativo de estas técnicas, que permite excluir infección si la prueba es negativa.27,32,36
Tomografía axial computarizada. Permite el estudio de lesiones más pequeñas, fragmentos óseos y fracturas complejas. Pueden valorarse partes blandas y hueso.37,38,39,40,41
Resonancia magnética nuclear. Ideal para el estudio de partes blandas y hueso.
La bibliografía internacional en el examen de la correlación entre el análisis histopatológico de la muestra ósea extraída quirúrgicamente y los resultados obtenidos a través de la resonancia magnética, concluyen, que cuanto mayor sea la intensidad de la señal, mayor probabilidad habrá de que la anormalidad sea la presencia de osteomielitis y que cuando la intensidad de la señal es mínima o de aumento moderado, el edema de la médula puede ser indistinguible de osteomielitis.39 Por otro lado, los estudios realizados en animales, no pueden ser representativos, ya que no van a reproducir las condiciones y complicaciones asociadas al pie diabético.40) Actualmente se considera que la resonancia magnética es la técnica que demuestra mayor sensibilidad y especificidad (100 % y 75 %, respectivamente), así como un VPP 92,9 % y un VPN 100 %, en comparación con otras técnicas de imagen. Y aunque ninguna de ellas permite de forma absoluta afirmar o excluir el diagnóstico de osteomielitis, si nos van a servir para apoyar o rebatir la sospecha clínica.42
La mayoría de los autores afirman que son más exactos los estudios con radioisótopos, PET o RMN pero son muy caros, tardan mucho tiempo para poder realizar un diagnóstico precoz y no están disponibles de forma general en todos los centros ambulatorios.1,23,36
La biopsia ósea se considera el estándar de oro “Gold Standard” para el diagnóstico definitivo de la osteomielitis, ya que nos permite establecer el estudio histopatológico y microbiológico del hueso obtenido mediante biopsia percutánea o cirugía.22,23 La biopsia abierta es preferible a la percutánea, sobre todo si se precisa desbridamiento y limpieza quirúrgica de la zona. Idealmente los resultados de la biopsia debe obtenerse antes del inicio de la antibioterapia.24
El éxito del tratamiento y pronóstico de los pacientes con osteomielitis depende de reconocer precozmente que un proceso infeccioso de partes blandas se encuentra en evolución, seguido de una pronta investigación que establezca y especifique un diagnóstico más preciso, para poder evitar las amputaciones. Se debería tener una herramienta clínica sencilla, barata y que la pueda realizar cualquier clínico en consulta para el diagnóstico precoz de la osteomielitis, pero, como concluye Lipsky en el 2007(24 existen muy pocos estudios prospectivos con la potencia estadística suficiente para establecer y validar un sistema de diagnóstico de la osteomielitis.
Por los resultados obtenidos se concluye que existen características clínicas, serológicas e imagenológicas predominantes en los pacientes con úlceras del pie diabético y diagnóstico histopatológico de osteomielitis.